修回日期: 2011-02-21
接受日期: 2011-03-02
在线出版日期: 2011-03-08
目的: 研究一株实验室减毒水泡性口炎病毒(VSV)对HepG2细胞的凋亡诱导作用, 并探讨其可能的作用机制.
方法: 首先将水泡性口炎病毒以1.0感染复数(MOI)的接种密度感染HepG2细胞, 同时设接种相同体积培养液的Mock感染组, 在不同时间点收集细胞, MTT法检测细胞增殖活性; AO/EB结合Hoechst/PI染色观察细胞凋亡形态学变化; Annexin V-FITC/PI双染法检测早期凋亡细胞数目; PI染色结合细胞周期分析sub-G1凋亡峰值; JC-1染色测定细胞线粒体跨膜电位(ΔΨm)水平; 比色法检测caspase-3, caspase-8及caspase-9的活性变化.
结果: 减毒VSV感染HepG2细胞后, 随着感染时间的增加, HepG2细胞存活率明显降低. VSV感染HepG2细胞24 h后, 早期凋亡细胞数高于Mock感染组(26.46%±6.01% vs 4.86%±2.28%, t = -5.817, P<0.01); sub-G1峰细胞数高于Mock感染组(14.07%±3.83% vs 3.99%±1.36%, t = -4.293, P<0.05); HepG2细胞线粒体跨膜电位(ΔΨm)明显降低(t = -4.586, P<0.05); caspase-9和caspase-3的活性显著升高(P<0.05或P<0.01).
结论: 人肝癌细胞HepG2是VSV敏感细胞株, VSV感染HepG2导致细胞线粒体ΔΨm下降, 激活caspase-9进而活化下游caspase-3, 最终通过内源性线粒体通路诱导细胞凋亡.
引文著录: 连海, 汤晶, 孙玉成, 张爽. 溶癌水泡性口炎病毒体外诱导人肝癌细胞HepG2凋亡的作用机制. 世界华人消化杂志 2011; 19(7): 667-673
Revised: February 21, 2011
Accepted: March 2, 2011
Published online: March 8, 2011
AIM: To investigate the apoptosis-inducing effect of a laboratory-attenuated vesicular stomatitis virus (VSV) strain on HepG2 cells and to explore the underlying mechanisms.
METHODS: After HepG2 cells were infected with VSV at a multiplicity of infection (MOI) of 1.0, cell viability was determined by MTT assay; morphological assessment of apoptosis was performed by acridine orange (AO)/ethidium bromide (EB) and Hoechst/PI staining; apoptotic cells were quantified by annexin V/PI double-staining and cell cycle analysis; mitochondrial membrane potential (ΔΨm) was measured by JC-1 staining; and activation of caspase proteolytic cascade was measured with caspase-9, caspase-8 and -3 colorimetric assay kits.
RESULTS: The attenuated VSV strain could markedly inhibit HepG2 cell proliferation in a time-dependent manner. After HepG2 cells were exposed to VSV at an MOI of 1.0 for 24 h, the percentages of early apoptotic cells (26.46% ± 6.01% vs 4.86% ± 2. 28%, t = -5.817, P < 0.01) and cells in sub-G1 phase (14.07% ± 3.83% vs 3.99% ± 1.36%, t = -4.293, P < 0.05) were increased compared with mock-infected cells. VSV infection significantly decreased mitochondria membrane potential (ΔΨm) (t = -4.586, P < 0.05) and increased the activity of caspase-9 and caspase-3 (both P < 0.05).
CONCLUSION: Human hepatoma cell line HepG2 is highly susceptible to infection with oncolytic VSV. VSV can inhibit the proliferation of HepG2 cell and promote apoptosis through the intrinsic mitochondria pathway. VSV-induced collapse of the mitochondrial trans-membrane potential could exert a feedback effect to elicit caspase-9, and then lead to the activation of the key downstream factor caspase-3.
- Citation: Lian H, Tang J, Sun YC, Zhang S. Mechanisms underlying vesicular stomatitis virus-induced apoptosis of HepG2 cells in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(7): 667-673
- URL: https://www.wjgnet.com/1009-3079/full/v19/i7/667.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i7.667
原发性肝癌(primary hepatic carcinoma, PHC)是指来源于肝脏上皮细胞的恶性肿瘤, 包括肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管细胞癌、肝细胞胆管细胞混合癌等. 其中以HCC最常见, 占原发性肝癌的80%-90%[1]. HCC是全球第5大恶性肿瘤, 死亡率位居世界第三[2]. 近年来, 我国肝癌发病率呈上升趋势, 已超过非洲居世界首位. 全世界每年新增加的肝癌病例约60万例, 其中40%发生在我国[2]. 临床上用于肝癌最常用的治疗手段是手术治疗配合化疗药物治疗[3]. 但由于肝癌患者一般诊断较晚, 临床上能够接受手术治疗的肝癌患者不超过30%, 而切除肿瘤的患者手术后复发率又高达70%, 再加上许多化疗药物对正常组织和细胞的不良反应都很大[4,5], 因此, 目前迫切需要寻找能够有效杀死癌细胞而对正常细胞无毒性的新型抗癌制剂. 溶癌病毒是一类通过自然减毒或遗传修饰而在肿瘤细胞中具有复制能力的病毒, 经过高度稀释的溶癌病毒能利用肿瘤细胞中抑癌基因的失活或缺陷, 选择性地在靶细胞内复制, 最终导致肿瘤细胞的溶解和死亡, 而在正常细胞内他只是少量存在或不能增殖[6,7]. 最近几年, 溶癌病毒的研究发展迅速, 特别是运用一些增殖型病毒来治疗癌症开始备受瞩目. 水泡性口炎病毒(vesicular stomatitis virus, VSV)是一种增殖型溶癌病毒, 属于有囊膜的单股负链RNA病毒, 是弹状病毒科(rhabdoviridae)水泡病毒属(vesiculovirus)的典型成员之一[8]. VSV能够诱导多种肿瘤细胞凋亡, 又能激活树突状细胞促进肿瘤抗原的提呈[9,10], 以上特点使其成为一种极具潜力的新型抗癌制剂. 为了探索一株实验室减毒VSV对肝癌细胞的溶癌作用, 本研究以人肝癌细胞HepG2为研究对象, 评价了VSV对HepG2细胞的凋亡诱导作用并试图阐明其相关信号机制, 为其进一步应用于肝癌防治奠定基础.
印第安纳株水泡性口炎病毒(VSV-IND)由本实验室保存, 在BHK-21细胞上经多次传代减毒, 病毒滴度为6×107 PFU. HepG2细胞购自中国科学院上海生命科学研究院细胞库, 由本室传代并保存. 细胞生长于100 mL/L新生犊牛血清的RPMI 1640培养基中, 50 mL/L CO2 37 ℃培养. RPMI 1640培养液、新生犊牛血清和谷氨酰胺购自Gibco公司; 胰蛋白酶和胎牛血清购自Hyclone公司. MTT、AO/EB、Hoechst33342/PI双染试剂盒、细胞周期检测试剂盒、Annexin V-FITC凋亡检测试剂盒、JC-1染色试剂盒以及caspase-3、8和9活性检测试剂盒均购自南京凯基生物技术有限公司.
1.2.1 VSV感染HepG2细胞: 将HepG2细胞用胰酶分散后, 培养于6孔培养板(1×106/孔), 培养细胞丰度达80%后, 用PBS洗2次, 将VSV接种于HepG2细胞[感染复数(multiplicity of infection, MOI) = 1.0], 同时设接种相同体积培养液的Mock感染组. 吸附40 min, 洗去未吸附的病毒, 添加含有20 mL/L胎牛血清的RPMI 1640维持液.
1.2.2 VSV感染HepG2细胞的MTT检测: 将VSV感染HepG2细胞后, 分别于感染后6、12、18、24、30 h, 加入MTT溶液(5 g/L, 溶于PBS中)20 μL, 37 ℃, 50 mL/L CO2继续培养4 h, 中止培养, 小心吸弃孔内培养上清液. 每孔加入150 μL DMSO, 震荡10 min, 使结晶物充分溶解. 酶联免疫检测仪上读取各孔A490值, 计算细胞存活率[存活率(%) = 实验组细胞A值/对照组细胞A值×100%].
1.2.3 AO/EB染色分析: 用细胞刮刀收集经VSV感染的HepG2细胞, PBS洗涤细胞二次(离心2 000 r/min, 5 min)收集并调整细胞浓度为5×105/mL. 用1 μL AO/EB溶液(1份PBS中100 mg/L AO溶液, 1份PBS中100 mg/L EB溶液)孵育25 μL悬浮细胞(0.5×106-2.0×106), 轻微混合. 置10 μL悬浮细胞于显微载玻片上, 加盖玻片, 荧光显微镜510 nm激发波长观察至少200个细胞.
1.2.4 Hoechst 33342/PI双染色分析: 用细胞刮刀收集经VSV感染的HepG2细胞, PBS洗涤细胞2次(离心2 000 r/min, 5 min)收集并调整细胞浓度为1×105/mL. 加入10 μL Heochst 33342染液, 混匀, 37 ℃孵育5-15 min; 细胞于4 ℃, 1 000 r/min离心5 min弃去上清液; 加入1.0 mL Buffer A工作液悬浮细胞, 加入5 μL PI染液, 室温避光放置5-15 min后混匀; 置10 μL悬浮细胞于显微载玻片上, 加盖玻片, 荧光显微镜488 nm激发波长观察至少200个细胞.
1.2.5 VSV感染HepG2细胞sub-G1峰检测: 用细胞刮刀收集经VSV感染的HepG2细胞, PBS洗涤细胞1次(离心2 000 r/min, 5 min)收集并调整细胞浓度为1×106/mL. 制备的单细胞悬液用体积分数为700 mL/L乙醇固定, 4 ℃保存, 染色前用PBS洗去固定液. 加100 μL RNase A 37 ℃水浴30 min, 再加入400 μL PI染色混匀, 4 ℃避光30 min, 上机检测, 记录激发波长488 nm处红色荧光.
1.2.6 VSV感染HepG2细胞凋亡检测: 用细胞刮刀收集经VSV感染的HepG2细胞, PBS洗涤细胞一次(离心2 000 r/min, 5 min)收集并调整细胞浓度为5×105/mL. 加入500 μL的Binding Buffer悬浮细胞, 加入5 μL Annexin V-FITC混匀后, 加入5 μL碘化丙碇(propidium iodide, PI)混匀, 室温避光反应10 min. 上机检测, 激发波长为488 nm, Annexin V-FITC的绿色荧光通过FITC通道(FL1)检测, PI红色荧光通过PI通道(FL3)检测.
1.2.7 VSV感染HepG2细胞JC-1染色分析: 用细胞刮刀收集经VSV感染的HepG2细胞, 用PBS洗涤细胞2次(离心2 000 r/min, 5 min), 收集不多于1×106的细胞. 吸取500 μL 1×Incubation Buffer, 加入1 μL JC-1, 涡旋混匀配成JC-1工作液. 取500 μL JC-1工作液将细胞均匀悬浮, 37 ℃, 50 mL/L CO2的培养箱中孵育15-20 min. 室温离心(2 000 r/min, 5 min)收集细胞, 用1×Incubation Buffer洗两次, 吸取500 μL 1×Incubation Buffer重新悬浮细胞. 上机检测, 绿色荧光通过FITC通道通常为FL1来检测; 红色荧光通过PI通道通常为FL2来检测.
1.2.8 VSV感染HepG2细胞caspase活性检测: 用细胞刮刀收集经VSV感染的HepG2细胞, 用PBS洗涤细胞2次(离心2 000 r/min, 5 min), 收集不多于5×106的细胞. 在收集的沉淀细胞中加入50 μL冰冷Lysis Buffer, 吹打均匀. 置冰上裂解20-60 min, 其间涡旋振荡3-4次, 4 ℃离心(10 000 r/min)1 min, 小心吸取上清转移至新的管中, 并放置冰上待用. 取少量上清(1-2 μL), 常规方法测定其中的蛋白浓度. 吸取50 μL含100-200 μg蛋白的细胞或组织裂解上清, 加入50 μL的2×Reaction Buffer, 加入5 μL caspase-3(caspase-8或9)Substrate并于37 ℃避光孵育4 h. 用酶标仪在λ = 405 nm或400 nm测定其A值.
统计学处理 采用SPSS10.0软件Student's t-test, 所有数据以mean±SD表示, P<0.05为有显著差异.
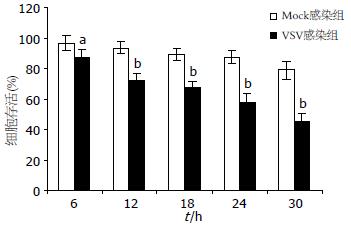
VSV感染HepG2细胞6、12、18、24和30 h后, MTT法检测HepG2细胞的A值, 计算细胞存活率. 结果如图1所示, VSV感染HepG2细胞6 h后, 细胞存活率, 明显低于Mock感染组(87.3%±5.6% vs 96.7%±4.8%, t = 2.631, P<0.05); VSV感染HepG2细胞30 h后, 细胞存活率仅为45.5%±5.2%, 与Mock感染组(78.9%±6.1%)相比, 差异极显著(t = 8.641, P<0.01). 说明溶癌VSV能够明显抑制人肝癌细胞HepG2的增殖.
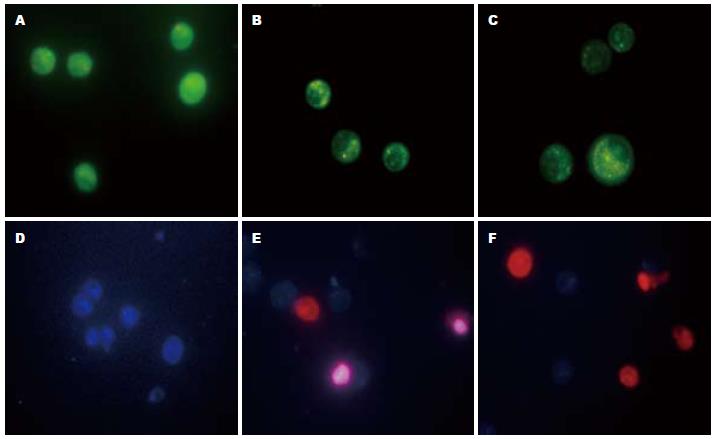
AO/EB染色结果显示, VSV感染后细胞染色质分布不均, 个别细胞核膜溶解, 染色质边集, 而正常细胞呈均质绿色. Hoechst/PI染色结果显示, VSV感染后细胞核呈现固缩浓染等凋亡形态学变化, 随着感染时间增加, 坏死细胞也开始增多(图2).
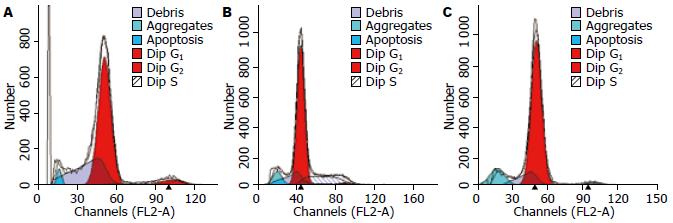
结果如图3所示, VSV感染12 h后凋亡细胞比例为8.76%±2.36%(t = -3.029, P<0.05), 24 h达到14.07%±3.83%(t = -4.293, P<0.05), 而Mock感染凋亡比例仅为3.99%±1.36%.
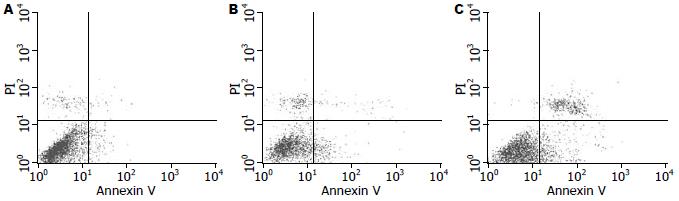
通过Annexin V和PI对HepG2细胞进行双标记后, 用流式细胞仪检测早期凋亡细胞. 随着感染时间的增加, 细胞早期凋亡率随之升高. VSV感染HepG2细胞12和24 h后, 细胞早期凋亡率分别为11.68%±3.8%(t = -2.664, P>0.05)和26.46%±6.01%(t = -5.817, P<0.01), Mock感染组细胞早期凋亡率为4.86%±2.28%(图4).
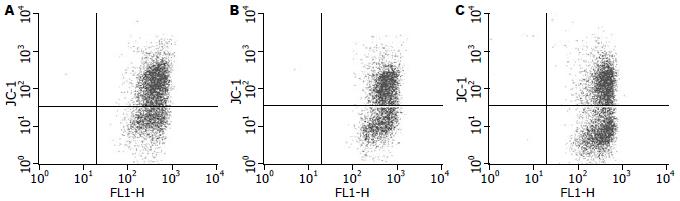
结果如图5所示, VSV感染12 h后即检测到HepG2细胞线粒体膜电位(ΔΨm)略微下降(t = -1.872, P>0.05), 24 h后HepG2细胞的线粒体ΔΨm下降细胞比例明显增加(t = -4. 586, P<0.05).
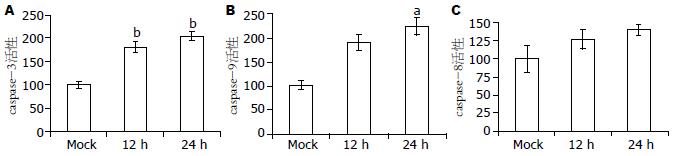
结果如图6所示, 与Mock感染组相比, VSV感染HepG2细胞24 h后, HepG2细胞内caspase-9(t = -2.965, P<0.05)与caspase-3(t = -9.529, P<0.01)的活性明显升高, caspase-8的活性略有升高(t = -0.978, P>0.05).
HCC是发病率最高的恶性肿瘤之一, 在我国也是癌症导致死亡的主要原因. 在世界范围内, 每年HCC的发患者数约为50万, 占人类癌症总发患者数的6%[11], 其中绝大多数病例出现在发展中国家, 尤其以中国、东亚和非洲国家的发病率最高[12]. HCC患者的存活率很低, 通常由于其起病隐匿, 侵袭性生长快速, 诊断较晚而预后很差, 近些年来其发病率和死亡率有逐年升高的趋势[1,12]. 对于PHC, 传统治疗模式疗效有限, 基因治疗代表肿瘤治疗的发展方向. 目前通常采用经遗传改造的无增殖能力的病毒, 或需有辅助病毒存在条件下才能进行复制的病毒缺陷株作为基因治疗的载体, 然而这类病毒载体存在共同的缺陷, 即在无复制能力的情况下无法保证充分的转导效率, 从而难以达到理想的治疗效果[13]. 因此, 需要一类具有复制能力的肿瘤杀伤型病毒, 这类病毒并不是外源基因的载体, 而是依靠病毒本身的特异性, 能够以肿瘤细胞为靶细胞, 在肿瘤细胞中复制以将其杀死并裂解, 释放出的子代病毒又可进一步感染周围的肿瘤细胞, 这类病毒又被称为溶癌病毒[7,14]. 目前正在研究开发的复制型溶癌病毒主要包括呼肠孤病毒[15], 新城疫病毒[16], 麻疹病毒[17]和VSV[18]. VSV是一种有囊膜负链RNA病毒, 能够感染多种哺乳动物细胞和昆虫细胞. 人感染VSV后一般无症状或出现轻微发热等类似流感的症状[19]. VSV能够选择性杀伤多种肿瘤细胞, 包括P53, Ras或Myc功能异常的肿瘤细胞, 像恶性胶质瘤, 结直肠癌, 胰腺癌和乳腺癌细胞[18,20-22]. VSV也被用于靶向治疗像白血病, 肝细胞癌, 鼻咽癌和膀胱癌等[23-26], 但其溶癌机制并未完全阐明.
目前认为, VSV能够选择性杀死肿瘤细胞主要是由于多种肿瘤细胞的抗病毒干扰素α和β通路被抑制[8]. 以前的研究也已表明, 几种人肝癌细胞系存在弱的干扰素反应, 其中包括人HepG2细胞[27]. 因此, 本研究选择人肝癌细胞HepG2为研究对象, 评价了一株实验室减毒VSV对人肝癌细胞的生长抑制作用. 结果表明, 随着VSV感染时间的增加, HepG2细胞的存活率显著降低, 呈明显的时间依赖性. 形态学研究结果表明, 减毒VSV在体外能够有效的诱导HepG2细胞凋亡. 细胞凋亡是细胞在一定的生理或病理条件下, 遵循自身程序, 由基因控制的细胞自主性死亡方式, 他与细胞增殖的动态平衡是维系生长发育、内环境稳定和免疫调节所必需的基本过程[28]. 细胞凋亡的信号转导途径很复杂, 存在多种转导途径. 目前, 已知有两种主要的转导途径, 死亡受体介导的外源性途径和线粒体参与的内源性途径[29]. 本研究通过Annexin V-FITC/PI双染法结合细胞周期分析sub-G1凋亡峰值评价了减毒VSV对HepG2细胞的凋亡诱导作用, 结果显示, VSV感染24 h后早期凋亡细胞数目为26.46%±6.01%(P<0.01), sub-G1峰细胞数目为14.07%±3.83%(P<0.05), 说明减毒VSV能够快速诱导HepG2细胞凋亡. 另外, 随着VSV感染时间的延长, HepG2细胞线粒体ΔΨm逐渐缺失(P<0.05), 说明VSV感染造成HepG2细胞线粒体严重受损. 为了进一步评价减毒VSV诱导HepG2细胞凋亡的信号传导通路, 我们接下来检测了细胞caspase-3, caspase-8及caspase-9的活性变化, 结果显示, VSV感染后显著激活caspase-9(P<0.05)和caspase-3(P<0.01).
总之, 我们认为人肝癌细胞HepG2是VSV敏感细胞株, VSV感染HepG2细胞后, 主要作用于细胞线粒体, 导致细胞线粒体ΔΨm下降, 激活caspase-9进而活化下游caspase-3, 最终通过内源性线粒体通路诱导HepG2细胞凋亡. 本研究首次阐明减毒VSV诱导人肝癌细胞HepG2凋亡的作用机制, 这些结果必将为进一步开发基于VSV的新一代溶癌制剂, 并为其合理应用于肝癌防治提供新的理论思路.
溶癌病毒是一类具有复制能力的肿瘤杀伤型病毒. 这类病毒可以依靠病毒本身的特异性在肿瘤细胞中复制而杀死并裂解肿瘤细胞, 从中释放出来的病毒又可以进一步感染周围的肿瘤细胞, 以此达到理想的治疗效果. 水泡性口炎病毒(VSV)是一种增殖型溶癌病毒, VSV在体外能够诱导多种肿瘤细胞凋亡, 但其溶癌机制并未完全阐明.
任浩, 副教授, 中国人民解放军第二军医大学微生物学教研室
目前正在研究开发的复制型溶癌病毒主要包括呼肠孤病毒、新城疫病毒、麻疹病毒和VSV. VSV具有生长迅速、复制快、安全性高等特点, 能够先于机体产生抗体之前就杀死肿瘤细胞, 因此, VSV作为新型溶癌病毒近年来受到了越来越多的关注.
Shinozaki等研究发现, 经肝动脉灌注溶癌VSV可显著延长大鼠转移性肝癌模型的生存期, 而且并未造成正常肝实质损害, 证实VSV是一种有效、安全的溶癌制剂. 谭龙益等报道, VSV对肝癌细胞具有选择性感染和溶解作用, 但其溶癌机制并不清楚.
本研究选择人肝癌细胞HepG2为研究对象, 评价了VSV对人肝癌细胞的溶癌机制. 结果表明, VSV感染HepG2细胞后, 主要作用于细胞线粒体, 激活caspase-9和caspase-3.
本研究将为进一步开发基于VSV的溶癌制剂并将其应用于肝癌治疗奠定基础.
本文学术性较好, 具有较好的基础和临床研究价值.
编辑: 李军亮 电编:何基才
| 1. | Shariff MI, Cox IJ, Gomaa AI, Khan SA, Gedroyc W, Taylor-Robinson SD. Hepatocellular carcinoma: current trends in worldwide epidemiology, risk factors, diagnosis and therapeutics. Expert Rev Gastroenterol Hepatol. 2009;3:353-367. [PubMed] [DOI] |
| 3. | Rampone B, Schiavone B, Martino A, Viviano C, Confuorto G. Current management strategy of hepatocellular carcinoma. World J Gastroenterol. 2009;15:3210-3216. [PubMed] [DOI] |
| 4. | Charette N, De Saeger C, Lannoy V, Horsmans Y, Leclercq I, Stärkel P. Salirasib inhibits the growth of hepatocarcinoma cell lines in vitro and tumor growth in vivo through ras and mTOR inhibition. Mol Cancer. 2010;9:256. [PubMed] [DOI] |
| 5. | Stefaniuk P, Cianciara J, Wiercinska-Drapalo A. Present and future possibilities for early diagnosis of hepatocellular carcinoma. World J Gastroenterol. 2010;16:418-424. [PubMed] [DOI] |
| 6. | Fukuhara H, Homma Y, Todo T. Oncolytic virus therapy for prostate cancer. Int J Urol. 2010;17:20-30. [PubMed] [DOI] |
| 7. | Stanford MM, Breitbach CJ, Bell JC, McFadden G. Innate immunity, tumor microenvironment and oncolytic virus therapy: friends or foes? Curr Opin Mol Ther. 2008;10:32-37. [PubMed] |
| 8. | Giedlin MA, Cook DN, Dubensky TW Jr. Vesicular stomatitis virus: an exciting new therapeutic oncolytic virus candidate for cancer or just another chapter from Field's Virology? Cancer Cell. 2003;4:241-243. [PubMed] [DOI] |
| 9. | Gaddy DF, Lyles DS. Oncolytic vesicular stomatitis virus induces apoptosis via signaling through PKR, Fas, and Daxx. J Virol. 2007;81:2792-2804. [PubMed] [DOI] |
| 10. | Ahmed M, Mitchell LM, Puckett S, Brzoza-Lewis KL, Lyles DS, Hiltbold EM. Vesicular stomatitis virus M protein mutant stimulates maturation of Toll-like receptor 7 (TLR7)-positive dendritic cells through TLR-dependent and -independent mechanisms. J Virol. 2009;83:2962-2975. [PubMed] [DOI] |
| 12. | Van Thiel DH, Ramadori G. Non-Viral Causes of Hepatocellular Carcinoma. J Gastrointest Cancer. 2010; Sep 7. [Epub ahead of print]. [PubMed] |
| 14. | Russell SJ, Peng KW. The utility of cells as vehicles for oncolytic virus therapies. Curr Opin Mol Ther. 2008;10:380-386. [PubMed] |
| 15. | Thirukkumaran C, Morris DG. Oncolytic viral therapy using reovirus. Methods Mol Biol. 2009;542:607-634. [PubMed] [DOI] |
| 16. | Ravindra PV, Tiwari AK, Sharma B, Chauhan RS. Newcastle disease virus as an oncolytic agent. Indian J Med Res. 2009;130:507-513. [PubMed] |
| 17. | Galanis E. Therapeutic potential of oncolytic measles virus: promises and challenges. Clin Pharmacol Ther. 2010;88:620-625. [PubMed] [DOI] |
| 18. | Ahmed M, Puckett S, Lyles DS. Susceptibility of breast cancer cells to an oncolytic matrix (M) protein mutant of vesicular stomatitis virus. Cancer Gene Ther. 2010;17:883-892. [PubMed] [DOI] |
| 19. | Lichty BD, Power AT, Stojdl DF, Bell JC. Vesicular stomatitis virus: re-inventing the bullet. Trends Mol Med. 2004;10:210-216. [PubMed] [DOI] |
| 20. | Ozduman K, Wollmann G, Piepmeier JM, van den Pol AN. Systemic vesicular stomatitis virus selectively destroys multifocal glioma and metastatic carcinoma in brain. J Neurosci. 2008;28:1882-1893. [PubMed] [DOI] |
| 21. | Shinozaki K, Ebert O, Woo SL. Treatment of multi-focal colorectal carcinoma metastatic to the liver of immune-competent and syngeneic rats by hepatic artery infusion of oncolytic vesicular stomatitis virus. Int J Cancer. 2005;114:659-664. [PubMed] [DOI] |
| 22. | Miller JM, Bidula SM, Jensen TM, Reiss CS. Vesicular stomatitis virus modified with single chain IL-23 exhibits oncolytic activity against tumor cells in vitro and in vivo. Int J Infereron Cytokine Mediator Res. 2010;2010:63-72. [PubMed] |
| 23. | Tumilasci VF, Olière S, Nguyên TL, Shamy A, Bell J, Hiscott J. Targeting the apoptotic pathway with BCL-2 inhibitors sensitizes primary chronic lymphocytic leukemia cells to vesicular stomatitis virus-induced oncolysis. J Virol. 2008;82:8487-8499. [PubMed] [DOI] |
| 24. | Marozin S, De Toni EN, Rizzani A, Altomonte J, Junger A, Schneider G, Thasler WE, Kato N, Schmid RM, Ebert O. Cell cycle progression or translation control is not essential for vesicular stomatitis virus oncolysis of hepatocellular carcinoma. PLoS. One. 2010;5:e10988. [PubMed] [DOI] |
| 25. | Alajez NM, Mocanu JD, Shi W, Chia MC, Breitbach CJ, Hui AB, Knowles S, Bell JC, Busson P, Takada K. Efficacy of systemically administered mutant vesicular stomatitis virus (VSVDelta51) combined with radiation for nasopharyngeal carcinoma. Clin Cancer Res. 2008;14:4891-4897. [PubMed] [DOI] |
| 26. | Hadaschik BA, Zhang K, So AI, Fazli L, Jia W, Bell JC, Gleave ME, Rennie PS. Oncolytic vesicular stomatitis viruses are potent agents for intravesical treatment of high-risk bladder cancer. Cancer Res. 2008;68:4506-4510. [PubMed] [DOI] |
| 27. | Melén K, Keskinen P, Lehtonen A, Julkunen I. Interferon-induced gene expression and signaling in human hepatoma cell lines. J Hepatol. 2000;33:764-772. [PubMed] [DOI] |
| 28. | Gregory CD, Pound JD. Microenvironmental influences of apoptosis in vivo and in vitro. Apoptosis. 2010;15:1029-1049. [PubMed] [DOI] |
| 29. | Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol. 2010;11:621-632. [PubMed] [DOI] |