修回日期: 2011-01-04
接受日期: 2011-01-11
在线出版日期: 2011-02-28
目的: 探讨IGF-1诱导的大鼠结肠平滑肌细胞(SMC)产生干细胞因子(SCF)的信号途径.
方法: 以不同时间(0, 5, 15, 30, 45, 60 min)、不同浓度(0, 50, 100, 150 μg/L)的IGF-1诱导结肠SMC; 以ERK1/2 siRNA干扰质粒转染大鼠结肠SMC, RT-PCR及Western blot检测IGF-1诱导下结肠SMC产生ERK1/2及SCF的变化.
结果: 在15 min时IGF-1诱导结肠SMC表达磷酸化ERK1/2最强(0.417±0.036 vs 0.101±0.015, P<0.05). 在100 μg/L作用15 min时磷酸化ERK1/2和SCF表达最强(0.790±0.051 vs 0.336±0.013; 0.765±0.061 vs 0.289±0.021, 均P<0.05). 在IGF-1诱导下, 转染入ERK1/2 siRNA的结肠SMC产生的p-ERK1/2、t-ERK1/2及SCF较对照组明显降低(0.284±0.021 vs 0.732±0.005; 0.256±0.015 vs 0.712±0.023; 0.219±0.020 vs 0.673±0.013; 0.621±0.027 vs 1.725±0.012; 0.821±0.019 vs 1.751±0.043; 0.275±0.061 vs 0.531±0.047; 均P<0.05).
结论: IGF-1可以使结肠SMC表达磷酸化ERK1/2和SCF增加. ERK1/2 siRNA可使ERK1/2和结肠SMC产生的SCF明显降低, 从而证实IGF-1促进大鼠结肠SMC产生SCF是通过ERKMAPK通路.
引文著录: 袁玉丰, 余盈娟, 林琳. ERK1/2 siRNA干扰质粒对IGF-1诱导结肠平滑肌细胞产生干细胞因子的影响. 世界华人消化杂志 2011; 19(6): 575-580
Revised: January 4, 2011
Accepted: January 11, 2011
Published online: February 28, 2011
AIM: To investigate how insulin-like growth factor-1 (IGF-1) regulates the expression of stem cell factor (SCF) in colonic smooth muscle cells (SMCs).
METHODS: After rat colonic SMCs were treated with different concentrations of IGF-1 (0, 50, 100, 150 μg/L) for different durations (0, 5, 15, 30, 45, 60 min), the levels of phosphorylated ERK1/2 and SCF were determined by RT-PCR and Western blot. Rat colonic SMCs were then transfected with siRNA against ERK1/2 to examine the impact of ERK1/2 down-regulation on IGF-1-induced SCF expression.
RESULTS: After treatment with IGF-1, the level of phosphorylated ERK1/2 in colonic SMCs reached a peak at about 15 min (0.417 ± 0.036 vs 0.101 ± 0.015; P < 0.05). The optimal concentration of IGF-1 to induce the expression of phosphorylated ERK1/2 and SCF was 100 μg/L (0.790 ± 0.051 vs 0.336 ± 0.013; 0.765 ± 0.061 vs 0.289 ± 0.021, both P < 0.05). After treatment with IGF-1, the expression levels of phosphorylated ERK1/2, total ERK1/2, and SCF in colonic SMCs transfected with siRNA against ERK1/2 were lower than those in the control group (0.284 ± 0.021 vs 0.732 ± 0.005; 0.256 ± 0.015 vs 0.712 ± 0.023; 0.219 ± 0.020 vs 0.673 ± 0.013; 0.621 ± 0.027 vs 1.725 ± 0.012; 0.821 ± 0.019 vs 1.751 ± 0.043; 0.275 ± 0.061 vs 0.531 ± 0.047; all P < 0.05).
CONCLUSION: IGF-1 treatment up-regulated the expression of phosphorylated ERK1/2 and SCF in colonic SMCs, while transfection with siRNA against ERK1/2 down-regulated IGF-1-induced expression of phosphorylated ERK1/2 and SCF, suggesting that the ERK/MAPK pathway may be involved in IGF-1-induced expression of phosphorylated ERK1/2 and SCF.
- Citation: Yuan YF, Yu YJ, Lin L. Transfection with siRNA against ERK1/2 inhibits IGF-1-induced stem cell factor expression in colonic smooth muscle cells. Shijie Huaren Xiaohua Zazhi 2011; 19(6): 575-580
- URL: https://www.wjgnet.com/1009-3079/full/v19/i6/575.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i6.575
胃肠动力障碍性疾病与胃肠道Cajal间质细胞(interstitial cells of Cajal, ICC)的缺失或病变有关, 干细胞因子(stem cell factor, SCF)作为ICC生长、功能及表型维持的主要调控因子, 是影响ICC数量和超微结构改变的直接原因. 研究发现, 胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)可调控胃平滑肌细胞(smooth muscle cell, SMC)合成SCF, 进而对胃ICC有保护作用[1]. 我们前期实验发现, IGF-1能促进体外培养的胃和结肠SMC合成SCF, 呈浓度和时间依赖性[2-4]; 且在细胞水平发现胃结肠SMC该作用是通过ERKMAPK通路完成的[3,4]. 本实验从基因水平进一步证实IGF-1诱导大鼠结肠SMC表达SCF的信号通路.
ERK1/2 siRNA由Invitrogen公司合成, 序列参照文献[5], ERK1/2 siRNA序列为: 5'-GCCGCCGCCGCCGCCAT-3', 与MAPK mRNA翻译起始部位的17个碱基序列互补; 随机核苷酸序列: 5'-CGCGCGCTCGCGCACCC-3'. SD大鼠, 雌雄不拘, 体质量180-200 g(南京医科大学动物中心提供). DMEM培养液、胎牛血清(Gibco公司); 大豆胰蛋白酶抑制剂(Gibco, USA); Ⅱ型胶原酶(Sigma公司); 重组大鼠IGF-1(R&D, UK); SCF抗体(Santa Cruz, USA); phospho-p44/42 MAPK抗体、p44/42 MAPK抗体(CST, USA).
1.2.1 结肠SMC的分离和培养: SD大鼠断椎处死, 快速取自肛门上2 cm至回盲部的全部结肠, 含抗生素的缓冲液反复漂洗、仔细剥离黏膜层和浆膜层. 将平滑肌组织减碎匀浆, 置入消化液(0.1%的Ⅱ型胶原酶和0.01%的大豆胰蛋白酶抑制剂)中, 30 ℃消化20 min, 1 000 r/min离心5 min、弃消化液, 反复2次, 加入含100 mL/L胎牛血清的DMEM培养液终止消化, 1 000 r/min离心5 min, DMEM培养液重悬细胞、过筛、50 mL/L CO2、37 ℃孵育箱中培养, SMC长至致密单层时, 传代培养. 用3-5代SMC进行实验.
1.2.2 转染: 按FuGENE®步骤进行操作: (1)将状态良好、处于对数生长期的SMC用2.5 g/L胰酶、完全培养基悬浮成单细胞悬液, 按照每孔3-6×106个细胞接种于6孔板中; (2)补充完全培养液至2 mL, 细胞生长稳定且细胞贴壁覆盖率70%-80%左右时, 进行转染实验; (3)用100 μL无血清DMEM培养液稀释2 μg质粒; (4)震荡混悬FuGENE®, 将6 μL FuGENE®加入质粒稀释液; (5)充分混合, 室温孵育15 min; (6)将质粒复合物缓慢加入各培养皿中(加有2 mL不含抗生素的完全培养液)、混匀、置于37 ℃、50 mL/L的CO2培养箱中培养; (7)第2天观察转染效率, 培养48 h.
1.2.3 分组: SMC+IGF-1(100 μg/L)[3], 分别培养0, 5, 15, 30, 45, 60 min. 不同浓度组: SMC+IGF-1(0, 50, 100, 150 μg/L)培养15 min. 转染组: 将结肠SMC分为对照组、反义组(加入ERK1/2 siRNA)、随机组(加入随机核苷酸), 培养48 h, 再加入100 μg/L IGF-1培养16 h. 以上实验重复3次.
1.2.4 RP-PCR法检测总ERK1、ERK2和SCF mRNA: 按TRIzol试剂提取各组细胞的总mRNA, 以cDNA为模板进行PCR扩增. (1)SCF和内参GAPDH的循环条件: 94 ℃预变性5 min、94 ℃变性15 s、55 ℃退火30 s、72 ℃延伸15 s、共循环30次, 最后于72 ℃延伸8 min. SCF上游引物: 5'-TTC GCT TGT AAT TGG CTT TGC-3'; 下游引物: 5'-CAA CTG CCC TTG TAA GAC TTG CA-3'(76 bp). GAPDH上游引物: 5'-CCC CCA ATG TAT CCG TTG TG-3'; 下游引物: 5'-TAG CCC AGG ATG CCC TTT AGT-3'(118 bp). (2)ERK1/2循环条件: 94 ℃预变性5 min、94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s、共循环30次, 最后于72 ℃延伸7 min. ERK1上游引物: 5'-TAC ACG CAG TTG CAG TAC ATC G-3'; 下游引物: 5'-CGC AGG ATC TGG TAG AGG AAG T-3'(332 bp); ERK2上游引物5'-GGA GCT TGT GGA AAT ACC TTG G-3'; 下游引物: 5'-GAC GCA GTG TTC CTC TCT GCT A-3'(499 bp)[6]. PCR产物经2%琼脂糖凝胶电泳、观察、拍照.
1.2.5 Western bolt法检测SMC中的p-ERK1/2、t-ERK1/2和SCF蛋白: 蛋白裂解液提取各组细胞蛋白, BCA法测定蛋白浓度. 40 μg蛋白/泳道加样, 恒流30 mA电泳, 恒压100 V转膜60 min, 封闭2 h. 分别加入p-ERK1/2、t-ERK1/2和SCF一抗, 4 ℃过夜; 二抗1:5 000, 37 ℃孵育, 曝光、显影.
统计学处理 所有数据录入SPSS10.0软件包分析, 以mean±SD表示, 采用方差分析和成组t检验, P<0.05为有显著性差异.
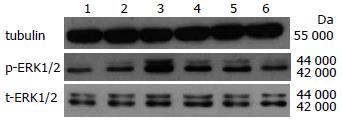
IGF-1(100 μg/L)作用于结肠SMC 5 min后p-ERK1/2表达开始增高, 15 min时表达最高(P<0.05), 之后逐渐降低, 但t-ERK1/2蛋白的表达无变化(P>0.05, 表1, 图1).
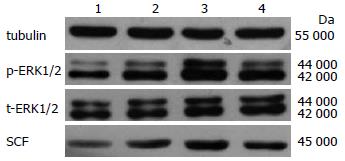
IGF-1在50 μg/L时, p-ERK1/2和SCF表达开始增加(P<0.05), 在100 μg/L时表达最多(P<0.05), 之后逐渐下降, 但t-ERK1/2没有变化(P>0.05, 表2, 图2).
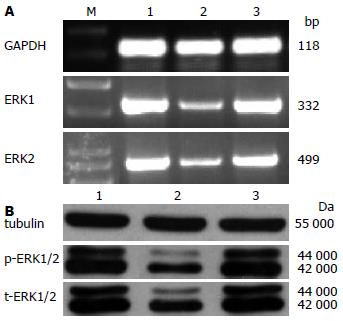
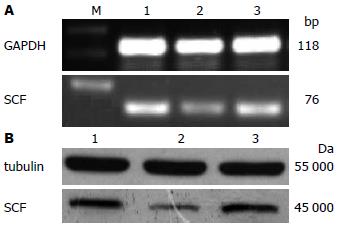
与对照组相比, 反义组结肠SMC产生p-ERK1/2、t-ERK1/2显著降低(P<0.05), 随机组无显著变化(P>0.05, 表3, 图3), 说明ERK1/2 siRNA确实降低了ERK1/2的表达.
胃肠动力障碍是消化科常见症候群(包括糖尿病胃肠动力障碍), 严重影响患者的生活质量, 其机制尚不清楚. ICC是一类起源于间充质的特殊细胞群, 以网状结构分布于消化系肠神经末梢和平滑肌细胞之间; ICC、肠神经细胞和SMC构成"功能元件", 共同调控胃肠道的各种生理功能[7,8]. 近年随着对胃肠道ICC结构、功能及其胃肠运动调控机制的深入研究, 已经证实ICC数量和结构异常与多种胃肠疾病相关[9-14].
SCF是一种多功能细胞生长因子, 包括可溶型干细胞因子(soluble stem cell factor, s-SCF)和膜结合型干细胞因子(membrane-bound stem cell factor, m-SCF), 两者都有生物学活性, 在多种细胞的增殖、分化和迁移过程中发挥重要的调控作用. 研究发现, 人体SCF可由多种细胞产生, 但维持胃肠ICC所需的SCF来源于胃肠SMC[1]. SCF与其天然配体c-Kit组成SCF-Kit系统, 直接参与ICC的分化、发育、增殖、表型维持等过程[15-18]. 我们的前期实验发现, SCF减少与胃肠ICC病变及胃肠运动障碍有直接关系, 给予外源性SCF可明显改善糖尿病模型鼠胃肠ICC及胃肠运动异常[16,19-20], 另外前期实验还提示, 体外培养胃和结肠SMC, 给予IGF-1可促进SCF表达[2-4].
IGF-1是胰岛素样生长因子家族中的一员, 具有促进细胞增殖和分化, 调节细胞周期, 加速细胞物质代谢, 抑制细胞凋亡等功能[21]. IGF-I的信号转导途径主要为P13K途径和MAPK途径[22]. 文献报道, IGF-1可使SMC表面的IGF-1 R磷酸化, 进而激活细胞内下游的信号通路, 主要通过PI3K、MAPK信号转导通路, 以协同或分别或以相反的作用方式, 参与IGF-1介导的细胞增殖、分化、抗凋亡等效应[23]. 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是细胞内的一类丝氨酸/苏氨酸蛋白激酶, 该家族主要包括细胞外信号调节蛋白激酶(extracellular regulating kinase, ERK)、c-Jun氨基末端激酶和P38蛋白激酶[24,25], 他将细胞外刺激信号转导至细胞内及细胞核内, 引起细胞一系列生物学反应如细胞增殖、分化、转化及凋亡[26,27]. ERK通路是迄今研究较多、备受关注的重要MAPK信号通路. 在细胞中各种因素[28,29]激活ERK1/2后, 活化的ERK1/2激酶移位到细胞核, 调控信号转导途径的关键效应分子(如NF-κB、AP-1、c-Myc等)的表达, 在细胞的增殖中起重要作用[30,31]. 我们前期实验将ERKMAPK的抑制剂PD98059加入结肠SMC、使IGF-1诱导的SCF表达降低, 提示IGF-1是通过ERKMAPK通路诱导结肠SMC产生SCF[2-4]. 本实验向结肠SMC转染ERK siRNA使p-ERK1/2、总ERK1/2和SCF表达均降低(包括mRNA和蛋白), 说明干扰成功, 进而从基因水平证实IGF-1诱导结肠SMC产生SCF确实通过ERKMAPK通路.
总之, 本实验从基因水平证实IGF-1诱导结肠SMC产生SCF的信号通路, 为进一步探讨SCF的调控、合成、保护胃肠ICC及其信号途径和影响因素提供了可靠的实验依据, 有利于进一步探讨胃肠ICC在胃肠动力障碍性疾病中的作用、为开发新的治疗药物拓展了思路.
胃肠动力障碍性疾病与胃肠道Cajal间质细胞(ICC)的缺失或病变有关, 干细胞因子(SCF)作为ICC生长、功能及表型维持的主要调控因子, 是影响ICC数量和超微结构改变的直接原因.
王钦红, 副教授, 美国杜克大学医学院肿瘤生物系
尽管已知IGF-1在多种细胞的增殖分化过程中扮演着重要角色, 但在胃肠道SMC中的具体作用机制尚不清楚.
Horvath等将糖尿病小鼠胃窦和胃体组织给予IGF-1, 可完全阻止ICC的减少, 提示IGF-1可能刺激平滑肌细胞表达干细胞因子, 进而对ICC起保护作用. 宁月季等在细胞水平用IGF-1刺激大鼠胃和结肠SMC, 发现IGF-1通过ERKMAPK通路刺激SMC产生SCF.
本研究首次应用RNA干扰技术对结肠SMC进行干预, 结果证实了IGF-1调控SMC产生SCF的信号通路.
IGF-1通过ERKPAPK通路刺激结肠SMC表达SCF, 从而对ICC起调控作用, 从而为临床治疗胃肠动力障碍性疾病提供了新的理论依据.
本文新颖性较好, 为更好地理解IGF-1调控SCF产生的机制提供实验理论基础.
编辑: 李薇 电编:何基才
| 1. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 2. | 宁 月季, 张 蔚, 成 家飞, 李 学良, 王 美峰, 林 琳. 胰岛素样生长因子1对大鼠结肠平滑肌细胞中干细胞因子表达的影响. 世界华人消化杂志. 2009;17:3502-3506. [DOI] |
| 5. | Glennon PE, Kaddoura S, Sale EM, Sale GJ, Fuller SJ, Sugden PH. Depletion of mitogen-activated protein kinase using an antisense oligodeoxynucleotide approach downregulates the phenylephrine-induced hypertrophic response in rat cardiac myocytes. Circ Res. 1996;78:954-961. [PubMed] |
| 6. | 葛 金华, 朱 月永, 刘 豫瑞, 江 家冀, 董 箐. siRNA降低COX-2基因表达对肝癌细胞系HepG2增殖的影响. 世界华人消化杂志. 2009;17:2244-2250. [DOI] |
| 7. | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine. Am J Physiol Cell Physiol. 2005;288:C710-C720. [PubMed] [DOI] |
| 8. | Wang XY, Sanders KM, Ward SM. Intimate relationship between interstitial cells of cajal and enteric nerves in the guinea-pig small intestine. Cell Tissue Res. 1999;295:247-256. [PubMed] [DOI] |
| 9. | Nakahara M, Isozaki K, Hirota S, Vanderwinden JM, Takakura R, Kinoshita K, Miyagawa J, Chen H, Miyazaki Y, Kiyohara T. Deficiency of KIT-positive cells in the colon of patients with diabetes mellitus. J Gastroenterol Hepatol. 2002;17:666-670. [PubMed] [DOI] |
| 10. | Battaglia E, Bassotti G, Bellone G, Dughera L, Serra AM, Chiusa L, Repici A, Mioli P, Emanuelli G. Loss of interstitial cells of Cajal network in severe idiopathic gastroparesis. World J Gastroenterol. 2006;12:6172-6177. [PubMed] |
| 11. | Ward SM, Sanders KM. Physiology and pathophysiology of the interstitial cell of Cajal: from bench to bedside. I. Functional development and plasticity of interstitial cells of Cajal networks. Am J Physiol Gastrointest Liver Physiol. 2001;281:G602-G611. [PubMed] |
| 12. | Piotrowska AP, Solari V, Puri P. Distribution of interstitial cells of Cajal in the internal anal sphincter of patients with internal anal sphincter achalasia and Hirschsprung disease. Arch Pathol Lab Med. 2003;127:1192-1195. [PubMed] |
| 13. | Sperelakis N, Daniel EE. Activation of intestinal smooth muscle cells by interstitial cells of Cajal in simulation studies. Am J Physiol Gastrointest Liver Physiol. 2004;286:G234-G243. [PubMed] [DOI] |
| 14. | Forster J, Damjanov I, Lin Z, Sarosiek I, Wetzel P, McCallum RW. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings. J Gastrointest Surg. 2005;9:102-108. [PubMed] [DOI] |
| 15. | Ward SM, Ordög T, Bayguinov JR, Horowitz B, Epperson A, Shen L, Westphal H, Sanders KM. Development of interstitial cells of Cajal and pacemaking in mice lacking enteric nerves. Gastroenterology. 1999;117:584-594. [PubMed] [DOI] |
| 18. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 19. | 罗 云, 林 琳, 张 红杰, 李 学良, 吴 高珏, 王 美峰. 糖尿病慢传输运动结肠Cajal间质细胞和干细胞因子的变化. 世界华人消化杂志. 2007;15:458-463. [DOI] |
| 20. | 徐 丽明, 林 琳, 罗 云, 吴 高珏, 汤 玉蓉, 张 红杰, 李 学良. 糖尿病结肠动力障碍时Cajal间质细胞和干细胞因子的变化以及胰岛素的干预效应. 胃肠病学. 2008;13:200-204. |
| 21. | Ji RR, Suter MR. p38 MAPK, microglial signaling, and neuropathic pain. Mol Pain. 2007;3:33. [PubMed] [DOI] |
| 22. | Lim HJ, Park HY, Ko YG, Lee SH, Cho SY, Lee EJ, Jameson JL, Jang Y. Dominant negative insulin-like growth factor-1 receptor inhibits neointimal formation through suppression of vascular smooth muscle cell migration and proliferation, and induction of apoptosis. Biochem Biophys Res Commun. 2004;325:1106-1114. [PubMed] [DOI] |
| 23. | Dupont J, Dunn SE, Barrett JC, LeRoith D. Microarray analysis and identification of novel molecules involved in insulin-like growth factor-1 receptor signaling and gene expression. Recent Prog Horm Res. 2003;58:325-342. [PubMed] [DOI] |
| 24. | Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science. 2002;298:1911-1912. [PubMed] [DOI] |
| 25. | Bobick BE, Kulyk WM. Regulation of cartilage formation and maturation by mitogen-activated protein kinase signaling. Birth Defects Res C Embryo Today. 2008;84:131-154. [PubMed] [DOI] |
| 26. | Dinev D, Jordan BW, Neufeld B, Lee JD, Lindemann D, Rapp UR, Ludwig S. Extracellular signal regulated kinase 5 (ERK5) is required for the differentiation of muscle cells. EMBO Rep. 2001;2:829-834. [PubMed] [DOI] |
| 27. | Yu W, Liao QY, Hantash FM, Sanders BG, Kline K. Activation of extracellular signal-regulated kinase and c-Jun-NH(2)-terminal kinase but not p38 mitogen-activated protein kinases is required for RRR-alpha-tocopheryl succinate-induced apoptosis of human breast cancer cells. Cancer Res. 2001;61:6569-6576. [PubMed] |
| 28. | Chang F, Steelman LS, Lee JT, Shelton JG, Navolanic PM, Blalock WL, Franklin RA, McCubrey JA. Signal transduction mediated by the Ras/Raf/MEK/ERK pathway from cytokine receptors to transcription factors: potential targeting for therapeutic intervention. Leukemia. 2003;17:1263-1293. [PubMed] [DOI] |
| 29. | Reddy KB, Nabha SM, Atanaskova N. Role of MAP kinase in tumor progression and invasion. Cancer Metastasis Rev. 2003;22:395-403. [PubMed] [DOI] |
| 30. | Raviv Z, Kalie E, Seger R. MEK5 and ERK5 are localized in the nuclei of resting as well as stimulated cells, while MEKK2 translocates from the cytosol to the nucleus upon stimulation. J Cell Sci. 2004;117:1773-1784. [PubMed] [DOI] |