修回日期: 2010-12-28
接受日期: 2011-01-06
在线出版日期: 2011-02-18
目的: 探讨RNA干扰沉默Akt对人食管鳞癌细胞体外增殖、迁移及血管生成拟态(VM)形成的影响.
方法: 应用倒置荧光显微镜观察Akt的干扰质粒转染食管癌细胞Eca109后绿色荧光蛋白的表达; 采用Western blot方法检测Akt蛋白的表达; 四甲基偶氮唑蓝(MTT)法检测转染前后细胞增殖能力的变化; Transwell方法检测干扰前后细胞迁移能力的变化; 取24孔培养板每孔加入300 μL Matrigel原液, 待其凝固, 每孔内接种1 mL浓度为5×105/mL的各组细胞悬液, 培养12 h后观察并计数转染前后各组细胞的管状结构数量.
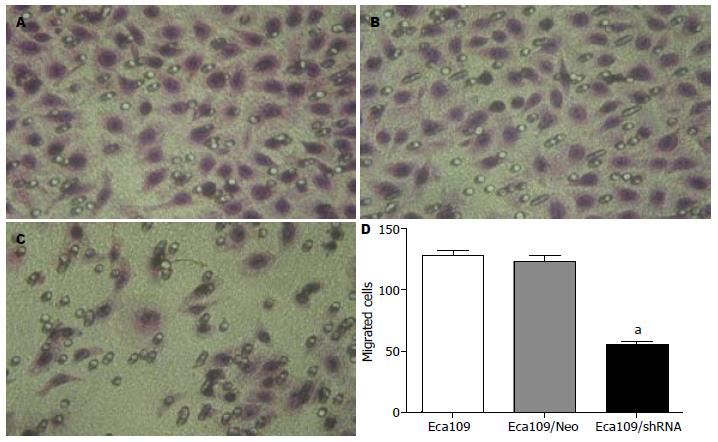
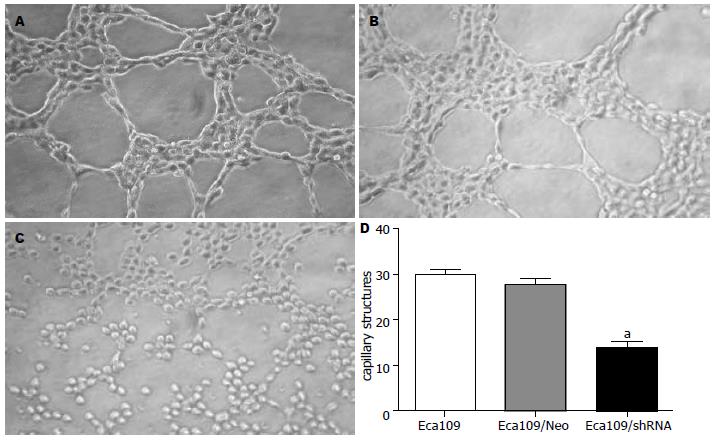
结果: Eca109/8单克隆干扰效果好, Western blot结果显示几乎无Akt表达. Akt被干扰后, 细胞增殖能力明显减弱(P<0.05), 运动迁移能力显著下降, 与未转染的细胞相比穿过人工基底膜的细胞数明显减少(59.33±2.87 vs 130.5±2.22, P<0.05). 三维培养提示干扰后细胞的管状结构数量明显减少(P<0.05).
结论: RNA干扰可引起Eca109中Akt的沉默, 而Akt表达下调后食管癌细胞株Eca109的增殖与迁移能力及VM能力均减弱. 推测阻断Akt通路有可能成为治疗人食管鳞癌的新靶点.
引文著录: 丁宗励, 施瑞华, 朱宏, 凌亭生, 郝波. RNA干扰Akt对食管癌细胞株Eca109生物学特性的影响. 世界华人消化杂志 2011; 19(5): 451-456
Revised: December 28, 2010
Accepted: January 6, 2011
Published online: February 18, 2011
AIM: To investigate the effect of RNA interference-mediated down-regulation of Akt on cell proliferation, migration, and vasculogenic mimicry formation in human esophageal squamous cell carcinoma cell line Eca109.
METHODS: Plasmids harboring small interfering RNA targeting the Akt gene were introduced into Eca109 cells by liposome-mediated transfection. The expression of Akt protein was measured by Western blot. The proliferation of Eca109 cells was determined by methyl thiazolyl tetrazolium (MTT) assay. The migration of Eca109 cells was evaluated by Transwell migration assay. Vasculogenic mimicry was evaluated by counting the number of capillary structures.
RESULTS: Akt expression was markedly down-regulated in Eca109/8 cell clone (transfected with the plasmid harboring small interfering RNA targeting the Akt gene). The expression of Akt protein in Eca109/8 cells could not be detected by Western blot. The proliferation of Eca109/8 cells decreased significantly compared with untransfected Eca109 cells (P < 0.05). Transwell migration assay showed that less Eca109/8 cells could move through the Transwell membrane when compared with untransfected Eca109 cells (59.33 ± 2.87 vs 130.5 ± 2.22, P < 0.05). Eca109 cells were capable of forming vasculogenic mimicry patterns in vitro. Silencing of the Akt gene could significantly suppress vasculogenic mimicry formation in Eca109 cells.
CONCLUSION: RNA interference-mediated down-regulation of Akt can attenuate the proliferation, migration, and vasculogenic mimicry formation of Eca109 cells. Blockade of the Akt pathway may provide a new approach to the treatment of human esophagus squamous cell carcinoma.
- Citation: Ding ZL, Shi RH, Zhu H, Ling TS, Hao B. RNA interference-mediated down-regulation of Akt attenuates cell proliferation and migration in human esophageal squamous cell carcinoma cell line Eca109. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 451-456
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/451.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.451
食管癌是常见恶性肿瘤之一, 位居第8位, 世界上90%以上的食管癌多为食管鳞状上皮细胞癌(esophageal squamous cell carcinoma, ESCC). 目前对食管癌的早期诊断率很低, 发现后多为中晚期, 早期转移和术后复发是造成食管癌死亡率居高不下的重要原因[1-3]. 目前研究结果提示食管癌是一种多基因异常疾病, 涉及癌基因的过表达和抑癌基因的突变、缺失等多方面的异常[4-9]. 蛋白激酶B(protein kinase B, PKB), 是一种相对分子质量大约为60 000 Da的蛋白激酶, 属于丝氨酸/苏氨酸蛋白激酶家族成员, 由于这种激酶是逆转录病毒Akt8癌基因v-Akt编码的蛋白产物, 故也称为Akt[10]. PKB/Akt是磷脂酰肌醇三磷酸激酶(phosphatidylinositol trisphosphate kinase, PI3K)下游的一个靶位点, 活化后的PKB/Akt在糖代谢、蛋白合成以及基因表达等过程中起着重要的调节作用[11]. PKB/Akt是细胞存活信号通路中的关键调节者, 能够促进细胞存活、抑制细胞凋亡. Akt的活化与肿瘤的发生发展密切相关, 如生长因子、细胞因子、PTEN的失活和Ras的激活等均可以导致Akt的活化[12]. 本研究通过建立食管癌细胞Eca109的稳定Akt干扰株, 探讨Akt下调后对Eca109的生物学行为等方面的影响.
人ESCC细胞株Eca109(中科院上海细胞所), pGCsi-Akt和阴性对照环形质粒(上海英骏公司)为携带绿色荧光蛋白(green fluorescent protein, GFP)报道基因, 并不干扰任何内源基因的短发状RNA载体. FBS DMEM(Hyclone), LipofectamineTM 2000(Invitrogen), 克隆环(Sigma), 兔抗人Akt mAb(Cell Signal Technology), 鼠抗人β-actin mAb(Sigma), 鼠抗人GAPDH mAb(Sigma), 人工基质Matrigel(BD公司).
1.2.1 细胞转染: 转染前1 d取对数生长期的Eca109细胞约2.0×105个接种于35 mm培养皿, 培养于不含抗生素的DMEM培养液, 次日观察细胞长至约70%-90%聚合开始转染. 取pGCsi-Akt质粒4 μg和LipofectamineTM 2000 10 μL分别稀释于250 μL不含抗生素的DMEM培养液, 5 min内混匀, 室温孵育20 min后加入培养皿. 6 h后更换新鲜的含100 mL/L胎牛血清DMEM培养液, 其后每2-3 d更换培养液. Eca109细胞转染后24 h按l:12的比例传代, 48 h后开始用含6 mg/L杀稻瘟菌素(筛选浓度在转染前制杀伤曲线后获得)的选择性培养液进行筛选, 约4 wk后挑取克隆在6 mg/L杀稻瘟菌素培养液中继续传代, 扩大培养. 同步转染阴性对照质粒. 将转染重组质粒pGCsi-shAkt及对应的阴性对照质粒的细胞分别命名为Eca109/shRNA及Eca109/Neo. 倒置荧光显微镜结合Western blot鉴定干扰效果.
1.2.2 Western blot: 细胞聚合后弃去培养液, 预冷PBS洗细胞2次, 加蛋白裂解液制备总蛋白, 超声破碎后4 ℃, 12 000 r/min, 离心10 min, 取上清. 采用BCA法定量蛋白浓度. 取总蛋白40 μg于100 ℃加热变性5 min后上样, 行40 mA稳流SDS PAGE电泳, 100 V稳压冰浴电转至PVDF膜, 50 g/L脱脂奶粉室温封闭1 h后TBST漂洗, 5 min×3, 加入适当浓度一抗(Akt 1:1 000, β-actin 1:4 000, GAPDH 1:8 000)4 ℃孵育过夜. 次日TBST漂洗5 min×3后再加HRP标记的二抗(羊抗鼠1:5 000,羊抗兔1:3 000)室温孵育1 h, TBST漂洗5 min×3. ECL化学发光法显影.
1.2.3 MTT法检测转染前后Eca109的增殖: 将不同细胞株按2 000/孔接种于96孔板, 与MTT(5 g/L)反应, 连续7 d, 最后1 d每孔加200 μL DMSO, 摇床振荡15 min溶解后, 在酶标仪上读取570 nm处的吸光度值(A值), 计算各组的A570均值, 绘制细胞增殖曲线.
1.2.4 Transwell实验检测转染前后Eca109的迁移能力: 采用孔径8 μm的24孔Transwell小室(corning). 用明胶均匀涂在小室下面晾干后, 上室加1×105个细胞, 总体积为200 μL. 下室加500 μL含100 mL/L胎牛血清的DMEM培养液. 24 h后甲醇固定, HE染色. 400倍光镜下随机取5个视野拍照, 计算穿膜细胞数.
1.2.5 体外三维培养观察细胞管道形成能力: 从-20 ℃中取出保存的Matrigel, 在-4 ℃下过夜使之融解成为液态. 微量移液枪头和24孔细胞培养板预先冰上预冷. 取24孔培养板每孔加入300 μL Matrigel原液, 小心摇动使之均匀分布于孔的各个部位并避免产生气泡. 所有操作必须在冰上进行. 37 ℃培养箱内孵育30 min待其凝固. 用2.5 g/L胰酶消化各组细胞至单细胞悬液, 在每孔内接种1 mL浓度为5×108/L的各组细胞悬液, 置于常氧培养. 12 h后终止培养, 观察各组食管癌细胞的管状结构排列情况和完整程度. 随机于倒置显微镜下(×200)取上、下、左、右、中心5个视野摄像记录并计数管状结构数量, 取每个视野的均值. 重复实验3次.
统计学处理 采用SPSS11.0统计软件处理数据. 计量资料, 用mean±SD表示. 两组数据比较采用成组t检验, P<0.05为有统计学意义.
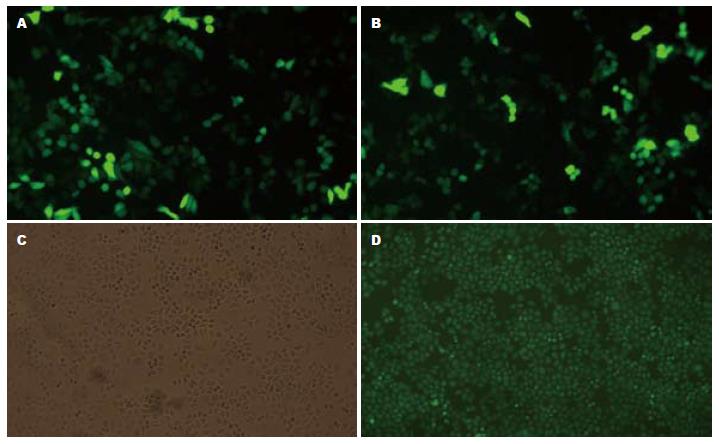
经过瞬时转染鉴定后选择1号干扰质粒继续行稳定转染, 在所挑出的单克隆中, 以8号单克隆转染效果佳, 简称为Eca109/8. 该细胞株在倒置荧光显微镜下发出绿色荧光, 证实质粒已转入细胞基因组并稳定表达(图1).
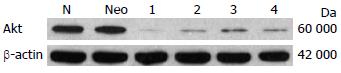
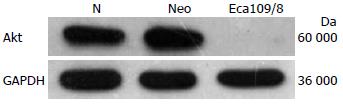
Eca109/8单克隆几乎无Akt的表达, 而转染阴性对照质粒的细胞株Akt的表达与未转染的细胞无明显差异. 瞬时转染时根据Western blot鉴定结果(图2), Akt蛋白表达显著减少, 尤其以1号质粒: 干扰效率最高, 选定1号质粒行稳定转染. 3 mo后稳定表达, 成功挑出干扰效率高的8号单克隆细胞株, 即Eca109/8, 经Western blot鉴定几乎无Akt的表达(图3).
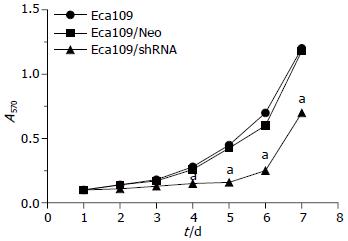
根据连续7d A值绘制的生长趋势图提示干扰组明显低于未转染组(P<0.05), 而阴性对照组与未转染组无明显差异(图4).
Akt沉默后, Eca109/8的迁移能力明显下降, 穿过人工膜的细胞数明显少与未转染组(59.33±2.87 vs 130.5±2.22, P<0.05), 而阴性对照组和未转染组穿膜细胞数无统计学差异(124.2±2.1 vs 130.5±2.22, P>0.05, 图5).
常氧情况下, Eca109及空载体组细胞在Matrigel上均能模拟血管内皮细胞的特性并相互连接, 约12 h后形成典型的血管网状样结构(capillary structure), 呈单个环状或多个环相连的网格状. 稳定转染组细胞常氧情况下体外管道形成能力均被明显抑制, 环状结构断裂, 多为不完全封闭环形及线状结构, 管状结构数目明显少于对照组(P<0.05, 图6).
PKB/Akt是细胞存活信号通路中的关键调节者, 在细胞发育不同阶段所发挥的作用并不相同. PKB/Akt的研究目前已经成为细胞信号转导研究领域的一个新热点[13]. RNA干扰是一种特异性基因沉默技术, 是生物进化过程中基因组水平上的免疫监控机制[14], 在反向遗传学研究、细胞信号转导通路研究和某些疾病如病毒感染、肿瘤及多种遗传相关性疾病的发病机制和治疗学研究中发挥着重要作用, 显示出了巨大的潜力; 其具有很强的特异性, 因此在基因等基础研究领域中占据着不可替代的地位[15]. RNA干扰的机制为外源性基因随机整合到宿主基因组并利用宿主细胞进行转录时, 宿主细胞常产生一些双链RNA(dsRNA), 随后dsRNA被切割酶Dicer剪切为21-23 bp的小干扰RNA(small interfering RNA, siRNA). siRNA再与酶蛋白结合形成RNA诱导的沉默复合体(RNA-induced silencing complex, RISC), RISC根据碱基互补配对原则与靶向mRNA结合, 最终导致目标mRNA降解, 从而导致基因沉默[16].
我们在以前的实验中曾经成功行RNA干扰技术沉默转录因子HIF-1α, 获得稳定转染的细胞株[17]. 在本实验中我们设计合成了4个不同序列的针对Akt1的干扰质粒pGCsi-Akt-1、pGCsi-Akt-2、pGCsi-Akt-3和pGCsi-Akt-4, 并经过瞬时转染筛选出干扰效率较高的pGCsi-Akt-1, 可见较强的绿色荧光蛋白表达, 且予以蛋白水平检测提示干扰效率最高. 后续实验中我们应用pGCsi-Akt-1干扰质粒稳定转染食管癌细胞Eca109, 单克隆扩大培养后, 倒置荧光显微镜下观察, 可见Eca109/8克隆有较强的绿色荧光蛋白表达, 提示质粒已整合到基因组中并稳定表达. Western blot结果显示, Eca109/8克隆几乎无Akt的表达, 进一步在蛋白水平证明了干扰的效果.
目前, 在哺乳动物中Akt有3种亚型, 即Akt1, Akt2和Akt3[18]. 其中以Akt1表达量最为丰富, 除肾脏, 肝脏及脾脏外, 其他组织都出现高表达. Akt2表达具有组织相关性, 在棕色脂肪中含量最多, 其次是骨骼肌和肝脏[19]. Akt3在脑和睾丸中含量极其丰富, 而在肠道及肌肉组织中为低水平表达[20]. 在多种人类肿瘤中Akt均表现为异常增多和持续性活化, 且在疾病发展中AKT的活化水平逐渐增加; 其中Akt1激酶活性高及高表达的肿瘤, 如前列腺癌、卵巢癌和乳腺癌预后差[21]. 并在卵巢癌、乳腺癌中发现Akt2表达过度的复发率高[22,23]. 在前列腺癌、乳腺癌中Akt3高表达, 预后差[24]. 以上说明Akt与肿瘤的发生、发展、转移和预后等密切相关. 我们在实验中发现, Akt被干扰后, 细胞增殖速度明显减慢, 细胞的迁移能力显著下降, 提示Akt在食管癌的转移过程中有重要作用. 我们的实验结果显示, 食管癌细胞株Eca109经针对Akt的干扰质粒转染, 用杀稻瘟菌素筛选后再单克隆化, 经Western blot鉴定的细胞株能稳定的抑制的表达. 其后的功能实验进一步提示Akt沉默后Eca109的增殖、迁移能力显著下降以及血管生成拟态(vasculogenic mimicry, VM)[25]发生的数量明显减少. 我们知道实体肿瘤的生长和转移有赖于血管的形成, 既往观点认为内皮依赖性血管是肿瘤获取血供的唯一途径. 然而, 1999年Maniotis等[25]发现在高侵袭性黑色素瘤中, 存在一种与经典的肿瘤血管生成途径完全不同的肿瘤微循环模式-VM, 即肿瘤细胞通过自身变形围成的无内皮细胞被覆的、由细胞外基质界定的微循环管道. 这些管道与微血管相通, 参与了肿瘤的微循环[26]. 目前多项临床研究提示VM的存在与肿瘤早期血道转移和不良预后密切相关[27-30]. 本研究通过体外三维培养的方式对ESCC Eca109细胞中VM现象进行观察, 使细胞在体外也能与细胞外基质相互作用, 表现出的生物学特征与体内状态下较为接近, 避免了传统二维培养体系的局限性. 三维培养结果证实食管癌细胞Eca109在Matrigel上均可形成血管网状样结构, 即VM, 而经Akt干扰后VM的能力明显减少, 本研究提示了Akt参与了血管拟态生成的调节. 以上结果提示Akt在食管癌的发生、进展及转移过程中起着重要作用, 有可能成为一个潜在的肿瘤治疗靶点.
食管癌是常见恶性肿瘤之一, 食管癌多为食管鳞状上皮细胞癌(ESCC). 目前对食管癌的早期诊断率很低, 发现后多为中晚期, 目前研究结果提示食管癌是一种多基因异常疾病. Akt的活化与肿瘤的发生发展密切相关.
李晟磊, 副主任医师, 郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室、郑州大学医学院病理教研室
PKB/Akt是细胞存活信号通路中的关键调节者, 在细胞发育不同阶段所发挥的作用并不相同. PKB/Akt的研究目前已经成为细胞信号转导研究领域的一个新热点.
Sasaki等研究发现利用RNA干扰技术沉默Akt, 可能成为分子靶向治疗前列腺癌的一个有效手段. Yu等成功构建PKB/Akt基因逆转录病毒shRNA载体, 转染血管平滑肌细胞(VSMC)能够明显抑制其分裂、分化和增殖.
Akt的相关研究虽然较多, 但在食管鳞癌中通过RNA干扰技术研究其功能的报道仍然尚少. 本文在高度恶性食管癌细胞株Eca109中的研究结果为证实Akt的生物学作用的普遍性提供了一定的理论依据.
本研究证实RNA干扰可以沉默食管癌细胞株Eca109的Akt表达, 抑制其增殖与迁移, 并可以影响血管生成拟态的形成, 为其将来临床应用提供了理论依据.
本文设计合理, 结果可靠, 具有一定的科学价值.
编辑: 曹丽鸥 电编:何基才
| 1. | The World Health Report 1997--conquering suffering, enriching humanity. World Health Forum. 1997;18:248-260. [PubMed] |
| 2. | Pisani P, Parkin DM, Bray F, Ferlay J. Estimates of the worldwide mortality from 25 cancers in 1990. Int J Cancer. 1999;83:18-29. [PubMed] [DOI] |
| 3. | Goseki N, Koike M, Yoshida M. Histopathologic characteristics of early stage esophageal carcinoma. A comparative study with gastric carcinoma. Cancer. 1992;69:1088-1093. [PubMed] [DOI] |
| 4. | Baylin SB. Mechanisms underlying epigenetically mediated gene silencing in cancer. Semin Cancer Biol. 2002;12:331-337. [PubMed] [DOI] |
| 5. | Mandard AM, Hainaut P, Hollstein M. Genetic steps in the development of squamous cell carcinoma of the esophagus. Mutat Res. 2000;462:335-342. [PubMed] [DOI] |
| 6. | Forastiere A, Weber R, Ang K. Treatment of head and neck cancer. N Engl J Med. 2008;358:1076; author reply 1077-1078. [PubMed] [DOI] |
| 7. | Kihara C, Seki T, Furukawa Y, Yamana H, Kimura Y, van Schaardenburgh P, Hirata K, Nakamura Y. Mutations in zinc-binding domains of p53 as a prognostic marker of esophageal-cancer patients. Jpn J Cancer Res. 2000;91:190-198. [PubMed] |
| 8. | Stoner GD, Gupta A. Etiology and chemoprevention of esophageal squamous cell carcinoma. Carcinogenesis. 2001;22:1737-1746. [PubMed] [DOI] |
| 9. | Xing EP, Yang GY, Wang LD, Shi ST, Yang CS. Loss of heterozygosity of the Rb gene correlates with pRb protein expression and associates with p53 alteration in human esophageal cancer. Clin Cancer Res. 1999;5:1231-1240. [PubMed] |
| 10. | Bellacosa A, Testa JR, Staal SP, Tsichlis PN. A retroviral oncogene, akt, encoding a serine-threonine kinase containing an SH2-like region. Science. 1991;254:274-277. [PubMed] [DOI] |
| 11. | Li J, Yen C, Liaw D, Podsypanina K, Bose S, Wang SI, Puc J, Miliaresis C, Rodgers L, McCombie R. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer. Science. 1997;275:1943-1947. [PubMed] [DOI] |
| 12. | Bellacosa A, Testa JR, Moore R, Larue L. A portrait of AKT kinases: human cancer and animal models depict a family with strong individualities. Cancer Biol Ther. 2004;3:268-275. [PubMed] [DOI] |
| 13. | 刘 静, 徐 玲, 刘 云鹏, 曲 秀娟, 张 晔, 侯 科佐, 胡 雪君, 姜 又红. 硼替佐米抑制PI3K/Akt通路增强胃癌细胞对TRAIL诱导凋亡的敏感性. 世界华人消化杂志. 2010;18:1854-1859. [DOI] |
| 14. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 15. | Leung RK, Whittaker PA. RNA interference: from gene silencing to gene-specific therapeutics. Pharmacol Ther. 2005;107:222-239. [PubMed] [DOI] |
| 16. | Tijsterman M, Plasterk RH. Dicers at RISC; the mechanism of RNAi. Cell. 2004;117:1-3. [PubMed] [DOI] |
| 18. | Gonzalez E, McGraw TE. The Akt kinases: isoform specificity in metabolism and cancer. Cell Cycle. 2009;8:2502-2508. [PubMed] [DOI] |
| 19. | Altomare DA, Lyons GE, Mitsuuchi Y, Cheng JQ, Testa JR. Akt2 mRNA is highly expressed in embryonic brown fat and the AKT2 kinase is activated by insulin. Oncogene. 1998;16:2407-2411. [PubMed] [DOI] |
| 20. | Nakatani K, Sakaue H, Thompson DA, Weigel RJ, Roth RA. Identification of a human Akt3 (protein kinase B gamma) which contains the regulatory serine phosphorylation site. Biochem Biophys Res Commun. 1999;257:906-910. [PubMed] [DOI] |
| 21. | Sun M, Wang G, Paciga JE, Feldman RI, Yuan ZQ, Ma XL, Shelley SA, Jove R, Tsichlis PN, Nicosia SV. AKT1/PKBalpha kinase is frequently elevated in human cancers and its constitutive activation is required for oncogenic transformation in NIH3T3 cells. Am J Pathol. 2001;159:431-437. [PubMed] [DOI] |
| 22. | Bellacosa A, de Feo D, Godwin AK, Bell DW, Cheng JQ, Altomare DA, Wan M, Dubeau L, Scambia G, Masciullo V. Molecular alterations of the AKT2 oncogene in ovarian and breast carcinomas. Int J Cancer. 1995;64:280-285. [PubMed] [DOI] |
| 23. | Cheng JQ, Godwin AK, Bellacosa A, Taguchi T, Franke TF, Hamilton TC, Tsichlis PN, Testa JR. AKT2, a putative oncogene encoding a member of a subfamily of protein-serine/threonine kinases, is amplified in human ovarian carcinomas. Proc Natl Acad Sci U S A. 1992;89:9267-9271. [PubMed] [DOI] |
| 24. | Nakatani K, Thompson DA, Barthel A, Sakaue H, Liu W, Weigel RJ, Roth RA. Up-regulation of Akt3 in estrogen receptor-deficient breast cancers and androgen-independent prostate cancer lines. J Biol Chem. 1999;274:21528-21532. [PubMed] [DOI] |
| 25. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] [DOI] |
| 27. | Guzman G, Cotler SJ, Lin AY, Maniotis AJ, Folberg R. A pilot study of vasculogenic mimicry immunohistochemical expression in hepatocellular carcinoma. Arch Pathol Lab Med. 2007;131:1776-1781. [PubMed] |
| 28. | Sun B, Qie S, Zhang S, Sun T, Zhao X, Gao S, Ni C, Wang X, Liu Y, Zhang L. Role and mechanism of vasculogenic mimicry in gastrointestinal stromal tumors. Hum Pathol. 2008;39:444-451. [PubMed] [DOI] |
| 29. | Li M, Gu Y, Zhang Z, Zhang S, Zhang D, Saleem AF, Zhao X, Sun B. Vasculogenic mimicry: a new prognostic sign of gastric adenocarcinoma. Pathol Oncol Res. 2010;16:259-266. [PubMed] [DOI] |
| 30. | Baeten CI, Hillen F, Pauwels P, de Bruine AP, Baeten CG. Prognostic role of vasculogenic mimicry in colorectal cancer. Dis Colon Rectum. 2009;52:2028-2035. [PubMed] |