修回日期: 2011-11-20
接受日期: 2011-12-07
在线出版日期: 2011-12-18
目的: 研究多药耐药蛋白(multidrug resistance protein, MRP)的相互作用蛋白及其对肿瘤耐药性的影响.
方法: 采用免疫沉淀结合质谱方法分离鉴定MRP的相互作用蛋白, 并对其中的耐药相关蛋白之一Annexin A5进行功能研究, Western blot及siRNA干扰技术分析MRP、Annexin A5蛋白表达的变化、相关性及胃癌SGC-7901细胞的耐药性变化.
结果: 经免疫沉淀结合质谱方法分离鉴定发现了14个MRP的相互作用蛋白, 其中Annexin A5为其中得分最高的蛋白; Western blot检测显示耐药细胞株SGC-7901/DDP中MRP、Annexin A5蛋白表达均高于SGC-7901和siRNA-SGC-7901/DDP, siRNA干扰Annexin A5表达后, siRNA-SGC-7901/DDP中MRP蛋白表达下调, MRP、Annexin A5蛋白在SGC-7901和siRNA-SGC-7901/DDP之间表达无明显差异; MTT法结果显示经siRNA干扰SGC-7901/DDP后, 顺铂、5-Fu和紫杉醇作用后的IC50值明显减少, 对其的敏感性分别增加了36倍、17倍和4倍.
结论: Annexin A5表达与胃癌细胞耐药有关, 是MRP的相互作用蛋白之一.
引文著录: 伍小平, 唐英姿, 黄卫国, 伍尤华. 胃癌多药耐药蛋白的相互作用蛋白鉴定及分子机制. 世界华人消化杂志 2011; 19(35): 3568-3573
Revised: November 20, 2011
Accepted: December 7, 2011
Published online: December 18, 2011
AIM: To identify proteins interacting with multidrug resistance protein (MRP) in gastric cancer cells and to evaluate their effect on tumor cell drug resistance.
METHODS: Proteins interacting with MRP were identified using immunoprecipitation and mass spectrometry. Of the proteins identified, Annexin A5 was chosen to further study its role in drug resistance of gastric cancer cells. The expression of MRP and Annexin A5 protein in SGC-7901cells and drug-resistant cell line SGC-7901/DDP was evaluated by Western blot.The impact of Annexin A5 knockdown on MRP expression and drug resistance of gastric cancer cells was evaluated using siRNA interference technology.
RESULTS: In total, 14 proteins interacting with MRP were identified. The protein expression of MRP and Annexin A5 in drug-resistant cell line SGC-7901/DDP was higher than that in SGC-7901 cell line. SiRNA-mediated silencing of the Annexin A5 gene in SGC-7901/DDP cells down-regulated the expression of MRP. The expression of Annexin A5 showed no significant difference between SGC-7901 cells and SGC-7901/DDP cells transfected with Annexin A5-specific siRNA. In addition, siRNA-mediated silencing of the Annexin A5 gene significantly reduced the IC50 values of cisplatin, paclitaxel and 5-Fu in gastric cancer cells, and increased cell sensitivity to these drugs by 36, 17 and 4 folds, respectively.
CONCLUSION: Annexin A5 is a MRP-interacting protein that may be related with tumor drug resistance in gastric cancer.
- Citation: Wu XP, Tang YZ, Huang WG, Wu YH. Identification of proteins interacting with multidrug resistance protein in gastric cancer. Shijie Huaren Xiaohua Zazhi 2011; 19(35): 3568-3573
- URL: https://www.wjgnet.com/1009-3079/full/v19/i35/3568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i35.3568
胃癌是常见的恶性肿瘤之一, 在我国其发病率居各类肿瘤的首位[1]. 胃癌耐药是胃癌化疗失败的主要原因之一[2], 他涉及多种复杂机制. 肿瘤细胞的多药耐药性(multidrug resistance, MDR)是指肿瘤细胞接触一种化疗药物并对其产生耐药后, 同时对其他化学结构和作用机制不同的化疗药物产生耐药[3]. 深入研究多要耐药性无疑具有重要的理论和临床意义. 以往的研究虽然揭示了一些胃癌多药耐药性产生的初步分子机制[4,5], 但多数是从单个基因或蛋白出发, 其分子机制远未完全阐明, 由于DNA和RNA水平并不能完全反映蛋白质水平的变化, 因此有必要在蛋白质整体水平上对胃癌多药耐药产生的机制进行研究.
研究发现, 多药耐药蛋白(multidrug resistance protein, MRP)作为一种防御机制在正常胃黏膜上高度表达, 而在胃癌组织的表达高于正常胃黏膜[6,7]; MRP在胃癌组织中呈异常高表达, 与癌旁组织有显著性差别, 与肿瘤细胞耐药有关[8-10]. 这些结果提示MRP是引起胃癌原发性耐药的原因之一. 为进一步研究MRP的分子机制, 我们拟通过靶向蛋白技术, 分离鉴定MRP1蛋白的相互作用蛋白, 并通过RNAi技术干扰其中关键的蛋白表达研究其耐药的分子机制.
SGC-7901及其耐药细胞株SGC-7901/DDP (人胃癌耐药顺铂细胞株)均购自中南大学细胞中心, 细胞用100 mL/L胎牛血清的RPMI 1640(GIBCO)培养液进行常规培养. RPMI 1640培基、胰酶、胎牛血清为美国GIBCO公司产品; 鼠抗人MRP、Annexin A5单克隆抗体, 鼠抗人β-actin抗体为美国Santa cruz公司产品; 辣根过氧化物酶标记羊抗鼠二抗购自美国DAKO公司; ECL(Enhanced chemiluminescence)试剂盒购自瑞典Amersham公司.
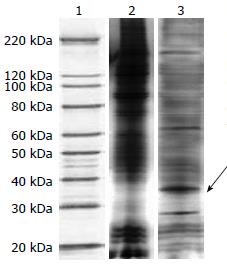
1.2.1 免疫共沉淀: 收集107个细胞在缓冲液中4 ℃裂解30 min, 11 000 r/min离心15 min, 上清液用于免疫沉淀, 1 500 μg的总蛋白与非免疫血清一起进行预吸附, 与100 μL的蛋白G-Sepharose结合, 进一步与10 μg的MRP抗体结合3 h; 加入100 μL蛋白G-Sepharose在4 ℃条件下放置1 h, 离心30 s, TBST洗3次, 0.1 mol/L甘氨酸洗脱后, SDS-PAGE电泳, 凝胶用考马斯蓝染色、切胶、胰蛋白酶消化, 质谱鉴定.
1.2.2 质谱图谱分析与数据库查询: ESI-Q-TOF质谱图解谱采用MicroMass公司的MassLynx软件进行, 从原始MS-MS谱中产生PKL格式的数据文件. 然后在数据库中进行查询. 数据库检索参数为: 数据库选择为NCBInr数据库, 物种分类(Taxonomy)选择为人(Human), 酶选择为Trypsin, 允许的未酶切位点选择为1, 固定修饰(Fixed modifications)选择为碘乙酰胺Carbamidomethyl(C)修饰, MS/MS容差选择为0.3 Da, 肽片段电荷数选择为1+、2+或3+, 选择Monoisotopic, 数据格式Data format选择为Micromass(PKL)格式, Instrument选择为(ESI-QUAD-TOF). 查询结果得分(Scores)>36认为该蛋白为有意义的蛋白.
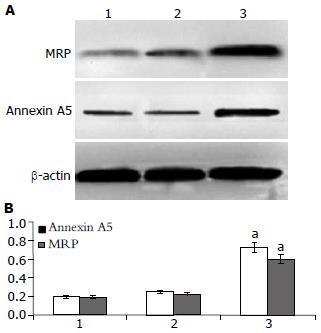
1.2.3 Western blot分析: (1)样品制备: 收集107个细胞后冰上裂解30 min, 4 ℃离心, 12 000 g×30 min, 转移上清, 绘制标准曲线测量蛋白浓度; (2)SDS-PAGE: 配置蛋白分离胶和积层胶, 再变性蛋白, 上样, 100 V电泳, 约需1-2 h; (3)转膜: PVDF膜三明治转移法, 100 V, 约60 min; (4)染色: 丽春红染色3-5 min, PBS漂洗2-3次, 每次3- 5 min, 观察蛋白条带; (5)封闭: 5%牛奶封闭1-2 h; (6)一抗结合: PVDF膜放入杂交袋中加入封闭液和适量一抗(浓度1:1 000), 摇床上室温过夜; (7)二抗结合: 弃去封闭液和一抗, 用适量的TBST漂洗3次, 每次10 min, 加入封闭液和适量二抗(浓度1: 1 000), 摇床上室温摇1-2 h, 剪开袋口, 弃去封闭液和二抗, 用适量的TBS-T液漂洗膜3次, 每次10 min; (8)检测: ECL化学发光法检测, 暗室中压上X光片, 曝光30 s-10 min, 显影, 洗片.
1.2.4 耐药性检测: MTT法检测各细胞株对化疗药物的敏感度, 以每孔500个细胞接种于96孔培养板中, 每孔体积200 μL, 每组设定5孔平行复孔, 加入不同浓度的化疗药物, 以不加药物干预作为对照组, 以不接种细胞而仅加培养液作为调零孔, 置CO2培养箱中孵育, 每隔24 h检测一次. 小心吸去上清, 每孔加入200 μL新鲜RPMI 1640培养液, 再加入5 mg/mL的MTT 20 μL, 37 ℃继续孵育4 h后, 终止培养, 小心吸弃孔内上清液, 加入150 μL DMSO, 振荡10 min, 使结晶物充分溶解, 以空白对照孔调零, ELX800酶标仪490 nm处测定各孔的吸光度值(A490), 取3个重复孔的平均值, 相对应A490值表示细胞增殖能力大小. 绘制不同药物浓度的细胞生长抑制率曲线, 并计算各化疗药物对细胞的半数抑制浓度(IC50).
1.2.5 siRNA干扰: Annexin A5的PCR引物5'-GCUUUAUGAUGCUUAUGA AdTdT-3'(正义), 5'-UUCAUA AGCAUCAUAAAGCdCdG-3'(反义); 由Takara公司合成. 步骤如下: (1)细胞接种: 胰酶消化细胞, 按3×105个细胞/孔接种于6孔板, 当细胞达到70%-80%融合时进行转染; (2)转染液的配制: A液: 在100 μL无血清培基中加12.5 μg Annexin A5 siRNA; B液: 在100 μL无血清培基中加Lipofactamine 2000脂质体10 μL, 室温静止置5 min; 混合A、B两液, 室温静置20 min, 形成复合体; (3)RPMI 1640无血清培养基洗涤待转染细胞2次; (4) A、B混合液中加无血清培基800 μL, 混匀, 小心加至6孔板中, 置37 ℃、50 mL/LCO2的温箱中孵育4 h; (5)最后每孔加入等体积含200 mL/L胎牛血清(FBS)的RPMI1640完全培养基使培养液中含100 mL/L胎牛血清, 置于50 mL/L CO2、37 ℃恒温培养箱中继续培养44 h; 收集细胞; (6)Western blot检测Annexin A5的表达水平, 确定干扰或表达效果; (7)MTT检测细胞株耐药性变化.
统计学处理 应用SPSS17.0统计软件对实验结果进行统计学分析, 计数资料两两比较用t检验, 组间比较采用ANOVA检验. P<0.05即差异有统计学意义.
通过免疫沉淀方法分离得到MRP免疫沉淀复合物(图1). 将所分离的蛋白质经ESI-Q-TOF-MS质谱进行鉴定, 并利用数据库检索后共有14个MRP相互蛋白质被鉴定, 其功能涉及细胞骨架、凋亡、增殖、血管生成、分子伴侣以及新陈代谢(表1). 实验中发现其中Annexin A5为其中得分最高的蛋白, 经过进一步查阅文献分析, 选取其作进一步耐药性研究.
| GI | 基因简写 | 蛋白名称 | 分子量(Da) | 序列覆盖(%) | 得分 | 功能 |
| 4809273 | ANX5 | Annexin A5 | 188921 | 19 | 501 | 增殖、凋亡 |
| 209969817 | HSPB1 | heat shock 27 kda protein | 22783 | 17 | 412 | 分子伴侣 |
| 21961605 | KRT10 | Keratin 10 | 59020 | 28 | 369 | 细胞骨架 |
| 12803727 | KRT7 | Keratin 7 | 51444 | 10 | 234 | 细胞骨架 |
| 306891 | HSP90AB1 | heat shock protein 90 kda alpha (cytosolic), class b member 1 | 83584 | 7 | 199 | 分子伴侣 |
| 1296662 | PLEC1 | plectin 1, intermediate filament binding protein 500 kda | 533408 | 1 | 187 | 细胞骨架 |
| 757924 | EGFR | epidermal growth factor receptor | 137626 | 4 | 147 | 增殖、血管生成 |
| 188492 | HSPA1L | heat shock 70 kda protein 1-like | 70755 | 4 | 125 | 分子伴侣 |
| 129369 | TP53 | Cellular tumor antigen p53 | 37814 | 12 | 112 | 抑癌基因 |
| 28336 | ACTB | actin, beta | 42318 | 9 | 105 | 细胞骨架 |
| 4757756 | ANXA2 | annexin a2 | 38808 | 12 | 103 | 胞膜运输 |
| 4503571 | ENO1 | enolase 1 | 47481 | 3 | 52 | 新陈代谢 |
| 148224884 | PTPMT1 | protein tyrosine phosphatase, mitochondrial 1 | 23000 | 6 | 51 | 新陈代谢 |
| 4506773 | S100A9 | s100 calcium binding protein a9 18(calgranulin b) | 13291 | 6 | 39 | 钙信号分子 |
通过Western blot分别检测了3个细胞株SGC-7901、siRNA-SGC-7901/DDP、SGC-7901/DDP中MRP、Annexin A5蛋白的表达水平. 实验发现, 耐药细胞株SGC-7901/DDP中MRP、Annexin A5蛋白表达均高于SGC-7901和siRNA-SGC-7901/DDP, 说明MRP、Annexin A5蛋白高表达与胃癌耐药性增高有关; siRNA干扰Annexin A5表达后, 发现siRNA-SGC-7901/DDP 中MRP蛋白表达下调, 说明Annexin A5蛋白与MRP蛋白之间具有相关性. 而MRP、Annexin A5蛋白在SGC-7901和siRNA-SGC-7901/DDP之间表达无明显差异(图2).
运用MTT法检测顺铂、5-Fu和紫杉醇孵育siRNA-SGC-7901/DDP、SGC-7901/DDP细胞株后细胞生长的变化, 结果显示经siRNA干扰SGC-7901/DDP后, 其IC50值明显减少, 胃癌细胞对顺铂、5-Fu和紫杉醇的敏感性分别增加36倍、17倍和4倍(表2). 说明Annexin A5表达下调后, 胃癌细胞对化疗药物的敏感性增加.
| 药 物 | IC50 (μmol/L) | 敏感性增加倍数 | |
| SGC-7901/cDDP | siRNA-SGC-7901/DDP | ||
| 顺铂 | 185.44±13.46 | 5.13±0.89a | 36 |
| 紫杉醇 | 21.43±12.46 | 1.22±0.12a | 17 |
| 5-Fu | 201.65±18.34 | 51.77±3.23a | 4 |
MRP是一种分子量为190 kDa的能量依赖型"药泵"的跨膜糖蛋白[11]. MRP增高可引起阿霉素、鬼白乙叉苷(VP-16)、长春花碱(Vinblastine)、长春新碱(VCR)、放线菌素D、秋水仙素等耐药[12-14], 他的结构、功能与P-gp有许多相似处. 其介导的多药耐药(MDR)机制还未完全阐明, 推测他可能通过将GSH与药物的结合物(GS-X)或者是未修饰的药物(但需要GSH的存在)跨膜移位到细胞外, 使细胞内药物浓度减少而导致细胞耐药[15]. 另外, MRP还可在细胞内隔离药物, 使药物不能与靶位点结合, 从而间接导致耐药[16,17]. MRP主要分布于细胞膜, 在内质网、高尔基复合体也有少量分布. 他在人类正常组织及肿瘤组织中广泛存在, 是引起MDR的因素之一. MRP至少有4种亚型, 已知MRP1增高是引起MDR的主要原因之一. MRP这种ATP依赖泵能将带负电荷的药物泵出细胞, 故可观察到许多MDR高表达的细胞系中抗癌药物聚集降低, 此外MRP1可引起细胞内药物分布改变, 使重要的攻击靶点(如胞核)的药物减少, 从而引起MDR[18]. 当然, MDR机制中MRP1的转运作用是可饱和的, 而且有GSH、P-gp和OTPO的共同参与[19].
串联亲和纯化(tandem affinity purification, TAP)耦联质谱技术是一种新的蛋白质相互作用研究技术. TAP耦联质谱技术同时具备了亲和纯化和免疫沉淀两者的优点, 能非常灵敏、快速地得到生理条件下与目的蛋白存在真实相互作用的蛋白质[19]. 本研究通过串联亲和纯化结合质谱方法发现14个MRP的相互作用蛋白, 这些蛋白功能涉及细胞骨架、凋亡、增殖、血管生成、分子伴侣以及新陈代谢等方面, 他们与肿瘤的耐药性之间的关系有待于进一步研究.
Annexin A5是膜联蛋白家族成员之一, 该蛋白位于人染色体4q26-q28, 由319个氨基酸组成, 蛋白分子量为35.8 KDa, 是膜联蛋白家族中分布最广泛、含量最丰富的成员之一[20]. Annexin A5可抑制PKC的活性. PKC是细胞内信号转导通路中最重要的因子之一, 目前多数学者认为PKC的激活平衡紊乱理论是肿瘤发生的重要因素[21]; Annexin A5具有抗炎活性、抗血栓、抗凝作用[22]; 与机体自身的免疫应答有关[22]; 参与了机体的病毒感染过程[22-25]. 此外, Annexin A5还具有促进肿瘤细胞凋亡, 抑制肿瘤细胞增殖的作用, 但机制目前尚未完全阐明. 近年来研究发现, Annexin A5也是一个重要的肿瘤标志物. 有人发现头颈部鳞癌中Annexin A5比正常表皮组织表达增加[26]; Annexin A5在宫颈鳞癌组织中比正常宫颈上皮表达增高, 其表达水平与宫颈鳞癌的分化程度呈负相关[27]. 膜联蛋白A5还参与了信号传导通路, 如钙依赖的蛋白激酶C(PKC)的抑制[28,29]; 膜联蛋白A5还可以通过直接与受体的细胞内区域相互作用而起到了血管内生长因子(vascular endothelial growth factor, VEGF)受体信号的作用[30]. 目前尚未见Annexin A5与MRP的相互作用及其与胃癌耐药的报道.
本研究发现Annexin A5是MRP的相互作用蛋白之一, 其功能与肿瘤细胞耐药有关. 我们发现耐药细胞株SGC-7901/DDP中MRP、Annexin A5蛋白表达均高于SGC-7901非耐药细胞株, 说明MRP、Annexin A5蛋白表达增高与胃癌细胞的耐药性增加有关; 而通过siRNA干扰Annexin A5表达后, 发现MRP蛋白表达也下调, 说明MRP蛋白与Annexin A5之间具有相关性. 为进一步证实Annexin A5表达下调能引起胃癌细胞耐药性的改变, 本研究采用siRNA技术干扰Annexin A5表达后, 发现胃癌细胞对顺铂、5-Fu和紫杉醇3组化疗药物的IC50值明显减小, 其对化疗药物的敏感性分别增加36倍、17倍和4倍, 说明Annexin A5表达下调后, 胃癌细胞对化疗药物的敏感性增加, 可能的分子机制与MRP表达下调有关.
总之, 我们在胃癌细胞中发现了14个MRP耐药相关的蛋白, 这些蛋白的功能涉及细胞骨架、凋亡、增殖、血管生成、分子伴侣以及新陈代谢等方面; Annexin A5是MRP耐药相关的关键蛋白之一, 其表达水平增高与胃癌细胞耐药性增加有关, 减少其表达能增强胃癌细胞对化疗药物的敏感性. 进一步研究这些蛋白的功能及其在肿瘤耐药中的分子机制很有必要.
胃癌耐药是胃癌化疗失败的主要原因之一, 而多药耐药蛋白(MRP)与肿瘤细胞耐药密切有关, 是引起胃癌原发性耐药的原因之一.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
以往的研究虽然揭示了一些胃癌多药耐药性产生的初步分子机制, 但多数是从单个基因或蛋白出发, 其分子机制远未完全阐明, 由于DNA和RNA水平并不能完全反映蛋白质水平的变化, 因此有必要在蛋白质整体水平上对胃癌多要耐药产生的机制进行研究
研究发现在头颈部鳞癌中Annexin A5比正常表皮组织表达增加、在宫颈鳞癌组织中比正常宫颈上皮表达增高. 其还参与了信号传导通路, 如钙依赖的蛋白激酶C(PKC)的抑制, 可以通过直接与受体的细胞内区域相互作用而起到了血管内生长因子(VEGF)受体信号的作用.
本实验通过串联亲和纯化结合质谱方法发现14个MRP的相互作用蛋白, 并通过siRNA干扰技术证实Annexin A5是MRP耐药相关的关键蛋白之一, 其表达下调可能增强胃癌细胞对化疗药物的敏感性.
Annexin A5是MRP耐药相关的关键蛋白之一, 其表达水平增高与胃癌细胞耐药性增加有关, 减少其表达能增强胃癌细胞对化疗药物的敏感性. 为进一步研究这些蛋白的功能及其在肿瘤耐药中的分子机制很有必要.
串联亲和纯化(tandem affinity purification, TAP)耦联质谱技术是一种同时具备了亲和纯化和免疫沉淀两者的优点, 能非常灵敏、快速地得到生理条件下与目的蛋白存在真实相互作用蛋白质的新蛋白质相互作用研究技术.
本研究通过串联亲和纯化结合质谱方法发现MRP的相互作用蛋白, 并通过siRNA干扰技术证实Annexin A5是MRP耐药相关的关键蛋白之一, 研究内容较新颖, 对进一步研究这些蛋白的功能, 进而揭示其在肿瘤耐药中的分子机制很有参考价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [DOI] |
| 2. | Sutter AP, Fechner H. Gene therapy for gastric cancer: is it promising? World J Gastroenterol. 2006;12:380-387. [PubMed] |
| 3. | Pauwels EK, Erba P, Mariani G, Gomes CM. Multidrug resistance in cancer: its mechanism and its modulation. Drug News Perspect. 2007;20:371-377. [DOI] |
| 4. | Zhang D, Fan D. Multidrug resistance in gastric cancer: recent research advances and ongoing therapeutic challenges. Expert Rev Anticancer Ther. 2007;7:1369-1378. [PubMed] [DOI] |
| 5. | Schumacher G, Hoffmann J, Cramer T, Spinelli A, Jacob D, Bahra M, Pratschke J, Pfitzmann R, Schmidt S, Lage H. Antineoplastic activity of 2-methoxyestradiol in human pancreatic and gastric cancer cells with different multidrug-resistant phenotypes. J Gastroenterol Hepatol. 2007;22:1469-1473. [PubMed] [DOI] |
| 6. | Kang HC, Kim IJ, Park HW, Jang SG, Ahn SA, Yoon SN, Chang HJ, Yoo BC, Park JG. Regulation of MDK expression in human cancer cells modulates sensitivities to various anticancer drugs: MDK overexpression confers to a multi-drug resistance. Cancer Lett. 2007;247:40-47. [PubMed] [DOI] |
| 7. | Han CY, Cho KB, Choi HS, Han HK, Kang KW. Role of FoxO1 activation in MDR1 expression in adriamycin-resistant breast cancer cells. Carcinogenesis. 2008;29:1837-1844. [PubMed] [DOI] |
| 8. | Stein U, Lage H, Jordan A, Walther W, Bates SE, Litman T, Hohenberger P, Dietel M. Impact of BCRP/MXR, MRP1 and MDR1/P-Glycoprotein on thermoresistant variants of atypical and classical multidrug resistant cancer cells. Int J Cancer. 2002;97:751-760. [PubMed] [DOI] |
| 9. | Lin HL, Liu TY, Wu CW, Chi CW. Berberine modulates expression of mdr1 gene product and the responses of digestive track cancer cells to Paclitaxel. Br J Cancer. 1999;81:416-422. [PubMed] [DOI] |
| 11. | Takara K, Sakaeda T, Okumura K. An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy. Curr Pharm Des. 2006;12:273-286. [PubMed] [DOI] |
| 12. | Keppler D. Multidrug resistance proteins (MRPs, ABCCs): importance for pathophysiology and drug therapy. Handb Exp Pharmacol. 2011;299-323. |
| 13. | Pal D, Kwatra D, Minocha M, Paturi DK, Budda B, Mitra AK. Efflux transporters- and cytochrome P-450-mediated interactions between drugs of abuse and antiretrovirals. Life Sci. 2011;88:959-971. [PubMed] [DOI] |
| 14. | Drain S, Catherwood MA, Alexander HD. Multidrug resistance in the chronic lymphoproliferative disorders. Leuk Lymphoma. 2010;51:1793-1804. [DOI] |
| 15. | van Zanden JJ, Geraets L, Wortelboer HM, van Bladeren PJ, Rietjens IM, Cnubben NH. Structural requirements for the flavonoid-mediated modulation of glutathione S-transferase P1-1 and GS-X pump activity in MCF7 breast cancer cells. Biochem Pharmacol. 2004;67:1607-1617. [PubMed] [DOI] |
| 16. | Kerwat K, Kerwat M, Graf J, Wulf H. [Resistance to antibiotics and multiresistant pathogens]. Anasthesiol Intensivmed Notfallmed Schmerzther. 2010;45:242-243. [PubMed] [DOI] |
| 17. | Mayur YC, Peters GJ, Prasad VV, Lemo C, Sathish NK. Design of new drug molecules to be used in reversing multidrug resistance in cancer cells. Curr Cancer Drug Targets. 2009;9:298-306. [PubMed] [DOI] |
| 18. | Bogush EA, Kirsanov VIu. [Up-to-date approaches to clinical estimate of phenotype of multiple drug resistance associated with function of ABC-transporters in human solid tumors]. Antibiot Khimioter. 2006;51:50-55. [PubMed] |
| 19. | Kuo MT. Roles of multidrug resistance genes in breast cancer chemoresistance. Adv Exp Med Biol. 2007;608:23-30. [DOI] |
| 20. | Funakoshi T, Hendrickson LE, McMullen BA, Fujikawa K. Primary structure of human placental anticoagulant protein. Bochemistry. 1987;26:8087-8092. [PubMed] [DOI] |
| 21. | Mi L, Xiao Z, Veenstra TD, Chung FL. Proteomic identification of binding targets of isothiocyanates: A perspective on techniques. J Proteomics. 2011;74:1036-1044. [PubMed] [DOI] |
| 23. | van Genderen HO, Kenis H, Hofstra L, Narula J, Reutelingsperger CP. Extracellular annexin A5: functions of phosphatidylserine-binding and two-dimensional crystallization. Biochim Biophys Acta. 2008;1783:953-963. |
| 24. | Rand JH, Wu XX, Quinn AS, Ashton AW, Chen PP, Hathcock JJ, Andree HA, Taatjes DJ. Hydroxychloroquine protects the annexin A5 anticoagulant shield from disruption by antiphospholipid antibodies: evidence for a novel effect for an old antimalarial drug. Blood. 2010;115:2292-2299. [PubMed] [DOI] |
| 25. | Rand JH, Wu XX, Quinn AS, Taatjes DJ. Resistance to annexin A5 anticoagulant activity: a thrombogenic mechanism for the antiphospholipid syndrome. Lupus. 2008;17:922-930. [PubMed] [DOI] |
| 26. | Wehder L, Arndt S, Murzik U, Bosserhoff AK, Kob R, von Eggeling F, Melle C. Annexin A5 is involved in migration and invasion of oral carcinoma. Cell Cycle. 2009;8:1552-1558. [PubMed] [DOI] |
| 27. | Hummerich L, Müller R, Hess J, Kokocinski F, Hahn M, Fürstenberger G, Mauch C, Lichter P, Angel P. Identification of novel tumour-associated genes differentially expressed in the process of squamous cell cancer development. Oncogene. 2006;25:111-121. [PubMed] |
| 28. | Cederholm A, Frostegård J. Annexin A5 as a novel player in prevention of atherothrombosis in SLE and in the general population. Ann N Y Acad Sci. 2007;1108:96-103. [PubMed] [DOI] |
| 29. | Kheifets V, Bright R, Inagaki K, Schechtman D, Mochly-Rosen D. Protein kinase C delta (deltaPKC)-annexin V interaction: a required step in deltaPKC translocation and function. J Biol Chem. 2006;281:23218-23226. [PubMed] [DOI] |