修回日期: 2011-10-15
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 探讨全反式维甲酸(ATRA)对肝癌细胞HepG2的诱导分化作用及侵袭迁移的影响.
方法: MTT法测定ATRA对肝癌细胞HepG2的抑制作用; 平皿集落形成法检测ATRA对HepG2细胞锚定依赖性生长作用; ELISA法检测ATRA作用前后HepG2 AFP分泌量的变化; RT-PCR检测ATRA对HepG2细胞MMP-9及Nanog的mRNA表达的影响; Western blot检测ATRA对HepG2细胞MMP-9及Nanog蛋白表达的影响; Transwell及划痕实验检测其对侵袭及迁移能力的影响.
结果: MTT法显示ATRA抑制体外培养人肝癌细胞HepG2细胞生长, 呈剂量和时间依赖性; ELISA显示ATRA诱导HepG2细胞分化和凋亡, 使代表肝细胞恶变的AFP分泌量明显下降(P<0.05); 平皿克隆形成实验结果表明未经ATRA处理的HepG2可形成克隆, 但经ATRA刺激后, 其形成克隆变小且数目明显减少; ATRA呈时间及浓度依赖性下调Nanog mRNA及蛋白的表达, 并在24 h呈浓度依赖性下调MMP-9 mRNA及蛋白表达; Transwell实验和划痕实验结果显示ATRA能抑制HepG2细胞的侵袭和迁移能力.
结论: ATRA可诱导HepG2细胞分化, 降低HepG2的侵袭迁移能力, 并可下调肿瘤干细胞分化调节基因Nanog的表达从而达到治疗肿瘤的目的.
引文著录: 陈宏辉, 彭蕾. 全反式维甲酸对肝癌细胞HepG2的分化、侵袭迁移的影响. 世界华人消化杂志 2011; 19(33): 3381-3389
Revised: October 15, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To investigate the effect of all-trans retinoic acid (ATRA) on the differentiation, invasion and metastasis of liver cancer HepG2 cells.
METHODS: After HepG2 cells were treated with different concentrations of ATRA, the proliferation of HepG2 cells was evaluated by MTT assay; anchorage-dependent growth was evaluated by colony formation assay; AFP secretion was determined by ELISA; the transcription levels of Nanog and MMP-9 were assessed by RT-PCR, and their protein levels were assessed by Western blot; and cell invasion and migration were evaluated by scratch test and transwell assay.
RESULTS: ATRA suppressed the proliferation and anchorage-dependent growth of HepG2 in a dose- and time-dependent manner. ATRA induced cell differentiation and decreased AFP secretion in HepG2 cells (both P < 0.05). Treatment with ATRA down-regulated the mRNA and protein levels of Nanog and MMP-9 (within 24 hours) in a dose- and time-dependent manner. In addition, ATRA could inhibit the invasion and metastasis of HepG2 cells.
CONCLUSION: ATRA may induce cell differentiation, reduce cell invasion and migration and down-regulate the levels of Nanog in HepG2 cells.
- Citation: Chen HH, Peng L. Effect of all-trans retinoic acid on the differentiation, invasion and metastasis of liver cancer HepG2 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3381-3389
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3381
原发性肝细胞癌是我国常见恶性肿瘤之一, 其死亡率在所有恶性肿瘤中居第3位, 全球每年约600 000人死于肝癌[1], 恶性肿瘤细胞丧失了正常分化的能力, 表现为分化障碍及失控性增殖. 利用分化诱导剂可使肿瘤细胞部分或全部恢复分化潜能, 转变为正常细胞或导致细胞凋亡, 从而达到治疗肿瘤的目的. 肿瘤的复发与转移, 其主要原因在于肿瘤细胞侵袭及迁移性的生物学行为, 降低肿瘤细胞侵袭及迁移能力可抑制肿瘤的复发与转移. ATRA是目前为止最重要的一种分化剂, 已成功应用于诱导白血病分化, 目前的研究表明, 他在一些实体肿瘤中也起着非常重要的作用[2-5].
人肝癌HepG2细胞由中南大学肿瘤所引进; ATRA购自Sigma公司; RPMI-1640培养基购自Gibco公司; 小牛血清购自杭州四季青公司; 人肝癌细胞AFP ELISA试剂盒购自于上海申科生物公司; RNA引物设计由康为生物试剂公司合成; RNA提取试剂盒购自北京康为试剂公司; Nanog抗体及MMP-9抗体购自EP-Tomic公司; Transwell小室购自于Corning公司; Matrigel基质胶购自于BD公司.
1.2.1 细胞培养: 用含100 mL/L新生牛血清的RPMI-1640培养液培养于37 ℃, 含50 mL/L CO2的恒温培养箱中.
1.2.2 MTT法: 取对数生长期细胞, 胰酶消化贴壁细胞, 吹打成单细胞悬液, 调整细胞浓度为4×104/mL, 以每孔200 μL接种于96孔板, 待6 h细胞贴壁后分别加入不同浓度的ATRA, 终浓度为(1 μmol/L、10 μmol/L、100 μmol/L), 溶媒对照组加入相同体积0.1%的DMSO, 空白对照组加入相同体积完全培养基, 每浓度设5个复孔, 分别培养24、48和72 h, 培养终止前每孔加入20 μL MTT, 孵育4 h, 取出96孔板, 弃除培养基, 每孔加入100 μL DMSO, 置于摇床上摇10 min, 酶标仪上570 nm检测吸光度(A)值.
1.2.3 平皿集落形成法: 取对数生长期细胞, 胰酶消化贴壁细胞, 吹打成单细胞悬液, 调整细胞浓度为4×102/mL,每孔加入1 mL细胞悬液, 待6 h细胞贴壁后分别加入不同浓度的ATRA, 终浓度为(1 μmol/L、10 μmol/L、100 μmol/L), 空白对照组加入相同体积完全培养基, 每浓度设3个复孔, 置37 ℃, 50 mL/L CO2培养箱中继续培养, 对照组形成50个以上细胞团即集落时结束培养, 约6 d, 在倒置荧光显微镜下观察拍照.
1.2.4 ELISA法检测ATRA对HepG2表达AFP的影响: 按试剂盒说明书操作: 收集各组细胞上清, 将标准品分别稀释为8 μg/L、4 μg/L、2 μg/L、1 μg/L、0.5 μg/L, 分别设空白孔, 标准品孔和待测样品孔, 空白孔加样品稀释液50 μL, 标准品孔加稀释好的标准品50 μL, 待测样品孔先加入样品稀释液40 μL, 再加待测样品10 μL; 待测样品每孔设3个复孔, 上样完成后, 将酶标板加盖, 置于垫有湿纱布的铝盒中, 再将铝盒放于37 ℃恒温生化箱孵育30 min; 弃去液体, 每孔加满稀释后洗涤液振荡30 s, 甩干洗涤液, 用滤纸拍干, 重复5次, 拍干; 每孔加入酶标试剂50 μL, 空白孔除外, 轻轻晃动混匀, 37 ℃恒温生化箱孵育30 min; 弃去液体, 每孔加满稀释后洗涤液振荡30 s, 甩干洗涤液, 用滤纸拍干, 重复5次, 拍干; 每孔先加入显色剂A50 μL, 再加入显色剂B50 μL, 轻轻振荡混匀, 37 ℃避光显色10 min; 取出酶标板, 每孔加入终止液50 μL, 终止反应(此时蓝色立刻转为黄色); 以空白孔调零, 于酶标仪上在450 nm波长下测量各孔的A值.
1.2.5 RT-PCR: Nanog实验分组: 溶媒对照组(含0.1%DMSO的培养基); 空白组(完全培养基); 24 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L); 48 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L); 72 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L). MMP-9实验分组: 24 h: 空白组、溶媒对照组、1 μmol/L组、10 μmol/L组、100 μmol/L组.
引物设计参照GenBank基因序列设计, 设计好后Blast, 比对结果与目的基因相符(表1); 抽提RNA; 逆转录; PCR扩增; 20 μL反应体系, Master mix 10 μL, ddH2O 6 μL, 10 μmol/L的PCR特异上下游引物各1 μL, cDNA 2 μL; 各反应条件如下: β-actin: 94 ℃, 5 min; 30个PCR循环(94 ℃, 30 s; 54.8 ℃, 30 s; 72 ℃, 60 s); 72 ℃, 5 min. Nanog: 94 ℃, 5 min; 30个PCR循环(94 ℃, 30 s; 51.9 ℃, 30 s; 72 ℃, 60 s); 72 ℃, 5 min. mmp-9: 94 ℃, 5 min; 30个PCR循环(94 ℃, 30 s; 48.8 ℃, 30 s; 72 ℃, 60 s); 72 ℃, 5 min. 电泳后的产物用自动电泳凝胶成像分析仪(Bio-Rad, USA)及Image-2200分析软件(Bio-Rad, USA)进行图像分析, 与β-actin灰度值的比值作为Nanog、MMP-9的相对含量.
| 基因 | 引物序列 | 退火温度(℃) | 产物长度(bp) |
| β-actin | F 5'-ATCTGGCACCACACCT-3' | ||
| R 5'-CGTATACTCCTGCTT-3' | 54.8 | 837 | |
| nanog | F 5'-ATGCCTCACACGGAGACTG-3' | ||
| R 5'-CTGCGTCACACCATTGCTA-3' | 51.9 | 369 | |
| mmp-9 | F 5'-TGGGCTACGTGACCTATGACAT-3' | ||
| R 5'-CACCTCCACTCCTCCCTTTC-3' | 48.8 | 165 |
1.2.6 Western blot: Nanog实验分组: 溶媒对照组(含0.1%DMSO的培养基); 空白组(完全培养基组); 24 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L); 48 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L); 72 h组(终浓度为1 μmol/L、10 μmol/L、100 μmol/L). MMP-9实验分组: 24 h: 空白组、1 μmol/L组、10 μmol/L组、100 μmol/L组.
提取蛋白后进行蛋白定量, 定量后加入上样缓冲液并行SDS-PAGE, 将蛋白转移到PVDF膜, 丽春红染色观察条带, 自来水冲洗后加5%脱脂奶粉封闭2 h, 分别加入抗Nanog、MMP-9及β-actin抗体, 4 ℃孵育过夜, PBS洗膜后加HRP标记的IgG, 室温孵育3 h, 洗膜后加入ECL发光试剂, X线胶片上曝光, 显影, 定影[6]. Image-2200分析软件测定Western blot条带的灰度值, 与β-actin灰度值的比值作为Nanog、MMP-9的相对含量.
1.2.7 划痕实验: 按每孔2×106个HepG2细胞接种在6孔板, 常规培养至90%的融合状态. 用无血清培养液洗细胞3次, 加入新鲜的无血清培养基. 用10 μL Eppendorf Tip在细胞板上划痕[7], 用含1%血清培养基洗细胞3次, 加入新鲜的含1%血清培养基. 加入不同浓度(0 μmol/L、1 μmol/L、10 μmol/L、100 μmol/L)的ATRA, 放入37 ℃, 50 mL/L CO2培养箱按0 h、24 h取样, 拍照. 计算划痕的距离, 以未加ATRA组为对照, 进行组间比较.
1.2.8 体外细胞侵袭实验: 体外细胞侵袭实验采用Transwell培养板, 迁移孔上下槽间为直径6.3 mm, 孔径8.0 μm的多聚碳酸膜. 具体的步骤为: 于4 ℃融解Matrigel, 每孔50 μL加入预冷的Transwell侵袭小室各孔的上室中, 将培养板置于37 ℃孵育过夜. 少量PBS清洗各孔, 用含不同浓度(0 μmol/L、1 μmol/L、10 μmol/L、100 μmol/L)ATRA的无血清培养液制备HepG2细胞悬液, 使细胞浓度为1.0×105/mL, 分别加入各孔的上室中, 每孔100 μL, 在下室加入含有100 mL/L FBS条件培养基500 μL. 每个孔重复3次, 37 ℃, 50 mL/L CO2孵育24 h. 取出带微孔滤膜的小室, PBS洗涤数次, 4%多聚甲醛固定10 min, 用棉棒擦去微孔滤膜上的Matrigel和未侵袭的细胞, 加入结晶紫(0.1%)染色20 min, PBS洗2遍, 显微镜下观察. 以200倍高倍视野侵袭至滤膜下表面的细胞数目多少反映肿瘤细胞侵袭能力的高低. 随机计数10个视野内的细胞数, 计算平均值进行统计学分析, 以未加ATRA组为对照, 进行组间比较, 实验重复3次.
统计学处理 采用SPSS13.0统计学软件进行结果处理. 实验所得数据采用mean±SD, 实验组与对照组的区别用t检验, P<0.05为差异有显著性.
ATRA 1 μmol/L、10 μmol/L、100 μmol/L分别作用于肝癌HepG2细胞24 h、48 h、72 h后, 其A570值均较空白对照组明显下降(P<0.05, 表2). 溶媒组与空白对照组比较差异无统计学意义(P>0.05). 其中100 μmol/L的ATRA作用HepG2细胞72 h A570值下降明显, 1 μmol/L在24 h A570值下降不明显. 说明高浓度ATRA能有效抑制肝癌HepG2细胞的增殖能力.
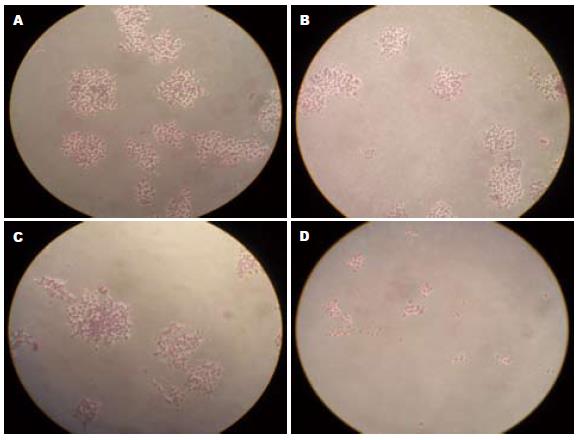
肝癌HepG2细胞在平皿中6 d可以形成克隆, 但ATRA作用后能抑制其克隆形成, 且ATRA的抑制程度与作用的浓度相关, 100 μmol/L ATRA作用后几乎无克隆生长, 1 μmol/L及10 μmol/L ATRA作用后仍可见少量克隆(图1). 表明ATRA可抑制HepG2细胞锚定依赖性生长能力.
ATRA在诱导肝癌细胞分化过程中, AFP分泌量均随处理天数的延长而呈降低趋势, 且组内不同浓度之间有显著性差异(P<0.05, 表3), 且无浓度-时间交互效应, 说明ATRA有诱导HepG2细胞分化的作用.
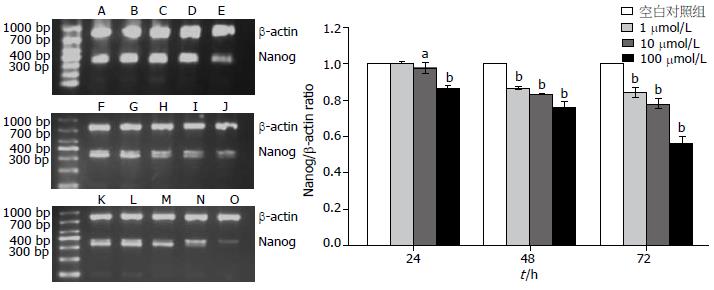
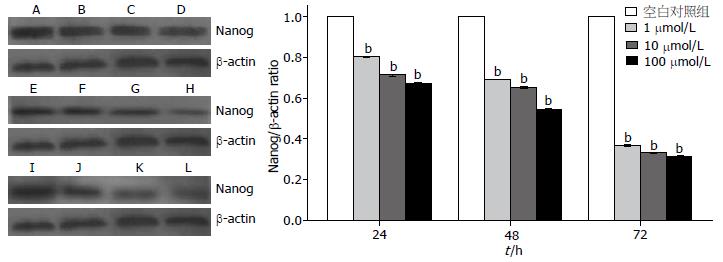
ATRA作用于HepG2细胞后, 与空白对照组比较, Nanog的mRNA及蛋白表达呈时间及浓度依赖性下降(P<0.05, 图2, 3), 无时间-浓度交叉效应.
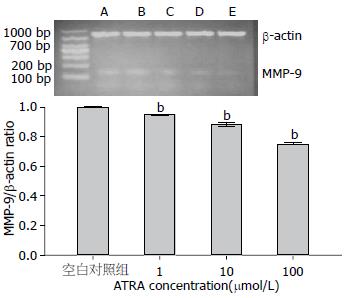
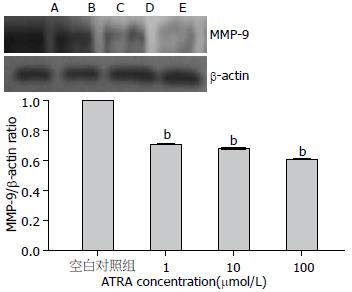
ATRA作用于HepG2细胞24 h后, 与空白对照组比较, MMP-9的mRNA及蛋白表达呈浓度依赖性下降(P<0.05, 图4, 5).
ATRA组; C: 10 μmol/L ATRA组; D: 100 μmol/L ATRA组. bP<0.01 vs 空白对照组.
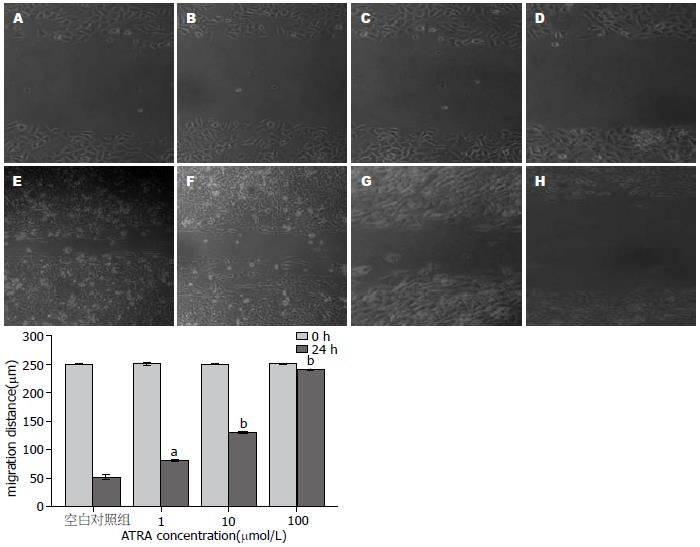
细胞划痕24 h后, ATRA处理的HepG2细胞组分别较各自空白对照组划痕距离明显增宽(P<0.05, 图6), 表明ATRA可抑制人肝癌HepG2细胞迁移能力.
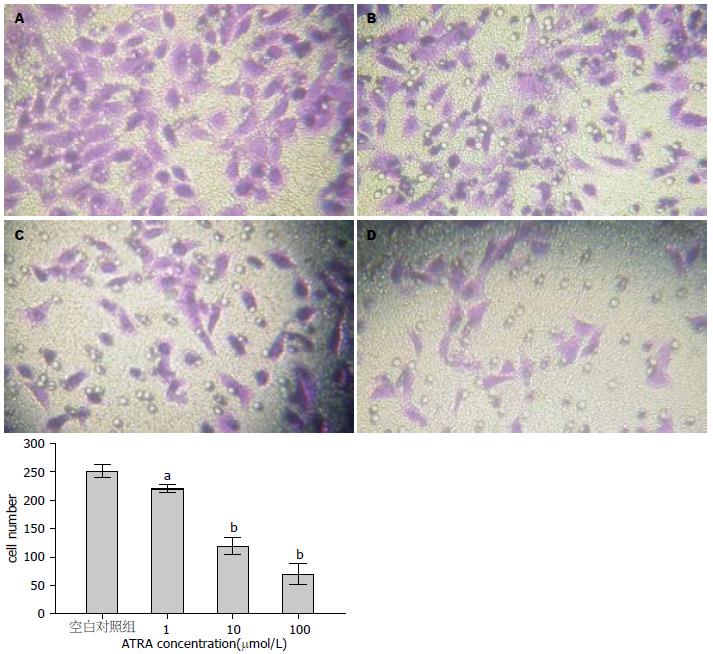
ATRA作用HepG2细胞24 h后, 侵袭至滤膜下表面的细胞数目较空白对照组明显减少(P<0.05, 图7), 表明ATRA可抑制人肝癌HepG2细胞的体外侵袭能力.
维甲酸(RA)类药物包括维生素A的天然及人工合成的衍生物. 维生素A(视黄醇)进入人体后转变成视黄醛, 再经氧化变成RA. RA是维持生长发育不可缺少的一种脂溶性维生素, 尤其在促进上皮组织分化生长及维持其正常功能方面起重要作用[8]. RA结构式由环状末端、多烯肽侧链和极性末端基团3部分组成, 当这3部分结构各自由不同基团取代时, 可得到生物活性不同的化合物. 目前RA类化合物根据结构不同分为3代: 第1代为极性末端被不同基团取代; 第2代为环状末端基团的改变; 第3代RA则是多烯肽侧链的改变, 并由于羧基方向不同分为2种异构体, 即顺式维甲酸及全反式维甲酸(all trans retinoic acid, ATRA), 其中全反式构型最为稳定和常见.
RA的生物活性是通过核内可被配体饱和的维甲酸受体(retinoic acid receptor, RAR)和维A类化合物X受体(retinoic X receptor, RXR)激活而介导的[9]. RA诱导细胞分化的机制上不明确, 但是大量研究表明ATRA诱导肿瘤细胞分化的作用可用于治疗肿瘤. 其可能的机制有: (1)RA受体的作用. RA受体包括RAR和RXA两种, 各有α、β、γ、δ 4种构体, 他们有不同的调节功能, 可通过与特异的RA结合发挥作用[10]; (2)对细胞周期的影响. 大量研究表明, RA可抑制肝癌细胞生长, 使细胞周期G0-G1延长, 影响DNA合成, 最终产生增殖抑制, 诱导细胞凋亡[11]; (3)调控基因和细胞因子的表达. Feng等[12]也报道ATRA能够提高肝癌细胞株SMMC27721细胞表面整合素α5β的表达, 抑制细胞生长并引起凋亡, 使肝癌细胞凋亡相关基因Fas和P53的蛋白表达增高, 并抑制bcl-2的表达, 从而诱导肝癌细胞凋亡. 有研究表明, TGF-β1是一重要的多功能的生长因子, 并已发现TGF-β1与ATRA的功能有一定关系[13]. Masaki等[14]表明ATRA通过诱导C/EBPβ-LIP的产生来降低人白蛋白的产生, 而白蛋白是诊断肝脏疾病的一项可靠的依据[15,16].
肿瘤细胞的锚定依赖性生长特性是肿瘤细胞区别于正常细胞的重要标志, 与肿瘤在体内的生长能力高度相关[17]. 在体外培养条件下, 细胞生长和锚定依赖等恶性特征消失, 可以代表肿瘤细胞的去恶化表现, 因此, 我们应用MTT及平皿集落形成法检测ATRA对体外培养肝脏细胞的生长及增殖能力的影响. 结果表明, ATRA能抑制肝癌HepG2的增殖及锚定依赖生长能力.
AFP是一种胚胎性蛋白, 主要由胚肝产生, 在早期胎肝组织中高表达而分化成熟肝细胞不表达. 随着肝细胞的分化, 抗原会逐渐消失, 在肝癌中分泌量增高, 而在正常成人肝中则无分泌[18]. 因此AFP是肝谱系的早期表面分子, 与肝癌的恶性程度密切相关[19], 可阻止肝癌细胞分化、凋亡, 促进肝癌细胞增殖, 起生长调节作用. 许多分化诱导剂可下调AFP的表达, 因此, AFP是肝癌细胞诱导分化的一个重要鉴定指标, 并被认为是诊断肝癌的标志蛋白[20-22]. 因此本实验通过ELISA法检测ATRA对肝癌HepG2的诱导分化作用, 结果表明, ATRA在诱导肝癌细胞分化过程中, AFP分泌量均随处理天数的延长而呈降低趋势, 且组内不同浓度之间有显著性差异(P<0.05), 无浓度-时间交互效应. 说明ATRA有诱导HepG2细胞分化的作用.
近年来, 随着"干细胞"的概念被引入肿瘤学研究, 以及多种肿瘤干细胞得到分离和鉴定, 肿瘤干细胞(cancer stem cells, CSCs)学说逐渐形成. 具有自我更新和无限增殖能力以及多向分化潜能, 是肿瘤形成的起始细胞并维持肿瘤的持续生长, 也称为"肿瘤起始细胞"(tumor-initiating cells, TICs), 在肿瘤的发生、进展、转移、复发中起关键作用[23,24]. 越来越多的研究表明原发性肝癌来源于肝癌干细胞, 肝癌可能来源于肝干细胞的分化成熟受阻. 肿瘤干细胞生物学作用的物质基础是表达于肿瘤干细胞膜表面的蛋白分子, 即肿瘤干细胞表面标志. 这些表面标志犹如肿瘤干细胞的"指纹", 研究者可以通过识别和利用这些表面标志来准确地筛选与分离肿瘤干细胞. 肿瘤干细胞的存在最早是从急性髓细胞白血病(AML)中得到证实的. Bonnet和Dick[25]在研究中发现, 只有表面标志为CD34+CD38-的白血病细胞能在其他小鼠体内重建AML. Oct4、Sox2、Nanog、SMO、β-Catenin、Wnt5b是近年来发现的干细胞相关基因. Nanog、Oct4和Sox2位于维持干细胞全能性调控网络的顶端, 共同调控与自我更新、分化有关的下游基因[26]. Nanog在维持胚胎干细胞的全能性中是必须的[27,28], 研究表明, Nanog在早期胚胎发育中表达, 而在已分化的细胞及成体组织中不再表达[29], 因此Nanog可作为肿瘤干细胞分化的指标. Nanog不仅与生殖系统肿瘤关系密切, 在胃肠道及肝癌中也存在表达, 且与实体瘤分化状态密切相关[30-32]. 肝癌细胞系HepG2细胞是一种来源于人肝母细胞瘤且被国际公认的细胞株, 具有典型的肝干细胞特性[33], 有研究表明, ATRA在诱导P19胚胎癌性干细胞分化过程中分化调节基因Nanog、oct4、coAA表达均下降[34], 表明ATRA诱导肿瘤分化与肿瘤干细胞分化调节基因有关. 因此本实验通过RT-PCR及Western blot检测ATRA作用于肝癌HepG2前后Nanog的mRNA及蛋白表达的变化, 结果显示, 肝癌HepG2细胞表达Nanog, 反式RA作用于HepG2细胞后, Nanog的mRNA表达及蛋白表达呈时间及浓度依赖性下降. 说明肝癌HepG2细胞中存在肝癌干细胞, Nanog不仅可作为肝癌干细胞的表面标记, 还可作为肝癌HepG2分化的一个指标.
肿瘤细胞和机体的协调关系被打破, 细胞间的黏附, 以及细胞基质的黏附, 基质金属蛋白酶(Mmps)的异常表达与活性都与肿瘤的侵袭及迁移行为有关[35]. Mmps是近年来发现的一组锌离子依赖性内肽酶, 为重要的细胞外基质降解酶, 他通过对细胞外基质不同成分的降解在肿瘤侵袭、转移中起关键作用[36]. Mmps家族包括多种, 已发现的有22个[37], 其中MMP-9是Mmps家族中最主要的成员之一, 研究表明ATRA可以增加甲状腺癌细胞对细胞外基质的黏附能力, 从而降低甲状腺癌细胞的侵袭能力; 也有研究表明ATRA可通过RA受体机制降低耐酸肠癌细胞的MMP-9及MMP2水平, 从而降低这种细胞的侵袭迁移能力; 最近研究表明, ATRA是抑制胃癌GIST细胞侵袭及能力的一种潜在试剂[38]. 因此本实验通过检测ATRA对肝癌HepG2 MMP-9 mRNA及蛋白的表达的影响, 侵袭小室及划痕实验检测ATRA对其侵袭及迁移能力的影响, 实验结果表明, 肝癌HepG2细胞可分泌MMP-9, 其分泌量随ATRA的浓度升高而下降; 侵袭实验表明, ATRA可呈浓度依赖性降低人肝癌细胞HepG2的体外侵袭能力; 划痕实验表明ATRA可成时间-浓度依赖性降低人肝癌细胞的迁移能力.
肿瘤的复发与转移, 其主要原因在于肿瘤细胞侵袭及迁移性的生物学行为, 降低肿瘤细胞侵袭及迁移能力可抑制肿瘤的复发与转移, ATRA是目前为止最重要的一种分化剂, 已成功应用于诱导白血病分化, 目前的研究表明, 他在一些实体肿瘤中也起着非常重要的作用.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科
通过研究ATRA对肿瘤干细胞分化基因Nanog的影响, 进一步阐明ATRA是否通过下调肿瘤干细胞分化调节基因达到治疗肿瘤的目的, 将对ATRA抗肿瘤作用机制起到推动作用.
研究已发现ATRA对胃癌、乳腺癌、结肠癌等恶性肿瘤有一定的抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡, 降低其侵袭迁移能力的作用.
本研究发现ATRA可诱导肝癌HepG2细胞分化, 抑制其增殖、侵袭及迁移能力. Nanog作为肝癌HepG2分化的一个指标, ATRA可降低其在肝癌HepG2中的表达.
探讨ATRA对肝癌细胞系HepG2的诱导分化作用及侵袭迁移的影响, 并且探讨了ATRA与肿瘤干细胞分化调节基因Nanog的关系, 为ATRA治疗肝癌进一步提供了临床依据.
本研究采用肿瘤细胞诱导分化剂ATRA体外诱导人肝癌细胞, 采用分子生物学方法检测ATRA对人肝癌细胞HepG2的生长、分化、侵袭和迁移能力的影响, 研究内容翔实, 对临床肝癌的治疗具有一定的参考价值.
编辑: 李军亮 电编:闫晋利
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Uruno A, Noguchi N, Matsuda K, Nata K, Yoshikawa T, Chikamatsu Y, Kagechika H, Harigae H, Ito S, Okamoto H. All-trans retinoic acid and a novel synthetic retinoid tamibarotene (Am80) differentially regulate CD38 expression in human leukemia HL-60 cells: possible involvement of protein kinase C-delta. J Leukoc Biol. 2011;90:235-247. [PubMed] [DOI] |
| 3. | Wang T, Jia L, Yang G, Ji S, Yao L, Zhang B. Identification of Juxtanodin promoter and its transcriptional regulation during the ATRA-induced differentiation of C6 cells. Mol Cell Biochem. 2011;350:177-183. [PubMed] [DOI] |
| 4. | Cho HY, Choi EK, Lee SW, Kim KH, Park SJ, Lee CK, Lee SW. All-trans retinoic acid induces TLR-5 expression and cell differentiation and promotes flagellin-mediated cell functions in human THP-1 cells. Immunol Lett. 2011;136:97-107. [PubMed] [DOI] |
| 5. | Suzukawa M, Nakazora T, Kawasaki Y, Tominaga T, Shinohara K. Massive ascites associated with all-trans retinoic acid treatment in therapy-related acute promyelocytic leukemia. Intern Med. 2010;49:457-460. [PubMed] [DOI] |
| 6. | Li C, McFadden SA, Morgan I, Cui D, Hu J, Wan W, Zeng J. All-trans retinoic acid regulates the expression of the extracellular matrix protein fibulin-1 in the guinea pig sclera and human scleral fibroblasts. Mol Vis. 2010;16:689-697. [PubMed] |
| 7. | Hoang TC, Bui TK, Taguchi T, Watanabe T, Sato Y. All-trans retinoic acid inhibits KIT activity and induces apoptosis in gastrointestinal stromal tumor GIST-T1 cell line by affecting on the expression of survivin and Bax protein. J Exp Clin Cancer Res. 2010;29:165. [PubMed] [DOI] |
| 8. | Collins MD, Mao GE. Teratology of retinoids. Annu Rev Pharmacol Toxicol. 1999;39:399-430. [PubMed] [DOI] |
| 9. | Bastien J, Rochette-Egly C. Nuclear retinoid receptors and the transcription of retinoid-target genes. Gene. 2004;328:1-16. [PubMed] [DOI] |
| 10. | Lefebvre P, Martin PJ, Flajollet S, Dedieu S, Billaut X, Lefebvre B. Transcriptional activities of retinoic acid receptors. Vitam Horm. 2005;70:199-264. [PubMed] [DOI] |
| 11. | Arce F, Gätjens-Boniche O, Vargas E, Valverde B, Díaz C. Apoptotic events induced by naturally occurring retinoids ATRA and 13-cis retinoic acid on human hepatoma cell lines Hep3B and HepG2. Cancer Lett. 2005;229:271-281. [PubMed] [DOI] |
| 12. | Feng Y, Wang LY, Cai T, Jin JW, Zhou GF, Cao LH, Zha XL. All-trans-retinoic acid increased the expression of integrin alpha5beta1 and induced "anoikis" in SMMC-7721 hepatocarcinoma cell. J Exp Clin Cancer Res. 2001;20:429-438. [PubMed] |
| 13. | Okuno M, Moriwaki H, Imai S, Muto Y, Kawada N, Suzuki Y, Kojima S. Retinoids exacerbate rat liver fibrosis by inducing the activation of latent TGF-beta in liver stellate cells. Hepatology. 1997;26:913-921. [PubMed] |
| 14. | Masaki T, Matsuura T, Ohkawa K, Miyamura T, Okazaki I, Watanabe T, Suzuki T. All-trans retinoic acid down-regulates human albumin gene expression through the induction of C/EBPbeta-LIP. Biochem J. 2006;397:345-353. [PubMed] [DOI] |
| 15. | Chlebowski RT, Grosvenor MB, Bernhard NH, Morales LS, Bulcavage LM. Nutritional status, gastrointestinal dysfunction, and survival in patients with AIDS. Am J Gastroenterol. 1989;84:1288-1293. [PubMed] |
| 16. | Phillips A, Shaper AG, Whincup PH. Association between serum albumin and mortality from cardiovascular disease, cancer, and other causes. Lancet. 1989;2:1434-1436. [PubMed] [DOI] |
| 17. | Liu L, Shack S, Stetler-Stevenson WG, Hudgins WR, Samid D. Differentiation of cultured human melanoma cells induced by the aromatic fatty acids phenylacetate and phenylbutyrate. J Invest Dermatol. 1994;103:335-340. [PubMed] [DOI] |
| 18. | Hu ZJ, Lang ZW, Song CZ, Zhang SJ. [Detection of hepatic progenitor cells in patients with severe hepatitis and their distribution]. Zhonghua Ganzangbing Zazhi. 2003;11:394-397. [PubMed] |
| 19. | Kobashi H, Miyake Y, Ikeda F, Yasunaka T, Nishino K, Moriya A, Kubota J, Nakamura S, Takaki A, Nouso K. Long-term outcome and hepatocellular carcinoma development in chronic hepatitis B or cirrhosis patients after nucleoside analog treatment with entecavir or lamivudine. Hepatol Res. 2011;41:405-416. [PubMed] [DOI] |
| 20. | Alqutub A, Peck D, Marotta P. Spontaneous regression of a large hepatocellular carcinoma: case report. Ger Med Sci. 2011;9:Doc07. [PubMed] |
| 21. | Kalva SP, Iqbal SI, Yeddula K, Blaszkowsky LS, Akbar A, Wicky S, Zhu AX. Transarterial chemoembolization with Doxorubicin-eluting microspheres for inoperable hepatocellular carcinoma. Gastrointest Cancer Res. 2011;4:2-8. [PubMed] |
| 22. | Behboudi S, Pereira SP. Alpha-fetoprotein specific CD4 and CD8 T cell responses in patients with hepatocellular carcinoma. World J Hepatol. 2010;2:256-260. [PubMed] [DOI] |
| 23. | Gil-Benso R, Martinez-Lorente A, Pellin-Perez A, Navarro-Fos S, Gregori-Romero MA, Carda C, Callaghan R, Peydro-Olaya A, Llombart-Bosch A. Characterization of a new rat cell line established from 2'AAF-induced combined hepatocellular cholangiocellular carcinoma. In Vitro Cell Dev Biol Anim. 2001;37:17-25. [PubMed] [DOI] |
| 24. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 25. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 26. | Boyer LA, Lee TI, Cole MF, Johnstone SE, Levine SS, Zucker JP, Guenther MG, Kumar RM, Murray HL, Jenner RG. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell. 2005;122:947-956. [PubMed] [DOI] |
| 27. | Pan G, Thomson JA. Nanog and transcriptional networks in embryonic stem cell pluripotency. Cell Res. 2007;17:42-49. [PubMed] [DOI] |
| 28. | Mitsui K, Tokuzawa Y, Itoh H, Segawa K, Murakami M, Takahashi K, Maruyama M, Maeda M, Yamanaka S. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell. 2003;113:631-642. [PubMed] [DOI] |
| 29. | Chambers I, Colby D, Robertson M, Nichols J, Lee S, Tweedie S, Smith A. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells. Cell. 2003;113:643-655. [PubMed] [DOI] |
| 30. | Takaishi S, Okumura T, Wang TC. Gastric cancer stem cells. J Clin Oncol. 2008;26:2876-2882. [PubMed] [DOI] |
| 31. | Xu XL, Xing BC, Han HB, Zhao W, Hu MH, Xu ZL, Li JY, Xie Y, Gu J, Wang Y. The properties of tumor-initiating cells from a hepatocellular carcinoma patient's primary and recurrent tumor. Carcinogenesis. 2010;31:167-174. [PubMed] [DOI] |
| 32. | Amin R, Mishra L. Liver stem cells and tgf-Beta in hepatic carcinogenesis. Gastrointest Cancer Res. 2008;2:S27-S30. [PubMed] |
| 33. | Ruck P, Xiao JC, Kaiserling E. Small epithelial cells and the histogenesis of hepatoblastoma. Electron microscopic, immunoelectron microscopic, and immunohistochemical findings. Am J Pathol. 1996;148:321-329. [PubMed] |
| 35. | Kleiner DE, Stetler-Stevenson WG. Matrix metalloproteinases and metastasis. Cancer Chemother Pharmacol. 1999;43 Suppl:S42-S51. [PubMed] [DOI] |
| 36. | Turner HE, Nagy Z, Esiri MM, Harris AL, Wass JA. Role of matrix metalloproteinase 9 in pituitary tumor behavior. J Clin Endocrinol Metab. 2000;85:2931-2935. [PubMed] [DOI] |
| 37. | Farias E, Ranuncolo S, Cresta C, Specterman S, Armanasco E, Varela M, Lastiri J, Pallotta MG, Bal de Kier Joffe E, Puricelli L. Plasma metalloproteinase activity is enhanced in the euglobulin fraction of breast and lung cancer patients. Int J Cancer. 2000;89:389-394. [PubMed] |
| 38. | García-Alonso I, Palomares T, Alonso-Varona A, Castro B, Del Olmo M, Portugal V, Méndez J. Effects of all-trans retinoic acid on tumor recurrence and metastasis. Rev Esp Enferm Dig. 2005;97:240-248. [PubMed] |