修回日期: 2011-11-02
接受日期: 2011-11-04
在线出版日期: 2011-11-08
目的: 构建胰十二指肠同源盒基因1 (pancreatic duodenum homeobox 1, Pdx1)启动子调控的荧光素酶基因表达载体, 筛选Pdx1启动子, 探讨Pdx1启动子活性受DNA甲基化的影响.
方法: 针对Pdx1基因启动子区域进行PCR扩增, 经限制性酶切法将扩增产物克隆至荧光素酶基因报告载体中, 构建pGL3-Pdx1重组质粒. 荧光素酶检测法检测胃癌细胞中Pdx1各段报告基因的启动子活性, 并用DNA甲基化酶SssI处理胃癌细胞, 比较各报告基因的启动子活性变化.
结果: 经过酶切和PCR法鉴定成功构建了9个携带Pdx1启动子的重组荧光素酶基因报告载体; 荧光素酶检测法显示与pGL3-basic比较, 含有F383的3个报告基因F383、F720和F1039有强启动子活性, 组间比较无显著性差异; 与对照组比较, SssI甲基化酶处理的F383、F720和F1039启动子活动明显降低(P<0.05).
结论: 成功获得由Pdx1启动子调控的荧光素酶基因表达载体, 并筛选出具有强启动子活性的3个报告基因(F383、F720和F1039), 且其启动子活性受DNA甲基化影响. 其中F383可能是Pdx1启动子核心, 这些结果为研究胃癌中Pdx1基因沉默的表观遗传学机制建立了基础.
引文著录: 马娟, 刘庆华, 王蓓蓓, 廖山婴, 沙卫红, 王启仪. 胃癌Pdx1启动子载体构建及其受DNA甲基化的调节. 世界华人消化杂志 2011; 19(31): 3222-3228
Revised: November 2, 2011
Accepted: November 4, 2011
Published online: November 8, 2011
AIM: To construct a reporter vector regulated by the Pdx1 promoter to determine the effect of DNA methylation on the promoter activity of Pdx1 gene.
METHODS: PCR amplification was performed to obtain nine potential Pdx1 promoter fragments, which were then cloned into the pGL3-basic vector to obtain recombinant pGL3-Pdx1 constructs. Promoter activity of different Pdx1 fragments in gastric cancer cells was detected by luciferase assay to identify the potential promoter area. The activity of the Pdx1 promoter with or without SssI methylase treatment was also evaluated by luciferase assay.
RESULTS: Luciferase assay showed that three fragments (F383, F720 and F1039), all of which contained the F383 sequence, had stronger promoter activity than pGL3-basic control. The promoter activity of these three fragments decreased significantly after SssI methylase treatment (all P < 0.05).
CONCLUSION: A luciferase reporter gene system containing the Pdx1 promoter was successfully constructed. F383 is the potential core area of the Pdx1 promoter. These results provide a basis for studying the epigenetic mechanism of Pdx1 gene silencing in gastric cancer.
- Citation: Ma J, Liu QH, Wang BB, Liao SY, Sha WH, Wang QY. Construction of a reporter vector regulated by the Pdx1 promoter and evaluation of the effect of DNA methylation on Pdx1 promoter activity in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2011; 19(31): 3222-3228
- URL: https://www.wjgnet.com/1009-3079/full/v19/i31/3222.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i31.3222
Pdx1即胰十二指肠同源异型基因1(Pancreatic Duodenal homeobox 1), 编码胰腺十二指肠同源框蛋白1(pancreatic duodenal homeoprotein 1), 又称IPF-1、IDX-1、IUF-1, 属于同源异型基因ParaHox亚族转录因子的一员[1,2], 位于染色体13q12.1上, 与胚胎消化道发育分化有关. 我们前期研究报道Pdx1基因在胃癌中表达下降[3,4], 但相关机制尚不明确. 已知抑癌基因或肿瘤抑制因子启动子的DNA高甲基化与肿瘤发生发展密切相关[5], 已有研究证实某些同源异型基因存在DNA甲基化并参与该基因在一系列肿瘤中的转录调节[6-13], 然而胃癌中Pdx1启动子转录调控的表观遗传学修饰研究未见报道, 因此我们假设启动子CpG岛高甲基化抑制胃癌Pdx1基因表达. 为验证假设, 本研究构建Pdx1启动子报告基因载体, 并转染胃癌细胞, 初步探讨DNA甲基化对Pdx1启动子活性的影响, 用于进一步研究胃癌中Pdx1沉默的可能机制.
人胃癌细胞AGS和TMK1购自美国ATCC细胞库(Manassas, VA); 质粒pGL3-basic购自Invitrogen公司; 大肠杆菌DH5α保存于本实验室. 质粒提取试剂盒、PCR产物回收试剂盒、限制性内切酶(XhoI和HindⅢ)、T4连接酶、CpG Methyltransferase (M.SssI)(Cat.No.M0226S)酶分别购自美国New England Biolabs公司; DNA提取试剂盒(DNeasy® Blood & Tissue Kit, Cat. No.69504)购自美国QIAGEN GmbH公司; 基因组DNA的亚硫酸钠修饰试剂盒(Chemicon CpGenome™ DNA Modification Kit, Cat.No.S7820)购自美国Chemicon公司; pGEM-T4载体(Cat.No.A3600)购自美国Promega公司.
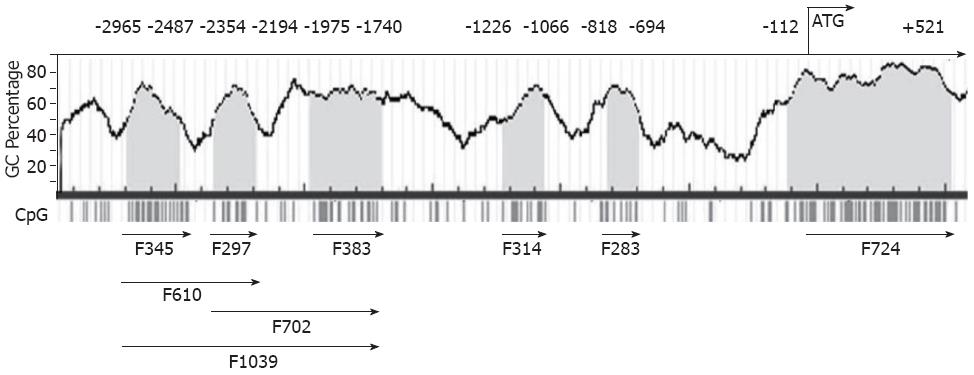
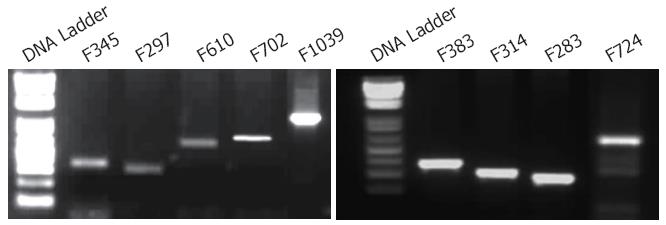
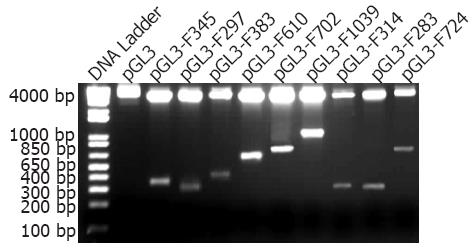
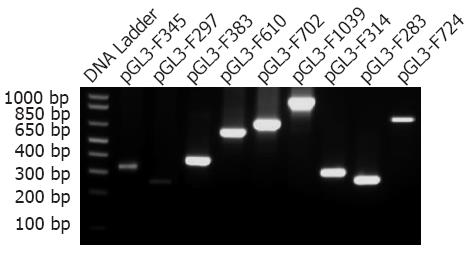
1.2.1 Pdx1启动子萤光素酶报告基因载体的构建与鉴定: (1)Pdx1基因启动子CpG岛预测和引物设计: 根据Promoter Database(http: //rulai.cshl.edu/cgi-bin/TRED/tred.cgi?process = home)和MethPrimer(http: //http://www.urogene.org/methprimer/index1.html), 获得Pdx1基因-2000 bp- +600 bp区域的启动子序列, 针对启动子序列的6个CpG岛(图1), 在线设计特异性引物(http: //frodo.wi.mit.edu/), 由天恒科技有限公司Sigma-Aldrich技术合成(表1). (2)启动子基因扩增: 将胃癌细胞用含100 mL/LFBS的RPMI 1640培养基在37 ℃, 50 mL/LCO2的培养箱中培养, 收集对数生长期细胞提取基因组DNA取基因组DNA模板2 μL、Hot-start Taq DNA聚合酶0.2 μL、上下游引物(10 pmol)各0.5 μL、dNTP Mixture(2.5 mM) 0.5 μL, 经95 ℃预变性3 min; 94 ℃变性 30 s, 56 ℃退火30 s, 72 ℃延伸45 s, 共40个循环; 72 ℃补延伸10 min后, 分别获得9个扩增片段, 长度分别为345 bp、297 bp、383 bp、610 bp、720 bp、1039 bp、314 bp、283 bp、724 bp. 取10 μL PCR扩增产物经2%琼脂糖凝胶电泳, 紫外线下观察, 凝胶成像系统成像(图2). (3)PCR产物与pGL3载体的构建与鉴定: 分别取上述PCR产物及pGL3-basic载体, 经XhoⅠ和HindⅢ双酶切后纯化回收. 取纯化后的pGL3-Basic载体1 μL及PCR产物7 μL混合, 45 ℃孵育5 min; 随后加入T4连接酶和T4连接酶缓冲液(10x)各1 μL, 混匀后置于16 ℃温育16 h, 最终使各段启动子基因序列插入无启动子的pGL3-basic载体中. 再取5 μL连接产物转化感受态大肠杆菌, 将转化后的克隆培养, 使用小量质粒抽提试剂盒抽提质粒, 4 ℃保存. 使用XhoⅠ和HindⅢ双酶切法(图3)及PCR扩增法(图4)初步筛选阳性克隆, 最后经过基因测序挑选出构建成功的重组报告基因载体pGL3-F345、pGL3-F297、pGL3-F383、pGL3-F610、pGL3-F720、pGL3-F1039、pGL3-F314、pGL3-F283、pGL3-F724.
| 部位(bp) | 引物名称 | 引物序列 | 合成片段(bp) |
| -2965 - -2487 | F345-I 1 | L: GCCTCGAG GTTAAATGGCTCGGGAAGGT | 345 |
| R: CGAAGCTT TGCCTGCGACCTATAGAAGG | |||
| -2354 - -2194 | F297-I 2 | L: GCCTCGAG GCTCCCTGGGTCCCTTCTAT | 297 |
| R: CGAAGCTT ACCCCCGGAGTGTTTACTTT | |||
| -1975 - -1704 | F383- I 3 | L: GCCTCGAG CGCAGACTGAGTCCAGAGTG | 383 |
| R: CGAAGCTT CGGTGATTTCTTCAGGGAAA | |||
| -2965 - -2194 | F610- I 1/I 2 | L: GCCTCGAG GTTAAATGGCTCGGGAAGGT | 610 |
| R: CGAAGCTT ACCCCCGGAGTGTTTACTTT | |||
| -2194 - -1704 | F702- I 2/I 3 | L: GCCTCGAG CTATAGGTCGCAGGCAGCAG | 702 |
| R: CGAAGCTT CGGTGATTTCTTCAGGGAAA | |||
| -2965 - -1704 | F1039- I 1/I 2/I 3 | L: GCCTCGAG GTTAAATGGCTCGGGAAGGT | 1039 |
| R: CGAAGCTT CGGTGATTTCTTCAGGGAAA | |||
| -1226 - -1066 | F314- I 4 | L: GCCTCGAG GCGGAGCAGTGATTTTTCTC | 314 |
| R: CGAAGCTT CATCTGTGCTTGGCTTCAAA | |||
| -818 - -694 | F283- I 5 | L: GCCTCGAG GCCCGTAGAGAGTCGTCAAG | 283 |
| R: CGAAGCTT TGGCATTCGTTGTGTGTTTT | |||
| -112 - +521 | F724- I 6 | L: GCCTCGAG GTACCTGGGCCTAGCCTCTT | 724 |
| R: CGAAGCTT TGAGAACCGGAAAGGAGAAA |
1.2.2 Pdx1报告基因的瞬时转染: (1)在转染前一天把约1×106细胞悬液种植到24孔板内, 次日细胞能达到80%-90%满密度时, 按照0.8 μg质粒DNA: 2 μL Lipofectamine 2000的比例转染空质粒pGL3和9个报告基因, 同时每孔均转染内参照Renilla. 37 ℃, 50 mL/LCO2环境下培养4 h后, 吸除含有Lipofectamine-DNA的培养液. 每孔加入1 mL含有10%FBS的新鲜RMPI 1640培养液继续培养24 h. 每组3个复孔, 独立重复实验3次. (2)为进一步观察Pdx1报告基因的启动子活性受DNA甲基化的影响, 将报告基因经SssI甲基化酶泛甲基化处理后瞬时转染胃癌细胞, 培养24 h, 检测Pdx1报告基因的Luciferase活性. 未经SssI酶处理的报告基因转染组是对照.
1.2.3 Pdx1报告基因的启动子活性检测: 转染24 h后收集细胞, 按照试剂盒Dual-Luciferase® Reporter Assay System(Cat.E1960)操作步骤, 使用Lumat LB 9507光度计(Berthold Technologies GmbH & Co.KG, 德国)分别读取各组firefly萤光素酶活性值和内参Renilla的萤光素酶活性值. 计算各报告基因的萤光素酶活性相对值, 即firefly萤光素酶活性值/Renilla的萤光素酶活性值. 每组3个复孔, 独立3次试验.
统计学处理 计数资料用mean±SD表示, 组间比较用t-test, P<0.05认为有统计学意义.
以胃癌细胞基因组DNA为模板, 扩增9段报告基因, 分别获得9个扩增片段, F345、F297、F383、F610、F720、F1039、F314、F283、F724(图1).
9个扩增片段和pGL3-basic经T4连接酶连接并转化E.coli DH5a感受态细菌后得到重组Pdx1启动子报告基因质粒载体. 再经XhoⅠ和HindⅢ双酶切和PCR扩增后, 得到不同长度的片段, 琼脂糖凝胶电泳结果显示和目的基因片段长度相符(图3, 4), 最后经基因测序证实Pdx1启动子报告基因载体构建成功.
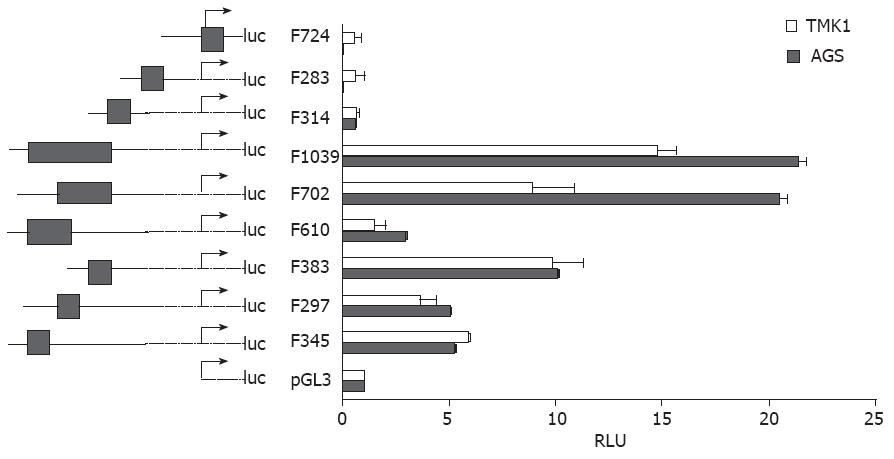
本研究选取Pdx1基因上游-2500 bp - +600 bp作为启动子区域, 针对这个区域内存在的6个CpG岛, 构建9个报告基因, 将各报告基因载体转染胃癌AGS和TMK1细胞后, 测定萤光素酶活性, 筛选有启动子活性的报告基因. 图5显示与空载体pGL3-basic比较, 包含F383的3个重组载体F383、F720、F1039有着较强的启动子活性. TMK1细胞中, F383、F720和F1039启动子活性没有显著差异(P>0.05); AGS细胞中, F702和F1039启动子活性较F383明显增加(P<0.05), 但F702和F1039两者之间无差异(P>0.05). F345、F297和F610有较弱的启动子活性, 组间无差异性. F314、F283和F724则无启动子活性.
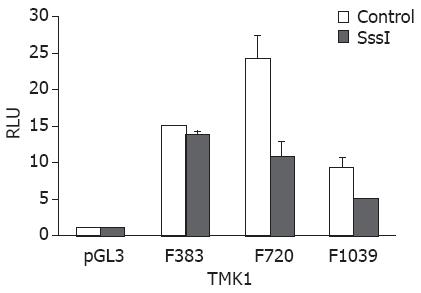
为进一步分析DNA甲基化对启动子活性的影响, 将SssI泛甲基化处理过的F383、F720和F1039转染TMK1细胞, 继续培养24 h后, 检测Pdx1报告基因的萤光素酶活性. 结果显示与对照组比较, SssI组启动子活性明显降低(P<0.05), 提示DNA甲基化抑制了Pdx1启动子活动(图6).
同源异型基因(homeotic gene)是一类包含同源框即183个氨基酸序列(homeobox)的调节基因, 能够编码有转录因子功能的同源异型蛋白(homeoproteins). 同源异型基因对于胚胎逐级分化并维持自身在成年组织的表达模式有着重要作用[14], 其异常表达与消化道肿瘤关系密切. CDX1和CDX2正常表达于小肠, 但在重度异型增生和肠型胃癌组织中表达上调[15,16], 在食管鳞癌和结肠癌中表达下调[6,7,17], SOX2在食管鳞癌组织中的表达水平显著高于正常黏膜组织[18]; IRX1在胃癌中表达缺失或下降[19]; PBX2在胃腺癌和食管鳞状细胞癌中高表达, 可能通过抑制凋亡促进肿瘤生长[20].
Pdx1属于同源异型基因亚族ParaHox家族成员[2], 与胚胎发育分化有关. 小鼠胚胎发育至第8.5天, 消化道的背细胞内开始出现Pdx1的表达, 第9天十二指肠、背胰芽和腹胰芽细胞内也有Pdx1的表达, 胚胎发育第17.5天直至小鼠出生 后, Pdx1基因则主要表达于胰脏内分泌腺的β细胞和十二指肠绒毛上皮的Brunner氏腺体, 胃窦内分泌腺细胞[21,22]. Pdx1在调控胰腺发育及胰内分泌腺β-细胞胰岛素基因方面起着关键作用[23,24], Pdx1基因的纯合子缺失、突变会导致小鼠胰腺无法形成[23]. Pdx1基因的异常表达亦与胃的分化发育和病理过程有关. Offield等[25]曾报道Pdx1基因敲除小鼠的胃十二指肠接合处难以发育成熟, 影响正常胃排空, 导致小鼠胃潴留. Faller等[26]则报道Pdx1表达与胃黏膜萎缩及化生的免疫学和形态学有关, Sakai等[27]在胃假幽门腺体及胃肿瘤中检测到PDX1蛋白的表达. 我们的前期研究进一步报道了Pdx1基因及蛋白在胃癌中表达下调甚至缺失的模式, 并发现转染Pdx1正义表达载体后, 胃癌细胞的增殖、侵袭和成瘤能力均受到抑制[3,28], 提示Pdx1基因可能是胃癌的肿瘤抑制因子, 抑制了胃癌的发生发展. 但胃癌Pdx1基因表达下调的转录调控机制尚不明了.
表观遗传学(Epigenetics)就是不改变基因本身的序列, 但是可以通过基因修饰、蛋白质与蛋白质、DNA和其他分子的相互作用而影响和调节遗传基因的功能和特性, 并且通过细胞分裂和增殖周期影响遗传. 表观遗传学在维持正常细胞功能、遗传印记、胚胎发育以及人类肿瘤发生中起着重要作用, 是目前新的研究热点. DNA甲基化是表观遗传学的重要组成部分, 指由DNA甲基转移酶(DNMT)催化, 把S腺苷甲硫氨酸(SAM)的甲基转移到胞嘧啶5位碳原子上, 生成5甲基胞嘧啶(5-mc)的过程. 在脊椎动物中, 基因组中富含CpG二核苷酸的一段DNA即CpG岛是DNA甲基化发生的主要位点, 常位于转录调控区附近. 启动子CpG岛高甲基化可导致抑癌基因的表达缺失, 与肿瘤的发生密切相关[5]. 近来研究报道某些homeobox基因存在DNA甲基化并参与该基因在一系列肿瘤中的转录调节. CDX1、CDX2在食管鳞癌及结肠癌中表达下调, 可能与启动子DNA甲基化相关[6,7]. HOPX-beta启动子甲基化在胃癌中是频发和肿瘤特异性的, 预示着HOPX-beta可能是临床肿瘤进展的潜在标记物[8]. Hoxa1基因在肝外胆管癌的癌前病变中存在DNA高甲基化[9]. Hoxa9基因启动子在肝细胞癌(HCC)组织中高甲基化[10,29]. 更有研究观察不同表观遗传调节药物对hemeobox基因表达的影响. Li等[11]研究报道药物地西他滨(5-aza-2'-deoxycytidine, DAC)、三氧化二砷(ATO)和MS-275通过重叠和单独的表观遗传学分子机制上调Rho5同源基因表达. 尚有研究探讨胃癌中hemeobox基因通过表观遗传学机制调节相关信号通路. Mutoh等[12]报道Cdx2转基因鼠的肠化生黏膜中, Shh启动子不是高甲基化的, 但Cdx2可直接结合Shh启动子的TATA盒区域, 从而下调Shh转录表达. Palakurthy等[13]研究报道HOXB3可结合Dnmt3b基因并上调DNMT3B表达, DNMT3B又可结合Rassf1a启动子, 从而导致Rassf1a甲基化及表达沉默. 然而关于胃癌中Pdx1基因表达下调的潜在表观遗传学机制尚未见研究报道. 故我们推测启动子CpG岛甲基化参与胃癌Pdx1基因表达下调, 为验证假设, 本研究构建Pdx1启动子报告基因, 确定Pdx1启动子区域, 初步探讨DNA甲基化对Pdx1启动子转录活性的调节作用.
Pdx1基因有3处具有转录活性的部位, 即-2839 bp - -2521 bp (AreaⅠ)、-2252 bp - -2023 bp(AreaⅡ)和-1939 bp - -1664 bp (AreaⅢ)[30]. Wiebe等[31]研究发现AreaⅢ可由Ptf1a结合激活, 进而调节早期胰腺的Pdx1表达, 更进一步证明了AreaⅢ的重要性. Vanvelkinbur等[32]则研究报道AreaⅠ和AreaⅡ可形成复合体调节Pdx1表达. 本研究选取Pdx1基因上游-2500 bp - +500 bp作为启动子区域, 针对这个区域内存在的6个CpG岛, 构建了9个报告基因, 结果显示构建的报告基因F345、F297和F383分别位于AreaⅠ、AreaⅡ和AreaⅢ, F610、F702及F1039则分别包含AreaⅠ/AreaⅡ、AreaⅡ/AreaⅢ和AreaⅠ/AreaⅡ/AreaⅢ区域. luciferase检测显示含有F383的F383、F702和F1039有较强的启动子活性, 且在AGS细胞中, 与F383比较, F702和F1039启动子活性明显增加, 但F702和F1039两者之间无差异, 提示位于-1975 bp - -1704 bp处的F383可能是Pdx1启动子的核心区域, F297可能与F383有协同作用, 增加了Pdx1启动子活性, 提示AreaⅢ是Pdx1启动子区域, 且AreaⅡ与AreaⅢ复合体能增加Pdx1启动子活性, 促进Pdx1转录, 进一步支持了Wiebe等[31]的研究结果. 但我们结果显示F345、F297有较弱的启动子活性, F610亦未显示出AreaⅠ/AreaⅡ复合体对启动子活性的协同作用, 未能支持Vanvelkinbur等人的研究[32].
本研究结果尚显示由CpG岛组成的F383、F702和F1039, 经SssI甲基化酶处理后, 启动子活性显著降低, 这提示F383、F702和F1039包含的CpG岛可能是转录功能区, DNA甲基化抑制了Pdx1启动子活性, 继而下调了Pdx1在胃癌中的表达, 这可作为一个间接证据支持Pdx1启动子CpG岛甲基化与其转录活性相关. 我们正在进一步进行胃癌组织和细胞中这些片段的DNA甲基化状态评估, 以期提供直接证据(数据未显示).
我们的研究结果为将来进一步研究可作用于Pdx1启动子的相关因子及研究Pdx1在胃癌发生发展过程中的作用及机制奠定了实验基础.
Pdx1即胰十二指肠同源异型基因1, 与胚胎消化道发育分化有关. 我们前期研究已经报道Pdx1在胃癌中表达下调, 但何种潜在机制调节Pdx1在胃癌中的表达尚不明了.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科
表观遗传学是近年来的研究热点、重点, DNA甲基化是其重要组成部分. 抑癌基因或肿瘤抑制因子启动子的DNA高甲基化与肿瘤发生发展密切相关.
某些同源异型基因如CDX2、HOPX-beta、Hoxa9启动子甲基化与消化系肿瘤相关.
目前国内外关于Pdx1在胃癌中的研究甚少, 本研究成功构建Pdx1启动子载体, 并初步验证Pdx1启动子活性受DNA甲基化抑制.
成功构建Pdx1启动子, 筛选出最强活性的启动子片段, 且进一步探讨了Pdx1启动子活性受DNA甲基化的影响, 为进一步深入研究胃癌Pdx1基因表达沉默的表观遗传学机制奠定基础.
DNA甲基化: 由DNA甲基转移酶(DNMT)催化, 把S腺苷甲硫氨酸(SAM)的甲基转移到胞嘧啶5位碳原子上, 生成5甲基胞嘧啶(5-mc)的过程..
本文成功构建了Pdx1启动子载体, 并初步探讨 了其甲基化状态与胃癌的关系, 为进一步研究胃癌机制奠定了基础, 文章有一定的创新性和科研价值.
编辑: 李军亮 电编:闫晋利
| 1. | Barucca M, Olmo E, Canapa A. Hox and paraHox genes in bivalve molluscs. Gene. 2003;317:97-102. [PubMed] [DOI] |
| 2. | Brooke NM, Garcia-Fernàndez J, Holland PW. The ParaHox gene cluster is an evolutionary sister of the Hox gene cluster. Nature. 1998;392:920-922. [PubMed] [DOI] |
| 3. | Ma J, Chen M, Wang J, Xia HH, Zhu S, Liang Y, Gu Q, Qiao L, Dai Y, Zou B. Pancreatic duodenal homeobox-1 (Pdx1) functions as a tumor suppressor in gastric cancer. Carcinogenesis. 2008;29:1327-1333. [PubMed] [DOI] |
| 4. | Zhu S, Xia HH, Yang Y, Ma J, Chen M, Hu P, Gu Q, Liang Y, Lin H, Wong BC. Alterations of gastric homeoprotein expression in Helicobacter pylori infection, incisural antralisation, and intestinal metaplasia. Dig Dis Sci. 2009;54:996-1002. [PubMed] [DOI] |
| 5. | Esteller M. Cancer epigenomics: DNA methylomes and histone-modification maps. Nat Rev Genet. 2007;8:286-298. [PubMed] [DOI] |
| 6. | Wong NA, Britton MP, Choi GS, Stanton TK, Bicknell DC, Wilding JL, Bodmer WF. Loss of CDX1 expression in colorectal carcinoma: promoter methylation, mutation, and loss of heterozygosity analyses of 37 cell lines. Proc Natl Acad Sci U S A. 2004;101:574-579. [PubMed] [DOI] |
| 7. | Guo M, House MG, Suzuki H, Ye Y, Brock MV, Lu F, Liu Z, Rustgi AK, Herman JG. Epigenetic silencing of CDX2 is a feature of squamous esophageal cancer. Int J Cancer. 2007;121:1219-1226. [PubMed] [DOI] |
| 8. | Ooki A, Yamashita K, Kikuchi S, Sakuramoto S, Katada N, Kokubo K, Kobayashi H, Kim MS, Sidransky D, Watanabe M. Potential utility of HOP homeobox gene promoter methylation as a marker of tumor aggressiveness in gastric cancer. Oncogene. 2010;29:3263-3275. [PubMed] [DOI] |
| 9. | Kim BH, Cho NY, Shin SH, Kwon HJ, Jang JJ, Kang GH. CpG island hypermethylation and repetitive DNA hypomethylation in premalignant lesion of extrahepatic cholangiocarcinoma. Virchows Arch. 2009;455:343-351. [PubMed] [DOI] |
| 10. | Feng Q, Stern JE, Hawes SE, Lu H, Jiang M, Kiviat NB. DNA methylation changes in normal liver tissues and hepatocellular carcinoma with different viral infection. Exp Mol Pathol. 2010;88:287-292. [PubMed] [DOI] |
| 11. | Li Q, Bartlett DL, Gorry MC, O'Malley ME, Guo ZS. Three epigenetic drugs up-regulate homeobox gene Rhox5 in cancer cells through overlapping and distinct molecular mechanisms. Mol Pharmacol. 2009;76:1072-1081. [PubMed] [DOI] |
| 12. | Mutoh H, Hayakawa H, Sashikawa M, Sakamoto H, Sugano K. Direct repression of Sonic Hedgehog expression in the stomach by Cdx2 leads to intestinal transformation. Biochem J. 2010;427:423-434. [PubMed] [DOI] |
| 13. | Palakurthy RK, Wajapeyee N, Santra MK, Gazin C, Lin L, Gobeil S, Green MR. Epigenetic silencing of the RASSF1A tumor suppressor gene through HOXB3-mediated induction of DNMT3B expression. Mol Cell. 2009;36:219-230. [PubMed] [DOI] |
| 14. | Abate-Shen C. Deregulated homeobox gene expression in cancer: cause or consequence? Nat Rev Cancer. 2002;2:777-785. [PubMed] [DOI] |
| 16. | 林 一帆, 王 长洪, 刘 杰, 胡 家露, 宋 福林, 陆 宇平, 陈 山泉, 杨 卓. 胃癌与癌前病变CdX2基因蛋白表达的意义. 世界华人消化杂志. 2004;12:1971-1973. [DOI] |
| 17. | Bonhomme C, Duluc I, Martin E, Chawengsaksophak K, Chenard MP, Kedinger M, Beck F, Freund JN, Domon-Dell C. The Cdx2 homeobox gene has a tumour suppressor function in the distal colon in addition to a homeotic role during gut development. Gut. 2003;52:1465-1471. [PubMed] [DOI] |
| 19. | Guo X, Liu W, Pan Y, Ni P, Ji J, Guo L, Zhang J, Wu J, Jiang J, Chen X. Homeobox gene IRX1 is a tumor suppressor gene in gastric carcinoma. Oncogene. 2010;29:3908-3920. [PubMed] [DOI] |
| 20. | Qiu Y, Song B, Zhao G, Deng B, Makino T, Tomita Y, Wang J, Luo W, Doki Y, Aozasa K. Expression level of Pre B cell leukemia homeobox 2 correlates with poor prognosis of gastric adenocarcinoma and esophageal squamous cell carcinoma. Int J Oncol. 2010;36:651-663. [PubMed] |
| 21. | Stoffers DA, Heller RS, Miller CP, Habener JF. Developmental expression of the homeodomain protein IDX-1 in mice transgenic for an IDX-1 promoter/lacZ transcriptional reporter. Endocrinology. 1999;140:5374-5381. [PubMed] [DOI] |
| 22. | Guz Y, Montminy MR, Stein R, Leonard J, Gamer LW, Wright CV, Teitelman G. Expression of murine STF-1, a putative insulin gene transcription factor, in beta cells of pancreas, duodenal epithelium and pancreatic exocrine and endocrine progenitors during ontogeny. Development. 1995;121:11-18. [PubMed] |
| 23. | Gannon M, Gamer LW, Wright CV. Regulatory regions driving developmental and tissue-specific expression of the essential pancreatic gene Pdx1. Dev Biol. 2001;238:185-201. [PubMed] [DOI] |
| 24. | Gu G, Dubauskaite J, Melton DA. Direct evidence for the pancreatic lineage: NGN3+ cells are islet progenitors and are distinct from duct progenitors. Development. 2002;129:2447-2457. [PubMed] |
| 25. | Offield MF, Jetton TL, Labosky PA, Ray M, Stein RW, Magnuson MA, Hogan BL, Wright CV. PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum. Development. 1996;122:983-995. [PubMed] |
| 26. | Faller G, Kirchner T. Immunological and morphogenic basis of gastric mucosa atrophy and metaplasia. Virchows Arch. 2005;446:1-9. [PubMed] [DOI] |
| 27. | Sakai H, Eishi Y, Li XL, Akiyama Y, Miyake S, Takizawa T, Konishi N, Tatematsu M, Koike M, Yuasa Y. Pdx1 homeobox protein expression in pseudopyloric glands and gastric carcinomas. Gut. 2004;53:323-330. [PubMed] [DOI] |
| 29. | Shin SH, Kim BH, Jang JJ, Suh KS, Kang GH. Identification of novel methylation markers in hepatocellular carcinoma using a methylation array. J Korean Med Sci. 2010;25:1152-1159. [PubMed] [DOI] |
| 30. | Gerrish K, Gannon M, Shih D, Henderson E, Stoffel M, Wright CV, Stein R. Pancreatic beta cell-specific transcription of the pdx-1 gene. The role of conserved upstream control regions and their hepatic nuclear factor 3beta sites. J Biol Chem. 2000;275:3485-3492. [PubMed] [DOI] |
| 31. | Wiebe PO, Kormish JD, Roper VT, Fujitani Y, Alston NI, Zaret KS, Wright CV, Stein RW, Gannon M. Ptf1a binds to and activates area III, a highly conserved region of the Pdx1 promoter that mediates early pancreas-wide Pdx1 expression. Mol Cell Biol. 2007;27:4093-4104. [PubMed] [DOI] |
| 32. | Van Velkinburgh JC, Samaras SE, Gerrish K, Artner I, Stein R. Interactions between areas I and II direct pdx-1 expression specifically to islet cell types of the mature and developing pancreas. J Biol Chem. 2005;280:38438-38444. [PubMed] [DOI] |