修回日期: 2011-10-15
接受日期: 2011-10-21
在线出版日期: 2011-10-28
目的: 建立丙型肝炎病毒(hepatitis C virus, HCV)核心(core, C)蛋白体外表达的非肝细胞模型.
方法: 核酸酶切法鉴定含有HCV1b基因型C蛋白编码基因的重组质粒pCMH6K的稳定性, 将pCMH6K瞬时及稳定转染于中华仓鼠卵巢(China hamster ovary, CHO)细胞并连续传代110 d, 免疫荧光法检测转染细胞内HCV C蛋白分布特征, RT-PCR法检测转染细胞内HCV C mRNA.
结果: pCMH6K含有与HCV1b基因型C蛋白编码基因(573 bp)相一致的特异性片段; 在pCMH6K瞬时以及稳定转染的CHO细胞内可见HCV C蛋白主要分布在胞质, 少部分在胞膜; 在不同时期稳定转染CHO细胞中均可见到与HCV C mRNA相一致的基因特异性片段(267 bp).
结论: 成功建立了能够持续表达HCV C蛋白的CHO细胞株.
引文著录: 薛宏丽, 冯国和. 一种用于HCV核心蛋白体外表达研究的CHO细胞模型的建立. 世界华人消化杂志 2011; 19(30): 3117-3121
Revised: October 15, 2011
Accepted: October 21, 2011
Published online: October 28, 2011
AIM: To establish a non-hepatic cell model expressing hepatitis C virus (HCV) core protein in vitro.
METHODS: Recombinant plasmid pCMH6K containing the gene encoding HCV 1b core protein was identified by restriction digestion and temporarily or stably transfected into Chinese hamster ovary (CHO) cells using Lipofectamine 2000. CHO cells transfected with the pCMH6K plasmid were passaged continuously for 110 days. Distribution of HCV core protein in transfected CHO cells was examined by immune fluorescence. The mRNA expression of HCV core protein in transfected CHO cells was examined by RT-PCR.
RESULTS: The pCMH6K plasmid contains the gene encoding HCV1b core protein. HCV core protein was mainly distributed in the cytoplasm and scarcely in the membrane of CHO cells temporarily or stably transfected with the pCMH6K plasmid. The mRNA expression of HCV core protein was also detected in CHO cells transfected with the pCMH6K plasmid.
CONCLUSION: CHO cells transfected with the pCMH6K plasmid could express HCV core protein persistently.
- Citation: Xue HL, Feng GH. Establishment of a CHO cell model expressing hepatitis C virus core protein in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(30): 3117-3121
- URL: https://www.wjgnet.com/1009-3079/full/v19/i30/3117.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i30.3117
丙型肝炎病毒核心(hepatitis C virus core, HCV C)蛋白可与宿主细胞蛋白相结合, 通过多种途径参与肝细胞脂肪变性、肝纤维化、胰岛素抵抗和干扰素抵抗等[1]. 长期、稳定的HCV体外细胞或动物感染模型的建立, 有益于对HCV持续感染机制、抗病毒治疗新药以及有效疫苗研发进行更深入的研究[2,3]. 本研究将构建的含有HCV C蛋白编码基因的真核表达重组质粒pCMH6K转染到中华仓鼠卵巢(China hamster ovary, CHO)细胞, 通过G418加压筛选获取阳性细胞克隆. 在进行持续传代110 d中, 定期通过免疫荧光、RT-PCR等方法检测HCV 1b基因型的C蛋白编码基因复制与表达. 稳定表达HCV C蛋白的CHO细胞株的建立将为进一步研究HCV C蛋白与宿主细胞的相互作用, 阐述HCV感染致病机制奠定基础.
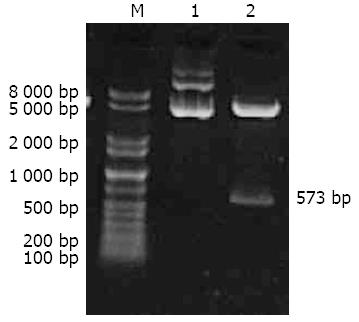
在BamHⅠ酶切位点插入全长573 bp的HCV 1b基因型C基因的重组质粒pCMH6K由日本金泽医科大学综合医学研究所王春福博士惠赠. 感受态菌DH5α购自TaKaRa公司; CHO细胞购自中国科学院上海细胞库, 生长于37 ℃、50 mL/L CO2及含有10% FCS的DMEM中. 小量质粒提取试剂盒购自Axygen公司; 细胞培养基DMEM购自Thermo Fisher生物制品北京有限公司; 胎牛血清购自天津市灏洋生物制品科技有限责任公司; 氨苄青霉素、脂质体(Lipofectamine 2000)和G418购自Invitrogen公司; BamHⅠ、Total RNA提取试剂和RT-PCR试剂盒购自TaKaRa公司; 小鼠的单克隆抗体HepC cAg(C7-50)购自Santa公司; FITC标记山羊抗小鼠IgG购自北京中杉公司. 引物选自HCV C区序列: 5'-TTA GGA TCC ACG AAT CCT AAA CCT CAA A-3'为上游引物, 位于HCV C区第348-366 nt位点; 5'- ACT GAA TTC CCT CAT TGC CAT AGA GGG-3'为下游引物, 互补于HCV C区第592-610 nt位点, 由TaKaRa公司合成. 采用RT-PCR方法检测pCMH6K稳定转染的不同时期CHO细胞中HCV C mRNA.
1.2.1 pCMH6K转化与鉴定: (1)pCMH6K转化: 解冻感受态细胞DH5α并取60 μL后加入pCMH6K溶液50 ng, 冰上放置30 min后42 ℃水浴热击90 s, 再迅速置冰上3 min, 加入1 mL LB液体培养基于37 ℃混匀, 225 r/min振荡1 h. 取10 μL菌液在含氨苄青霉素(80 mg/L)的LB琼脂糖培养基上37 ℃过夜培养; (2)pCMH6K提取: 从平板培养基上挑取单菌落接种于含有氨苄青霉素(80 mg/L)的3 mL LB液体培养基中, 37 ℃、225 r/min, 摇菌16 h, 参照质粒小提试剂盒说明书进行pCMH6K小剂量提取; (3)pCMH6K酶切鉴定: 取pCMH6K溶液2 μL加BamHⅠ 2 μL, 10×Buffer 4 μL, 最终总体积40 μL, 37 ℃酶切1 h, 取5 μL用于1%琼脂糖凝胶电泳鉴定.
1.2.2 脂质体(Lipofectamine2000)法瞬时转染pCMH6K: (1)CHO细胞常规培养: 取6孔板培养CHO细胞(37 ℃、50 mL/L CO2、10%胎牛血清和双抗的DMEM)至培养细胞达到90%以上融合; (2)pCMH6K转染: 将4 μg pCMH6K与无血清无抗生素的DMEM混合至总体积250 μL, 即溶液A; 将10 μL脂质体与240 μL无血清无抗生素的DMEM混匀并室温孵育5 min, 即溶液B; 将溶液A与溶液B混合并室温孵育20 min形成脂质体/质粒混合物. 加上述混合物于6孔板培养的CHO细胞, 37 ℃、50 mL/L CO2孵育4 h后加入10% FCS的DMEM继续培养至24 h; (3)免疫荧光法检测HCV C蛋白: 4%多聚甲醛固定转染pCMH6K的CHO细胞1 h, 加入0.1%的Triton溶液10 min, 加入1% BSA封闭1 h, 加入一抗HepC cAg(0.1% BSA稀释, 稀释度1∶100)并于4 ℃孵育过夜, 暗室中加入二抗FITC标记山羊抗小鼠IgG(0.1% BSA稀释, 稀释度1∶100)37 ℃避光孵育1 h; 荧光显微镜下观察细胞并拍照.
1.2.3 脂质体(Lipofectamine2000)法稳定转染pCMH6K: (1)筛选最佳G418浓度: 将CHO细胞接种于24孔板, 孵育24 h后, 每孔分别加入不同浓度的G418, 依次为600 mg/L、650 mg/L、700 mg/L、750 mg/L、800 mg/L、850 mg/L、900 mg/L、每种浓度设3个孔, 余下3孔为正常细胞对照. 培养11 d后确定能杀死所有细胞的最低G418浓度作为本实验的最佳筛选浓度, 即为800 mg/L; (2)pCMH6K稳定转染: 用24孔板(每孔0.5 mL)培养CHO细胞24 h, 将pCMH6K 0.8 μg与脂质体2 μL混合并加入无血清无抗生素的DMEM至总体积为100 μL, 室温孵育20 min后加入24孔板的CHO细胞中, 培养6 h后更换为新鲜含10% FCS的DMEM继续培养至24 h, 将CHO细胞以1∶4的比例接种到6孔板和24孔板中, 常规培养24 h, 待细胞密度增至50%-70%汇合时, 分别加入800 mg/L含G418的DMEM培养液筛选, 加压筛选2 wk时, 正常细胞及脂质体对照细胞均死亡. 将具有抗生素抗性的阳性CHO细胞克隆, 用含400 mg/L G418的DMEM维持筛选培养扩大阳性克隆, 传代培养110 d, 细胞稳定生长, 并收集维持筛选后第35、40、45、50、65、85、90、95、100、105以及110天等不同时期的细胞.
1.2.4 免疫荧光检测稳定转染细胞株中HCV C蛋白: 培养pCMH6K转染的CHO细胞并接种至6孔板中的盖玻片上, 培养24 h使细胞密度达到80%以上, 免疫荧光检测pCMH6K转染的CHO细胞中HCV C蛋白的方法同前, 50%甘油封片, 于荧光显微镜下观察细胞并拍照.
1.2.5 RT-PCR法检测稳定转染细胞株中HCV C mRNA: (1)细胞总RNA提取: 将上述不同时期收集的pCMH6K稳定转染CHO细胞, 按Total RNA提取试剂盒说明书进行细胞总RNA提取, 紫外线分光光度仪分别测定其浓度; (2)RT-PCR: 将提取的RNA稀释成500 mg/L, 以小鼠管家基因GAPDH作为内参, RT-PCR反应条件, RT: 42℃ 30 min, 99 ℃ 5 min , 5 ℃ 5 min, PCR: 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 35循环, 最后72 ℃延伸5 min. 取PCR反应液3 μL、小鼠管家基因GAPDH PCR反应液2 μL进行1.5%琼脂糖凝胶电泳分析.
提取pCMH6K经BamHⅠ酶切、1%琼脂糖凝胶电泳分析, 可见到约573 bp的片段, 与HCV 1b基因型C蛋白编码基因大小相一致(图1).
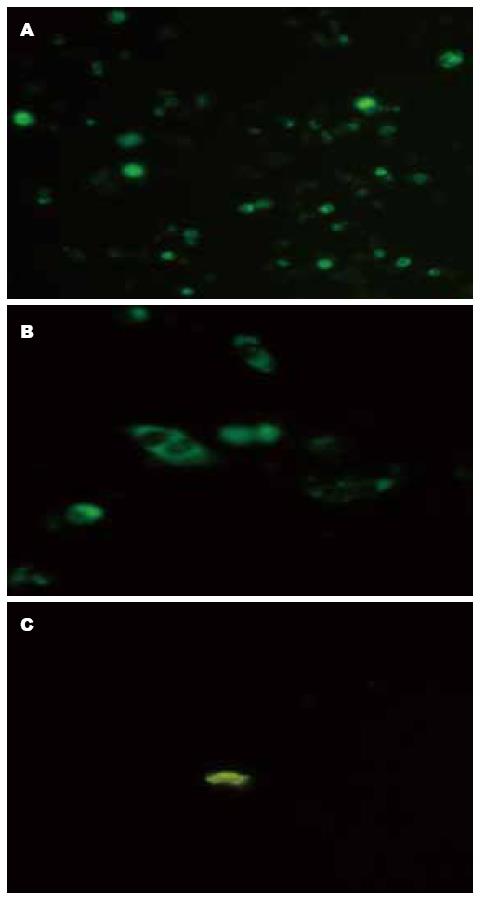
转染pCMH6K的CHO细胞于24 h可见较显著的绿色荧光标记(图2A), 高倍视野可见绿色荧光标记主要分布在胞质, 也可见于胞膜(图2B); 未转染pCMH6K的CHO细胞未见特异性绿色荧光标记, 仅见散在的无特异性绿色荧光杂质(图2C).
pCMH6K稳定转染后的CHO细胞于培养后48 h加入G418, 加压筛选2 wk, 可见单个及小细胞团簇形成即阳性克隆出现(图3A), 维持筛选第3天(图3B)、6天、12天、15天可见细胞团簇逐渐扩大并融合; 维持筛选后第35天、40天、45天、50天、65天、85天、90天、95天、100天、105天以及110天(图3C)等不同时期的细胞, 可见细胞稳定生长, 通过与同步传代的正常CHO细胞(图3D)进行光镜下比较, 二者在细胞形态上没有显著区别.
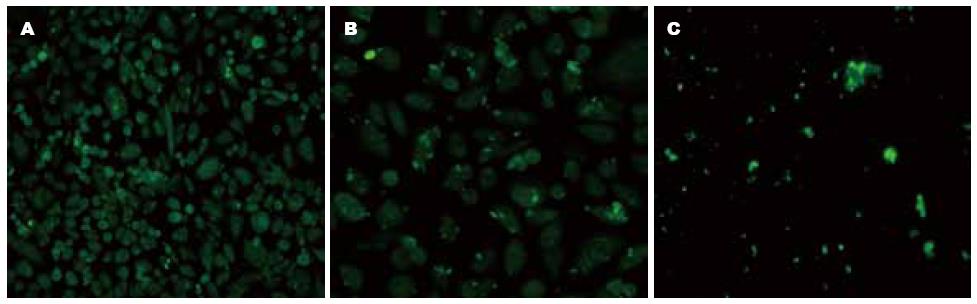
与未转染CHO细胞(图4C)比较, 稳定转染的CHO细胞(图4A, 4B)可见较显著绿色荧光标记.
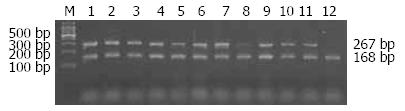
经琼脂糖凝胶电泳可见特异性条带, 反应产物大约267 bp, 未转染细胞未见特异性条带, 小鼠的管家基因GAPDH产物约168 bp(图5).
近年研究发现HCV C蛋白除作为核壳体蛋白具有病毒颗粒组装功能外, 还参与调节细胞凋亡[4,5]、脂代谢[6,7]、转录[8,9]以及抗原递呈[10]等作用, 与干扰素抵抗也有密切关系[11]. HCV C蛋白具有广泛的反式激活作用, 与宿主细胞蛋白相互作用, 是导致病毒持续感染以及肝细胞癌变的重要原因[12]. 深入认知和分析HCV C蛋白分子生物学特性, 对阐明HCV持续性感染与致癌机制以及HCV对肝细胞脂肪变与干扰素疗效的影响等诸多问题具有重要意义. 稳定、持续表达HCV C蛋白的细胞感染模型的建立, 将为HCV C蛋白与宿主细胞相互作用的系列研究提供契机[2,3].
本研究将构建的含有HCV 1b基因型C基因的真核表达重组质粒pCMH6K, 经转化、提取、酶切鉴定后, 通过脂质体法瞬时转染CHO细胞. 经免疫荧光检测证实HCV C蛋白在细胞中表达, 高倍视野下可见表达的部位在胞质和胞膜, 以胞质为主. pCMH6K稳定转染的研究将为用于HCV C蛋白体外表达研究的CHO细胞模型的建立提供可能. 在适宜的G418筛选浓度控制下, 从筛选出pCMH6K转染的CHO细胞阳性克隆到细胞成簇、细胞团融合以及稳定传代共计110 d期间, 分别收集维持筛选的第35、40、45、50、65、85、90、95、100、105以及110天的传代CHO细胞, 经免疫荧光检测细胞中HCV C蛋白表达分布特点, 可见特异性的绿色荧光标记仍主要分布在胞质, 少部分在胞膜; 同pCMH6K瞬时转染的CHO细胞的免疫荧光检测结果相一致, 但表达量较前者明显增加. 应用针对HCV C基因负链区域特异性引物, 通过RT-PCR方法检测上述不同时期稳定转染CHO细胞中HCV C基因mRNA, 经1.5%琼脂糖凝胶电泳分析, 均可见到与HCV C mRNA相一致的特异性片段(267 bp), 证实pCMH6K稳定转染的CHO细胞在110 d内存在HCV C基因的持续性转录与表达, 进而提示建立了稳定表达HCV C蛋白的CHO细胞模型.
早期研究认为HCV是一种严格的嗜肝病毒, 不能在肝细胞以外的细胞中复制, 而后续研究发现HCV还可体外感染单核细胞与淋巴细胞. 先后用HCV体外感染的细胞株包括人单核细胞株(U937)、人T淋巴细胞株(Molt-4)、人胆囊细胞株(Kirlich)、猪肾细胞株(PK15)以及鼠睾丸细胞株(STE)[13]等. 虽然HCV在猪肾细胞株、鼠睾丸细胞株和人肝癌细胞(Hep3B)中能间接表达相关蛋白, 但是在上述细胞中只能检测到HCV RNA的正链, 却无法检测到HCV负链, 即复制中间体, 说明上述细胞的选择仍难阐述HCV复制环节. 本研究选用非人源CHO细胞作为含HCV C基因重组质粒稳定转染的受体细胞, RT-PCR法在pCMH6K稳定转染的不同时期CHO细胞内检测到HCV C mRNA, 证明了含HCV C基因重组子可在CHO细胞内转录与表达特点, 此模型的建立可为后续HCV C蛋白分子生物学特性以及与宿主细胞相互作用的体外研究奠定基础.
丙型肝炎病毒核心蛋白可与宿主细胞蛋白相结合, 通过多种途径参与肝细胞脂肪变性、肝纤维化、肝硬化和肝细胞癌的发生, 与胰岛素抵抗、干扰素抵抗有密切关系, 在HCV感染的致病机制中起重要作用. 至今尚不能建立长期而稳定的HCV体外感染细胞模型和动物模型, 严重影响了对HCV复制机制、持续感染机制、与宿主蛋白的相互作用以及新药与疫苗研发等相关内容的深入研究.
任浩, 副教授, 中国人民解放军第二军医大学微生物学教研室
如何建立长期而稳定的HCV体外感染细胞或动物模型, 为HCV变异性、复制机制、与宿主蛋白的相互作用以及新药与疫苗的研发提供研究平台, 一直是近20余年来丙型肝炎研究领域的热点与难点.
任浩等建立了持续产生HCVcc的HCV 2a型体外细胞感染模型, IFNα能抑制FL-J6JFH HCVcc感染细胞中HCV RNA的复制, 为研究HCV的结构与功能提供了实验平台.
本研究选用非人源CHO细胞作为含HCV C基因重组质粒稳定转染的受体细胞, 建立稳定表达HCV C蛋白的细胞模型, 为研究HCV C蛋白的作用奠定基础.
本研究建立了体外稳定表达HCV 核心蛋白的非肝细胞模型, 为后续研究HCV核心蛋白与宿主细胞的相互作用, 阐述HCV感染的致病机制提供研究平台.
本研究旨在建立HCV体外感染的非肝细胞模型, 既是HCV感染研究领域的热点, 又具有创新性, 具有较好的学术价值.
编辑: 曹丽鸥 电编:何基才
| 4. | Suzuki R, Sakamoto S, Tsutsumi T, Rikimaru A, Tanaka K, Shimoike T, Moriishi K, Iwasaki T, Mizumoto K, Matsuura Y. Molecular determinants for subcellular localization of hepatitis C virus core protein. J Virol. 2005;79:1271-1281. [PubMed] [DOI] |
| 5. | Sacco R, Tsutsumi T, Suzuki R, Otsuka M, Aizaki H, Sakamoto S, Matsuda M, Seki N, Matsuura Y, Miyamura T. Antiapoptotic regulation by hepatitis C virus core protein through up-regulation of inhibitor of caspase-activated DNase. Virology. 2003;317:24-35. [PubMed] [DOI] |
| 6. | Koike K, Moriya K. Metabolic aspects of hepatitis C viral infection: steatohepatitis resembling but distinct from NASH. J Gastroenterol. 2005;40:329-336. [PubMed] [DOI] |
| 7. | Yamaguchi A, Tazuma S, Nishioka T, Ohishi W, Hyogo H, Nomura S, Chayama K. Hepatitis C virus core protein modulates fatty acid metabolism and thereby causes lipid accumulation in the liver. Dig Dis Sci. 2005;50:1361-1371. [PubMed] [DOI] |
| 8. | de Lucas S, Bartolomé J, Amaro MJ, Carreño V. Hepatitis C virus core protein transactivates the inducible nitric oxide synthase promoter via NF-kappaB activation. Antiviral Res. 2003;60:117-124. [PubMed] [DOI] |
| 9. | Sato Y, Kato J, Takimoto R, Takada K, Kawano Y, Miyanishi K, Kobune M, Sato Y, Takayama T, Matunaga T. Hepatitis C virus core protein promotes proliferation of human hepatoma cells through enhancement of transforming growth factor alpha expression via activation of nuclear factor-kappaB. Gut. 2006;55:1801-1808. [PubMed] [DOI] |
| 10. | Giannini C, Caini P, Giannelli F, Fontana F, Kremsdorf D, Bréchot C, Zignego AL. Hepatitis C virus core protein expression in human B-cell lines does not significantly modify main proliferative and apoptosis pathways. J Gen Virol. 2002;83:1665-1671. [PubMed] |
| 11. | Hadziyannis SJ, Sette H, Morgan TR, Balan V, Diago M, Marcellin P, Ramadori G, Bodenheimer H, Bernstein D, Rizzetto M. Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med. 2004;140:346-355. [PubMed] |
| 12. | Ohkawa K, Ishida H, Nakanishi F, Hosui A, Ueda K, Takehara T, Hori M, Hayashi N. Hepatitis C virus core functions as a suppressor of cyclin-dependent kinase-activating kinase and impairs cell cycle progression. J Biol Chem. 2004;279:11719-11726. [PubMed] [DOI] |
| 13. | Boonstra A, van der Laan LJ, Vanwolleghem T, Janssen HL. Experimental models for hepatitis C viral infection. Hepatology. 2009;50:1646-1655. [PubMed] [DOI] |