修回日期: 2010-10-27
接受日期: 2010-11-02
在线出版日期: 2011-01-28
目的: 研究Wnt信号传导通路的关键因子β-catenin和COX-2在肝癌细胞株HepG2及其克隆形成细胞中的表达, 探讨Wnt信号传导通路在不同增殖能力细胞中表达的异质性.
方法: 以HepG2细胞为研究对象, 采用软琼脂克隆形成实验筛选克隆形成细胞, 应用RT-PCR、免疫化学和Western blot等技术, 检测Wnt信号传导通路的关键因子β-catenin和COX-2在肝癌细胞株HepG2及其克隆形成细胞中的表达.
结果: β-catenin mRNA和蛋白质在克隆形成细胞中的表达水平高于HepG2细胞(0.905 vs 0.549; 1.021 vs 0.700; 均P<0.05). β-catenin的阳性信号在HepG2细胞中主要分布于细胞质, 克隆形成细胞中主要分布于细胞核. COX-2 mRNA和蛋白质在HepG2细胞中的表达高于克隆形成细胞(0.857 vs 0.527; 0.731 vs 0.434; 均P<0.05). 大多数HepG2细胞中表达COX-2蛋白, 阳性反应沉淀物主要位于细胞质, 少数克隆形成细胞中有COX-2蛋白弱表达.
结论: Wnt信号传导途径的关键因子β-catenin和COX-2与肝癌分化程度相关. β-catenin和COX-2等Wnt信号传导通路的关键因子在肝癌细胞HepG2及其克隆形成细胞的分布模式支持克隆形成细胞具有肝癌干细胞的特征.
引文著录: 王宝松, 魏德全, 于树娜, 姜栋栋, 赵金岭, 史才兴, 蒋吉英. Wnt信号通路在HepG2细胞株及其克隆形成细胞中表达的异质性. 世界华人消化杂志 2011; 19(3): 284-288
Revised: October 27, 2010
Accepted: November 2, 2010
Published online: January 28, 2011
AIM: To investigate the heterogeneous expression of Wnt signal molecules in HepG2 cells with different proliferative ability.
METHODS: The soft agar colony formation assay was used to separate HepG2 colony-forming cells. The mRNA expression and protein expression and distribution of β-catenin and COX-2 in parental HepG2 cells and HepG2 colony-forming cells were detected by RT-PCR, Western blotting and immunochemistry, respectively.
RESULTS: The expression levels of β-catenin mRNA and protein in HepG2 colony-forming cells were significantly higher than those in parental HepG2 cells (0.905 vs 0.549; 1.021 vs 0.700; both P < 0.05). β-catenin was mainly localized in the cytoplasm in parental HepG2 cells and in the nucleus in HepG2 colony-forming cells. The expression levels of COX-2 mRNA and protein in parental HepG2 cells were significantly higher than those in HepG2 colony-forming cells (0.857 vs 0.527; 0.731 vs 0.434; both P < 0.05). Immunochemistry analysis showed that most HepG2 cells were positive for COX-2.
CONCLUSION: β-catenin and COX-2 may be closely related to the degree of differentiation of hepatocellular carcinoma. The expression patterns of β-catenin and COX-2 in parental HepG2 cells and HepG2 colony-forming cells imply that HepG2 colony-forming cells have the characteristics of liver cancer stem cells.
- Citation: Wang BS, Wei DQ, Yu SN, Jiang DD, Zhao JL, Shi CX, Jiang JY. Heterogeneous expression of Wnt signal molecules in parental HepG2 cells and HepG2 colony-forming cells. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 284-288
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/284.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.284
肿瘤异质性概念汇集了肿瘤在空间、时间和结构等方面的表现, 研究表明肿瘤细胞间或细胞内的信号传导也是存在异质性的. Wnt信号通路是一条在生物进化过程中十分保守的信号通路, 该通路异常或不恰当的活化与肿瘤干细胞的形成以及肿瘤的发生、发展密切相关. 近年来Wnt信号通路异常与肝癌发病机制的关系已成为研究的热点. 本研究选取Wnt信号通路的关键因子β-catenin和COX-2, 检测其在人肝癌HepG2细胞株及其克隆形成细胞中的表达, 探讨Wnt信号通路在不同增殖能力细胞中表达的异质性, 为肝癌的靶向治疗提供新的治疗靶点.
人肝癌HepG2细胞株由潍坊医学院免疫学教研室梁淑娟博士惠赠. DMEM高糖培养基(美国Gibco公司), 低熔点琼脂(上海YITO Bio-instrument公司), 胎牛血清(杭州四季青生物技术有限公司), 胰蛋白酶(美国Sigma公司), 96孔板、24空板(青岛爱普科生物工程有限公司), 鼠抗人β-catenin单克隆抗体、羊抗人COX-2多克隆抗体(Santa Cruz公司), 即用型DAB显色试剂盒(北京中杉金桥生物技术有限公司), RNA提取试剂盒、AMV第1链cDNA合成试剂盒、PCR扩增试剂盒、β-catenin和COX-2引物(上海生工生物工程技术服务有限公司); PVDF膜(Sigma), ECL发光试剂盒(Pierce Biotechnology), 封闭蛋白干粉(武汉博士德生物工程有限公司).
1.2.1 软琼脂克隆: 以1%的琼脂糖凝胶作为储备胶, 冷却至50 ℃时, 与培养基按比例混合配制0.6%的底层胶铺于培养皿中; 再冷却至42 ℃时, 按比例与细胞悬液混合, 0.2%的上层琼脂. 待上层琼脂凝固后在其表面覆盖一层完全培养基以防止琼脂表面干燥, 然后放入细胞培养箱中培养, 每日镜下观察, 并补充培养基, 约2 wk后取出分离单个细胞克隆群落进行培养.
1.2.2 RT-PCR: 根据人β-catenin、COX-2的mRNA序列, 利用Primer 5.0引物设计软件, 设计引物序列. β-catenin: 上游引物5'-GGTGGGCTGCAGAAAATGGTT-3', 下游引物5'-GATGGCAGGCTCAGTGATGTCTTC-3', 扩增产物567 bp. COX-2: 上游引物5'-CGAGGTGTATGTATGAGTGT-3', 下游引物5'-AGTGGGTAAGTATGTAGTGC-3', 扩增产物157 bp. β-actin: 上游引物5'-TCCTGTGGCATCCACGAAACT-3', 下游引物5'-GAAGCATTTGCGGTGGACGAT-3', 扩增产物314 bp. 按RNA提取试剂盒说明提取总RNA, 1%琼脂糖凝胶电泳检测RNA的完整性, 将合格的RNA样品保存于-70 ℃冰箱备用. 按照美国Fermentas公司逆转录试剂盒说明合成cDNA的第1链. 再进行PCR扩增. PCR反应条件为: 94 ℃ 4 min; 94 ℃ 1 min, 55 ℃(COX-2: 51 ℃)30 s, 72 ℃ 1 min, 35个循环; 72 ℃延伸7 min. 用BiospectrumAC分析软件分析电泳条带, 计算目的基因与内参照(β-actin)扩增带灰度值之比, 即得目的基因mRNA的相对表达量.
1.2.3 免疫细胞化学染色: 常规免疫细胞化学染色观察β-catenin、COX-2蛋白质的表达. 两人双盲法观察切片. 采用Image-Pro Plus 5.0图像处理软件, 在高倍镜下(×40)每张片子随机选取10个视野区, 对阳性结果区域进行灰度扫描, 以其平均相对灰度值作为表达量的值.
1.2.4 免疫蛋白印迹: 常规免疫蛋白印迹方法, 用BiospectrumAC分析软件分析电泳条带, 计算目的基因与内参照(β-actin)扩增带灰度值之比, 即得目的蛋白的相对表达量.
统计学处理 采用SPSS11.0统计软件对结果进行分析, 结果用mean±SD记录, 数据采用两组均数的t检验, 检验水准α = 0.05.
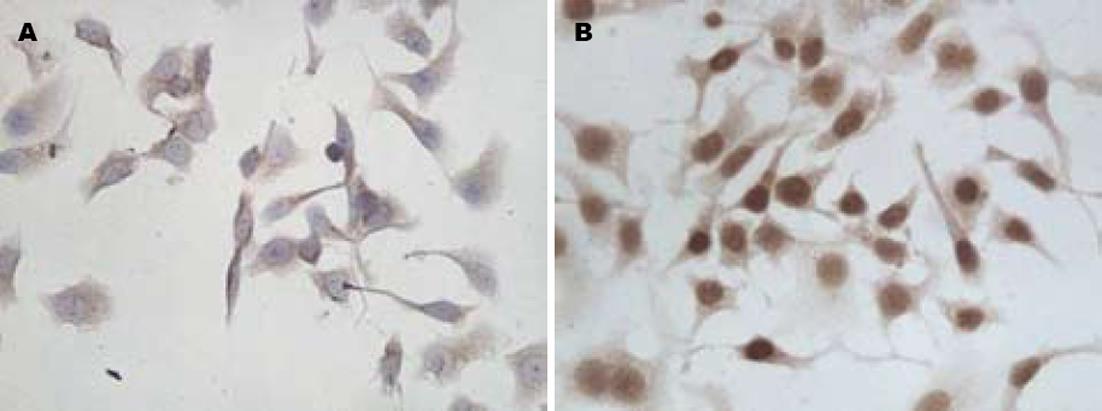
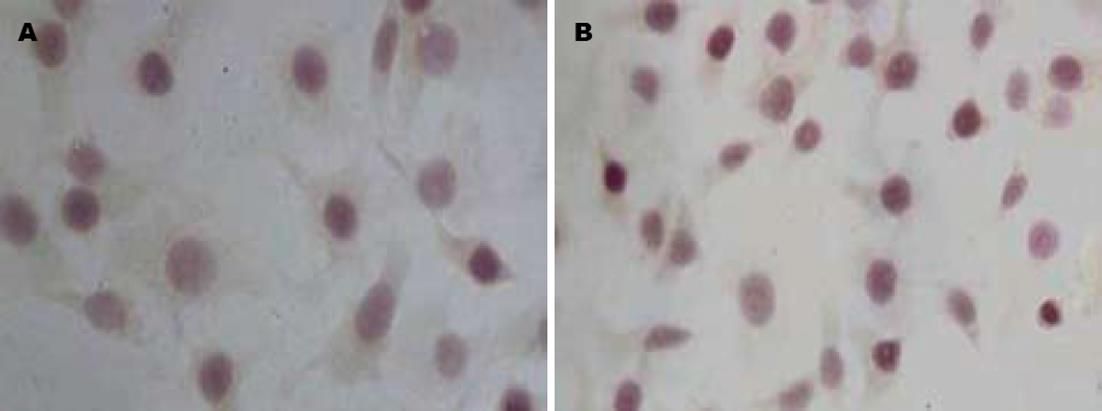
免疫化学发现, HepG2细胞多呈β-catenin阳性反应, 阳性反应沉淀物主要分布于细胞质, 少见细胞核表达; 克隆形成细胞中, 多呈β-catenin强阳性, 阳性反应沉淀物主要分布于细胞核, 少数细胞质也有表达, 且在胞核的表达较强, 在胞质的表达较弱(图1). β-catenin在HepG2细胞及其克隆形成细胞中的免疫化学灰度值见表1, 结果显示阳性细胞的数量在HepG2细胞及其克隆形成细胞中呈增高趋势, 差异有统计学意义(P<0.05). RT-PCR检测β-catenin mRNA在HepG2细胞及其克隆形成细胞中β-catenin/β-actin的灰度比值见表2, β-catenin mRNA在克隆形成细胞中的表达水平高于HepG2细胞, 差异有统计学意义(P<0.05). 免疫印迹检测β-catenin蛋白在HepG2细胞及其克隆形成细胞中β-catenin/β-actin的灰度比值见表3; 在克隆形成细胞中β-catenin蛋白表达水平高于HepG2细胞中的表达水平, 差异有统计学意义(P<0.05).
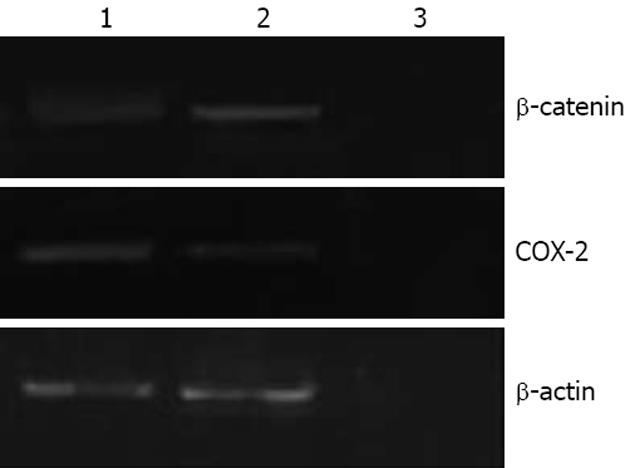
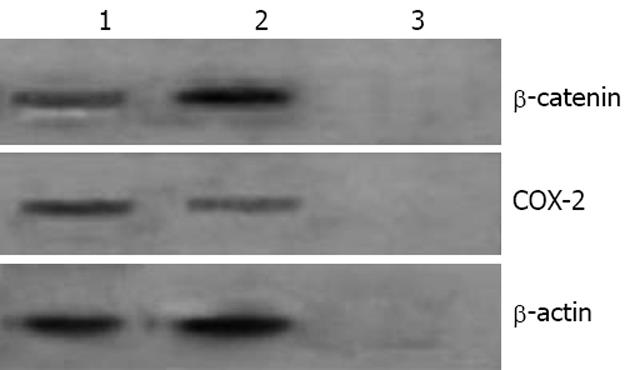
免疫化学发现, HepG2细胞多可表达COX-2蛋白, 阳性反应沉淀物主要位于细胞质, 少数克隆形成细胞中有COX-2蛋白弱表达(图2). COX-2在HepG2细胞及其克隆形成细胞中的免疫化学灰度值见表1, 结果显示COX-2在HepG2细胞中的表达高于克隆形成细胞, 差异有统计学意义(P<0.05). RT-PCR结果显示, COX-2 mRNA在HepG2细胞及其克隆形成细胞中的表达见表2, COX-2 mRNA在HepG2细胞中的表达高于克隆形成细胞, 差异有统计学意义(P<0.05, 图3). 免疫印迹检测COX-2蛋白在HepG2细胞及其克隆形成细胞中COX-2/β-actin的灰度比值见表3; COX-2蛋白在HepG2细胞中的表达高于克隆形成细胞, 差异有统计学意义(P<0.05, 图4).
Wnt信号通路是一条十分保守的信号转导通路, 存在于从线虫到人类的各种动物体内, 参与调节细胞的生长、迁移和分化及多种肿瘤的发生发展, 被认为是肿瘤发生过程中的关键信号通路之一[1]. Wnt信号通路在成体细胞中的不恰当激活将导致机体发育的异常, 肿瘤的发生, 研究表明Wnt信号通路的异常与大肠癌、胃癌、乳腺癌、肺癌、前列腺癌[2-6]等多种恶性肿瘤的发生密切相关.
肝癌是人类最常见的恶性肿瘤之一, 我国肝癌的发病率和死亡率均较高, 其中死亡率位于恶性肿瘤的第2位. Wnt信号通路与肝癌的关系已取得了不少研究成果, 但Wnt信号传导通路在肝癌中的具体作用机制以及肝癌中是否存在肝癌干细胞至今尚无定论.
软琼脂克隆形成实验是一种公认的被用来分离具有克隆能力的细胞的实验方法. Hambuger等[7]研究发现, 只有约0.02%-0.10%的癌细胞可以在软琼脂上形成克隆. Sell等[8]认为仅少数癌细胞是实际上致瘤性的细胞, 而那些可在软琼脂上形成克隆的肿瘤细胞有可能就是肿瘤干细胞(cancer stem cell, CSS)或肿瘤起始细胞(tumor initiating cell, TSC). 本研究通过软琼脂克隆形成实验对HepG2细胞进行筛选, 筛选出的克隆形成细胞增殖能力更强. 进一步检测Wnt信号通路在HepG2细胞及其克隆形成细胞中的表达, 为肝癌干细胞的存在提供依据.
β-catenin是Wnt信号转导途径中的关键因子, 是连环蛋白家族的成员之一. 正常成熟细胞内的Wnt信号通路是关闭的, β-catenin蛋白在细胞质内的表达水平很低, 不进入细胞核. 当Wnt信号通路异常时, 胞外的蛋白可失磷酸化, 而造成β-catenin在胞质积累, 当达到一定水平时即进入胞核, 如激活cyclin D1和c-Myc等可导致细胞的增殖[9]. 已有研究表明, β-catenin在肝癌中存在异常表达, 但其与肝癌的分化程度是否相关尚存在争议[10-12]. 本研究结果显示β-catenin在HepG2细胞中以胞质表达为主, 而在克隆形成细胞中则以胞核表达为主, β-catenin在克隆形成细胞中的表达水平高于HepG2细胞, 提示β-catenin在克隆形成细胞中的的异位表达率高, 说明细胞的成熟可能受阻. 提示克隆形成细胞为非成熟细胞. β-catenin异常表达可能与肝癌的分化程度有关.
COX-2是前列腺素合成限速酶, 是炎症过程中的一个重要的诱导酶. 已有研究多表明[13-16], COX-2在肝癌中的表达与分化程度有关, 分化好的HCC中COX-2的表达明显高于分化差的HCC. 本研究结果显示, COX-2在HepG2细胞中呈胞质阳性表达, 而在克隆形成细胞中仅极少数细胞出现COX-2的弱阳性表达, COX-2在HepG2细胞中的表达高于克隆形成细胞, 提示COX-2可能与肝癌的分化程度相关.
通过探讨Wnt信号通路与肝癌以及肝癌干细胞的关系, 我们发现Wnt信号传导途径的关键因子β-catenin在克隆形成细胞中高表达, 而COX-2在克隆形成细胞中低表达, 支持克隆形成细胞分化程度低, 具备肿瘤干细胞的特征, 这将有助于深入了解肝癌产生的具体机制, 进而探讨肝癌发生、转移、耐药性以及预后相关的分子机制, 为肝癌的治疗提供有效的治疗靶点.
Wnt信号通路是一条在生物进化过程中十分保守的信号通路, 该通路异常或不恰当的活化与肿瘤干细胞的形成以及肿瘤的发生、发展密切相关.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科
近年来Wnt信号通路异常与肝癌发病机制的关系已成为研究的热点.
本文研究了Wnt信号传导通路的关键因子β-catenin和COX-2在肝癌细胞株HepG2及其克隆形成细胞中的表达, 结果显示β-catenin在克隆形成细胞中高表达, 而COX-2在克隆形成细胞中低表达, 支持克隆形成细胞分化程度低, 具备肿瘤干细胞的特征.
本文探讨了Wnt信号通路在不同增殖能力肝癌细胞中表达的异质性, 为肝癌的靶向治疗提供新的治疗靶点.
本文可读性较好, 具有一定的学术参考价值.
编辑: 李军亮 电编:何基才
| 1. | Pennisi E. How a growth control path takes a wrong turn to cancer. Science. 1998;281:1438-1439, 1441. [PubMed] [DOI] |
| 2. | Jansson EA, Are A, Greicius G, Kuo IC, Kelly D, Arulampalam V, Pettersson S. The Wnt/beta-catenin signaling pathway targets PPARgamma activity in colon cancer cells. Proc Natl Acad Sci U S A. 2005;102:1460-1465. [PubMed] [DOI] |
| 3. | Pan KF, Liu WG, Zhang L, You WC, Lu YY. Mutations in components of the Wnt signaling pathway in gastric cancer. World J Gastroenterol. 2008;14:1570-1574. [PubMed] [DOI] |
| 4. | Schlange T, Matsuda Y, Lienhard S, Huber A, Hynes NE. Autocrine WNT signaling contributes to breast cancer cell proliferation via the canonical WNT pathway and EGFR transactivation. Breast Cancer Res. 2007;9:R63. [PubMed] [DOI] |
| 5. | Tennis M, Van Scoyk M, Winn RA. Role of the wnt signaling pathway and lung cancer. J Thorac Oncol. 2007;2:889-892. [PubMed] [DOI] |
| 6. | Jiang YG, Luo Y, He DL, Li X, Zhang LL, Peng T, Li MC, Lin YH. Role of Wnt/beta-catenin signaling pathway in epithelial-mesenchymal transition of human prostate cancer induced by hypoxia-inducible factor-1alpha. Int J Urol. 2007;14:1034-1039. [PubMed] [DOI] |
| 7. | Hamburger AW, Salmon SE. Primary bioassay of human tumor stem cells. Science. 1977;197:461-463. [PubMed] [DOI] |
| 8. | Sell S, Leffert HL. Liver cancer stem cells. J Clin Oncol. 2008;26:2800-2805. [PubMed] [DOI] |
| 9. | Krieghoff E, Behrens J, Mayr B. Nucleo-cytoplasmic distribution of beta-catenin is regulated by retention. J Cell Sci. 2006;119:1453-1463. [PubMed] [DOI] |
| 10. | Wang XH, Sun X, Meng XW, Lü ZW, Liu MN, Pei FH. [The role and significance of Wnt/beta-catenin signaling pathway regulating the signaling molecules in hepatocellular carcinoma]. Zhonghua Ganzangbing Zazhi. 2010;18:672-675. [PubMed] |
| 11. | Yang W, Yan HX, Chen L, Liu Q, He YQ, Yu LX, Zhang SH, Huang DD, Tang L, Kong XN. Wnt/beta-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells. Cancer Res. 2008;68:4287-4295. [PubMed] [DOI] |
| 13. | Tang TC, Poon RT, Lau CP, Xie D, Fan ST. Tumor cyclooxygenase-2 levels correlate with tumor invasiveness in human hepatocellular carcinoma. World J Gastroenterol. 2005;11:1896-1902. [PubMed] |