修回日期: 2010-12-07
接受日期: 2010-12-15
在线出版日期: 2011-01-28
目的: 探讨WWOX基因转染胆管癌细胞株QBC939后对其增殖、凋亡与侵袭性的影响.
方法: 用脂质体转染法将WWOX重组真核表达质粒转染QBC939细胞, 建立稳定表达WWOX基因的细胞株. 将其分为以下3组: QBC939组, QBC939/con组和QBC939/WWOX组. 荧光定量RT-PCR和Western blot法检测各组WWOX mRNA和蛋白水平的表达; MTT实验检测转染前后各组细胞增殖活性的变化; FCM法检测各组细胞的凋亡; Transwell小室侵袭实验检测各组肿瘤细胞侵袭力的变化.
结果: 建立了稳定表达WWOX基因的QBC939/WWOX细胞株, WWOX mRNA和蛋白的表达增加[3.71(3.64-3.78) vs 1.00(0.98-1.02), 1.07(1.02-1.13); 0.86±0.03 vs 0.25±0.01, 0.27±0.02, 均P<0.05], 转染后的QBC939细胞MTT吸光度明显下降(0.63±0.04 vs 0.90±0.05, 0.87±0.04, 均P<0.01), FCM显示QBC939/WWOX组的细胞凋亡率明显增高(21.4%±2.35% vs 1.24%±0.35%, 1.73%±0.48%, 均P<0.01), 侵袭实验显示转移至下室滤膜的细胞数明显减少(70.00±4.58 vs 102.33±8.33, 107.00±9.00, 均P<0.01).
结论: WWOX基因能抑制胆管癌细胞株QBC939的增殖, 加速肿瘤细胞凋亡并降低其侵袭力, 可能作为胆管癌基因治疗的一个新靶点.
引文著录: 朱凯, 黄强, 邵峰, 任维华. WWOX基因转染对胆管癌细胞增殖、凋亡及侵袭的影响. 世界华人消化杂志 2011; 19(3): 251-256
Revised: December 7, 2010
Accepted: December 15, 2010
Published online: January 28, 2011
AIM: To investigate the effect of transfection with the WW domain-containing oxidoreductase (WWOX) gene on cell proliferation, apoptosis and invasion in human cholangiocarcinoma cell line QBC939.
METHODS: A recombinant eukaryotic expression plasmid containing the WWOX gene was introduced into QBC939 cells by liposome-mediated transfection. The mRNA and protein expression of WWOX in QBC939 cells stably transfected with the recombinant plasmid was detected by quantitative RT-PCR and Western blotting, respectively. Cell proliferation was tested by methyl thiazolyl tetrazolium (MTT) assay. Cell apoptosis was assessed by flow cytometry (FCM). Cell invasion was determined by Transwell chamber assay.
RESULTS: QBC939 cells stably transfected with the recombinant plasmid were successfully generated. The expression of WWOX mRNA and protein was markedly increased in QBC939 cells transfected with the recombinant plasmid when compared with untransfected QBC939 cells and those transfected with control plasmid [3.71(3.64-3.78) vs 1.00(0.98-1.02), 1.07(1.02-1.13); 0.86 ± 0.03 vs 0.25 ± 0.01, 0.27 ± 0.02, all P < 0.05]. WWOX gene transfection significantly decreased cell proliferation [0.63 ± 0.04 vs 0.90 ± 0.05, 0.87 ± 0.04, both P < 0.01] but promoted apoptosis (21.40% ± 2.35% vs 1.24% ± 0.35%, 1.73% ± 0.48%, both P < 0.01). Transwell chamber assay showed that the number of transfected cells that passed the Transwell membrane was significantly less than those of control cells (70.00 ± 4.58 vs 102.33 ± 8.33, 107.00 ± 9.00, both P < 0.01).
CONCLUSION: WWOX expression inhibits proliferation, accelerates apoptosis, and reduces invasion in human cholangiocarcinoma cell line QBC939, suggesting that the WWOX gene may be a novel target for gene therapy of cholangiocarcinoma.
- Citation: Zhu K, Huang Q, Shao F, Ren WH. WWOX gene transfection inhibits proliferation, accelerates apoptosis, and reduces invasion in human cholangiocarcinoma cell line QBC939. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 251-256
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/251.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.251
胆管癌是起源于胆管上皮细胞的恶性肿瘤, 其特点是起病隐匿、恶性程度高、早期诊断困难、手术切除率低, 近年来胆管癌的发病率有增加趋势[1]. 含有WW结构域的氧化还原酶基因(WW domain-containing oxidoreductase, WWOX)是2000年Bednarek等[2]应用鸟枪法基因测序技术在染色体普通脆性位点(common fragile sites, CFS)区域鉴别出的一个新的抑癌基因. WWOX 基因定位于染色体16q23.3-24.1区, 并跨越了整个常见染色体脆性部位FRA16D. 近年来的大量研究发现多种肿瘤组织中WWOX蛋白表达降低或丢失, 并发现这与WWOX基因转录及缺失有关, 提示WWOX基因为多种肿瘤的候选抑制基因[3]. 本研究通过基因转染, 有限恢复胆管癌细胞中抑癌基因的表达, 观察WWOX基因对胆管癌细胞增殖、凋亡和侵袭的影响.
pmCherry-N1-WWOX由我们自行构建, 胆管癌细胞株QBC939购于ScienCell Research Labortories U.S, TRIzol、Lipofectamine2000(美国Invitrogen公司), RPMI 1640培养液、胎牛血清(美国Hyclon公司), 小剂量质粒提取试剂盒和SYBR GreenⅠ荧光定量RT-PCR试剂盒购自Promega公司, 鼠抗人WWOX抗体, GAPDH抗体(美国Santa Cruz), 辣根过氧化物酶标记的羊抗鼠抗体(北京中杉金桥生物技术有限公司), 胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)、G418购于美国Sigma公司, Annexin V-FITC凋亡检测试剂盒购自Roche公司, Transwell小室、Matrigel Matrix、Fibronectin购于美国BD公司, 其他常规试剂均为进口分装或国产分析纯.
1.2.1 细胞培养及转染: QBC939细胞在含10%胎牛血清RPMI 1640的培养液中于37 ℃、饱和湿度及50 mL/L CO2的培养箱中传代培养. QBC939细胞呈单层贴壁生长. 将QBC939细胞接种至6孔板中, 每孔5×105个细胞, 以完全培养液培养24 h后用不含血清的RPMI 1640培养液洗涤2次, 分别加入含有WWOX基因的pmCherry-N1-WWOX质粒和不含有WWOX基因的pmCherry-N1对照质粒各5 µg, 25 min后再加入脂质体Lipofectamine2000 10 µL/孔. 转染6 h后, 更换为完全培养液, 继续培养24 h后加入G418(500 mg/L)进行筛选, 7 d后以 200 mg/L维持筛选压力. 2 wk后挑取单克隆进行鉴定并扩增培养, 稳定转染WWOX的细胞命名为QBC939/WWOX细胞, 对照质粒转染细胞命名为QBC939/con细胞, 进行后续实验.
1.2.2 WWOX基因表达检测: 采用TRIzol试剂提取3组细胞总RNA, 取定量的RNA 1 µg. 转染前后QBC939细胞的WWOX表达情况通过荧光定量RT-PCR进行检测. 根据GenBank所查询的序列(NM_016373.1), 使用Primer 5.0软件设计引物: 上游引物F: 5'-GACTGGCGTTTACTGTGGATGA-3', 下游引物R: 5'-CAAAAGACTTGGCGGTTTCG-3'; 看家基因选择β-actin, 上游引物F: 5'-TGACGTGGACATCCGCAAAG-3', 下游引物R: 5'-CTGGAAGGTGGACAGCGAGG-3'. 按试剂盒说明书设定荧光定量PCR反应体系及参数, 确定标准曲线后进行荧光定量RT-PCR. 反转录反应条件的设置: 25 ℃ 10 min, 40 ℃ 60 min, 85 ℃ 5 min; 扩增条件的设置: 94 ℃ 4 min; 94 ℃ 20 s、60 ℃ 30 s、72 ℃ 30 s, 循环35次; 72 ℃检测信号. 3个实验组各做6次重复实验, 每次目的基因和看家基因的Ct值相减得到∆Ct, 把自然生长的QBC939细胞作为参照因子(calibrator), 经看家基因均一化处理后, 通过2-∆∆Ct方法计算[4]. WWOX基因表达差异通过实验组细胞相对于自然生长组细胞的倍数来表示.
1.2.3 Western blot检测WWOX蛋白表达: 取1×106个细胞, 冷PBS缓冲液洗涤3次后, 再用双去污剂裂解液裂解细胞, 12 000 r/min离心15 min, 取上清液采用BCA法测定蛋白浓度. 蛋白量调整一致后, 加入SDS缓冲液, 100 ℃变性5 min. 根据待测目的蛋白分子量配制相应浓度的SDS-PAGE胶. 蛋白样品经电泳分离后, 电转移至硝酸纤维素膜上. 将膜置于含5%脱脂奶粉的TBST中封闭2 h, 随后加入相应一抗反应过夜, 最后与HRP标记的二抗在室温下反应1 h后ECL法显影. 以目的蛋白与GAPDH条带灰度值之比表示目的蛋白的相对表达水平.
1.2.4 MTT法检测体外细胞增殖情况: 收集培养到对数生长期的QBC939细胞, 调整细胞悬液浓度并计数, 用微量移液器加入96孔板中, 每孔200 µL, 细胞数为3×103个, 未使用的边缘孔用无菌PBS填充. 分别培养0、24、48、72和96 h后加入30 µL MTT(5 g/L), 继续培养4 h, 离心后除去上清液, 加入200 µL DMSO振荡20 min, 使用酶标仪检测490 nm波长处的吸光度A值, 每组细胞设3个复孔, 取4孔的平均值作为结果.
1.2.5 FCM检测细胞凋亡: 用标记了FITC的Annexin V作为荧光探针, 利用流式细胞仪可检测细胞凋亡的发生, 正常细胞和早期凋亡细胞的细胞膜是完整的. 碘化丙碇(propidium iodide, PI)是一种核酸染料, 他不能透过完整的细胞膜, 但在凋亡中晚期的细胞和死细胞, PI能透过细胞膜与细胞核结合呈现红色. 将Annexin V与PI匹配使用, 可以将凋亡早期的细胞和晚期的细胞以及死细胞区分开来. 离心收集细胞, 用预冷PBS洗涤细胞2次, 用Binding Buffer悬浮细胞后调整细胞浓度为1×109 cells/L. 细胞悬液中加入5 µL Annexin V-FITC摇匀避光孵育15 min后加入10 µL PI染液避光孵育5 min后立即上流式细胞仪分析, 每组实验重复4次.
1.2.6 Transwell小室侵袭实验: 在穿膜小室(transwell chamber)的上、下室之间铺有用基质胶(Matrigel)制备好的膜, 取不含血清的浓度为2×108 cells/L的细胞悬液200 µL种植于上室, 下室加入含胎牛血清的培养基, 肿瘤细胞会向营养成分高的下室迁移. 37 ℃、饱和湿度及50 mL/L CO2的培养箱中培养24 h, 小心取出上室, 用湿棉签擦去膜上未穿过膜的细胞, 0.1%结晶紫染色, 取左上、左下、右上、右下及中心5个视野, 倒置显微镜下直接计数穿膜细胞数.
统计学处理 计量资料以mean±SD表示, 采用方差分析检验, 率的比较采用χ2检验, 所有数据录入SPSS13.0软件进行计算, 以P<0.05作为差异有统计学意义.
荧光定量RT-PCR显示, QBC939/WWOX实验组在质粒转染后, WWOX的表达量比QBC939/con和QBC939自然生长组有所升高, 表达量是自然生长的QBC939细胞的3.71倍(P<0.05), 可见转染后的WWOX基因表达上调(表1).
| ΔCt | ΔΔCt | 2-ΔΔCt | |
| QBC939 | 1.341±0.035 | 0.000±0.035 | 1.00(0.98-1.02) |
| QBC939/con | 1.238±0.069 | -0.103±0.069 | 1.07(1.02-1.13) |
| QBC939/WWOX | -0.549±0.027 | -1.890±0.027 | 3.71(3.64-3.78) |
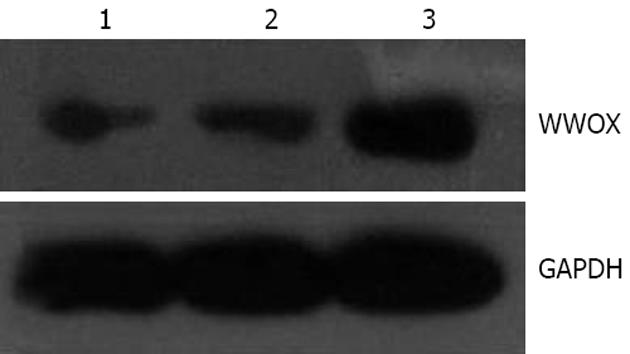
Western blot检测结果显示, QBC939组、QBC939/con组和QBC939/WWOX组的WWOX/GAPDH的比值分别为0.25±0.01, 0.27±0.02和0.86±0.03. 可见WWOX蛋白表达水平在稳定转染的胆管癌细胞中显著升高(P<0.05, 图1).
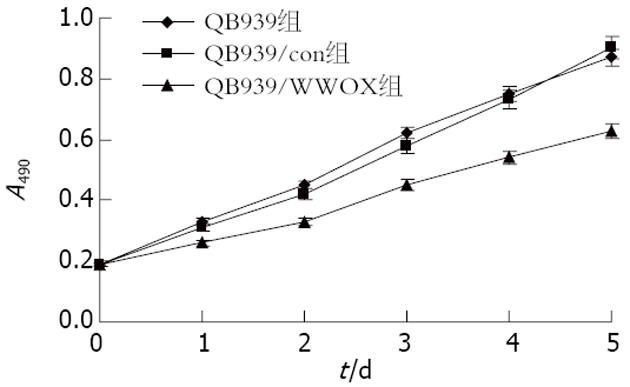
从每天MTT检测情况结合统计学分析, 实验当天各组A值差别无统计学意义, 各组处于接种时的状态; 随着时间的推移, QBC939/WWOX组的细胞增殖下调明显, 第2天的A值与QBC939自然生长细胞以及QBC939/con细胞比较, 差异均有统计学意义(P<0.01). 实验组细胞增殖相对于2个对照组被明显抑制(表2, 图2).
| 分组 | 第0天 | 第1天 | 第2天 | 第3天 | 第4天 | 第5天 |
| QBC939组 | 0.19±0.01 | 0.33±0.02 | 0.45±0.03 | 0.62±0.02 | 0.75±0.05 | 0.87±0.04 |
| QBC939/con组 | 0.19±0.01 | 0.31±0.01 | 0.42±0.02 | 0.58±0.03 | 0.73±0.03 | 0.90±0.05 |
| QBC939/WWOX组 | 0.19±0.01 | 0.26±0.02 | 0.33±0.02 | 0.45±0.04 | 0.54±0.03 | 0.63±0.04 |
| F值 | 0.263 | 19.866 | 25.466 | 24.517 | 38.708 | 51.357 |
| P值 | 0.774 | <0.05 | <0.01 | <0.01 | <0.01 | <0.01 |
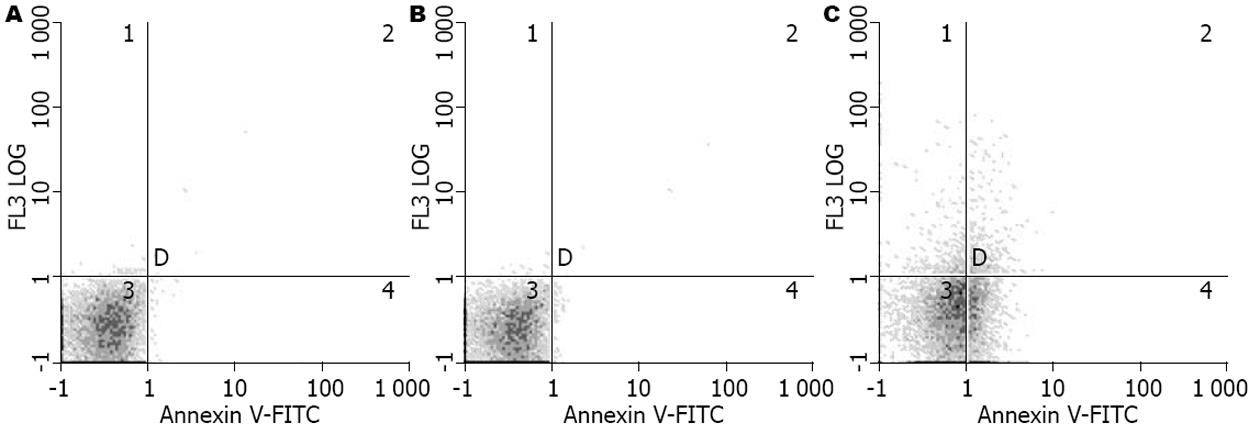
WinMDI 2.9软件分析发现, QBC939/con和QBC939组、QBC939/WWOX组细胞凋亡率分别为1.24%±0.35%、1.73%±0.48%和21.4%±2.35%, 实验组与2个对照组间的差异均有统计学意义(P<0.01). 实验组细胞的凋亡率要明显高于2个对照组(图3).
结果显示QBC939/WWOX组与QBC939/con和QBC939组间的差异有统计学意义(70±4.58 vs 102.33±8.33, 107±9.00, P<0.01), 2个对照组间的细胞侵袭力差异无统计学意义, 说明QBC939/WWOX细胞组侵袭力减弱.
肝外胆管癌占肝胆系统恶性肿瘤的10%-15%, 早在1990年中华医学会的调查就发现胆管癌的发病率以每年5%的速度上升[5]. 胆管癌的生长以浸润性生长为特征, 其浸润和转移导致手术切除范围不能达到根治的目的, 是术后复发的主要原因. 对胆管癌组织的相关研究发现, WWOX基因和蛋白表达在胆管癌中高频缺失, 且缺失发生与组织分级呈负相关[6], 因此推测该基因与胆管癌的发生、发展关系密切.
细胞癌基因的激活和抑癌基因的失活是近年来肿瘤研究中的热点, 其中抑癌基因的失活被认为是重要的致癌因素. 一些研究认为, DNA损伤是恶性肿瘤发生、发展的重要机制, 染色体脆性位点抑癌基因对DNA损伤高度敏感, 而这些常见脆性位点往往对应着一些新的抑癌基因[7,8].
WWOX长约1.1 Mb, 其开放读码框长约1 245 bp, 编码414个氨基酸组成的蛋白. WWOX蛋白通过WW结构域与富含比咯氨酸的配基结合介导蛋白-蛋白间的相互作用, 而此过程受到酪氨酸磷酸化的调控[9]. WWOX蛋白是一种促凋亡蛋白, 参与多种信号转导途径[10-12]: 增强肿瘤坏死因子(tumor necrosis factor, TNF)介导的细胞毒性, 与TNF凋亡途径中的TRADD和TRAF2作用; 与κBα/P53凋亡途径中的P53作用; 与细胞应激途径中的JNK1作用. WWOX转录产物异常及WWOX蛋白表达缺失或减少, 已在多种原发肿瘤及肿瘤细胞株中得到证实, 尤其在与环境致癌因素密切相关的肿瘤如胃癌、肺癌、乳腺癌、食管癌、肝癌、结肠癌、造血系统恶性肿瘤等[13-19]更是如此. Fabbri等[20]通过对不同肿瘤中该基因的研究证明, WWOX基因是一个常见的基因组不稳定者也是一个潜在的肿瘤生长的抑制者.
胆管癌发病隐匿、缺乏理想的早期诊断标志物、对常规放疗化疗缺乏敏感性, 这些原因造成胆管癌患者的预后极差. 加强胆管癌分子生物学特性的研究是改善胆管癌诊疗现状的最重要的途径之一[21]. 本研究通过构建了人WWOX基因的真核表达载体pmCherry-N1-WWOX, 建立稳定表达WWOX基因QBC939/WWOX细胞株. 荧光定量RT-PCR及Western blot检测结果显示WWOX基因在QBC939/WWOX细胞中mRNA及蛋白表达明显增加. 采用MTT、流式细胞术和小室侵袭实验等手段观察细胞生物学行为变化. 结果表明稳定表达WWOX基因的胆管癌细胞增殖减慢; 侵袭能力是衡量肿瘤转移潜能的重要标志之一, 本研究表明, 转染WWOX基因后QBC939细胞的侵袭能力明显下降, 说明WWOX基因对肿瘤细胞的运动能力有明显抑制作用; FCM实验表明恢复WWOX基因的表达可以加速胆管癌细胞的凋亡, 推测WWOX基因可能是通过加速细胞凋亡而抑制QBC939细胞的增殖. WWOX作为基因治疗的一种候选基因, 能有效逆转肿瘤细胞的生物学行为, 将在肿瘤的临床治疗中发挥重要的作用. 但是WWOX在胆管细胞癌变过程中的具体作用机制目前尚不完全清楚[22]. 进一步探WWOX的功能, 将对深入了解其在胆管癌发生、发展过程中的作用提供新的线索, 为胆管癌的诊断、治疗提供新的靶点和研究方向.
胆管癌恶性程度高、早期诊断困难、手术切除率低, 对其分子发病机制的研究可以加深对胆管癌的了解. WWOX基因是目前肿瘤研究的新兴领域和热点, 近年来研究发现多种肿瘤组织WWOX蛋白表达降低或丢失, 提示WWOX基因为多种肿瘤的候选抑制基因.
姚登福, 教授, 南通大学附属医院分子医学中心
细胞癌基因的激活和抑癌基因的失活是近年来肿瘤研究中的热点, 其中抑癌基因的失活被认为是重要的致癌因素.
顾军等采用RT-PCR及免疫组织化学方法研究发现肝外胆管癌中WWOX低表达且其表达与胆管癌的组织学分级呈负相关. Aqeilan等发现WWOX基因为多种肿瘤的候选抑制基因.
本研究证实了WWOX基因在胆管癌细胞系中低表达, 恢复其表达后可以有效逆转胆管癌细胞的恶性生物学行为, 证明该基因可能作为胆管癌基因治疗以及预测肿瘤复发的一个新靶点.
本研究证实过表达WWOX基因能抑制胆管癌细胞的增殖, 加速肿瘤细胞凋亡并降低其侵袭力, 临床研究也发现该基因与性激素相关肿瘤的预后显著相关, 这些都为进一步探索胆管癌的发病机制及基因治疗提供了新的思路.
本文可读性较好, 具有一定的临床参考意义.
编辑: 李薇 电编:何基才
| 1. | Khan SA, Thomas HC, Davidson BR, Taylor-Robinson SD. Cholangiocarcinoma. Lancet. 2005;366:1303-1314. [PubMed] [DOI] |
| 2. | Bednarek AK, Laflin KJ, Daniel RL, Liao Q, Hawkins KA, Aldaz CM. WWOX, a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1, a region frequently affected in breast cancer. Cancer Res. 2000;60:2140-2145. [PubMed] |
| 3. | Aqeilan RI, Trapasso F, Hussain S, Costinean S, Marshall D, Pekarsky Y, Hagan JP, Zanesi N, Kaou M, Stein GS. Targeted deletion of Wwox reveals a tumor suppressor function. Proc Natl Acad Sci U S A. 2007;104:3949-3954. [PubMed] [DOI] |
| 4. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 7. | Finnis M, Dayan S, Hobson L, Chenevix-Trench G, Friend K, Ried K, Venter D, Woollatt E, Baker E, Richards RI. Common chromosomal fragile site FRA16D mutation in cancer cells. Hum Mol Genet. 2005;14:1341-1349. [PubMed] [DOI] |
| 8. | Smith DI, McAvoy S, Zhu Y, Perez DS. Large common fragile site genes and cancer. Semin Cancer Biol. 2007;17:31-41. [PubMed] [DOI] |
| 9. | Ingham RJ, Colwill K, Howard C, Dettwiler S, Lim CS, Yu J, Hersi K, Raaijmakers J, Gish G, Mbamalu G. WW domains provide a platform for the assembly of multiprotein networks. Mol Cell Biol. 2005;25:7092-7106. [PubMed] [DOI] |
| 10. | Chang NS, Doherty J, Ensign A, Lewis J, Heath J, Schultz L, Chen ST, Oppermann U. Molecular mechanisms underlying WOX1 activation during apoptotic and stress responses. Biochem Pharmacol. 2003;66:1347-1354. [PubMed] [DOI] |
| 11. | Chang NS, Pratt N, Heath J, Schultz L, Sleve D, Carey GB, Zevotek N. Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity. J Biol Chem. 2001;276:3361-3370. [PubMed] [DOI] |
| 12. | Chang NS, Doherty J, Ensign A. JNK1 physically interacts with WW domain-containing oxidoreductase (WOX1) and inhibits WOX1-mediated apoptosis. J Biol Chem. 2003;278:9195-9202. [PubMed] [DOI] |
| 13. | Aqeilan RI, Kuroki T, Pekarsky Y, Albagha O, Trapasso F, Baffa R, Huebner K, Edmonds P, Croce CM. Loss of WWOX expression in gastric carcinoma. Clin Cancer Res. 2004;10:3053-3058. [PubMed] [DOI] |
| 14. | Donati V, Fontanini G, Dell'Omodarme M, Prati MC, Nuti S, Lucchi M, Mussi A, Fabbri M, Basolo F, Croce CM. WWOX expression in different histologic types and subtypes of non-small cell lung cancer. Clin Cancer Res. 2007;13:884-891. [PubMed] [DOI] |
| 15. | Płuciennik E, Kusińska R, Potemski P, Kubiak R, Kordek R, Bednarek AK. WWOX--the FRA16D cancer gene: expression correlation with breast cancer progression and prognosis. Eur J Surg Oncol. 2006;32:153-157. [PubMed] [DOI] |
| 16. | Kuroki T, Trapasso F, Shiraishi T, Alder H, Mimori K, Mori M, Croce CM. Genetic alterations of the tumor suppressor gene WWOX in esophageal squamous cell carcinoma. Cancer Res. 2002;62:2258-2260. [PubMed] |
| 17. | Park SW, Ludes-Meyers J, Zimonjic DB, Durkin ME, Popescu NC, Aldaz CM. Frequent downregulation and loss of WWOX gene expression in human hepatocellular carcinoma. Br J Cancer. 2004;91:753-759. [PubMed] |
| 18. | 许 红霞, 周 建农, 莫 伏根, 侯 宁, 胡 赛男, 束 永前. 抑癌基因WWOX和FHIT在结直肠癌中的表达及其临床意义. 南京医科大学学报(自然科学版). 2007;27:812-815. |
| 19. | Ishii H, Vecchione A, Furukawa Y, Sutheesophon K, Han SY, Druck T, Kuroki T, Trapasso F, Nishimura M, Saito Y. Expression of FRA16D/WWOX and FRA3B/FHIT genes in hematopoietic malignancies. Mol Cancer Res. 2003;1:940-947. [PubMed] |
| 20. | Fabbri M, Iliopoulos D, Trapasso F, Aqeilan RI, Cimmino A, Zanesi N, Yendamuri S, Han SY, Amadori D, Huebner K. WWOX gene restoration prevents lung cancer growth in vitro and in vivo. Proc Natl Acad Sci U S A. 2005;102:15611-15616. [PubMed] [DOI] |
| 21. | Yee K, Sheppard BC, Domreis J, Blanke CD. Cancers of the gallbladder and biliary ducts. Oncology (Williston Park). 2002;16:939-946, 949; discussion 949-950, 952-953, 956-957. [PubMed] |
| 22. | Chang NS, Hsu LJ, Lin YS, Lai FJ, Sheu HM. WW domain-containing oxidoreductase: a candidate tumor suppressor. Trends Mol Med. 2007;13:12-22. [PubMed] [DOI] |