修回日期: 2010-12-01
接受日期: 2010-12-07
在线出版日期: 2011-01-28
目的: 探讨SUMO-1、MDM2和P53对化疗药5-Fu诱导的HepG2细胞凋亡的影响.
方法: 5-Fu诱导HepG2细胞产生凋亡, 以质粒pCMV-HDM1B(pMDM2)和pcDNA3-His6-SUMO-1(pSUMO-1)转染细胞, 应用Western blot检测经药物诱导及转染前后细胞中内源性P53蛋白的表达强度, 流式细胞仪检测细胞凋亡比例变化.
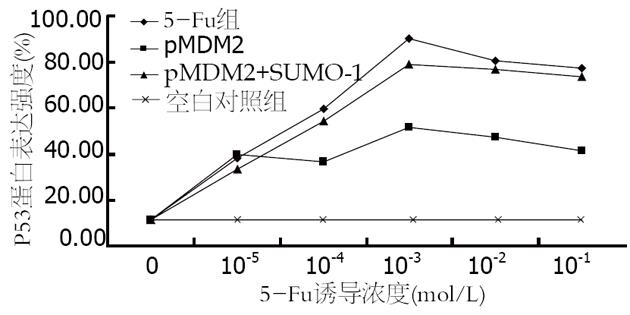
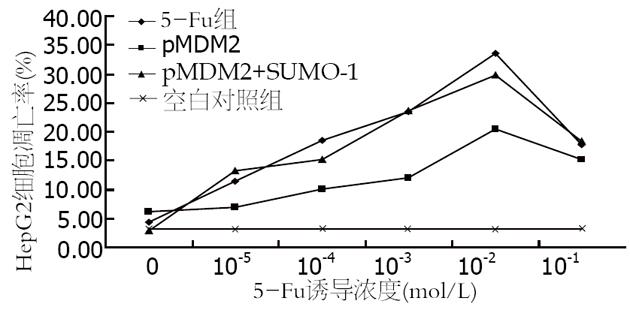
结果: HepG2细胞内源性P53蛋白表达强度与空白对照组相比明显增高, 于1×10-3 mol/L浓度处最强(90.15%±4.22% vs 11.27%±1.18%, P<0.05). 随5-Fu浓度的增加, HepG2细胞凋亡率逐渐升高, 于1×10-2 mol/L浓度处凋亡率最高(33.61%±3.15% vs 3.22%±0.60%, P<0.05). 转染pMDM2的细胞具有明显的抗凋亡特性, 与同浓度未转染细胞相比, P53蛋白表达强度和细胞凋亡率均明显下降(51.80%±0.78% vs 90.15%±4.22%; 20.45%±2.23% vs 33.61%±3.15%, 均P<0.05). 共转染pSUMO-1的细胞其浓度-蛋白表达强度-凋亡率曲线又接近未转染细胞, 与单纯转染pMDM2细胞相比, P53蛋白表达强度和细胞凋亡率显著上升, 差异有统计学意义(78.85%±2.43% vs 51.80%±0.78%, 29.83%±0.53% vs 20.45%±2.23%, 均P<0.05). 只转染pSUMO-1细胞的P53蛋白表达和凋亡率与未转染细胞相似, 两者间差异无统计学意义.
结论: SUMO-1通过抑制MDM2对P53在胞质的降解及增强P53在细胞核内的表达, 可促进化疗药物诱导的细胞凋亡, 提高肿瘤细胞对化疗药物的敏感性, 在药物诱导的细胞凋亡中具有显著协同效应.
引文著录: 卢星榕, 沈松菲, 池畔. SUMO-1、MDM2和P53对5-Fu诱导细胞凋亡的影响. 世界华人消化杂志 2011; 19(3): 240-245
Revised: December 1, 2010
Accepted: December 7, 2010
Published online: January 28, 2011
AIM: To investigate the role of small ubiquitin-like modifier-1 (SUMO-1), murine double minute gene 2 (MDM2) and P53 in 5-flurouracil (5-Fu)-induced apoptosis of HepG2 cells.
METHODS: Non-transfected HepG2 cells and HepG2 cells transfected with pMDM2 and pSUMO-1 plasmids, alone or both, were treated with different concentrations of 5-Fu for 36 hours. The expression of endogenous P53 protein in HepG2 cells was detected by Western blot.
RESULTS: Treatment with 5-Fu significantly increased the relative expression level of endogenous P53 protein and the apoptosis rate of HepG2 cells in a concentration-dependent manner (90.15% ± 4.22% vs 11.27% ± 1.18%, 33.61% ± 3.15% vs 3.22% ± 0.60%, both P < 0.05). Cells transfected with the pMDM2 plasmid had an apparent resistance to 5-Fu-induced apoptosis of HepG2 cells. The relative expression level of P53 protein and the apoptosis rate in cells transfected with the pMDM2 plasmid were much lower than those in non-transfected cells treated with the same concentration of 5-Fu (51.80% ± 0.78% vs 90.15% ± 4.22%; 20.45% ± 2.23% vs 33.61% ± 3.15%, both P < 0.05). No significant differences were noted in the relative expression level of P53 protein and the apoptosis rate between cells co-transfected with the pSUMO-1 and pMDM2 plasmids and non-transfected cells (78.85% ± 2.43% vs 51.80% ± 0.78%, 29.83% ± 0.53% vs 20.45% ± 2.23%, both P < 0.05).
CONCLUSION: SUMO-1 could inhibit MDM2-induced degradation of P53 protein and enhance the nuclear expression of P53, thus promoting 5-Fu-induced cell apoptosis and elevating chemosensitivity.
- Citation: Lu XR, Shen SF, Chi P. Role of SUMO-1, MDM2 and P53 in 5-flurouracil-induced apoptosis of HepG2 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 240-245
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/240.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.240
野生型p53基因(wtp53)可诱发细胞凋亡, 抑制肿瘤细胞形成和生长, 鼠双微粒体基因2(murine double minute gene 2, MDM2, 人同源基因为HDM2)蛋白由wtp53基因诱导表达, 与P53蛋白结合后通过促进P53蛋白的泛素化降解, 形成P53-MDM2反馈调节环路, 小分子泛素样修饰体-1(small ubiquitin-like modifier-1, SUMO-1)在蛋白翻译后修饰中具有很重要的作用, 可与泛素竞争某些底物蛋白的受体结合位点, 抑制泛素对诸如P53蛋白等底物的降解, 增强wtp53等抑癌基因的稳定性和转录活性[1]. 本实验以HepG2细胞为靶细胞, 分别及同时转染pwtp53、pMDM2和pSUMO-1质粒后, 观察其对化疗药5-Fu诱导的HepG2细胞凋亡的影响.
人肝母细胞瘤细胞HepG2购自武汉典型培养物保藏中心. 培养在RPMI1640培养基中, 37 ℃, 50 mL/L CO2饱和湿度, 用时补加100 mL/L热灭活胎牛血清, 2 mmol/L谷氨酰胺, 100 kU/L青霉素和100 mg/L链霉素. 取对数生长期细胞供接种孔板使用. 5-Fu: 制剂规格0.25 g/10 mL/支, 上海旭东海普药业有限公司.
1.2.1 质粒瞬时转染: 利用阳离子脂质体转染试剂Lipofectamine2000(购自Invitrogen公司), 按试剂盒说明步骤, 将pcDNA3-wtp53(pwtp53)、pCMV-HDM1B(pMDM2)、pcDNA3-His6-SUMO-1(pSUMO-1)质粒和空质粒pcDNA3分别及同时转染HepG2细胞, 培养36 h后, 获得不同转染细胞系. 上述质粒由英国St.Andrews大学David Lane实验室的Dimitris Xirodimas教授惠赠.
1.2.2 抗肿瘤药物5-Fu诱导HepG2细胞凋亡: 将HepG2细胞悬液以5×105个/孔接种于6孔板上, 其中供免疫荧光原位检测的孔板中置入盖玻片, 常规培养24 h至细胞汇合度达80%-90%后行同步化处理, 实验组于转染后各孔加入化疗药物5-Fu, 浓度梯度为0, 1×10-5, 1×10-4, 1×10-3, 1×10-2, 1×10-1 mol/L, 每个浓度3个平行样, 培养36 h后检测各项指标.
1.2.3 Western blot检测P53蛋白在HepG2细胞中的表达强度: 用全自动图像分析仪分析测定条带的面积和灰度值, 计算出积分灰度值与内参蛋白β-actin灰度值相比得到P53蛋白表达强度值(%).
1.2.4 流式细胞仪检测HepG2细胞凋亡比例: 以未转染任何质粒的HepG2细胞为空白阴性对照, 在FACScan流式细胞仪上波长>620 nm处测定PI产生的红光, 得到各组细胞凋亡比例, 每组重复3次, 每个样本测定1×104个细胞.
统计学处理 P53蛋白表达强度值(%)及细胞凋亡率(%)以mean±SD表示, 使用SAS9.2软件进行统计学处理, 两样本间蛋白表达强度值及凋亡率比较采用t检验(SNK法), P<0.05为差异有统计学意义.
药物诱导后, 随5-Fu浓度的增加, P53蛋白表达亦逐渐增强, 于1×10-3 mol/L浓度处最强, 是诱导P53表达的敏感浓度. 在同一药物浓度不同组之间, 未转染细胞P53蛋白表达最明显, 只转染pMDM2的细胞, P53蛋白表达明显下降, 与除对照组以外的其他各组比较差异有统计学意义(P<0.05), 而共转染pSUMO-1后, 细胞P53蛋白表达则又接近未转染细胞或仅转染pSUMO-1的细胞, 与只转染pMDM2细胞相比差异有统计学意义(P<0.05, 表1, 图1).
药物诱导后, 随5-Fu浓度的增加, HepG2细胞凋亡率逐渐升高, 在细胞周期G1期前, 出现明显的亚二倍体凋亡峰, 于1×10-2 mol/L浓度处凋亡率最高, 该浓度是诱导细胞凋亡的敏感浓度, 5-Fu浓度增加至1×10-1 mol/L时, 细胞死亡以坏死为主, 凋亡率反而下降. 在同一药物浓度不同组之间, 未转染细胞凋亡率最高, 只转染pMDM2的细胞凋亡率明显下降, 与除对照组以外的其他各组比较差异有显著意义(P<0.05), 而共转染pSUMO-1后, 细胞凋亡率又与未转染细胞或仅转染pSUMO-1的细胞相近, 与只转染pMDM2细胞相比差异有显著意义(P<0.05, 表2, 图2).
目前, 在肿瘤的分子生物学领域, p53是研究最多的抑癌基因, 主要参与DNA复制和修复过程, 能通过调节转录因子控制细胞周期, 并可依据需要诱导细胞凋亡, p53基因发生突变后, 由于空间构象发生改变, 失去了对细胞生长、凋亡和DNA损伤的修复调控作用, p53基因即由抑癌基因转变为癌基因. 大约50%以上的肿瘤中存在p53基因的突变[2], 是人类肿瘤中最常失活的抑癌基因,说明该基因的突变很可能是人类肿瘤产生的主要原因.
另外, 对于有关癌基因MDM2的功能被描述最多的就是与P53结合从而调节其活性[3,4], Dong等[5]应用免疫组织化学方法发现胰腺癌中P53和MDM2蛋白表达均升高, 提示其与肿瘤增殖及判断预后相关, 而另一项研究则显示MDM2基因的点突变与肝细胞癌无显著相关[6]; 但MDM2仍有许多功能未得到阐明, 1996年鉴定出的MDM2类似物MDMX[7], 他也能与P53结合并抑制其转录活性, 哪些激酶是真正调节MDM2与P53相互作用的[8], 是否还有其他的生物大分子能直接干扰MDM2和P53的相互作用[9], 似乎MDM2会和p53一样成为一个基因家族, MDM2的作用机制也会变得越来越复杂.
SUMO-1是近几年出现的研究新热点[10,11], SUMO-1对真核细胞中蛋白的翻译后修饰具有重要作用, 包括核胞质的信号传递、复杂基因组的精确复制以及基因表达的调控[12-14]. SUMO-1可通过对P53蛋白的翻译后修饰而增强P53的转录活性[15], 同时也可与其他因子共同调节MDM2作为E1泛素连接酶的活性, 而增强或减弱MDM2对P53的降解[16], 说明P53、MDM2和SUMO-1三者间有着千丝万缕的联系.
5-Fu广泛应用于消化道癌肿包括胃肠道肿瘤、原发性和转移性肝癌的栓塞化疗等, 为细胞周期特异性药, 主要抑制S期瘤细胞, 5-Fu在体内先转变为5-氟-2-脱氧尿嘧啶核苷酸, 后者抑制胸腺嘧啶核苷酸合成酶, 阻断脱氧尿嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸, 从而抑制DNA的生物合成, 此外, 还能通过阻止尿嘧啶和乳清酸掺入 RNA而达到抑制其合成的作用.
许多抗肿瘤药物可诱导细胞凋亡, 由于化疗药物的细胞毒作用, 诱导凋亡的同时也阻断程序中某些代谢途径, Inada等[17]就裸鼠内移植胃癌和结肠癌细胞株用5-Fu做凋亡诱导实验, 发现随药物浓度及作用时间延长凋亡细胞增加, 停滞于S期细胞增多, 同时一组有关大肠癌的统计数据也显示术前经5-Fu化疗的患者其细胞凋亡指数明显高于未化疗的对照组, 且与增殖指数呈负相关[18]. 以5-杂氮类药物干预细胞亦能导致p53基因上调[19], 体外培养细胞经紫外线等损伤因素作用后, 细胞DNA发生断裂, 可诱导细胞内源性P53蛋白表达, 细胞生长停滞于G1期并导致细胞发生凋亡[20]. 本实验结果亦显示, HepG2细胞经5-Fu诱导后, 随药物浓度的递增, 细胞内P53蛋白表达明显升高, 同时细胞凋亡也越明显, 说明5-Fu通过P53途径诱导细胞产生凋亡, 也说明诱导细胞内产生P53蛋白的高表达是5-Fu抗肿瘤的重要机制之一. 当药物浓度超过一定范围时(本实验为>1×10-3 mol/L), 细胞主要以坏死为主, 编码P53蛋白的DNA亦发生不可逆性损伤, P53蛋白的表达及凋亡率反而下降.
Shetty等[21]用含野生型p53基因的腺病毒载体(Ad-P53)转染横纹肌肉瘤细胞系, 然后以5-Fu、更生霉素D、博来霉素及长春新碱染毒细胞, P53出现0-20倍不同程度的表达, 化疗敏感性与pax3-FKHR、p21、Bax或Bcl-2的表达水平无关, 而与P53及其调节基因MDM2的表达相关. Schumacher等[22]对SCID鼠种植HT29结肠癌细胞并经5-Fu化疗后, 印戒型细胞中野生型P53阳性表达率由17%增高到45%, 同时MDM2蛋白的表达也明显增加, 而未分化癌细胞中突变型P53的表达又高于印戒型细胞, 说明突变型P53蛋白的表达与肿瘤组织的病理分型有关, 含有野生型p53基因的癌细胞对5-Fu化疗更敏感. Kaeser等[23]应用RNA干扰技术封闭成纤维细胞内的MDM2基因, 阻断了P53-MDM2负反馈调节环, 可以提高p53目的基因的表达, 细胞对5-Fu化疗敏感性上升50%. Pääjärvi等[24]在研究HepG2细胞中P53-MDM2相互作用时发现, 3-羟基-3-甲基-戊二酰-辅酶A(3-hydroxy-3-methyl-glutaryl-CoA, HMG-CoA)还原酶抑制剂普伐他汀(常用作降脂药), 可以诱导MDM2蛋白Ser166位点及2A10特异性抗原决定簇位点的磷酸化, 该位点的磷酸化可激活MDM2蛋白的泛素连接酶活性, 增强MDM2对P53的降解, HepG2细胞内P53/MDM2半衰期缩短, 最终减弱5-Fu等药物诱导HepG2细胞的凋亡. P53羧基端含有与MDM2相互作用的结构域, Zhao等[25]用一种可与该结构域结合的Daxx蛋白来调控P53的功能, 当有MDM2表达时, P53的去乙酰化可以促进Daxx与P53的结合, 共转染Daxx和MDM2基因, 可以明显抑制P53对其下游启动子的激活, 细胞对5-Fu诱导的凋亡具有极强的抵抗性, 产生5-Fu耐药. 本实验结果显示转染pMDM2的细胞对5-Fu诱导的细胞凋亡有抵抗性, 转染质粒在细胞内表达MDM2蛋白, 大量降解药物诱导产生的内源性P53蛋白, 与未转染细胞相比, 其P53蛋白表达和细胞凋亡率均明显下降(P<0.05).
SUMO-1在细胞增殖、分化、凋亡等多种生理过程中发挥重要作用, 至今已发现193种SUMO-1潜在的作用底物, 其中23种已被证实存在于细胞核内, 如小核糖核蛋白、不均一性核糖核蛋白、核糖体蛋白、组蛋白、RNA组合蛋白及转录蛋白[26], 而在EGFP-SUMO-1高表达的HepG2细胞中, 利用双向凝胶电泳及质谱检测, 发现不均一性核糖核蛋白hnRNP A2/B1的表达上调[27]. Shao等[28]通过降低促性腺激素以诱导鼠卵巢颗粒细胞凋亡, 其SUMO-1蛋白表达明显升高, 提示SUMO-1在调控细胞核蛋白的定位及稳定性方面具有重要功能. 本实验通过SUMO-1的修饰以调控P53功能, 在共转染SUMO-1和MDM2基因的细胞中, 可显著恢复P53的凋亡活性, 提示不仅存在直接的对P53蛋白降解和抑制降解作用, P53诱导的细胞凋亡还与其细胞定位有关. P53蛋白的C末端是其促进细胞凋亡的中心区域, 这一区域的磷酸化和乙酰化状态将影响P53与DNA的结合活性, 也即影响P53下游其他凋亡因子的启动活性[29,30], 推测SUMO-1可与P53蛋白C末端结合而阻止泛素类蛋白分子对P53的降解, 增强P53的转录活性.
总之, P53蛋白被SUMO-1修饰后, 可促进其核定位或在核内某一区域浓聚而脱逃MDM2对其在胞质的降解, 最终增强P53的转录及诱导凋亡活性, SUMO-1-P53修饰机制的建立, 为试图通过调控P53功能治疗肿瘤提供了新思路.
SUMO-1可通过对P53蛋白的翻译后修饰而增强P53的转录活性, 同时也可与其他因子共同调节MDM2作为E1泛素连接酶的活性, 而增强或减弱MDM2对P53的降解, 说明P53、MDM2和SUMO-1三者间有着千丝万缕的联系.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科
小分子泛素样修饰蛋白-1(SUMO-1)是近几年出现的研究新热点, SUMO-1对真核细胞中蛋白的翻译后修饰具有重要作用, 包括核胞质的信号传递、复杂基因组的精确复制以及基因表达的调控.
Kaeser等应用RNA干扰技术封闭成纤维细胞内MDM2基因, 阻断了P53-MDM2负反馈调节环, 可以提高p53目的基因的表达, 细胞对5-Fu化疗敏感性上升50%.
P53蛋白被SUMO-1修饰后, 可促进其核定位或在核内某一区域浓聚而脱逃MDM2对其在胞质的降解, 最终增强P53的转录及诱导凋亡活性, SUMO-1-P53修饰机制的建立, 为试图通过调控P53功能治疗肿瘤提供了新思路.
本文可读性较好, 具有较高的学术价值.
编辑: 李薇 电编:李薇
| 1. | Lu X, Yi J. SUMO-1 enhancing the p53-induced HepG2 cell apoptosis. J Huazhong Univ Sci Technolog Med Sci. 2005;25:289-291. [PubMed] [DOI] |
| 2. | Keegan PE, Lunec J, Neal DE. p53 and p53-regulated genes in bladder cancer. Br J Urol. 1998;82:710-720. [PubMed] |
| 3. | Vaseva AV, Marchenko ND, Moll UM. The transcription-independent mitochondrial p53 program is a major contributor to nutlin-induced apoptosis in tumor cells. Cell Cycle. 2009;8:1711-1719. [PubMed] [DOI] |
| 4. | Shangary S, Ding K, Qiu S, Nikolovska-Coleska Z, Bauer JA, Liu M, Wang G, Lu Y, McEachern D, Bernard D. Reactivation of p53 by a specific MDM2 antagonist (MI-43) leads to p21-mediated cell cycle arrest and selective cell death in colon cancer. Mol Cancer Ther. 2008;7:1533-1542. [PubMed] [DOI] |
| 5. | Dong M, Ma G, Tu W, Guo KJ, Tian YL, Dong YT. Clinicopathological significance of p53 and mdm2 protein expression in human pancreatic cancer. World J Gastroenterol. 2005;11:2162-2165. [PubMed] |
| 6. | Leu JD, Lin IF, Sun YF, Chen SM, Liu CC, Lee YJ. Association between MDM2-SNP309 and hepatocellular carcinoma in Taiwanese population. World J Gastroenterol. 2009;15:5592-5597. [PubMed] [DOI] |
| 7. | Shvarts A, Steegenga WT, Riteco N, van Laar T, Dekker P, Bazuine M, van Ham RC, van der Houven van Oordt W, Hateboer G, van der Eb AJ. MDMX: a novel p53-binding protein with some functional properties of MDM2. EMBO J. 1996;15:5349-5357. [PubMed] |
| 8. | Kojima K, Konopleva M, Samudio IJ, Ruvolo V, Andreeff M. Mitogen-activated protein kinase kinase inhibition enhances nuclear proapoptotic function of p53 in acute myelogenous leukemia cells. Cancer Res. 2007;67:3210-3219. [PubMed] [DOI] |
| 9. | Becker K, Marchenko ND, Palacios G, Moll UM. A role of HAUSP in tumor suppression in a human colon carcinoma xenograft model. Cell Cycle. 2008;7:1205-1213. [PubMed] [DOI] |
| 10. | Hochstrasser M. SP-RING for SUMO: new functions bloom for a ubiquitin-like protein. Cell. 2001;107:5-8. [PubMed] |
| 12. | Kaikkonen S, Jääskeläinen T, Karvonen U, Rytinki MM, Makkonen H, Gioeli D, Paschal BM, Palvimo JJ. SUMO-specific protease 1 (SENP1) reverses the hormone-augmented SUMOylation of androgen receptor and modulates gene responses in prostate cancer cells. Mol Endocrinol. 2009;23:292-307. [PubMed] [DOI] |
| 13. | Campbell LA, Faivre EJ, Show MD, Ingraham JG, Flinders J, Gross JD, Ingraham HA. Decreased recognition of SUMO-sensitive target genes following modification of SF-1 (NR5A1). Mol Cell Biol. 2008;28:7476-7486. [PubMed] [DOI] |
| 14. | Brunet Simioni M, De Thonel A, Hammann A, Joly AL, Bossis G, Fourmaux E, Bouchot A, Landry J, Piechaczyk M, Garrido C. Heat shock protein 27 is involved in SUMO-2/3 modification of heat shock factor 1 and thereby modulates the transcription factor activity. Oncogene. 2009;28:3332-3344. [PubMed] [DOI] |
| 15. | Rodriguez MS, Desterro JM, Lain S, Midgley CA, Lane DP, Hay RT. SUMO-1 modification activates the transcriptional response of p53. EMBO J. 1999;18:6455-6461. [PubMed] [DOI] |
| 16. | Buschmann T, Fuchs SY, Lee CG, Pan ZQ, Ronai Z. SUMO-1 modification of Mdm2 prevents its self-ubiquitination and increases Mdm2 ability to ubiquitinate p53. Cell. 2000;101:753-762. [PubMed] |
| 17. | Inada T, Ichikawa A, Kubota T, Ogata Y, Moossa AR, Hoffman RM. 5-FU-induced apoptosis correlates with efficacy against human gastric and colon cancer xenografts in nude mice. Anticancer Res. 1997;17:1965-1971. [PubMed] |
| 19. | Xiao WH, Sanren GW, Zhu JH, Li QW, Kang HR, Wang RL, Song LP, Ye M. Effect of 5-aza-2'-deoxycytidine on immune-associated proteins in exosomes from hepatoma. World J Gastroenterol. 2010;16:2371-2377. [PubMed] [DOI] |
| 20. | Latonen L, Kurki S, Pitkänen K, Laiho M. p53 and MDM2 are regulated by PI-3-kinases on multiple levels under stress induced by UV radiation and proteasome dysfunction. Cell Signal. 2003;15:95-102. [PubMed] [DOI] |
| 21. | Shetty S, Taylor AC, Harris LC. Selective chemosensitization of rhabdomyosarcoma cell lines following wild-type p53 adenoviral transduction. Anticancer Drugs. 2002;13:881-889. [PubMed] [DOI] |
| 22. | Schumacher U, Adam E, Feldhaus S, Katoh M, Lane DP. Cell differentiation and chemotherapy influence p53 and Mdm2 immunoreactivity in human HT29 colon cancer cells grown in scid mice. Cancer Lett. 2001;166:215-221. [PubMed] [DOI] |
| 23. | Kaeser MD, Pebernard S, Iggo RD. Regulation of p53 stability and function in HCT116 colon cancer cells. J Biol Chem. 2004;279:7598-7605. [PubMed] [DOI] |
| 24. | Pääjärvi G, Roudier E, Crisby M, Högberg J, Stenius U. HMG-CoA reductase inhibitors, statins, induce phosphorylation of Mdm2 and attenuate the p53 response to DNA damage. FASEB J. 2005;19:476-478. [PubMed] |
| 25. | Zhao LY, Liu J, Sidhu GS, Niu Y, Liu Y, Wang R, Liao D. Negative regulation of p53 functions by Daxx and the involvement of MDM2. J Biol Chem. 2004;279:50566-50579. [PubMed] [DOI] |
| 26. | Matafora V, D'Amato A, Mori S, Blasi F, Bachi A. Proteomics analysis of nucleolar SUMO-1 target proteins upon proteasome inhibition. Mol Cell Proteomics. 2009;8:2243-2255. [PubMed] [DOI] |
| 27. | Ma KW, Au SW, Waye MM. Over-expression of SUMO-1 induces the up-regulation of heterogeneous nuclear ribonucleoprotein A2/B1 isoform B1 (hnRNP A2/B1 isoform B1) and uracil DNA glycosylase (UDG) in hepG2 cells. Cell. Biochem Funct. 2009;27:228-237. [PubMed] [DOI] |
| 28. | Shao R, Rung E, Weijdegård B, Billig H. Induction of apoptosis increases SUMO-1 protein expression and conjugation in mouse periovulatory granulosa cells in vitro. Mol Reprod Dev. 2006;73:50-60. [PubMed] [DOI] |
| 29. | Hupp TR, Lane DP, Ball KL. Strategies for manipulating the p53 pathway in the treatment of human cancer. Biochem J. 2000;352 Pt 1:1-17. [PubMed] [DOI] |
| 30. | Gu W, Luo J, Brooks CL, Nikolaev AY, Li M. Dynamics of the p53 acetylation pathway. Novartis Found Symp. 2004;259:197-205; discussion 205-207, 223-225. [PubMed] |