修回日期: 2010-12-06
接受日期: 2010-12-15
在线出版日期: 2011-01-28
目的: 探讨血小板活化因子(PAF)对肠上皮细胞骨架F-actin的影响以及肠三叶因子(ITF)对此影响的抑制作用.
方法: 体外培养人结肠腺癌细胞株Caco-2, 分为4组. 对照组: 不加刺激物及干预因素; 实验组: 加入PAF, 终浓度分别为0、50、100和200 nmol/L, 作用24 h; PAF 100 nmol/L, 分别作用0、2、4、8、12、24、48 h; ITF预防组: 先加入ITF 0.3 mol/L, 30 min后加入PAF 100 nmol/L; ITF治疗组: 先加入PAF 100 nmol/L, 30 min后加入ITF 0.3 mol/L, 24 h后进行实验. 应用跨上皮电阻(TEER)反映肠上皮细胞屏障通透性; 免疫荧光染色法观察F-actin的定位、重排以及形态学变化; 流式细胞术对F-actin蛋白进行定量分析.
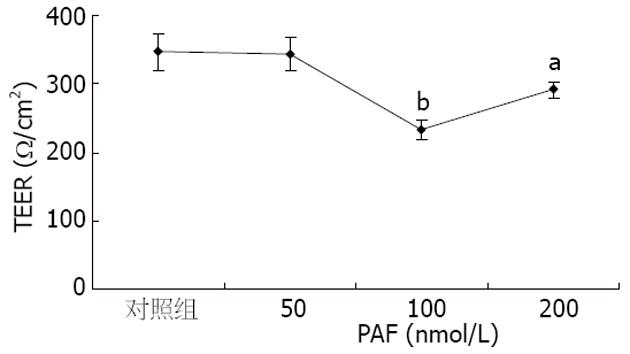
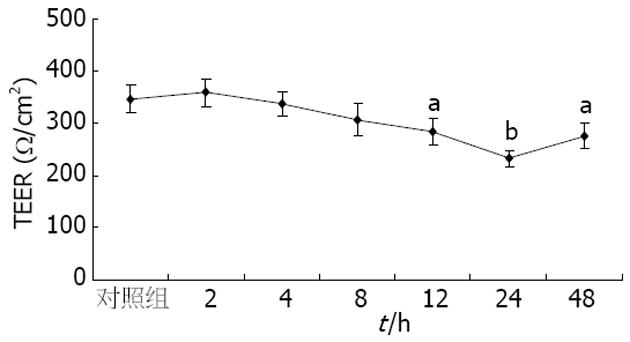
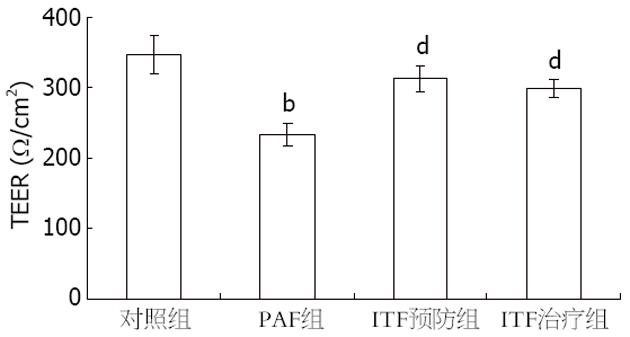
结果: 给予50 nmol/L PAF, 作用8-12 h即可引起TEER的下降, PAF 100 nmol/L作用24 h, TEER降到最低点, 与对照组相比, 差异显著(232.75 Ω/cm2±15.74 Ω/cm2vs 346.75 Ω/cm2±26.69 Ω/cm2, P<0.01); 预防或治疗性给予ITF, TEER有所恢复, 与模型组相比, 差异显著(313.75 Ω/cm2±18.28 Ω/cm2, 299 Ω/cm2±13.16 Ω/cm2vs 232.75 Ω/cm2±15.74 Ω/cm2, 均P<0.01). TRITC-phalloidin直接免疫荧光染色显示正常Caco-2细胞, F-actin主要环绕于细胞周边, 排列紧密圆滑, 无明显间隙, 细胞界限清晰. PAF 100 nmol/L作用24 h后, F-actin出现重排, 断裂, 周边肌动蛋白丝带模糊, 部分细胞出现横跨细胞的应力纤维结构. 预防或治疗性给予ITF后, 具有正常F-actin染色的细胞比例增加, 周边肌动蛋白丝带逐渐清晰, 胞质内应力纤维减少, 但环点状断裂未完全修复. 预防组作用更强. 以TRITC-phalloidin的相对平均荧光强度表示F-actin的含量, 经流式细胞仪检测发现PAF 100 nmol/L作用24 h后, F-actin含量明显减少(218.56±23.18 vs 425.35±40.31, P<0.01), 给予ITF后F-actin的含量有所增加, 与模型组相比差异显著(391.76±58.57, 360.86±8.68 vs 218.56±23.18, 均P<0.01), 但仍低于对照组.
结论: PAF可以改变肠上皮细胞骨架F-actin的定位及定量, 从而影响肠上皮细胞屏障功能; ITF可以通过抑制F-actin重排, 恢复F-actin蛋白定量而稳定细胞骨架.
引文著录: 许玲芬, 滕旭, 吴捷, 郭静, 毛志芹, 孙梅. ITF对PAF引起的肠上皮细胞骨架F-actin破坏的抑制作用. 世界华人消化杂志 2011; 19(3): 233-239
Revised: December 6, 2010
Accepted: December 15, 2010
Published online: January 28, 2011
AIM: To explore whether treatment with platelet-activating factor (PAF) disrupts the intestinal epithelial barrier by altering the F-actin cytoskeleton and, if so, whether treatment with intestinal trefoil factor (ITF) exerts a protective effect against PAF-induced disruption of the F-actin cytoskeleton.
METHODS: An in vitro model of intestinal epithelium was established with Caco-2 cells. PAF at different concentrations (0, 50, 100, 200 nmol/L) was incubated with postconfluent monolayers of Caco-2 cells for 24 h. Moreover, 100 nmol/L PAF was administered for different periods (0, 2, 4, 8, 12, 24, 48 h). ITF (0.3 mol/L) was administered 30 min before or after PAF treatment (100 nmol/L). Transendothelial electrical resistance (TEER) was measured to evaluate the permeability of intestinal epithelial cell monolayers. Immunofluorescent staining and flow cytometry were used to observe the morphological alterations and conduct protein quantitation of the F-actin cytoskeleton.
RESULTS: Compared with the control group, TEER decreased in cells treated with PAF (100 nmol/L) for 24 h (232.75 Ω/cm2 ± 15.74 Ω/cm2vs 346.75 Ω/cm2 ± 26.69 Ω/cm2, P < 0.01). While compared with the model group, TEER had little enhancement in cells treated with ITF (313.75 Ω/cm2 ± 18.28 Ω/cm2, 299 Ω/cm2 ± 13.16 Ω/cm2vs 232.75 Ω/cm2 ± 15.74 Ω/cm2, both P < 0.01). Treatment with PAF induced a significant decline in paracellular permeability. After treatment with PAF (100 nmol/L) for 24 h, extensive disorganization, kinking, condensation, and beading of the F-actin ring could be seen and the mean fluorescent intensity of F-actin had a significant decline (218.56 ± 23.18 vs 425.35 ± 40.31, P < 0.01). Treatment with ITF could reverse the high permeability of intestinal epithelial cell monolayers partly by recovering the normal structure of F-actin and increasing the content of F-actin (391.76 ± 58.57, 360.86 ± 8.68 vs 218.56 ± 23.18, both P < 0.01).
CONCLUSION: PAF plays an important role in the regulation of intestinal mucosal permeability and induces the structural alterations of the F-actin cytoskeleton. Treatment with ITF can protect intestinal epithelium by restricting the rearrangement of the F-actin cytoskeleton.
- Citation: Xu LF, Teng X, Wu J, Guo J, Mao ZQ, Sun M. Treatment with ITF attenuates PAF-induced disruption of the F-actin cytoskeleton in an in vitro model of intestinal epithelium. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 233-239
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/233.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.233
肠黏膜屏障是机体最重要的免疫防御屏障, 将机体与肠道内的外源性物质隔离开来, 避免病原微生物的侵袭和抗原分子的损伤[1-5]. 屏障的完整性受一个复杂的网络调控, 包括细胞骨架、紧密连接、黏附连接等. 其中细胞骨架成分F-actin对维持正常肠黏膜通透性具有重要作用, 上皮细胞F-actin的重组和/或再分布可以引起上皮细胞屏障通透性改变[6-8]. 有研究资料表明肌动蛋白在维持胃肠黏膜屏障的完整性和功能中是关键成分, 若其破坏将导致黏膜损伤[9]. 用乙醇破坏胃肠黏膜屏障的完整性而观察到微管骨架的破坏[10].
血小板活化因子(platelet-activating factor, PAF)是一种具有生物活性的脂性介质, 主要由血小板、中性粒细胞、单核细胞以及内皮细胞产生[11]. PAF同样可以由肠上皮细胞产生[12,13], 参与肠道的生理及病理过程: 生理状态下, 他可以调节肠道的正常通透性[14]; 在多种肠道疾病如炎症性肠病、坏死性小肠结肠炎等中, 均发现PAF发挥着重要作用[15,16], 即使未引起肠损伤的小剂量PAF, 也可以引起其他细胞因子和转录因子的活化, 增加肠黏膜通透性[17-22], 在多种细胞系中也发现了PAF的特异性受体[23,24]. 但PAF引起上皮细胞屏障通透性改变是否与细胞骨架成分F-actin的重排有关, 尚无研究证实.
肠三叶因子(intestinal trefoil factor, ITF)属三叶肽家族, 是近年来被人们注意到的对胃肠道黏膜屏障有重要保护和修复作用的多肽[25,26]. 大量的动物实验也证明ITF在维持肠上皮细胞的完整性, 恢复肠黏膜的正常通透性方面均起到重要作用[27,28]. 但其作用机制仍不明了.
本实验应用Caco-2细胞建立体外肠上皮细胞屏障模型, 观察PAF是否引起细胞骨架F-actin的重排? ITF是否通过抑制F-actin的重排而起保护作用? 为ITF的临床应用提供理论依据.
人结肠腺癌细胞株(Caco-2)购于中国科学院上海细胞所, 由ATCC引进; DMEM培养基、胰酶和胎牛血清(fatal bovine serum, FBS)购自Gibco公司; PAF、罗丹明-鬼笔环肽(TRITC-phalloidin)购自Sigma公司; 基因重组肠三叶因子(recombinant intestinal trefoil factor, rITF)由北京大学蛋白质工程及植物基因工程国家重点实验室提供.
1.2.1 细胞培养: Caco-2细胞常规培养, 培养液为DMEM培养基, 含150 mL/L进口FBS, 1%青链霉素双抗液, 通入50 mL/L CO2(相对湿度90%), 置37 ℃培养箱, 传代后7 d左右细胞生长达到融合开始进行实验, 每种实验均选取3组非同代细胞进行.
1.2.2 分组: 分别设对照组、实验组、ITF预防组、ITF治疗组. 对照组: 不加刺激物及干预因素. 实验组: 加入PAF, 终浓度分别为0、50、100、200 nmol/L, 作用24 h; 加入PAF 100 nmol/L, 分别作用0、2、4、8、12、24、48 h. ITF预防组: 先加入rITF 0.3 mol/L, 30 min后加入PAF 100 nmol/L, 24 h后进行实验. ITF治疗组: 先加入PAF 100 nmol/L, 30 min后加入rITF 0.3 mol/L, 24 h后进行实验.
1.2.3 跨上皮电阻测定: 将细胞接种于Transwell, 应用EVOM测定跨上皮电阻(transepithelial electrical resistance, TEER). 整个过程在恒定温度下(37 ℃)进行, 每个Transwell均取不同方向的3个点, 重复测定3次, 取平均值即为该样品的TEER值, 以Ω/cm2表示; 因为Transwell膜本身也具有一定的TEER, 因此标准的TEER应将样品的实测TEER值减去空白对照的TEER值.
1.2.4 F-actin的免疫荧光染色: 采用直接免疫荧光染色法. 置盖玻片于六孔板中接种细胞, 爬片生长至融合, 换无血清培养液, 按照实验分组加入PAF及rITF. 弃培养液, PBS洗涤, 40 g/L多聚甲醛固定, 0.5% Triton X-100打孔, 10% BSA封闭, 加入浓度为1∶100的TRITC-phalloidin, 每片约100 μL, 室温避光反应40 min, 弃染料, PBS漂洗, 甘油封片, 用荧光显微镜观察并拍照.
1.2.5 流式细胞术对肠上皮细胞F-actin的定量分析: 将细胞接种于六孔板中, 生长至融合, 换无血清培养液, 按照实验分组加入PAF及rITF. 弃培养液, 加胰酶消化, 弃胰酶, 终止消化, 反复吹打成单细胞悬液, 收集细胞. 4 ℃ PBS离心洗涤, 加无水乙醇, -20 ℃过夜固定; 0.5% Triton X-100打孔; 加入浓度为1∶60的TRITC-phalloidin, 每管100 μL, 室温避光反应1 h, 弃染料, PBS离心洗涤; PBS稀释至1 mL, 混匀细胞, 转移至流式管中, 上流式细胞仪分析, FL2通道, 每个样品记数10 000个细胞.
统计学处理 所有实验均重复4次, 结果用mean±SD表示, 统计由SPSS12.0软件完成. 采用One-way ANOVA法对各组间数据进行比较, P<0.05被认为有显著差异.
给予50 nmol/L PAF, 作用8-12 h即可引起TEER的下降, PAF 100 nmol/L作用24 h, TEER降到最低点, 与对照组相比, 差异显著(232.75±15.74 Ω/cm2vs 346.75±26.69 Ω/cm2, P<0.01); 预防或治疗性给予ITF, TEER有所恢复, 与模型组相比, 差异显著(313.75±18.28 Ω/cm2, 299.00 Ω/cm2±13.16 Ω/cm2vs 232.75 Ω/cm2±15.74 Ω/cm2, 均P<0.01). 提示PAF可以直接降低Caco-2细胞屏障的TEER, 而ITF可以部分恢复肠黏膜屏障通透性(图1-3).
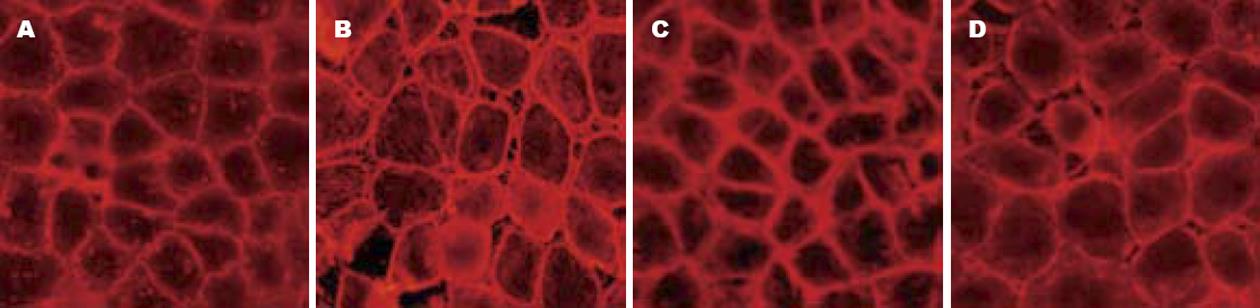
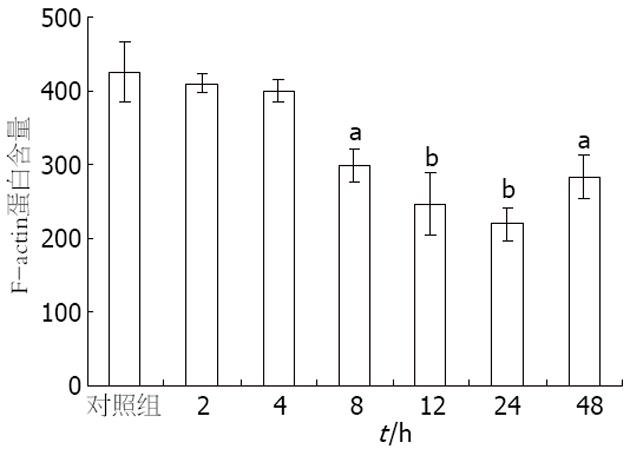
F-actin染色应用的是TRITC-phalloidin特异性荧光探针直接标记, 因为其有专一结合微丝骨架应力纤维主要成分F-actin的特性, 用于显示F-actin的分布. 在正常Caco-2细胞, F-actin主要环绕于细胞周边, 形成周边肌动蛋白丝带, 在细胞与细胞接触部位呈束状相互连接, 细胞中央偶尔可见不规则纤维丝. 细胞生长融合为单层后, 可见细胞间F-actin排列紧密圆滑, 轮廓完整连续, 无明显间隙, 细胞界限清晰. PAF作用8-12 h后, 就可见细胞骨架F-actin出现重排, 表现为外周致密带边缘变的毛糙不规整, 出现环点状断裂, 细胞中央有弥散actin及少量应力纤维形成. 作用24 h, 可见周边肌动蛋白丝带模糊, 在细胞皮质区的F-actin纤维致密斑减少, 部分细胞出现明显横跨细胞的应力纤维结构. 48 h后周边肌动蛋白丝带变细, 断断续续, 胞质内仍可见少量应力纤维. 给予不同浓度的PAF发现, 以PAF 100 nmol/L破坏最为明显. 当预防或治疗性给予rITF并共同培养24 h后, 免疫荧光染色发现, 具有正常F-actin染色的细胞比例在增加, 周边肌动蛋白丝带逐渐清晰, 胞质内应力纤维减少, 但外周致密带边缘仍毛糙不规整, 环点状断裂未完全修复. 比较而言, 预防性给药恢复细胞骨架正常结构的能力更强(图4).
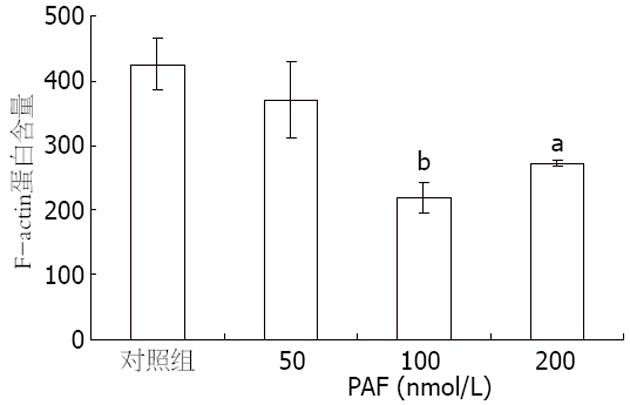
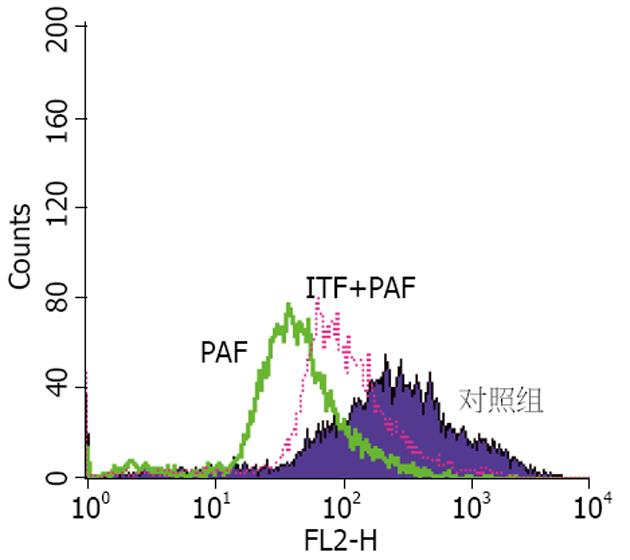
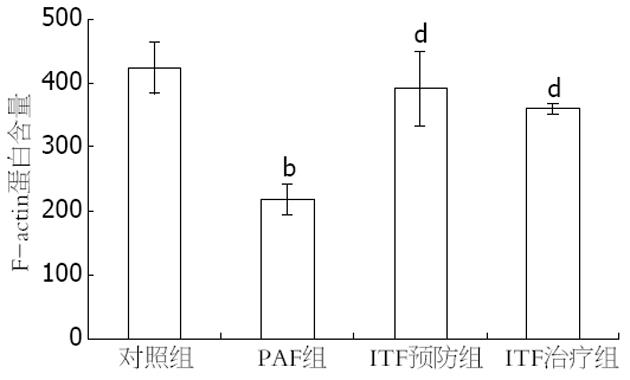
流式细胞术(flow cytometry, FCM)是一种可以对细胞或亚细胞结构进行快速测量的新型分析技术和分选技术, TRITC-phalloidin可以专一结合F-actin. 以TRITC-phalloidin的平均荧光强度表示F-actin的含量. 经FCM检测发现: PAF作用8 h后, F-actin含量开始减少, 峰左移; 24 h后明显下降, 峰左移明显, 与对照组相比差异显著(298.26±23.18, 218.56±23.18 vs 425.35±40.31, 均P<0.05, P<0.01), 作用持续到48 h, 但48 h与24 h相比无明显差异(282.41±29.5 vs 218.56±23.18, P>0.05, 图5). 而PAF作用浓度对F-actin含量的影响更为显著, 以PAF 100 nmol/L下降最为明显, 与对照组相比差异显著(218.56±23.18 vs 425.35±40.31, P<0.01, 图6). 给予rITF作用24 h, F-actin的含量有所增加, 与PAF 100 nmol/L组相比差异显著(391.76±58.57, 360.86±8.68 vs 218.56±23.18, 均P<0.01), 但仍低于对照组, 峰右移, 但未移回原位. 预防组较治疗组作用更强, 但无统计学意义(图7, 8).
肌动蛋白骨架介导了许多真核细胞重要的生理功能, 作为网络结构还为细胞提供必要的形态和极性. F-actin是个动力结构蛋白, 其特殊的性质决定和主导了细胞的移动、分泌和信号转导等功能[29,30]. F-actin的重组与细胞旁通路的开放之间存在着结构和功能的关系. 在多种急慢性疾病状态下如感染[31]、创伤、烧伤、应激、窒息缺氧[32]、缺血/再灌注[33]、药物、毒素等以及肠道的慢性炎症性疾病如克罗恩病、溃疡性结肠炎[34,35]等均可引起肠黏膜屏障的破坏, 肠通透性的增加, 进而造成全身炎症反应. 为了观察在这个过程中是否出现了上皮细胞骨架成分F-actin的重组和/或再分布? 这种改变与炎症因子作用的时间以及剂量之间的关系如何? 我们进行了如下实验.
首先应用Caco-2细胞建立体外肠上皮细胞屏障模型. 观察正常Caco-2细胞F-actin的结构, 显示其分布于胞质内近细胞膜处, 形成环状致密周围带, 光滑连续, 分布均匀, 排列整齐, 形成典型的鹅卵石样形态, 这是保持细胞形态和细胞间连接的结构基础. 胞质中未见密集的F-actin纤维, 细胞间连接紧密, 没有明显间隙形成.
我们在以往的研究中已经证实[36], PAF可以直接引起肠黏膜屏障通透性的改变. 本实验应用TEER测定肠黏膜屏障通透性, 也证实了不同浓度PAF作用不同时间对通透性的影响以及ITF的保护作用. 但这种改变是否与细胞骨架蛋白F-actin的结构改变有关是本文研究的目的. 当PAF作用于Caco-2细胞8-12 h时, 发现骨架蛋白F-actin的结构就已发生改变, 细胞间连接略松散, 周边肌动蛋白致密带毛糙, 细胞质内出现中央短纤维和少量应力纤维; 作用24 h, 细胞形态结构发生进一步变化, 细胞质内actin纤维聚合成束, 形成应力纤维, 而细胞边缘actin致密带却变薄、变细或变模糊甚至消失, 细胞间缝隙增大、增多; 而在作用48 h时, F-actin的重组有所恢复. 所有这些改变以PAF浓度为100 nmol/L时最重. 通过流式细胞仪定量分析F-actin的蛋白含量, 结果显示F-actin蛋白量较正常明显减少, 以24 h减少最显著. 定量检测的结果和形态学的变化意义基本一致. 说明PAF影响了F-actin的再分布和重构, 且具有时间效应, 其剂量效应可能与受体饱和度有关. 这也证实了细胞骨架F-actin的重排是PAF引起肠上皮细胞屏障通透性增强的一个重要机制.
ITF属三叶肽家族, 是近年来被人们注意到的对胃肠道黏膜屏障有重要保护和修复作用的多肽, 是一种新型的生长因子类多肽物质. 他的生理功能主要体现在两个方面[25,26]: 首先ITF可与黏液糖蛋白相互作用或交联, 形成黏弹性的黏液凝胶层, 对肠道黏液层起固定和支持作用, 防止有害物质对肠黏膜细胞的损伤, 从而增强胃肠道黏膜屏障的保护能力; 其次ITF具有很强的促进细胞增殖与移行的能力, 被认为是黏膜损伤的快速反应肽, 在损伤早期即可表达, 促进受损区域上皮细胞重建并加快上皮细胞移行速度, 因而在肠道的自我保护机制中占据重要地位. 大量的动物实验也证明ITF在维持肠上皮细胞的完整性, 恢复肠黏膜的正常通透性方面均起到重要作用, 但作用机制仍不明了. 体外研究发现ITF高表达的细胞, 其TEER明显增高, 肠通透性降低[37], 但与细胞骨架的重排是否相关, 尚无研究证实.
本实验中我们预防或治疗性给予rITF后, 周边肌动蛋白丝带逐渐清晰, 胞质内应力纤维减少, 但外周致密带边缘仍毛糙不规整, 环点状断裂未完全修复; FCM检测F-actin蛋白含量较前增加, 预防性给药改变更显著. 由此我们认为稳定细胞骨架结构, 防止细胞骨架重排也是ITF恢复肠黏膜的正常通透性的一个机制, 为ITF作为一个肠道保护因子提供理论依据.
肠黏膜屏障作为机体最重要的免疫防御屏障, 其完整性与多种疾病状态相关, 如感染、创伤、应激、缺血/再灌注等急性过程以及肠道的慢性炎症性疾病如克罗恩 病、溃疡性结肠炎等. 细胞骨架成分F-actin的重组与细胞旁通路的开放之间存在着结构和功能的关系. PAF引起的肠黏膜屏障通透性的改变是否与F-actin的结构改变相关, ITF对肠黏膜屏障的保护作用是否与稳定细胞骨架结构, 防止细胞骨架重排有关尚无报道.
杨桦, 教授, 中国人民解放军第三军医大学新桥医院普通外科
肠黏膜屏障通透性增高是多种疾病的发病基础. 探讨引起通透性增高的关键环节, 其发病的信号转导机制, 并研制有效的预防和治疗药物, 是此领域的研究热点.
相关资料表明在维持胃黏膜屏障的完整性和功能中肌动蛋白是关键成分, 若其破坏将导致黏膜损伤; 用乙醇破坏胃黏膜屏障的完整性而观察到微管骨架的破坏. 体外研究也发现ITF高表达的细胞, 其TEER明显增高, 肠通透性降低.
目前关于PAF引起肠黏膜通透性增高的体外实验报道极少, 他对于细胞骨架结构F-actin的重组和/或再分布的影响的文章国内尚未见报道. 研究ITF对肠黏膜损伤的抑制作用并从稳定细胞骨架结构, 防止细胞骨架重排的角度探讨其作用机制是本研究的创新点.
本文发现PAF可以改变肠上皮细胞骨架F-actin的定位及定量, 从而影响肠黏膜屏障功能; ITF可以通过抑制F-actin重排, 恢复F-actin蛋白定量而稳定细胞骨架, 起到保护作用. 为进一步探讨肠黏膜屏障破坏机制及ITF的研发及应用奠定基础.
本文创新性较好, 为研究肠三叶因子抑制细胞骨架破坏的机制奠定了实验基础.
编辑: 李薇 电编:何基才
沈阳市科学技术计划基金资助项目, No. F10-205-1-45.
| 1. | Hollander D. The intestinal permeability barrier. A hypothesis as to its regulation and involvement in Crohn's disease. Scand J Gastroenterol. 1992;27:721-726. [PubMed] [DOI] |
| 2. | Purohit V, Bode JC, Bode C, Brenner DA, Choudhry MA, Hamilton F, Kang YJ, Keshavarzian A, Rao R, Sartor RB. Alcohol, intestinal bacterial growth, intestinal permeability to endotoxin, and medical consequences: summary of a symposium. Alcohol. 2008;42:349-361. [PubMed] [DOI] |
| 3. | Choudhry MA, Chaudry IH. Alcohol, burn injury, and the intestine. J Emerg Trauma Shock. 2008;1:81-87. [PubMed] [DOI] |
| 4. | Menconi MJ, Salzman AL, Unno N, Ezzell RM, Casey DM, Brown DA, Tsuji Y, Fink MP. Acidosis induces hyperpermeability in Caco-2BBe cultured intestinal epithelial monolayers. Am J Physiol. 1997;272:G1007-G1021. [PubMed] |
| 5. | Unno N, Menconi MJ, Smith M, Aguirre DE, Fink MP. Hyperpermeability of intestinal epithelial monolayers is induced by NO: effect of low extracellular pH. Am J Physiol. 1997;272:G923-G934. [PubMed] |
| 6. | Yuan SY. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 2000;7:395-403. [PubMed] |
| 7. | Blum MS, Toninelli E, Anderson JM, Balda MS, Zhou J, O'Donnell L, Pardi R, Bender JR. Cytoskeletal rearrangement mediates human microvascular endothelial tight junction modulation by cytokines. Am J Physiol. 1997;273:H286-H294. [PubMed] |
| 8. | Banan A, Zhang Y, Losurdo J, Keshavarzian A. Carbonylation and disassembly of the F-actin cytoskeleton in oxidant induced barrier dysfunction and its prevention by epidermal growth factor and transforming growth factor alpha in a human colonic cell line. Gut. 2000;46:830-837. [PubMed] |
| 9. | Banan A, Fitzpatrick L, Zhang Y, Keshavarzian A. OPC-compounds prevent oxidant-induced carbonylation and depolymerization of the F-actin cytoskeleton and intestinal barrier hyperpermeability. Free Radic Biol Med. 2001;30:287-298. [PubMed] [DOI] |
| 10. | Banan A, Fields JZ, Decker H, Zhang Y, Keshavarzian A. Nitric oxide and its metabolites mediate ethanol-induced microtubule disruption and intestinal barrier dysfunction. J Pharmacol Exp Ther. 2000;294:997-1008. [PubMed] |
| 11. | Jeong YI, Jung ID, Lee CM, Chang JH, Chun SH, Noh KT, Jeong SK, Shin YK, Lee WS, Kang MS. The novel role of platelet-activating factor in protecting mice against lipopolysaccharide-induced endotoxic shock. PLoS One. 2009;4:e6503. [PubMed] [DOI] |
| 12. | Guerrant RL, Fang GD, Thielman NM, Fonteles MC. Role of platelet activating factor in the intestinal epithelial secretory and Chinese hamster ovary cell cytoskeletal responses to cholera toxin. Proc Natl Acad Sci U S A. 1994;91:9655-9658. [PubMed] [DOI] |
| 13. | Gustafson C, Kald B, Sjödahl R, Tagesson C. Phospholipase C from Clostridium perfringens stimulates formation and release of platelet-activating factor (PAF-acether) in cultured intestinal epithelial cells (INT 407). Scand J Gastroenterol. 1991;26:1000-1006. [PubMed] [DOI] |
| 14. | Tan XD, Chang H, Qu XW, Caplan M, Gonzalez-Crussi F, Hsueh W. Platelet-activating factor increases mucosal permeability in rat intestine via tyrosine phosphorylation of E-cadherin. Br J Pharmacol. 2000;129:1522-1529. [PubMed] [DOI] |
| 15. | Wardle TD, Hall L, Turnberg LA. Platelet activating factor: release from colonic mucosa in patients with ulcerative colitis and its effect on colonic secretion. Gut. 1996;38:355-361. [PubMed] |
| 16. | Hsueh W, Caplan MS, Sun X, Tan X, MacKendrick W, Gonzalez-Crussi F. Platelet-activating factor, tumor necrosis factor, hypoxia and necrotizing enterocolitis. Acta Paediatr Suppl. 1994;396:11-17. [PubMed] [DOI] |
| 17. | Liu SX, Tian R, Baskind H, Hsueh W, De Plaen IG. Platelet-activating factor induces the processing of nuclear factor-kappaB p105 into p50, which mediates acute bowel injury in mice. Am J Physiol Gastrointest Liver Physiol. 2009;297:G76-G81. [PubMed] [DOI] |
| 18. | Wang H, Qu X, De Plaen IG, Hsueh W. Platelet-activating factor and endotoxin activate CCAAT/enhancer binding protein in rat small intestine. Br J Pharmacol. 2001;133:713-721. [PubMed] [DOI] |
| 19. | Tan X, Sun X, Gonzalez-Crussi FX, Gonzalez-Crussi F, Hsueh W. PAF and TNF increase the precursor of NF-kappa B p50 mRNA in mouse intestine: quantitative analysis by competitive PCR. Biochim Biophys Acta. 1994;1215:157-162. [PubMed] |
| 20. | Tan XD, Wang H, Gonzalez-Crussi FX, Chang H, Gonzalez-Crussi F, Hsueh W. Platelet activating factor and endotoxin increase the enzyme activity and gene expression of type II phospholipase A2 in the rat intestine. Role of polymorphonuclear leukocytes. J Immunol. 1996;156:2985-2990. [PubMed] |
| 21. | Wang H, Tan X, Chang H, Gonzalez-Crussi F, Remick DG, Hsueh W. Regulation of platelet-activating factor receptor gene expression in vivo by endotoxin, platelet-activating factor and endogenous tumour necrosis factor. Biochem J. 1997;322:603-608. [PubMed] |
| 22. | Duncan KR, Baker PN, Gowland PA, Issa B, Moore R, Worthington B, Johnson IR. Demonstration of changes in fetal liver erythropoiesis using echo-planar magnetic resonance imaging. Am J Physiol. 1997;273:G965-G967. [PubMed] |
| 23. | Youlyouz I, Magnoux E, Guglielmi L, Denizot Y. Expression of a splice variant of the platelet-activating factor receptor transcript 2 in various human cancer cell lines. Mediators Inflamm. 2002;11:329-331. [PubMed] [DOI] |
| 24. | Merendino N, Dwinell MB, Varki N, Eckmann L, Kagnoff MF. Human intestinal epithelial cells express receptors for platelet-activating factor. Am J Physiol. 1999;277:G810-G818. [PubMed] |
| 25. | Kindon H, Pothoulakis C, Thim L, Lynch-Devaney K, Podolsky DK. Trefoil peptide protection of intestinal epithelial barrier function: cooperative interaction with mucin glycoprotein. Gastroenterology. 1995;109:516-523. [PubMed] [DOI] |
| 26. | Hernández C, Santamatilde E, McCreath KJ, Cervera AM, Díez I, Ortiz-Masiá D, Martínez N, Calatayud S, Esplugues JV, Barrachina MD. Induction of trefoil factor (TFF)1, TFF2 and TFF3 by hypoxia is mediated by hypoxia inducible factor-1: implications for gastric mucosal healing. Br J Pharmacol. 2009;156:262-272. [PubMed] [DOI] |
| 29. | Carpenter CL. Actin cytoskeleton and cell signaling. Crit Care Med. 2000;28:N94-N99. [PubMed] |
| 30. | dos Remedios CG, Chhabra D, Kekic M, Dedova IV, Tsubakihara M, Berry DA, Nosworthy NJ. Actin binding proteins: regulation of cytoskeletal microfilaments. Physiol Rev. 2003;83:433-473. [PubMed] |
| 31. | Moriez R, Salvador-Cartier C, Theodorou V, Fioramonti J, Eutamene H, Bueno L. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats. Am J Pathol. 2005;167:1071-1079. [PubMed] [DOI] |
| 32. | Tazuke Y, Drongowski RA, Teitelbaum DH, Coran AG. The effect of hypoxia on permeability and bacterial translocation in Caco-2 adult and I-407 fetal enterocyte cell culture models. Pediatr Surg Int. 2003;19:316-320. |
| 33. | Kozar RA, Verner-Cole E, Schultz SG, Sato N, Bick RJ, Desoignie R, Poindexter BJ, Moore FA. The immune-enhancing enteral agents arginine and glutamine differentially modulate gut barrier function following mesenteric ischemia/reperfusion. J Trauma. 2004;57:1150-1156. [PubMed] [DOI] |
| 34. | Oshitani N, Watanabe K, Nakamura S, Fujiwara Y, Higuchi K, Arakawa T. Dislocation of tight junction proteins without F-actin disruption in inactive Crohn's disease. Int J Mol Med. 2005;15:407-410. [PubMed] |