修回日期: 2010-12-09
接受日期: 2010-12-21
在线出版日期: 2011-01-28
目的: 研究已酮可可碱(PTX)对重度失血性休克大鼠再灌注后肝损伤的影响, 并探讨其可能的作用机制.
方法: 48只SD大鼠随机分为4组: 对照组(C组)、单纯休克组(NR组)、乳酸林格氏液组(LR组)、乳酸林格氏液联合PTX组(LRPTX组). 复制重度失血性休克模型, 连续检测MAP的变化. LR及LRPTX组以3倍失血量LR/LRPTX(PTX 25 mg/kg)液复苏. 各组分别于休克前、休克1 h及复苏4 h时间点测谷丙转氨酶(ALT)及谷草转氨酶(AST). NR组在休克1 h处死大鼠, LR组、LRPTX组及C组在复苏4 h处死大鼠, 取肝组织检测TNF-α、NF-κB、巨噬细胞炎性蛋白-2(MIP-2)的蛋白表达及髓过氧化物酶(MPO)活性. 电镜及光镜下观察肝组织病理变化.
结果: 与C组比较, 各组大鼠休克1 h MAP (mmHg)降低(37.3±2.1, 37.0±2.0, 37.6±2.2 vs 106.0±2.6, 均P<0.05), 液体复苏后MAP上升, LR及LRPTX组复苏后3 h及4 h时间点, MAP(mmHg)下降(88.3±3.0, 87.6±4.3 vs 105.0±2.9; 69.0±2.0, 66.7±2.1 vs 102.1±1.1, 均P<0.05). 与C组比较, 其他各组血中AST(U/L)(142.0±8.3, 144.1±7.6, 147.2±8.1 vs 45.1±6.3; 427.0±12.5, 365.3±8.0 vs 51.1±6.3, 均P<0.01)及ALT(U/L)明显升高(86.3±7.8, 88.3±6.6, 89.1±5.9 vs 53.6±6.1; 342.9±4.7, 280.4±9.1 vs 50.6±7.6, 均P<0.05); 肝组织TNF-α、NF-κB及MIP-2的蛋白表达明显升高, MPO活性增加(均P<0.05), 肝组织病理学损伤明显; 与LR组比较, LRPTX组复苏后4 h血中AST及ALT明显降低(均P<0.05), TNF-α、NF-κB及MIP-2的蛋白含量明显下降, MPO活性降低(均P<0.05), 肝组织病理学损伤减轻.
结论: PTX通过减少TNF-α的释放, 抑制NF-κB的活化, 下调趋化因子的表达, 减轻失血性休克再灌注后肝组织损伤.
引文著录: 陆化梅, 耿智隆, 赵峰, 杨木强. 己酮可可碱对重度失血性休克大鼠再灌注后肝损伤的影响. 世界华人消化杂志 2011; 19(3): 227-232
Revised: December 9, 2010
Accepted: December 21, 2010
Published online: January 28, 2011
AIM: To investigate the effects of treatment with pentoxifylline (PTX) on ischemia/reperfusion-induced liver injury in rats with severe hemorrhagic shock.
METHODS: Forty-eight Sprague-Dawley rats were randomly and equally divided into four groups: control group, shock group (NR group), Lactated Ringer's (LR) solution-treated group (LR group), LR solution plus PTX group (LR-PTX group). A rat model of severe hemorrhagic shock was generated, and arterial blood pressure (MAP) was determined continuously. Blood specimens were collected before shock and 1 and 4 h after resuscitation for determination of serum AST and ALT levels. The rats of the NR group were killed 1 h after shock to collect liver samples. The rats of the LR and LR-PTX groups were resuscitated with LR and LR-PTX (25 mg/kg, three times the volume of shed blood), respectively, and then killed 4 h after resuscitation to collect liver samples to determine the expression of TNF-α, NF-κB and MIP-2 proteins and MPO activity. Liver injury was examined by light microscopy and electron microscopy.
RESULTS: Compared with the control group, MAP (mmHg) decreased significantly 1 h after shock in the other groups (37.3 ± 2.1, 37.0 ± 2.0, 37.6 ± 2.2 vs 106.0 ± 2.6, all P < 0.05). After resuscitation, MAP rose initially but decreased at 3 and 4 h in the LR and LR-PTX groups (88.3 ± 3.0, 87.6 ± 4.3 vs 105.0 ± 2.9; 69.0 ± 2.0, 66.7 ± 2.1 vs 102.1 ± 1.1, P < 0.05). Serum AST and ALT levels at 1 h after shock and 4 h after resuscitation in the NR, LR and LR-PTX groups were significantly higher than those in the control group (142.0 ± 8.3, 144.1 ± 7.6, 147.2 ± 8.1 vs 45.1 ± 6.3; 427.0 ± 12.5, 365.3 ± 8.0 vs 51.1 ± 6.3, all P < 0.01; 86.3 ± 7.8, 88.3 ± 6.6, 89.1 ± 5.9 vs 53.6 ± 6.1; 342.9 ± 4.7, 280.4 ± 9.1 vs 50.6 ± 7.6, all P < 0.05). The expression of NF-κB, TNF-α and MIP-2 proteins and MPO activity in the liver were significantly increased and pathologic injury was more significant in the NR, LR and LR-PTX groups compared with the control group (all P < 0.05). Compared with the LR group, serum AST and ALT levels at 4 h after resuscitation were significantly lower in the LR-PTX group (P < 0.05). The expression levels of NF-κB, TNF-α and MIP-2 proteins and MPO activity in the liver were significantly lower (all P < 0.05) and pathologic injury was milder in the LR-PTX group than in the LR group.
CONCLUSION: Treatment with PTX can protect against ischemia/reperfusion-induced liver injury in rats with severe hemorrhagic shock by inhibiting TNF-α release and NF-κB activation and decreasing the expression of inflammatory mediators.
Key Words: Hemorrhagic shock; Liver injury; Resuscitation; Pentoxifylline
- Citation: Lu HM, Geng ZL, Zhao F, Yang MQ. Treatment with pentoxifylline reduces ischemia/reperfusion-induced liver injury in rats with severe hemorrhagic shock. Shijie Huaren Xiaohua Zazhi 2011; 19(3): 227-232
- URL: https://www.wjgnet.com/1009-3079/full/v19/i3/227.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i3.227
失血性休克及液体复苏所导致的细胞损伤、细胞因子过度释放是全身炎症反应(systemic inflammatory response syndrome, SIRS)、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、以及多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的主要病理生理基础[1,2]. 目前, 临床上用于失血性休克复苏的溶液, 各有其优缺点, 能够恢复器官灌注、维持组织氧供, 又不加重细胞损伤及诱发激烈免疫反应的理想液体尚无[3,4]. 因此, 早期采取有效的复苏策略(既联合应用细胞保护的药物)比损伤后再企图免疫调节来减轻细胞损伤的观点, 已成为当今失血性休克研究的热点[5,6]. 己酮可可碱(pentoxifylline, PTX)属黄嘌呤衍生物, 是非选择性磷酸二酯酶抑制剂, 近年来有研究表明[7,8]其有选择性抗炎作用, 尤其对缺血再灌注后肺、肠损伤有一定的抑制作用, 但其是否对失血性休克再灌注后肝损伤具有抑制作用及可能的作用机制目前尚未完全阐明. 本研究通过建立重度失血性休克大鼠模型, 观察乳酸林格氏液联合PTX复苏对肝脏损伤后炎症因子及超微结构变化的影响, 探讨PTX对重度失血性休克再灌注后肝损伤的影响和其可能机制.
健康成年♂SD大鼠48只, 体质量280-320 g, 购于甘肃省中医学院动物实验中心. 实验前适应性饲养5 d, 环境温度控制在22 ℃-26 ℃, 湿度控制在40%-70%, 自由进食饮水, 每12 h昼夜交替1次.
1.2.1 造模: 实验前12 h禁食, 自由饮水. 实验当日, 实验室温度控制在22 ℃-26 ℃, 经腹腔给予3%戊巴比妥钠(50 mg/kg)麻醉, 右股动脉插管监测平均动脉压(mean arterial pressure, MAP)和放血, 右股静脉插管用于输液. 所有导管均用7.5 kU/L的肝素生理盐水预充. 术毕, 按500 U/kg给予全身肝素化处理. 动物稳定10 min, 待生命体征平稳. 采用改良Wiggers等[9]的方法复制失血性休克模型. 经右侧股动脉导管放血, 30 min内使MAP降低至35 mmHg, 通过放血或自体血回输维持MAP 35 mmHg±5 mmHg水平60 min, 复制重度失血性休克模型. 实验全程动物保持自主呼吸, 肛温控制在37 ℃±0.5 ℃.
1.2.2 复苏方案及分组: 采用随机数字表法将实验动物分为4组, 分别为对照组(C组12只)、单纯休克组(NR组12只)乳酸林格液(安徽环球药业股份有限公司生产)复苏组(LR组12只)、乳酸林格液复合己酮可可碱(开封康诺药业有限公司)复苏组(LRPTX组12只). C组动物只麻醉, 右股动静脉置管, 不放血, 不复苏; LR、LRPTX组动物麻醉后, 右股动静脉置管, 复制重度失血性休克模型, NR组动物麻醉后, 右股动静脉置管, 复制重度失血性休克模型, 休克1 h后处死, 取肝组织保存. LR及LRPTX(PTX按照25 mg/kg加入液体)组动物在休克1 h后经以右股静脉给予3倍失血量RL/LRPTX液复苏, 20 min内恒速输入, C组、LR组及LRPTX组(复苏液恒速输注完毕后)给予生理盐水6 mL/(kg•h)维持输注4 h.
1.2.2 指标检测: (1)静脉血AST、ALT检测: 在休克前(基础值)、复苏前(休克1 h即刻)及复苏后4 h时间点从股静脉抽血1 mL, 抽血同时以等量血回输, 血液4 ℃ 3 000 r/min 离心15 min, 取上清液采用紫外分光光度计测量AST、ALT的活性; (2)肝组织TNF-α、NF-κB蛋白含量测定: NR组在休克1 h即刻, 其余各组在复苏后4 h时间点, 采用穿刺心脏法处死大鼠, 取左叶部分肝组织, 用40 g/L多聚甲醛固定后常规石蜡包埋并做肝组织切片, 采用免疫组织化学S-P法染色, 检测肝组织中TNF-α和NF-κB(试剂盒购自美国R&D公司)的蛋白表达. 全自动图像分析系统分析阳性染色, 测定TNF-α和NF-κB阳性表达的吸光度值, 随机选择5个视野, 取其平均值反应TNF-α和NF-κB蛋白表达; (3)肝组织巨噬细胞炎性蛋白2(macrophage inflammatory protein-2, MIP-2)、髓过氧化物酶(myeloperoxidase, MPO)测定: NR组在休克1 h即刻, 其余各组在复苏后4 h时间点, 处死大鼠取新鲜左叶肝组织100 mg, 制备肝组织匀浆, 采用比色法测定肝组织中MPO的含量[10]; 采用ELISA双抗夹心法测定MIP-2蛋白含量[11]; (4)肝组织病理学观察: NR组在休克1 h即刻, 其余各组在复苏后4 h时间点, 处死大鼠, 取左叶部分肝组织, 用40 g/L的甲醛固定, 经脱水、石蜡包埋、切片, 行苏木素-伊红(HE)染色, 光镜下观察肝组织病理学变化. 取0.1 cm×0.1 cm×0.1 cm左叶肝组织, 立即置于2.5%的戊二醛溶液中, 常规电镜制作, 透射电镜下观察肝细胞超微结构改变.
统计学处理 应用SPSS11.0统计学软件进行统计学分析, 计量资料以mean±SD表示, 组间比较采用单因素方差分析, 两两比较采用SNK法. 组内不同时间点比较采用重复测量的方差分析, P<0.05为差异有统计学意义.
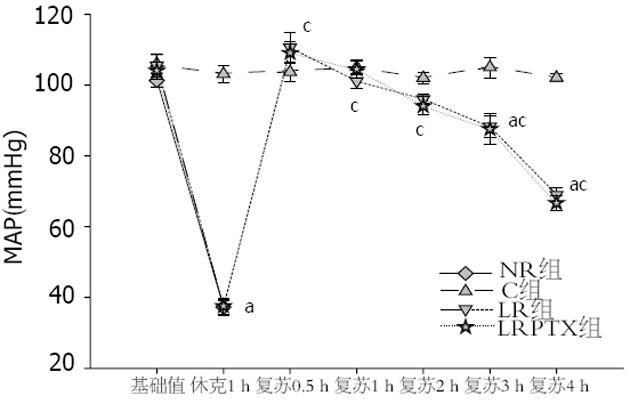
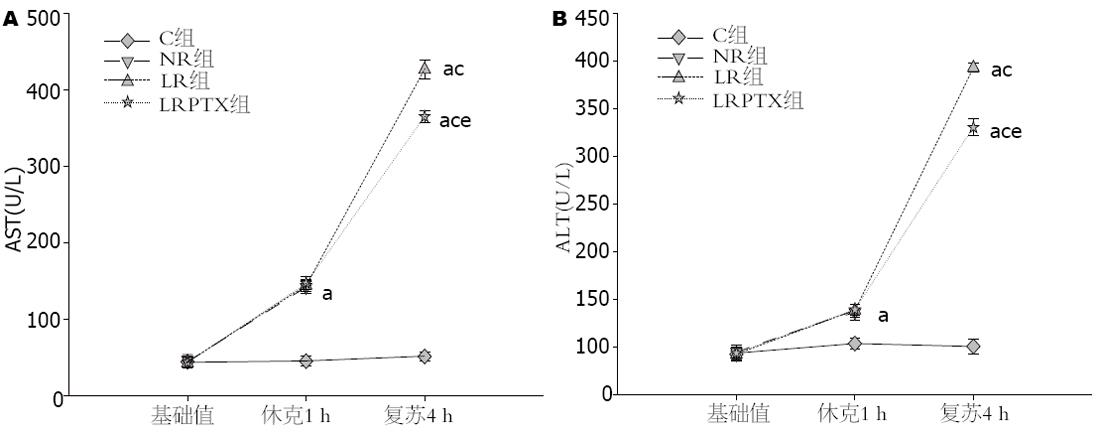
各组大鼠MAP基础值比较差异无统计学意义. 与C组比较, 各组休克1 h时间点MAP(mmHg)降低(37.3±2.1, 37.0±2.0, 37.6±2.2 vs 106.0±2.6, 均P<0.05), LR组及LRPTX组复苏3、4 h时间点MAP下降(88.3±3.0, 87.6±4.3 vs 105.0±2.9; 69.0±2.0, 66.7±2.1 vs 102.1±1.1, 均P<0.05, 图1). 与同组内休克1 h即刻时间点比较, LR及LRPTX复苏后各时间点, MAP上升(P<0.05). LR组与LRPTX组组间比较各时间点MAP无明显变化(P>0.05); 血中AST、ALT的变化(图2): 与C组比较, 其余3组在休克1 h即刻及复苏后4 h时间点血中AST、ALT升高(AST: 142.0±8.3, 144.1±7.6, 147.2±8.1 vs 45.1; 427.0±12.5, 365.3±8.0 vs 51.1±6.3, 均P<0.05; ALT: 86.3±7.8, 88.3±6.6, 89.1±5.9 vs 53.6±6.1; 342.9±4.7, 280.4±9.1 vs 50.6±7.6, 均P<0.05); 与同组内休克1 h即刻时间点比较, LR及LRPTX复苏后4 h血中AST(U/L)、ALT(U/L)升高(P<0.05); 与LR比较, LRPTX复苏后4 h血中AST、ALT降低(P<0.05).
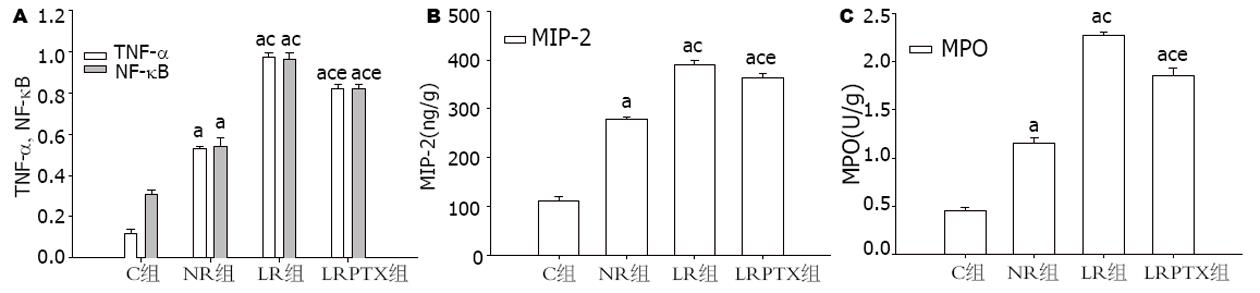
与C组比较, 各组NF-κB、TNF-α、MIP-2(μg/L)及MPO(U/g)明显升高(0.54±0.04, 0.96±0.63, 0.82±0.02 vs 0.31±0.02; 0.53±0.01, 0.97±0.02, 0.82±0.02 vs 0.12±0.02; 279.17±4.88, 389.89±8.22, 364.01±7.27 vs 111.57; 1.15±0.06, 2.27±0.04, 1.86±0.07 vs 0.46±0.03, 均P<0.05); 与NR比较, LR及LRPTX组NF-κB、TNF-α、MIP-2及MPO明显升高(P<0.05, 图3); 与LR组比较, LRPTX组各指标明显降低(P<0.05).
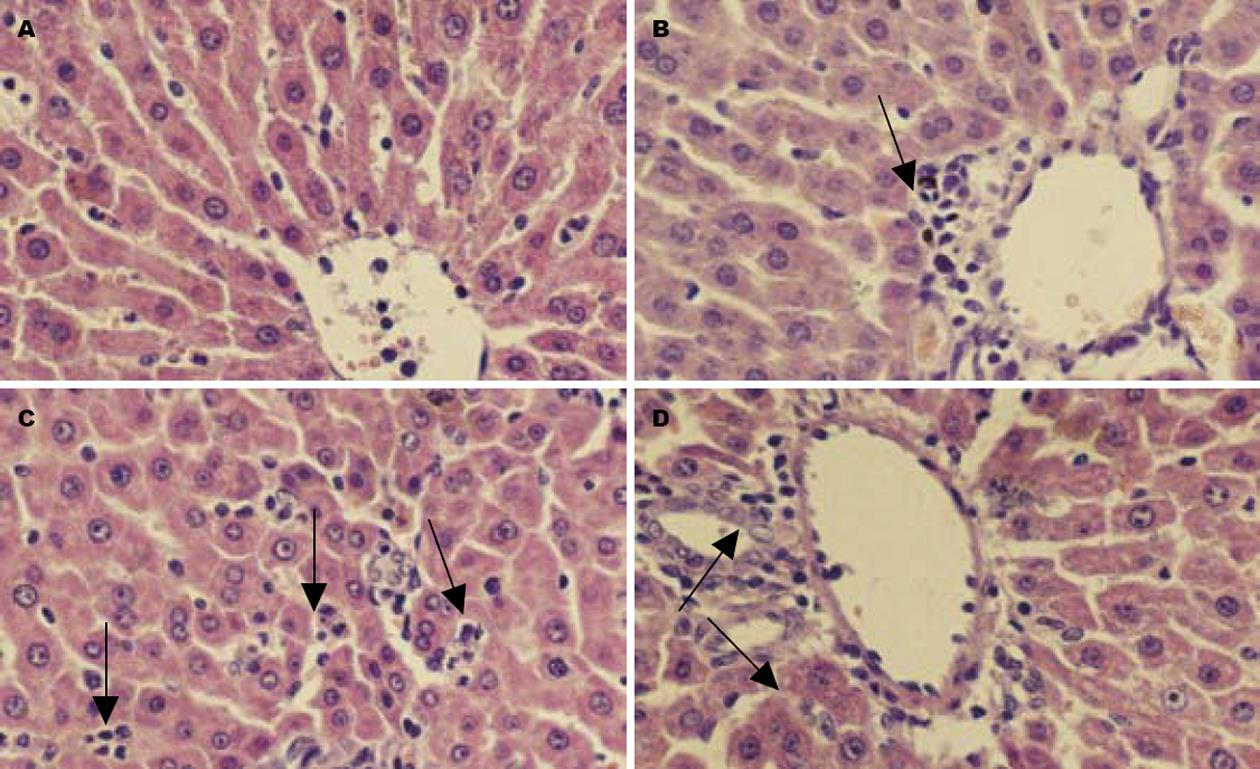
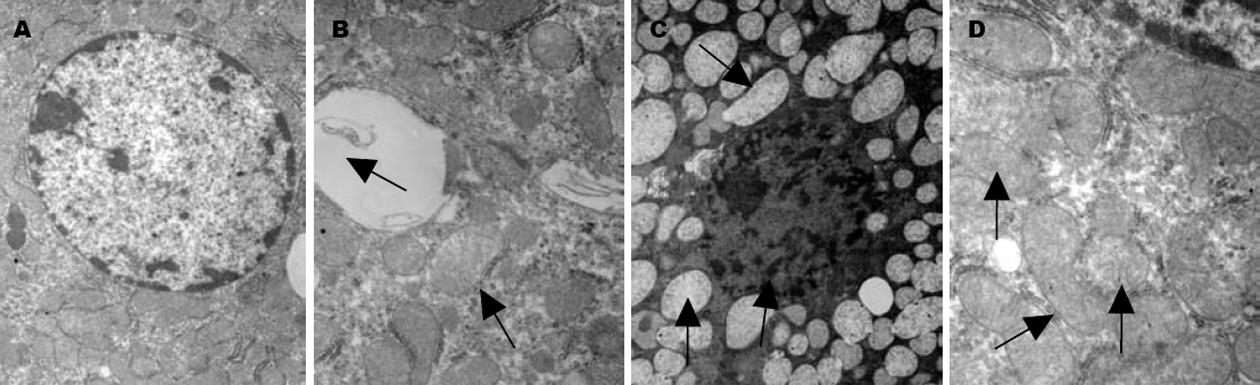
光镜下观察(图4): C组可见肝索排列整齐, 肝窦形态正常, 肝细胞边界清楚、形态正常; NR组, 肝小叶细胞轻微肿胀, 肝窦基本正常部分肝细胞边界不清, 血管周围有炎性细胞浸润. LR组肝索排列部分紊乱, 肝窦间隙明显狭窄, 肝细胞肿胀, 部分肝细胞空泡变性, 局灶性肝细胞坏死; LRPTX组, 肝细胞肿胀, 肝窦形态基本正常, 部分肝细胞边界不清, 偶有肝细胞固缩, 汇管区有炎性细胞浸润. 电镜下(图5)可见C组肝细胞超微结构基本正常, 未见肿胀, 细胞核结构完整, 线粒体脊完整, 粗面内质网结构完整, 排列整齐; NR细胞线粒体轻微肿胀, 线粒体嵴疏松, 毛细胆管有少量胆汁淤积; LR组肝细胞染色质边集, 核膜溶解, 线粒体肿胀明显, 大量空泡形成, 局灶性肝细胞溶解坏死; LRPTX组肝细胞, 线粒体仍有肿胀, 空泡形成少.
本实验参照文献[5,6]选用25 mg/kg作为PTX应用剂量, 联合LR复苏重度失血性休克大鼠, 结果显示, 液体复苏后, 大鼠MAP显著升高, 尽管复苏后3 h MAP有所下降, 但仍能满足组织灌注[12,13]. 然而LR组及LRPTX组复苏后4 h时间点血浆中AST、ALT含量较NR组(休克1 h时间点)明显升高; 光镜及电镜观察显示LR组及LRPTX组肝组织损伤较NR组明显. 国内周虹等的研究[14]显示出血性休克再灌注后肺、肾、心脏组织中MDA含量及病理损伤明显较单纯休克重. 国外研究[15,16]也显示: 失血性休克液体复苏后肺组织中性粒细胞聚集明显较单纯休克多, 组织损伤较单纯休克严重. 本实验中大鼠经历1 h出血性休克在液体复苏前虽已导致肝功能及肝组织结构受损, 但液体复苏后, 大鼠肝功能受损更为明显. 而与LR组比较, LRPTX组AST、ALT含量显著降低, 肝组织损伤明显减轻, 说明早期联合应用PTX可减轻失血性休克再灌注后肝组织的损伤程度.
目前认为TNF-α是失血性休克炎症反应的启动因子, 可上调其他因子的产生[4,17]. 肝脏含有人体大约80%的单核/巨噬细胞, 是细胞因子的产地和储库, 失血性休克及液体再灌注可刺激肝组织分泌大量的TNF-α等细胞因子[18]. 这些因子一方面可使循环中的中性粒细胞在肝组织内趋化、黏附聚集、活化进而损伤肝细胞; 另一方面可以通过血液循环影响肺脏和其他器官; 其次还能随胆汁分泌到肠道加重肠道的损伤[19]. NF-κB是一种细胞内普遍存在的转录因子, 具有和多种细胞因子基因启动子区域固定核苷酸序列结合而启动基因转录的功能, 正常情况下与其抑制物IκB结合, 存在于静止期细胞的胞浆中. 当诱导因子TNF-α等刺激时, IκB磷酸化而被降解, NF-κB二聚体被激活, 进入细胞核内, 和多种细胞因子基因启动子结合, 诱导基因转录, 参与组织损伤[20]. 本研究结果显示, 与LR组比较, LRPTX组TNF-α、NF-κB的表达下降, MPO活性降低; 肝索排列基本正常, 肝窦间隙正常, 肝细胞线粒体肿胀减轻且空泡形成减少. 说明PTX通过抑制炎性因子TNF-α、NF-κB的生成, 阻止其之间的循环, 减轻失血性休克再灌注后肝脏损伤. 其作用机制为: (1)PTX抑制磷酸二酯酶活性, 引起细胞内cAMP浓度升高, 直接抑制TNF-α的生成[7,8]; (2)PTX活化cAMP依赖的PKA, 抑制NF-κB与其抑制物IκB解离, 从而抑制NF-κB进入核内, 和基因启动子结合, 诱导基因转录[21].
MIP-2是以中性粒细胞为特定靶细胞的趋化因子, 关于MIP-2的产生机制目前还不清楚. Lentsh等[19]在鼠肝缺血再灌注损伤中观察到MIP-2与TNF-α的变化正相关, 用抑制剂预处理后显著减少了MIP-2、TNF-α蛋白的表达. Hehlgans等[20,23]在鼠的纤维肉瘤细胞中发现, MIP-2的分泌是NF-κB依赖性的, MIP-2具有NF-κB的结合位点. 本研究结果显示, 与LR组比较, LRPTX组MIP-2的表达下降, MPO活性降低, 其机制可能是PTX通过减少TNF-α生成, 抑制NF-κB的活化, 减少活化的NF-κB进入核内与MIP-2基因启动子区域的固定核苷酸序列结合, 进一步减少MIP-2的合成.
总之, 在液体复苏早期联合应用PTX能够从炎症反应上游阻断损伤放大作用的共同传导途径, 显著减轻重度失血性休克大鼠再灌注后肝损伤. 但是本实验观察时间较短, 许多方面尚有待进一步研究.
肝脏是人体各种物质代谢、能量转换及供应的枢纽和主导器官, 也是应激条件下代谢最为活跃的器官, 失血性休克后肝组织损伤, 可产生大量的细胞因子如TNF-α等, 这些因子一方面可使循环中的中性粒细胞在肝内趋化、黏附聚集、活化进而损伤肝细胞; 另一方面可以通过血液循环影响肺脏和其他器官; 其次还能随胆汁分泌到肠道加重肠道的损伤. 肝组织损伤程度对失血性休克后SIRS、MODS的发生、发展有重要的意义.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院急诊外科
目前, 临床上用于失血性休克复苏的溶液, 各有其优缺点, 能有效改善失血性休克后液体再灌注导致的细胞损伤和炎症反应的理想液体尚无. 因此, 早期采取有效的复苏策略(既联合应用细胞保护的药物)比损伤后再企图免疫调节来减轻细胞损伤的观点, 已成为当今失血性休克研究的热点.
己酮可可碱非选择性磷酸二酯酶抑制剂, 有研究表明其有选择性抗炎作用, 尤其对缺血再灌注后肺、肠损伤有一定的保护作用, 能抑制中性粒细胞在肺、肠内积聚, 降低炎性介质的生成等.
本研究通过复制重度失血性休克动物模型, 观察液体复苏早期联合应用已酮可可碱对肝组织损伤的影响, 探讨其可能的作用机制.
本研究证实液体复苏后肝组织出现明显的损伤, PTX能够抑制炎症因子的释放, 从而降低肝损伤, 为临床应用提供实验依据.
本文选题恰当, 为已酮可可碱在临床上的应用奠定了实验基础, 有一定的临床参考价值.
编辑: 李薇 电编:李薇
| 1. | Bilkovski RN, Rivers EP, Horst HM. Targeted resuscitation strategies after injury. Curr Opin Crit Care. 2004;10:529-538. [PubMed] [DOI] |
| 2. | Yao YM, Redl H, Bahrami S, Schlag G. The inflammatory basis of trauma/shock-associated multiple organ failure. Inflamm Res. 1998;47:201-210. [PubMed] [DOI] |
| 3. | Nascimento P Jr, de Paiva Filho O, de Carvalho LR, Braz JR. Early hemodynamic and renal effects of hemorrhagic shock resuscitation with lactated Ringer's solution, hydroxyethyl starch, and hypertonic saline with or without 6% dextran-70. J Surg Res. 2006;136:98-105. [PubMed] [DOI] |
| 4. | Alam HB, Rhee P. New developments in fluid resuscitation. Surg Clin North Am. 2007;87:55-72, vi. [PubMed] [DOI] |
| 5. | Santry HP, Alam HB. Fluid resuscitation: past, present, and the future. Shock. 2010;33:229-241. [PubMed] [DOI] |
| 6. | Boomer L, Jones W, Davis B, Williams S, Barber A. Optimal fluid resuscitation: timing and composition of intravenous fluids. Surg Infect (Larchmt). 2009;10:379-387. [PubMed] [DOI] |
| 7. | Deree J, de Campos T, Shenvi E, Loomis WH, Hoyt DB, Coimbra R. Hypertonic saline and pentoxifylline attenuates gut injury after hemorrhagic shock: the kinder, gentler resuscitation. J Trauma. 2007;62:818-827; discussion 827-828. [PubMed] [DOI] |
| 8. | Deree J, Martins JO, Leedom A, Lamon B, Putnam J, de Campos T, Hoyt DB, Wolf P, Coimbra R. Hypertonic saline and pentoxifylline reduces hemorrhagic shock resuscitation-induced pulmonary inflammation through attenuation of neutrophil degranulation and proinflammatory mediator synthesis. J Trauma. 2007;62:104-111. [PubMed] [DOI] |
| 9. | Wiggers HC, Ingraham RC. Hemorrhagic shock; definition and criteria for its diagnosis. J Clin Invest. 1946;25:30-36. [PubMed] [DOI] |
| 10. | Hei ZQ, Huang HQ, Zhang JJ, Chen BX, Li XY. Protective effect of Astragalus membranaceus on intestinal mucosa reperfusion injury after hemorrhagic shock in rats. World J Gastroenterol. 2005;11:4986-4991. [PubMed] |
| 11. | Liu C, Li A, Weng YB, Duan ML, Wang BE, Zhang SW. Changes in intestinal mucosal immune barrier in rats with endotoxemia. World J Gastroenterol. 2009;15:5843-5850. [PubMed] [DOI] |
| 12. | Vincenzi R, Cepeda LA, Pirani WM, Sannomyia P, Rocha-E-Silva M, Cruz RJ Jr. Small volume resuscitation with 3% hypertonic saline solution decrease inflammatory response and attenuates end organ damage after controlled hemorrhagic shock. Am J Surg. 2009;198:407-414. [DOI] |
| 13. | Wang P, Li Y, Li J. Hydroxyethyl starch 130/0.4 prevents the early pulmonary inflammatory response and oxidative stress after hemorrhagic shock and resuscitation in rats. International Immunopharmacology. 2009;9:347-353. [DOI] |
| 15. | Alama HB, Stanton K, Koustova E, Burris D, Rich N, Rhee P. Effect of different resuscitation strategies on neutrophil activation in a swine model of hemorrhagic shock. Resuscitation. 2004;60:91-99. [PubMed] [DOI] |
| 16. | Hierholzer C, Billiar TR. Molecular mechanisms in the early phase of hemorrhagic shock. Langenbecks Arch Surg. 2001;386:302-308. [PubMed] [DOI] |
| 17. | Lehnert M, Arteel GE, Smutney OM, Conzelmann LO, Zhong Z, Thurman RG, Lemasters JJ. Dependence of liver injury after hemorrhage/resuscitation in mice on NADPH oxidase-derived superoxide. Shock. 2003;19:345-351. [PubMed] [DOI] |
| 18. | Lee CC, Chang IJ, Yen ZS, Hsu CY, Chen SY, Su CP, Chiang WC, Chen SC, Chen WJ. Delayed fluid resuscitation in hemorrhagic shock induces proinflammatory cytokine response. Ann Emerg Med. 2007;49:37-44. [PubMed] [DOI] |
| 19. | Lentsch AB, Yoshidome H, Cheadle WG, Miller FN, Edwards MJ. Chemokine involvement in hepatic ischemia/reperfusion injury in mice: roles for macrophage inflammatory protein-2 and Kupffer cells. Hepatology. 1998;27:507-512. [PubMed] [DOI] |
| 20. | Hehlgans T, Müller P, Stopfer P, Männel DN. Activation of the lymphotoxin-beta receptor induces NFkappaB-dependent interleukin-6 and MIP-2 secretion in mouse fibrosarcoma cells. Eur Cytokine Netw. 2003;14:103-107. [PubMed] |