修回日期: 2011-10-12
接受日期: 2011-10-14
在线出版日期: 2011-10-18
目的: 研究c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路在慢性乙型肝炎患者外周血单个核细胞(peripheral blood mononuclear cells, PBMC)激活诱导细胞死亡(activation induced cell death, AICD)过程中的作用.
方法: 选取慢性乙型肝炎患者40例, 采用完全随机化方法随机分为2组, 慢性乙肝组(n = 20), 慢性乙肝+抑制剂组(n = 20), 选取健康对照组(n = 20). 体外分离培养PBMC, 模拟细胞在体内的AICD过程, 其中慢性乙肝+抑制剂组在重新刺激凋亡前用JNK特异性抑制剂SP600125 20 μmol/L预处理2 h. 应用Western blot检测各组中磷酸化JNK(p-JNK)、总JNK、磷酸化c-jun(p-c-jun)、Bim(bcl-2 interacting mediator of cell death)的表达, 流式细胞术检测PBMC凋亡.
结果: 慢性乙肝组PBMC凋亡率高于健康对照组, 也高于慢性乙肝+抑制剂组, 差异有统计学意义(P<0.05). 慢性乙肝+抑制剂组PBMC凋亡率高于健康对照组, 差异有统计学意义(P<0.05). 慢性乙肝组p-JNK的表达高于健康对照组(t = 5.885, P<0.01), 也高于慢性乙肝+抑制剂组(t = 11.502, P<0.01). 总JNK在三个组的表达无统计学差异. 慢性乙肝组p-c-jun的表达高于健康对照组(t = 5.477, P<0.01), 也高于慢性乙肝+抑制剂组(t = 12.899, P<0.01). 慢性乙肝组Bim的表达高于健康对照组(t = 9.133, P<0.01), 也高于慢性乙肝+抑制剂组(t = 10.086, P<0.01). 慢性乙肝组PBMC凋亡率与p-JNK蛋白的表达成正相关(r = 0.823, P<0.01).
结论: JNK信号通路参与介导了慢性乙型肝炎患者PBMC的AICD过程, 是其凋亡增多的机制之一.
引文著录: 侯炳旭, 冯丽英. JNK信号通路在慢性乙型肝炎患者外周血单个核细胞中的活化. 世界华人消化杂志 2011; 19(29): 3075-3080
Revised: October 12, 2011
Accepted: October 14, 2011
Published online: October 18, 2011
AIM: To study the role of the JNK signal pathway in activation-induced cell death (AICD) in peripheral blood mononuclear cells (PBMC) from patients with chronic hepatitis B (CHB).
METHODS: Forty CHB patients were randomly and equally divided into two groups: CHB group and CHB+inhibitor group. The normal control group was composed of twenty healthy blood donors. PBMC were isolated, cultured in vitro, and used to stimulate AICD. The CHB+inhibitor group was pretreated with the JNK specific inhibitor SP600125(20 μmol/L) for 2 h before re-stimulation of apoptosis. The expression of p-JNK, total JNK, p-c-Jun and Bim proteins was detected by Western blot, and the apoptosis of PBMC was measured by flow cytometry.
RESULTS: The apoptosis rate of PBMC was significantly higher in the CHB+inhibitor group than in the healthy control group, and in the CHB group than in the healthy control group and CHB+inhibitor group (all P < 0.05). The expression of p-JNK, p-c-Jun and Bim was significantly higher in the CHB group than in the healthy control group and in the CHB+inhibitor group (all P < 0.01). No significant differences were observed in the expression of total JNK among the three groups. The apoptosis rate of PBMC had positive correlation with the expression of p-JNK in CHB patients (r = 0.823, P < 0.01).
CONCLUSION: The JNK signal pathway is involved in mediating AICD in PBMC from CHB patients.
- Citation: Hou BX, Feng LY. Role of the JNK signal pathway in activation-induced cell death in PBMC from patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2011; 19(29): 3075-3080
- URL: https://www.wjgnet.com/1009-3079/full/v19/i29/3075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i29.3075
乙型肝炎病毒(hepatitis B virus, HBV)易致慢性化感染, 但其慢性化机制尚不完全清楚. 近年来有研究发现慢性乙型肝炎(chronic viral hepatitis B, CHB患者存在淋巴细胞的激活诱导细胞死亡(activation induced cell death, AICD)过多的现象[1-3], 并认为可能是导致HBV持续慢性感染的一个重要因素[3]. 因此如何通过调节AICD来减少淋巴细胞凋亡, 改善CHB患者的细胞免疫功能, 将是打破免疫耐受状态、清除体内HBV的可能途径. 但是目前关于CHB患者淋巴细胞发生AICD的机制尚未完全阐明. c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路能介导多种胞外刺激诱导的细胞凋亡, 参与了许多细胞凋亡的发生[4]. 近年来研究证明JNK信号通路参与介导了多种疾病(流感、人类黑色素瘤等)淋巴细胞的AICD过程[5,6]. 但是关于JNK信号通路是否也参与介导了CHB患者淋巴细胞的AICD过程还未见报道. 为此我们以CHB患者外周血单个核细胞(peripheral blood mononuclear cells, PBMC)为研究对象, 体外模拟AICD过程[7], 观察应用JNK特异性抑制剂SP600125前后PBMC中磷酸化JNK(p-JNK)、总JNK及其下游转录因子磷酸化c-jun(p-c-jun)和下游蛋白Bim(bcl-2 interacting mediator of cell death)的表达及PBMC凋亡率的变化, 研究JNK信号通路在CHB患者外周血单个核细胞AICD过程中的作用, 进一步探讨AICD发生的机制, 为CHB的治疗提供理论依据.
选取河北医科大学第二医院住院及门诊慢性乙型肝炎患者共40例, 其中男性22例, 女性18例, 年龄在18-60岁, 平均年龄35岁. 采用完全随机化方法随机分为2组, 慢性乙肝组20例, 慢性乙肝+抑制剂组20例. 所有病例诊断标准均符合2005年中华医学会制定的"慢性乙型肝炎防治指南", 乙型肝炎标志物HBsAg阳性、HBeAg或抗-HBe阳性和抗-HBc阳性, 1×103 copies/mL<HBV DNA<1×107 copies/mL, ALT 2倍以上升高. 排除HAV、HCV、HDV、HEV和HIV感染, 排除近3 mo应用糖皮质激素、干扰素等影响免疫功能药物的患者, 除外有近期急性感染患者. 健康对照组20例, 男12例, 女8例, 年龄在18-45岁, 平均年龄30岁, 取自健康献血员, 签署知情同意书. 植物血凝素PHA(石家庄华瑞公司); 1640培养液(北京索莱宝科技有限公司); 淋巴细胞分离液(北京鼎国公司); 注射用白介素-2(北京双鹭药业公司); 抗人的CD3抗体(美国Biolegend公司); 胎牛血清(杭州四季青生物制品公司); 兔抗p-JNK单克隆抗体、兔抗Bim多克隆抗体(美国Bioworld公司); 兔抗JNK多克隆抗体、兔抗p-c-jun多克隆抗体、兔抗GAPDH多克隆抗体、抗兔IgG(二抗)、SP600125(美国Santa Cruz公司); WB细胞裂解液(石家庄华瑞公司); 碘化丙啶PI(美国Sigma公司).
1.2.1 PBMC的制备: 采用密度梯度离心法进行PBMC提取, 无菌条件下抽取肝素抗凝静脉血4 mL, 用4 mL生理盐水使血液等体积稀释. 离心管中加人淋巴细胞分离液4 mL, 将离心管倾斜45 ℃, 将稀释血液在距淋巴细胞分离液界面上1 cm处沿试管壁加至分离液面上, 保持将离心管放置于水平式离心机内, 在18 ℃-20 ℃, 以2 000 r/min离心20 min, 混合液分为4层. 离心后用毛细吸管插人灰白色层液面析出层内细胞混合物, 移入另一离心管中. 用5倍体积的生理盐水洗涤2次, 每次2 000 r/min, 10 min. 用RPMI-1640培养液定容细胞, 计数细胞后再调整细胞至1×106个/mL单个核细胞. 用台盼蓝染液检查所分离的细胞活性, 取2滴细胞悬液加1滴2%台盼蓝, 3-5 min后取样作湿片高倍镜检, 活细胞不着色, 死细胞染成蓝色. 计数200个细胞, 计算活细胞百分率, 活性在95%以上.
1.2.2 PBMC的培养: 将分离获得的PBMC, 加入25 cm2培养瓶中, 静置2 h, 除去贴壁细胞, 用含100 mL/L胎牛血清的RMPI 1640培养基进行培养, PBMC浓度为1×106个细胞/mL. 培养液中加入PHA, PHA终浓度为100 μg/mL, 置37 ℃, 50 mL/L CO2培养箱培养, 16-18 h后, 用生理盐水清洗3遍, 洗净培养液中的PHA, 加入外源性IL-2 1000 kU/L进行培养, 每3 d更换培养基, 培养至少7 d. 用500 mg/L CD3抗体重新刺激PBMC 48 h后, 收集细胞. 其中慢性乙肝+抑制剂组在加抗CD3抗体前用JNK特异性抑制剂SP600125 20 μmol/L 预处理2 h.
1.2.3 流式细胞术检测细胞凋亡: 700 mL/L预冷的乙醇固定细胞, 4 ℃过夜. 离心2 000 r/min, 5 min, 去掉固定液, 并用冷PBS洗2次, 加入Rnase A 100 μL, 37 ℃ 30 min后加入PI染液900 μL, 4 ℃避光静置30 min后上流式细胞仪检测细胞周期, 以Gl峰左侧出现亚二倍体细胞群的峰形者为凋亡细胞群. 每次计数105个细胞, 计算细胞凋亡率.
1.2.4 Western blot检测PBMC中p-JNK、总JNK、p-c-jun、Bim蛋白的表达: 提取总蛋白, 测蛋白含量, 按每孔100 µg计算样品蛋白上样量. 行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳, 用PVDF膜进行冰浴转膜, 取出膜用5%脱脂奶粉4 ℃封闭过夜. 在4 ℃一抗(1:500)反应过夜, 二抗(1:5 000)室温封闭2 h. 暗室中滴加ECL试剂行曝光、显影和定影. 采用美国Image JA软件对Westernblot结果进行定量分析, 灰度值以累积吸光度(IA)表示, 结果以目的蛋白与GAPDH的IA值的比值表示.
统计学处理 用SPSS17.0软件进行统计分析. 计量资料数据均以mean±SD表示, 2组间均数差异性比较采用t检验, 3组间均数差异性比较采用SNK-q检验. 两指标之间的相关性采用pearson法进行直线相关分析. P<0.05即认为有统计学意义.
分离的PBMC, 用台盼蓝染液检查细胞活性: 计数200个细胞,活细胞百分率在95%以上. 镜下可见花团状的细胞团说明细胞激活增殖(图1).
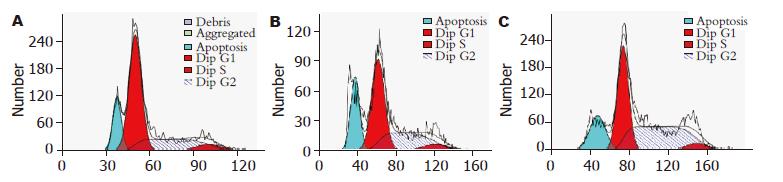
慢性乙肝组患者PBMC凋亡率(28.27%±4.61%)高于健康对照组(19.36%±5.90%), 差异有统计学意义(P<0.05), 也高于慢性乙肝+抑制剂组(23.37%±5.52%), 差异有统计学意义(P<0.05). 慢性乙肝+抑制剂组PBMC凋亡率(23.37%±5.52%)高于健康对照组(19.36%±5.90%), 差异有统计学意义(P<0.05, 图2).
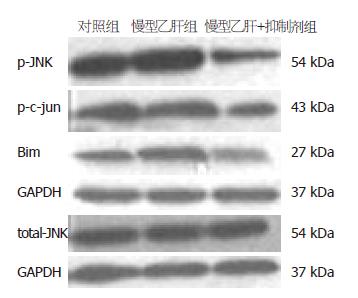
Western blot显示在大约54 kDa位置出现p-JNK特异性条带, 54 kDa位置出现总JNK特异性条带, 43 kDa位置出现p-c-jun特异性条带, 27 kDa位置出现Bim特异性条带, 在37 kDa位置出现GAPDH条带, 经Image JA软件灰度扫描并与内参比较分析显示: 慢性乙肝组p-JNK蛋白的表达量高于健康对照组(1.09±0.16 vs 0.83±0.12, t = 5.885, P<0.01), 也高于慢性乙肝+抑制剂组(1.09±0.16 vs 0.53±0.15, t = 11.502, P<0.01), 差异有统计学意义. 总JNK蛋白在3个组的表达差异无统计学意义. 慢性乙肝组p-c-jun蛋白的表达量高于健康对照组(1.21±0.15 vs 0.96±0.13, t = 5.477, P<0.01), 也高于慢性乙肝+抑制剂组(1.21±0.15 vs 0.62±0.14, t = 12.899, P<0.01), 差异有统计学意义. 慢性乙肝组Bim蛋白的表达量高于健康对照组(0.96±0.14 vs 0.58±0.12, t = 9.133, P<0.01), 也高于慢性乙肝+抑制剂组(0.96±0.14 vs 0.52±0.13, t = 10.086, P<0.01), 差异有统计学意义(图3和表1).
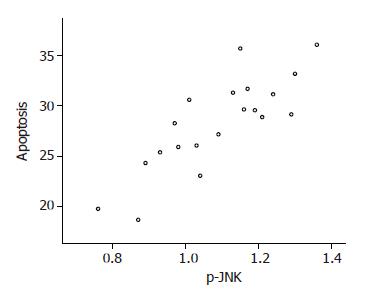
在AICD过程中慢性乙肝组PBMC凋亡率与PBMC中p-JNK蛋白的表达成正相关(r = 0.823, P<0.01, 图4).
AICD是指已活化的成熟淋巴细胞(T或B细胞)再次受到激活信号(特别是TCR/CD3复合体)激活后所发生的细胞凋亡, 它既是维持机体免疫稳定的一种生理机制, 也是形成外周免疫耐受的重要原因[8]. 本实验在体外培养PBMC, 模拟细胞在体内的AICD过程, 结果发现慢性乙肝组的PBMC凋亡率明显高于健康对照组, 这与短期内激活PBMC的凋亡情况相一致[3], 这表明慢性乙肝患者的PBMC存在AICD过多的现象. CHB患者的PBMC可能在HBV特异性抗原刺激下被激活, 再发生自身凋亡(即AICD), 这可能导致CHB患者淋巴细胞数量减少、功能下降和免疫细胞比例失衡, 从而减弱了机体的细胞免疫功能和有效的针对HBV的特异性细胞免疫应答, 使机体对HBV的清除作用减弱, 最终造成对HBV的免疫耐受, 这可能是导致HBV持续慢性感染的一个重要原因[9].
JNK家族是一类丝氨酸/苏氨酸蛋白激酶, 是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族的一员[10]. JNK信号通路介导了许多细胞凋亡的发生, 在多种疾病的发生发展中起重要作用[11]. p-JNK是JNK的活性形式, 通过检测p-JNK的表达可以反映JNK信号通路的活化情况. c-Jun和Bim都是JNK介导的细胞凋亡信号通路中的重要下游分子[12]. c-Jun是一种核内转录因子, 是JNK重要的核内底物, 活化的JNK转位到细胞核后能够使c-Jun磷酸化而激活, 从而提高其转录活性, 促进下游凋亡相关靶基因的转录而分别启动死亡受体途径及线粒体途径的细胞凋亡[13,14]. p-c-Jun的激活同样也反映了JNK信号通路的活化情况. Bim蛋白是JNK重要的胞浆底物, 是Bcl-2家族中一种重要的凋亡调节蛋白[15]. 活化的JNK能够通过激活转录因子c-Jun等而上调Bim的表达, 也可以在胞质内直接使Bim蛋白磷酸化而诱发线粒体途径的细胞凋亡[12]. 本研究发现慢性乙肝组PBMC中p-JNK及其下游转录因子p-c-jun和下游蛋白Bim的表达量均较健康对照组高, 而总JNK蛋白的表达量无显著性差异, 表明p-JNK蛋白表达的增加是JNK活化所致, 慢性乙型肝炎患者PBMC中存在JNK信号通路的过度激活, 但是其激活的原因尚未阐明, 我们推测与HBV的持续慢性感染有关. Wang等[16]研究表明HBV X蛋白(HBx)能够持续激活JNK和P38信号通路而介导肝细胞的凋亡, 在CHB患者的PBMC中也可以检出HBx mRNA[17], 那么在CHB患者的PBMC中HBx能否激活JNK信号通路而介导凋亡, HBx是否是JNK信号通路过度激活的原因还需要进一步研究.
研究证实JNK信号通路参与介导了多种疾病淋巴细胞的AICD过程, 但是关于JNK信号通路是否也参与介导了CHB患者PBMC的AICD过程还未见报道. 本研究通过在体外培养PBMC, 模拟细胞在体内的AICD过程, 发现慢性乙肝组PBMC的凋亡率与p-JNK蛋白的表达呈正相关. 应用JNK特异性抑制剂SP600125[18,19]预处理细胞后, 可以明显抑制p-JNK及其下游转录因子p-c-jun和下游蛋白Bim的表达, PBMC凋亡率也明显降低, 表明JNK信号通路参与介导了慢性乙型肝炎患者PBMC的AICD过程. 由于抑制JNK并不能使CHB患者PBMC的凋亡率完全降至正常, 因此JNK信号通路只是介导CHB患者PBMC凋亡增多的机制之一, 关于PBMC发生AICD的其他机制还有待于进一步的研究.
免疫治疗是目前慢性乙型肝炎治疗的研究热点, 如何通过恢复自身的免疫力来彻底清除病毒达到治愈乙肝的目标是我们目前面临的主要问题. 本研究发现JNK信号通路参与介导了慢性乙型肝炎患者PBMC的AICD过程, 是CHB患者PBMC凋亡增多的机制之一, 应用SP600125抑制JNK后, 可以降低慢性乙肝患者PBMC凋亡率. 这给我们治疗慢性乙型肝炎带来了新的思路, 我们可以探索从不同水平干预JNK或其下游底物的表达, 通过抑制JNK通路来减少淋巴细胞凋亡, 改善CHB患者的细胞免疫功能, 提高机体清除HBV的能力.
JNK信号通路能介导多种胞外刺激诱导的细胞凋亡, 参与了许多细胞凋亡的发生. 近年来研究证明JNK信号通路参与介导了多种疾病(流感、人类黑色素瘤等)淋巴细胞的AICD过程, 但是关于JNK信号通路是否也参与介导了慢性乙肝患者淋巴细胞的AICD过程还未见报道.
崔莲花, 副教授, 青岛大学医学院公共卫生系; 魏继福, 副研究员, 江苏省人民医院中心实验室
慢性乙肝患者淋巴细胞的AICD过多现象是多年来研究的重点. 如何通过调节AICD来减少淋巴细胞凋亡, 改善慢性乙肝患者的细胞免疫功能是近年研究的热点.
Chhabra等研究发现人类黑色素瘤表位特异性原始CTL发生的AICD是由JNK所介导的, 伴随着凋亡诱导因子AIF的释放和大规模的DNA碎片裂, 应用JNK特异性抑制剂SP600125能够阻碍凋亡诱导因子AIF的线粒体-核转位, 并阻止CTL发生AICD.
本实验以慢性乙肝患者PBMC为研究对象, 体外模拟AICD过程, 研究JNK信号通路在CHB患者外周血单个核细胞AICD过程中的作用, 进一步探讨AICD发生的机制, 为慢性乙型肝炎的治疗提供理论依据.
本研究发现JNK信号通路参与介导了慢性乙型肝炎患者PBMC的AICD过程, 是CHB患者PBMC凋亡增多的机制之一.
AICD: 指已活化的成熟淋巴细胞(T或B细胞)再次受到激活信号(特别是TCR/CD3复合体)激活后所发生的细胞凋亡, 它既是维持机体免疫稳定的一种生理机制, 也是形成外周免疫耐受的重要原因.
本文主要研究了JNK信号通路在CHB患者外周血单个核细胞AICD过程中的作用, 并初步探讨了AICD发生的机制, 有一定科研意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Nakamura K, Yuh K, Sugyo S, Shijo H, Kimura N, Okumura M. Apoptosis observed in peripheral T lymphocytes from patients with chronic hepatitis B. Gastroenterology. 1996;111:156-164. [PubMed] [DOI] |
| 2. | Lohman BL, Welsh RM. Apoptotic regulation of T cells and absence of immune deficiency in virus-infected gamma interferon receptor knockout mice. J Virol. 1998;72:7815-7821. [PubMed] |
| 4. | Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002;192:1-15. [PubMed] [DOI] |
| 5. | Chhabra A, Mehrotra S, Chakraborty NG, Dorsky DI, Mukherji B. Activation-induced cell death of human melanoma specific cytotoxic T lymphocytes is mediated by apoptosis-inducing factor. Eur J Immunol. 2006;36:3167-3174. [PubMed] [DOI] |
| 6. | Mehrotra S, Chhabra A, Hegde U, Chakraborty NG, Mukherji B. Inhibition of c-Jun N-terminal kinase rescues influenza epitope-specific human cytolytic T lymphocytes from activation-induced cell death. J Leukoc Biol. 2007;81:539-547. [PubMed] [DOI] |
| 7. | Strasser A, Pellegrini M. T-lymphocyte death during shutdown of an immune response. Trends Immunol. 2004;25:610-615. [PubMed] [DOI] |
| 8. | Green DR, Droin N, Pinkoski M. Activation-induced cell death in T cells. Immunol Rev. 2003;193:70-81. [PubMed] [DOI] |
| 10. | Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions. Methods Mol Biol. 2010;661:3-38. [PubMed] [DOI] |
| 11. | Johnson GL, Nakamura K. The c-jun kinase/stress-activated pathway: regulation, function and role in human disease. Biochim Biophys Acta. 2007;1773:1341-1348. [PubMed] |
| 12. | Bogoyevitch MA, Kobe B. Uses for JNK: the many and varied substrates of the c-Jun N-terminal kinases. Microbiol Mol Biol Rev. 2006;70:1061-1095. [PubMed] [DOI] |
| 13. | Carboni S, Antonsson B, Gaillard P, Gotteland JP, Gillon JY, Vitte PA. Control of death receptor and mitochondrial-dependent apoptosis by c-Jun N-terminal kinase in hippocampal CA1 neurones following global transient ischaemia. J Neurochem. 2005;92:1054-1060. [PubMed] [DOI] |
| 14. | Dunn C, Wiltshire C, MacLaren A, Gillespie DA. Molecular mechanism and biological functions of c-Jun N-terminal kinase signalling via the c-Jun transcription factor. Cell Signal. 2002;14:585-593. [PubMed] [DOI] |
| 15. | 叶 艳, 张 林杰. 凋亡调节蛋白BIM的研究进展. 国外医学. 生理、病理科学与临床分册. 2004;24:548-550. |
| 16. | Wang WH, Grégori G, Hullinger RL, Andrisani OM. Sustained activation of p38 mitogen-activated protein kinase and c-Jun N-terminal kinase pathways by hepatitis B virus X protein mediates apoptosis via induction of Fas/FasL and tumor necrosis factor (TNF) receptor 1/TNF-alpha expression. Mol Cell Biol. 2004;24:10352-10365. [PubMed] [DOI] |
| 17. | Nakamoto Y, Kaneko S. Mechanisms of viral hepatitis induced liver injury. Curr Mol Med. 2003;3:537-544. [PubMed] [DOI] |
| 18. | Bennett BL, Sasaki DT, Murray BW, O'Leary EC, Sakata ST, Xu W, Leisten JC, Motiwala A, Pierce S, Satoh Y. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase. Proc Natl Acad Sci U S A. 2001;98:13681-13686. [PubMed] [DOI] |
| 19. | Shin M, Yan C, Boyd D. An inhibitor of c-jun aminoterminal kinase (SP600125) represses c-Jun activation, DNA-binding and PMA-inducible 92-kDa type IV collagenase expression. Biochim Biophys Acta. 2002;1589:311-316. [PubMed] [DOI] |