修回日期: 2011-06-21
接受日期: 2011-06-28
在线出版日期: 2011-09-18
目的: 探讨mTOR和JNK信号通路在结肠癌中作用及可能的相互作用关系.
方法: 免疫方法检测p-mTOR及p-JNK在结肠癌组织和正常结肠组织中的表达情况. 体外培养人结肠癌细胞株HT-29细胞, 转染mTOR siRNA抑制mTOR表达, 使用JNK抑制剂SP600125抑制JNK表达. Western blot法分别检测抑制mTOR和JNK后HT-29细胞中p-JNK、p-mTOR蛋白的表达.
结果: 在人结肠癌组织中p-mTOR和p-JNK表达阳性率分别为60%和56%, 且两者阳性表达相关性分析存在正相关性(r = 0.480, P<0.01). HT-29细胞株中抑制mTOR信号通路后mTOR siRNA转染组和空白对照组、Control siRNA组比较增殖(A值)明显降低, 差异具有统计学意义(0.275±0.033, 0.460±0.376 vs 0.479±0.012, 均P<0.01), mTOR siRNA转染组凋亡指数明显高于空白对照组和Control siRNA组, 差异具有统计学意义(12.330±1.533, 1.000±0.147 vs 1.667±0.577, 均P<0.01). 抑制JNK信号通路后可见随着SP600125剂量的升高, A值整体变化呈下降趋势, 两者呈负相关(r = -0.857, P<0.01), 细胞凋亡指数先是迅速上升, 而在10 μmol/L至100 μmol/L则变化不大, 各剂量组凋亡指数差别有统计学意义(F = 142.67, P<0.01). mTOR siRNA转染抑制mTOR后的p-JNK蛋白表达无差异; SP600125抑制JNK后的p-mTOR表达减少(P<0.01).
结论: 在结肠癌HT-29细胞中抑制mTOR信号通路及JNK信号通路均有抑制细胞增殖, 促进细胞凋亡作用; JNK信号通路对mTOR信号通路存在促进作用.
引文著录: 张志永, 张谢夫. mTOR与JNK信号通路在人结肠癌HT-29细胞中的作用及相互关系. 世界华人消化杂志 2011; 19(26): 2735-2740
Revised: June 21, 2011
Accepted: June 28, 2011
Published online: September 18, 2011
AIM: To investigate the possible interaction and relationship between mammalian target of rapamycin (mTOR) and c-Jun N-terminal kinase (JNK) signal pathways in colon cancer.
MEHTODS: Immunohistochemical methods were applied to detect p-JNK and p-mTOR expression in colon cancer tissues. Human colon cancer cell line HT29 was cultured in vitro. The expression of mTOR protein was inhibited using specific siRNA, and JNK protein was inhibited with JNK inhibiter SP600125. The expression of p-JNK and p-mTOR proteins was determined by Western blot. Cell proliferation was detected by MTT assay, and apoptosis was detected by TUNEL assay.
RESULTS: The levels of p-mTOR and p-JNK were higher in colon cancer than in normal control tissue (both P < 0.01). High expression of p-mTOR was correlated with that of p-JNK in human colon cancer tissues (0.275 ± 0.033, 0.460 ± 0.376 vs 0.479 ± 0.012, both P < 0.01). Compared to control cells, HT-29 cell proliferation was significantly decreased in cells transfected with siRNA targeting the mTOR gene and those treated with JNK inhibitor (12.330 ± 1.533, 1.000 ± 0.147 vs 1.667 ± 0.577, both P < 0.01), while apoptotic index was significantly increased in the two groups (both P < 0.01). The expression of p-JNK protein showed no significant difference between the mTOR siRNA transfection group and normal control group (P = 0.364). The expression of m-TOR protein in the JNK inhibitor group was significantly decreased compared to the normal control group (P < 0.01).
CONCLUSION: Inhibition of the mTOR or JNK signaling pathways suppresses proliferation and increases apoptosis of HT-29 cells. The JNK signally pathway may activate the mTOR signaling pathway in HT-29 cells.
- Citation: Zhang ZY, Zhang XF. Interaction and relationship between mTOR and JNK signal pathways in human colon cancer cell line HT-29. Shijie Huaren Xiaohua Zazhi 2011; 19(26): 2735-2740
- URL: https://www.wjgnet.com/1009-3079/full/v19/i26/2735.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i26.2735
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)和c-Jun氨基末端酶(c-Jun N-terminal kinase, JNK)均为人体细胞内广泛存在的蛋白激酶, 参与调控细胞生长, 细胞分化和细胞凋亡等多个重要的生理过程. JNK属于促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族成员之一. 近几年, mTOR信号通路与MAPK信号通路在肿瘤发病中的相互作用开始得到关注, 目前的研究成果主要集中在mTOR与同属MAPK家族的细胞外信号调节激酶 (extracellular sinal-regulated kinase, ERK)之间[1,2]. JNK与ERK同属MAPK家族, mTOR与JNK信号通路在结肠癌的发生发展中有无相互作用尚不清楚. 本研究以免疫组织化学方法检测p-mTOR和p-JNK在人结肠癌组织中的表达; 体外培养人结肠癌细胞株HT-29, 应用siRNA干扰技术及JNK特异性抑制剂分别抑制mTOR信号通路和JNK信号通路, 探讨他们在结肠癌中的作用及可能的相互关系.
50例结肠癌标本来自郑州大学第一附属医院普通外科2009-10/2010-06手术治疗结肠癌病例, 同时取非结肠癌手术病例切除结肠组织50例进行对照. DAKO ChemMate EnVision HRP试剂盒, 购自广州基因公司. 人结肠癌细胞株HT29来自中山大学医学院. 胎牛血清、RPMI 1640购自美国Gibco公司. Lipofectamine 2000转染试剂盒购自美国Invitrogen公司. 抗体p-mTOR购自Santa Cruz. p-JNK抗体购自北京博奥森公司.
1.2.1 免疫组织化学检测: 标本常规切片处理, p-mTOR和p-JNK浓度均为1∶200, 按照试剂盒说明操作, PBS代替一抗空白对照, 试剂公司提供阳性对照切片. p-mTOR结果判定: 以细胞质或者细胞核内出现棕黄色染色颗粒为标准判定阳性细胞, 低倍镜下(×200)选取典型病变视野10个/切片, 每视野计数100个细胞, 以阳性细胞≥10%为阳性, 并记为+; ≥20%记为++; ≥40%记为+++; ≥80%记为++++. p-JNK结果判定: 以细胞质或者细胞膜出现棕黄色染色颗粒为标准判定阳性细胞, 低倍镜下(×200)选取典型病变视野10个/切片, 每视野计数100个细胞, 以阳性细胞≥10%为阳性, 并记为+; ≥20%记为++; ≥40%记为+++; ≥80%记为++++.
1.2.2 细胞培养: 将HT-29细胞冻存管从液氮罐中取出, 迅速置于37 ℃水浴中, 轻轻摇晃令其尽快融化; 使用无菌吸管吸出细胞悬液, 转移至无菌离心管中, 滴加10 mL培养基, 1 000 r/min离心5 min; 将上清倒去后, 加入培养基作适当稀释, 制成单细胞悬液, 再转入无菌培养瓶中37 ℃培养箱中培养. 细胞培养2-3 d后, 更换1次培养液, 待细胞长满至80%左右时, 使用胰蛋白酶消化, 使细胞至漂浮状态, 终止消化后1∶2分瓶传代.
1.2.3 细胞分组和处理: 将HT-29细胞分为空白对照组(不转染siRNA)、Control siRNA组(转染无义对照siRNA)、mTOR siRNA转染组、JNK抑制剂组. JNK抑制剂组处理前一天将对数生长期细胞用胰蛋白酶消化后, 接种于6孔板, 保证每孔有5×105个细胞; 用DMSO将JNK抑制剂SP600125稀释为不同浓度(5、10、20、40、60、80、100 μmol/L)后加入到细胞培养基中, 培养24 h后收集细胞分组检测. mTOR siRNA转染组、Control siRNA组按1.2.4中的方法进行处理.
1.2.4 siRNA的体外合成及细胞转染: siRNA的体外合成参照根据广州市锐博生物科技有限公司的RNAi设计工具进行设计, 经实验摸索合成1段干扰效果好的特异性mTOR siRNA, 其详细序列为: Sense: 5'-GCCACAGUCUUCACUUGCAdTdT-3'; Asense: 3'-dTdT CGGUGUCAGAAGUGAACGU-5'. 同时体外转录合成1段无义对照siRNA. 转染前一天将对数生长期细胞用胰蛋白酶消化后, 接种于6孔板, 保证每孔有5×105个细胞; 转染前用Opti-MEM培养基分别将SiRNA和Lipofectamine2000脂质体稀释, SiRNA的稀释浓度为100 pmol组, 室温孵育5 min将两者混匀; 孵育20 min后, 将混合物加入到细胞培养基中, 培养24 h后收集细胞检测.
1.2.5 Western blot检测细胞p-JNK、p-mTOR蛋白的表达: 细胞用PBS清洗2遍; 加100 μL的Total Protein Extraction到1×106的细胞中, 抽提细胞总蛋白; BSA法蛋白定量. 取等量蛋白样品到10% SDS-PAGE胶上样, 电压90 V, 恒压电泳120 min; 跑好的胶在转膜液中浸泡20 min; 从下至上分别放入滤纸、胶、PVDF膜、滤纸, 夹子夹好放入倒好转膜液的转膜槽中, 电压90 V, 恒压电泳120 min. 将膜取出, 加入5%脱脂奶粉的PBS室温封闭1 h. 分别加入一抗p-mTOR(1∶200)、p-JNK(1∶200)、β-actin(1∶1 000)到5%脱脂牛奶中, 在室温下振荡孵化90 min, 然后洗膜4次: 1×PBS 15 min 1次; 5 min 3次; 分别加入二抗(1∶3 000)到5%脱脂牛奶中, 在室温孵化1 h, 洗膜4次: 1×PBS 15 min 1次; 5 min 3次; 以1∶40比例混合显色基质B液和A液, 均匀滴加膜上, 静置2 min, 用保鲜膜将膜包好, 轻轻挤出多余显色基质, 放入暗盒, 曝光4 min后, 蛋白表达情况使用凝胶成像分析系统进行检测. 获得的图像用软件ImageTool 3.0测灰度值, 并与内参相比得其相对值, 取4次重复实验结果的均值进行比较.
1.2.6 MTT法检测细胞增殖情况: 将HT-29细胞计数后, 以2×104的密度接种到96孔细胞培养板中; 细胞预处理后培养24 h, 显微镜下观察贴壁生长良好后每孔加入100 μL的MTT试剂, 继续培养4 h; 除去培养液, 每孔加入150 μL的无血清的DMSO, 振荡10 min充分融解结晶物; 选择570 nm波长, 在酶标仪上检测各孔光吸收值(A值). 每孔A值减去空白孔A值为测试孔A值. 活细胞数与A值成正比. 每组设4个复孔, 取其平均值.
1.2.7 TUNEL法检测细胞凋亡情况: 蒸馏水浸洗细胞爬片数次. 细胞爬片于PBS洗5 min×3次. 在细胞爬片上滴加TdT酶反应液, 37 ℃孵育1h. 细胞爬片于PBS洗5 min×3次. 在细胞爬片上滴加streptavidin-HRP工作液, 37 ℃孵育30 min. 细胞爬片于PBS洗5 min×3次. DAB显色, 水洗终止反应. 苏木素复染1 min, 自来水冲洗5 min. 脱水、晾干、中性树胶封片, 结果观察. 结果分析方法: 选择10个典型视野, 高倍镜下计数至少1 000个肿瘤细胞, 凋亡指数(apoptosis index, AI) = TUNEL阳性肿瘤细胞数/肿瘤细胞数×100%.
统计学处理 实验数据采用SPSS13.0统计软件分析, 两独立样本t检验, 数据以mean±SD表示. 两组配对资料的比较采用Friedman秩和检验, 多组定量资料的比较采用单因素方差分析或析因设计资料的方差分析, 方差齐时两两比较采用SNK法, 方差不齐时两两比较采用Dunnett's T3检验, 两变量的相关性分析采用Spearman秩相关分析, 以P<0.05为差异有统计学意义.
结肠癌部位结肠黏膜组织的磷酸化雷帕霉素靶蛋白(p-mTOR)和磷酸化c-Jun氨基末端酶(p-JNK)表达程度均高于对照部位, 经Friedman秩和检验, 差别均有统计学意义(P<0.05, 表1).
| 指标 | 分组 | 表达情况 n(%) | Z值 | P值 | ||||
| - | + | ++ | +++ | ++++ | ||||
| p-mTOR | 实验组 | 20(40) | 11(22) | 8(16) | 5(10) | 6(12) | 4.50 | <0.001 |
| 对照组 | 43(86) | 4(8) | 3(6) | 0(0) | 0(0) | |||
| p-JNK | 实验组 | 22(44) | 5(10) | 10(20) | 8(16) | 5(10) | 4.40 | <0.001 |
| 对照组 | 43(86) | 5(10) | 2(4) | 0(0) | 0(0) | |||
p-mTOR阳性表达和p-JNK的表达关系呈正相关(r = 0.480, P<0.01).
2.3.1 抑制mTOR后mTOR和JNK表达情况: mTOR siRNA抑制mTOR表达后, 空白对照组和Control siRNA组的灰度值比值比较差别无统计学意义(P = 0.080), 但两组的灰度值比均大于mTOR siRNA转染组, 差别有统计学意义(1.175±0.045, 1.460±0.094 vs 0.389±0.247, 均P<0.01). 抑制mTOR表达后, 空白对照组、Control siRNA组和mTOR siRNA转染组的JNK表达灰度值比值差异无统计学意义.
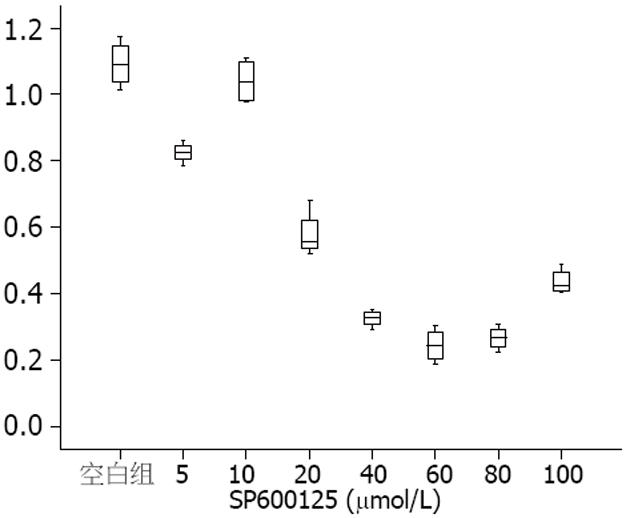
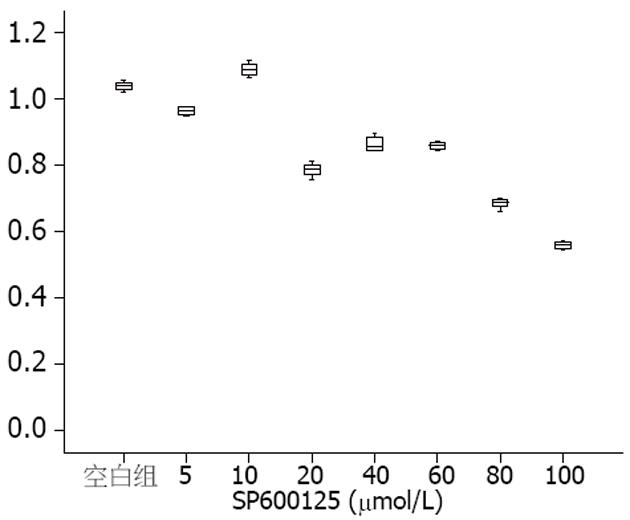
2.3.2 抑制JNK后JNK和mTOR表达情况: SP600125抑制JNK信号通路后, 随着SP600125剂量的升高, JNK表达灰度值比值整体变化呈下降趋势(图1), Spearman相关分析显示, 两者呈负相关(r = -0.795, P<0.01). SP600125抑制人结肠癌HT-29细胞后, 可以见到随着SP600125剂量的升高, p-mTOR表达灰度值比值整体变化呈下降趋势(图2), Spearman相关分析显示, 两者呈负相关(r = -0.874, P<0.01).
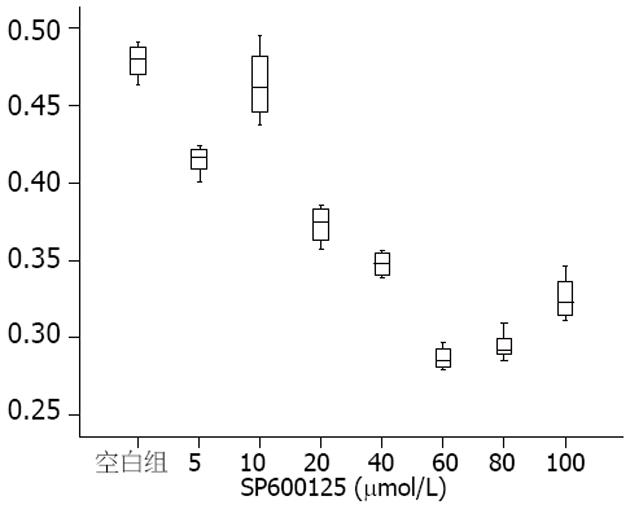
mTOR siRNA转染组和空白对照组、Control siRNA组比较增殖(A值)明显降低, 差异具有统计学意义(0.275±0.033, 0.460±0.376 vs 0.479±0.012, 均P<0.01). SP600125抑制人结肠癌HT-29细胞后, 可见随着SP600125剂量的升高, A值整体变化呈下降趋势(图3), Spearman相关分析显示, 两者呈负相关(r = -0.857, P<0.01).
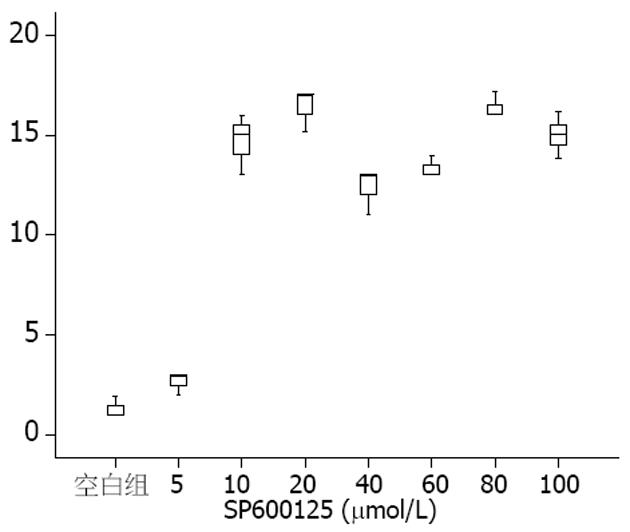
mTOR siRNA转染组凋亡指数明显高于空白对照组和Control siRNA组, 差异具有统计学意义(12.330±1.533, 1.000±0.147 vs 1.667±0.577, 均P<0.01). 在不同剂量的SP600125作用下, 人结肠癌HT-29细胞凋亡指数随着SP600125剂量的升高, 先是迅速上升, 而在10-100 μmol/L则变化不大(图4), 各剂量组凋亡指数差别有统计学意义(F = 142.67, P<0.01).
mTOR是一种丝氨酸/苏氨酸蛋白激酶. 其可被多种外界因素激活而参与基因转录、蛋白质翻译、核糖体生物合成, 并能调控能量代谢、细胞周期和细胞凋亡等多个重要的细胞生理功能[3-5]. 近来研究发现, 多种肿瘤的发生发展过程中都伴有mTOR信号通路的异常[6-9]. Slattery等[10]研究指出, mTOR及其信号通路有关的因子发生遗传学变异显著加大了直肠或结肠癌的风险. 本实验证实, mTOR在人结肠癌组织及HT-29细胞中存在高表达, 应用mTOR siRNA特异性沉默mTOR基因表达后, mTOR蛋白表达显著降低, 且伴随HT-29细胞增殖降低, 凋亡率增加, 表明mTOR蛋白在促进结肠癌HT-29细胞增殖、抑制细胞凋亡中发挥着重要作用. 国内学者多个[11,12]研究也证实mTOR在人结肠癌细胞株中高表达. mTOR 信号通路有可能是结肠癌治疗中的一个重要靶点[13,14].
JNK属于MAPK家族4种成员之一, 其余3种分别为ERK1/2、p38及ERK5. JNK信号途径可以调控细胞生长、癌基因转化、细胞分化和细胞凋亡等多种生命过程[15-17], 已经证实JNK信号途径的异常与多种类别的疾病发生有关[18-21]. 在对哺乳动物的JNK信号研究中也发现, JNK能够促进肿瘤形成[22-24]. 最近的研究发现大肠癌细胞JNK磷酸化可激活其下游成员使大肠癌基质金属蛋白酶的分泌增加, 导致大肠癌细胞的运动和侵袭力增加, 最终促进癌细胞的转移[25]. Nateri等[26]剔除JNK磷酸化的位点时, 能使小鼠肠道肿瘤变小, 肿瘤细胞减少, 并且延长小鼠的寿命. 在本实验研究中, JNK在人结肠癌组织及HT-29细胞中呈高表达, JNK抑制剂可显著抑制结肠癌HT-29细胞的增殖促进其细胞凋亡, 表明JNK信号通路在结肠癌中扮演了重要角色, JNK的激活可能促进结肠癌的发生发展, 阻断JNK信号通路对结肠癌具有的抑制作用.
mTOR信号通路和JNK信号通路都在细胞生长、细胞周期调节、细胞凋亡方面起着重要作用, 两者的信号传递通路均含有多个原癌基因和抑癌基因, 并存在复杂的调节网络, 他们之间的相互作用目前并不清楚. 如前言所述, 多项研究表明了mTOR信号通路和MAPK信号通路有关. 在一项有关亚历山大疾病的研究中发现, 因神经胶质原纤维酸性蛋白质堆积激活的p38 MAPK, 可以降低mTOR磷酸化水平, 从而提高自噬能力, 阻止疾病的进展[27]. Chen等[28]在研究重金属镉对细胞凋亡的影响时发现, 阻断JNK能部分阻止细胞凋亡, 阻断mTOR也能达到同样的效果, JNK和mTOR信号网络的激活和镉诱导的细胞凋亡有关. Chiang等[29]在一项关于乳腺癌的研究中发现, 中药单体薯蓣皂甙配基能抑制Akt和mTOR磷酸化而加强JNK的磷酸化. 这提示mTOR信号通路和JNK信号通路有可能在肿瘤的发生发展中存在着相互作用. 本研究发现在人结肠癌组织中, p-mTOR和p-JNK均存在高表达(P<0.01), p-mTOR和p-JNK高表达之间存在正相关性(P<0.01), 说明在结肠癌发生发展中mTOR信号通路和JNK信号通路可能存在相互促进作用.
有限的资料从不同的侧面论述了这两个信号通路可能存在的联系. Fujishita等[30]的一项关于家族性息肉病小鼠模型研究显示, 在此模型中mTORC1信号通路是被激活的, mTORC1抑制剂RA001可以阻止肿瘤的形成, 但确切机制尚不清楚, 使用JNK抑制剂sp600125也可以明显抑制肿瘤的形成, 同时研究还发现使用JNK活化剂Anisomycin可以激活mTORc1, 这提示JNK和mTOR信号通路可能在肿瘤的形成中共同起作用. Benoit等[31]的实验探讨了在使用JNK抑制剂抑制的人结肠癌细胞株LS174T或者JNK基因突变的LS174T细胞株中加入雷帕霉素后, 雷帕霉素的抗增殖作用较正常的细胞株增强. 实验结果表明, 雷帕霉素诱导的JNK磷酸化降低了其阻滞mTOR信号通路所带来的抗肿瘤作用. 这些文献结果显示JNK信号通路和mTOR信号通路之间的确存在着某种可能的关联, 但对这种可能关系研究尚处于初期阶段. 本实验研究探讨了mTOR和JNK信号通路在调控结肠癌的发生发展中的作用. 研究显示, siRNA抑制mTOR表达后, p-JNK的表达没有明显的变化; JNK抑制剂抑制了JNK信号通路后, p-mTOR的表达降低. 结果提示JNK信号通路下游位点可能对mTOR信号通路存在促进或者激活作用, 这种相互作用关系的进一步明确对揭示结肠癌发生过程中复杂信号通路的变化, 以及选择可能的治疗靶点有积极作用.
mTOR和JNK为哺乳动物细胞内广泛存在的蛋白激酶, 可调控细胞生长、细胞分化和细胞凋亡等重要的生理过程. 近年许多研究证明, mTOR和JNK信号通路的异常和临床多种疾病的发生和发展相关.
顾国利, 副主任医师, 中国人民解放军空军总医院普通外科; 李革, 副教授, 延边大学附属医院普外1科; 刘丽江, 教授, 江汉大学医学院病理学与病理生理学教研室
研发前沿 肿瘤发生和发展与多种因素有关. 细胞内信号传导通路的异常, 导致癌基因激活或者抑癌基因失活是各种肿瘤研究的热点. 现有的研究已经分别证明在结肠癌的发生发展过程中存在者mTOR和JNK信号通路的异常, 但是这两个信号通路在结肠癌发生发展中有无相互作用, 并未见到报道.
Albert等报道在胶质母细胞瘤中mTOR抑制剂可激活与JNK同属MAPK家族的ERK1/2. Fujishita等发现在家族性息肉病小鼠模型中, JNK活化剂可以激活mTORc1.
研究从细胞信号通路相互作用的角度出发, 探讨了mTOR和JNK信号通路在结肠癌组织及结肠癌HT-29细胞中的作用及其相互关系. 初步证实了JNK信号通路在结肠癌中对mTOR信号通路存在影响.
实验证明mTOR信号通路和JNK信号通路均可再结肠癌的发生发展中起到作用, 并且JNK信号通路对mTOR信号通路存在促进作用, 这些信号通路的相互作用点对于结肠癌治疗药物靶点的选择具有一定指导意义.
本文立题新颖, 有创新性, 实验设计和技术路线合理, 思路清晰, 结论可信, 有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Albwert L, Karsy M, Murali R, Jhanwar-Uniyal M. Inhibition of mTOR Activates the MAPK Pathway in Glioblastoma Multiforme. Cancer Genomics Proteomics. 2009;6:255-261. [PubMed] |
| 2. | Auyeung KK, Mok NL, Wong CM, Cho CH, Ko JK. Astragalus saponins modulate mTOR and ERK signaling to promote apoptosis through the extrinsic pathway in HT-29 colon cancer cells. Int J Mol Med. 2010;26:341-349. [PubMed] |
| 3. | Bai X, Jiang Y. Key factors in mTOR regulation. Cell Mol Life Sci. 2010;67:239-253. [PubMed] [DOI] |
| 4. | Shaw RJ, Cantley LC. Ras, PI(3)K and mTOR signalling controls tumour cell growth. Nature. 2006;441:424-430. [PubMed] [DOI] |
| 5. | Guertin DA, Sabatini DM. Defining the role of mTOR in cancer. Cancer Cell. 2007;12:9-22. [PubMed] [DOI] |
| 6. | Menon S, Manning BD. Common corruption of the mTOR signaling network in human tumors. Oncogene. 2008;27 Suppl 2:S43-S51. [PubMed] [DOI] |
| 7. | Kinkade CW, Castillo-Martin M, Puzio-Kuter A, Yan J, Foster TH, Gao H, Sun Y, Ouyang X, Gerald WL, Cordon-Cardo C. Targeting AKT/mTOR and ERK MAPK signaling inhibits hormone-refractory prostate cancer in a preclinical mouse model. J Clin Invest. 2008;118:3051-3064. [PubMed] |
| 8. | Guertin DA, Sabatini DM. An expanding role for mTOR in cancer. Trends Mol Med. 2005;11:353-361. [PubMed] [DOI] |
| 9. | Proud CG. Signalling to translation: how signal transduction pathways control the protein synthetic machinery. Biochem J. 2007;403:217-234. [PubMed] [DOI] |
| 10. | Slattery ML, Herrick JS, Lundgreen A, Fitzpatrick FA, Curtin K, Wolff RK. Genetic variation in a metabolic signaling pathway and colon and rectal cancer risk: mTOR, PTEN, STK11, RPKAA1, PRKAG2, TSC1, TSC2, PI3K and Akt1. Carcinogenesis. 2010;31:1604-1611. [PubMed] [DOI] |
| 13. | Pencreach E, Guérin E, Nicolet C, Lelong-Rebel I, Voegeli AC, Oudet P, Larsen AK, Gaub MP, Guenot D. Marked activity of irinotecan and rapamycin combination toward colon cancer cells in vivo and in vitro is mediated through cooperative modulation of the mammalian target of rapamycin/hypoxia-inducible factor-1alpha axis. Clin Cancer Res. 2009;15:1297-1307. [PubMed] [DOI] |
| 14. | Lee YK, Park SY, Kim YM, Kim DC, Lee WS, Surh YJ, Park OJ. Suppression of mTOR via Akt-dependent and -independent mechanisms in selenium-treated colon cancer cells: involvement of AMPKalpha1. Carcinogenesis. 2010;31:1092-1099. [PubMed] [DOI] |
| 15. | Mori Y, Gotoh Y. [Role of the JNK signaling pathway]. Tanpakushitsu Kakusan Koso. 2008;53:1252-1257. [PubMed] |
| 17. | Johnson GL, Nakamura K. The c-jun kinase/stress-activated pathway: regulation, function and role in human disease. Biochim Biophys Acta. 2007;1773:1341-1348. [PubMed] |
| 19. | Wagner EF, Nebreda AR. Signal integration by JNK and p38 MAPK pathways in cancer development. Nat Rev Cancer. 2009;9:537-549. [PubMed] [DOI] |
| 20. | Major CD, Wolf BA. Interleukin-1beta stimulation of c-Jun NH(2)-terminal kinase activity in insulin-secreting cells: evidence for cytoplasmic restriction. Diabetes. 2001;50:2721-2728. [PubMed] [DOI] |
| 21. | Eshraghi AA, Van de Water TR. Cochlear implantation trauma and noise-induced hearing loss: Apoptosis and therapeutic strategies. Anat Rec A Discov Mol Cell Evol Biol. 2006;288:473-481. [PubMed] [DOI] |
| 22. | Uhlirova M, Jasper H, Bohmann D. Non-cell-autonomous induction of tissue overgrowth by JNK/Ras cooperation in a Drosophila tumor model. Proc Natl Acad Sci U S A. 2005;102:13123-13128. [PubMed] [DOI] |
| 23. | Antonyak MA, Kenyon LC, Godwin AK, James DC, Emlet DR, Okamoto I, Tnani M, Holgado-Madruga M, Moscatello DK, Wong AJ. Elevated JNK activation contributes to the pathogenesis of human brain tumors. Oncogene. 2002;21:5038-5046. [PubMed] [DOI] |
| 24. | Sakurai T, Maeda S, Chang L, Karin M. Loss of hepatic NF-kappa B activity enhances chemical hepatocarcinogenesis through sustained c-Jun N-terminal kinase 1 activation. Proc Natl Acad Sci U S A. 2006;103:10544-10551. [PubMed] [DOI] |
| 26. | Nateri AS, Spencer-Dene B, Behrens A. Interaction of phosphorylated c-Jun with TCF4 regulates intestinal cancer development. Nature. 2005;437:281-285. [PubMed] [DOI] |
| 27. | Tang G, Yue Z, Talloczy Z, Hagemann T, Cho W, Messing A, Sulzer DL, Goldman JE. Autophagy induced by Alexander disease-mutant GFAP accumulation is regulated by p38/MAPK and mTOR signaling pathways. Hum Mol Genet. 2008;17:1540-1555. [PubMed] [DOI] |
| 28. | Chen L, Liu L, Luo Y, Huang S. MAPK and mTOR pathways are involved in cadmium-induced neuronal apoptosis. J Neurochem. 2008;105:251-261. [PubMed] [DOI] |
| 29. | Chiang CT, Way TD, Tsai SJ, Lin JK. Diosgenin, a naturally occurring steroid, suppresses fatty acid synthase expression in HER2-overexpressing breast cancer cells through modulating Akt, mTOR and JNK phosphorylation. FEBS Lett. 2007;581:5735-5742. [PubMed] [DOI] |
| 30. | Fujishita T, Aoki M, Taketo MM. JNK signaling promotes intestinal tumorigenesis through activation of mTOR complex 1 in Apc(Δ716) mice. Gastroenterology. 2011;140:1556-1563.e6. [PubMed] |
| 31. | Benoit M, Dormond-Meuwly A, Demartines N, Dormond O. Targeting the JNK signaling pathway potentiates the antiproliferative efficacy of rapamycin in LS174T colon cancer cells. J Surg Res. 2011;167:e193-e198. [PubMed] [DOI] |