修回日期: 2011-08-19
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 体外研究shRNA(short hairpin RNA)沉默基因TRAF6的表达对RAW264.7细胞增殖的影响, 初步探讨TRAF6-shRNA对LPS/TLR4胞内信号转导的影响.
方法: 构建靶向抑制小鼠TRAF6的shRNA的真核表达载体, 转染RAW264.7细胞后培养48 h, 予以终浓度为100 ng/mL的LPS刺激, 0、4、8 h和16 h后收集细胞上清, 同时设空白对照及地塞米松阳性对照组, ELISA法测定上清液中TNF-α、IL-1β、TGF-β1, Real-time PCR方法检测TRAF6、IL-6、COX-2 mRNA, Western blot检测细胞核内NF-κB p65.
结果: 转染TRAF6-shRNA 48 h后, TRAF6 mRNA及蛋白表达明显受到抑制, 其抑制率分别为79.17%、68.74%. MTT法检测结果显示, 重组质粒转染72 h内对细胞增殖无明显的抑制. LPS刺激后, TNF-α、IL-1β、TGF-β1表达量都有明显变化(P<0.01), 其中TNF-α、IL-1β在8 h达高峰, TGF-β1在16 h达高峰, TRAF6 基因沉默后, 以上细胞因子增长率明都显下降(P<0.01). 实验结果显示, TRAF6基因沉默明显能下调IL-6、COX-2 mRNA表达, 并能抑制LPS激活的NF-κB核转位.
结论: 重组质粒TRAF6-shRNA能有效降低RAW264.7细胞中基因TRAF6 mRNA及蛋白的表达, 并对内毒素炎症反应具有明显的抑制效应.
引文著录: 陈锋, 孙继民, 何生松, 庞然, 许娟娟, 董继华. TRAF6 shRNA对LPS/TLR4信号传导通路的体外干预作用. 世界华人消化杂志 2011; 19(25): 2637-2643
Revised: August 19, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To investigate the impact of small hairpin RNA (shRNA)-mediated silencing of the tumor necrosis factor receptor-associated factor 6 (TRAF6) gene on the lipopolysaccharide (LPS)/toll-like receptor (TLR) 4 signaling pathway in vitro.
METHODS: ShRNA sequences targeting the TRAF6 gene were designed, synthesized and used to construct eukaryotic expression plasmids. After transfection of the recombinant plasmids into RAW264.7 cells, cell proliferation was measured by methyl thiazolyl tetrazolium (MTT) assay. Inflammatory cellular models were established by LPS stimulation. Levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and transforming growth factor-β1 (TGF-β1) in the supernatants, mRNA expression of TRAF6, interleukin-6 (IL-6) and cyclooxygenase-2 (COX-2), protein expression of TRAF6, and translocation of NF-κB were assayed by ELISA, real-time quantitative PCR and Western blot, respectively.
RESULTS: The mRNA and protein expression of TRAF6 was lower in cells transfected with TRAF6-shRNA1 or TRAF6-shRNA2 (79.17% and 68.74%, respectively) compared to other groups. Therefore, cells transfected with pGCsi-TRAF6-shRNA1 or 2 were used for subsequent experiments. TRAF6 knockdown significantly inhibited the proliferation of RAW264.7 cells within 72 h after transfection, reduced the production of pro-inflammatory cytokines and mediators including TNF-α, IL-1β, IL-6 and COX-2, and inhibited NF-κB nuclear translocation. Moreover, TRAF6 knockdown could suppress the release of TGF-β1 at the protein level.
CONCLUSION: TRAF6 knockdown can, to some extent, inhibit early inflammatory response stimulated by LPS. TRAF6 may become a potential therapeutic target for many inflammation-related diseases.
- Citation: Chen F, Sun JM, He SS, Pang R, Xu JJ, Dong JH. ShRNA-mediated silencing of the TRAF6 gene inhibits LPS/TLR4 signaling in vitro. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2637-2643
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2637.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2637
肿瘤坏死因子受体相关因子(tumour necrosis factor-receptor-associated factors, TRAFs)家族成员是一类多功能的胞内衔接蛋白, TRAFs蛋白交织于一系列信号传导网络中, 从而影响细胞的生存、增殖、分化和死亡, 参与多个生物学过程的调控. 在细菌脂多糖(lipopolysaccharide, LPS)激活的信号核因子κB(nuclear factor-κB, NF-κB)通路中, 肿瘤坏死因子受体相关因子6(tumour necrosis factor-receptor-associated factor-6, TRAF6)作为LPS/TLR4下游信号通路的调节子, 可介导多条信号通路(TNF-α、IL-1和RANKL通路)[1], 最终激活转录因子NF-κB、AP-1、PKB/Akt等, 介导病原体相关分子模式(pathogen -associated molecular pattern, PAMP)引起的天然和获得性免疫及炎症反应[2,3]. 近年来研究证明, 单核巨噬细胞通过分泌表达多种炎症相关因子, 在急性肝衰竭炎症反应中占有重要地位. 在医学实验中, RAW264.7巨噬细胞经内毒素刺激被广泛用作炎症细胞模型, 用于抗炎药物效果研究[4]. 因此, 本实验设计构建重组质粒pGCsi-TRAF6-shRNA, 利用RNA干扰(RNA interference, RNAi)技术, 以小鼠RAW264.7单核巨噬细胞系为研究对象, 研究体外抑制TRAF6表达和功能对逆转或减慢内毒素炎症反应的影响.
RAW264.7细胞由华中科技大学同济医学院附属协和医院中心实验室董继华主任惠赠; 重组质粒pGCsi-TRAF6-shRNA由本实验室前期构建; 质粒中提试剂盒购自Omega公司; 胎牛血清(FCS)购自杭州四季青生物公司; DMEM高糖培养基购自美国Gibco公司; 脂质体Trans Fectin购自美国Bio-Rad公司; TRIzol、MTT、DMSO、LPS购自美国Invitrogen公司; 逆转录试剂盒、SYBR Green realtime PCR试剂盒购自ToYoBo公司; ELISA试剂盒(TNF-α、IL-1β、TGF-β1)购自美国Cusabio公司; TRAF6多克隆抗体购自Santa Cruz公司.
1.2.1 pGCsi-TRAF6-shRNA真核表达载体的构建及鉴定: 以GenBank已公布的小鼠TRAF6 mRNA序列(NM009424)为参考序列, 用美国Invitrogen公司的在线设计软件BLOCK-iTTM RNAi Designer, 筛选出4条理论上最佳siRNA序列: shRNA1(900-920)、shRNA2(1303-1323)、shRNA3(2324-2344)、shRNA4(3285-3305). LOOP结构选用了TCAA GAG, 末端以polyT作为RNA聚合酶Ⅲ终止信号, 两端设计有BamHⅠ和HindⅢ酶切位点. shRNA寡核苷酸序列及Negative-shRNA表达载体由北京毅新兴业科技有限公司合成提供. 构建的真核表达载体进行酶切和测序鉴定完全正确[5].
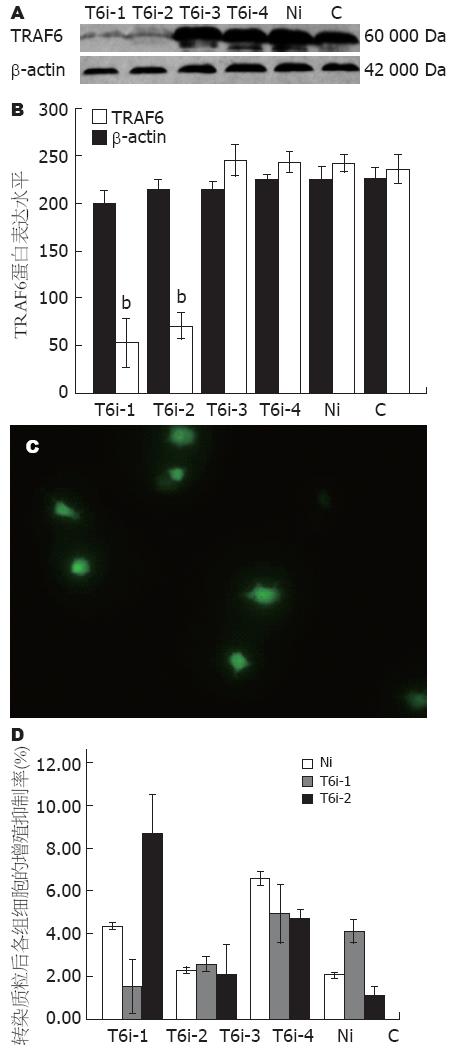
1.2.2 细胞培养及转染: 用高糖DMEM培养基(含100 mL/L FCS, 100 kU/L的青霉素/链霉素)在50 mL/L CO2, 37 ℃, 饱和湿度的条件下培养RAW264.7细胞. 转染前24 h, 胰酶消化细胞, 将细胞接种于6孔板, 当细胞汇合度约70%-90%时进行转染. 分别用250 μL无血清培养基稀释DNA和Trans Fectin, 将DNA(g)/Trans Fectin(L)按2∶5比例混合, 室温孵育20 min后, 将500 μL混合物加入到含血清培养基的细胞中, 转染4 h后更换培养基, 第2天重复转染1次. 实验分为正常对照组(C组)、阴性对照组(转染Negative-shRNA表达载体的细胞, 即Ni组)和重组质粒转染组(转染pGCsi-TRAF6-shRNA-1, 2, 3, 4表达载体, 即T6i-1, 2, 3, 4组), 每组均设3个复孔. 在第2次转染48 h后在荧光显微镜下观察表达绿色荧光的细胞, 以Western blot检测TRAF6(抗体1∶200)蛋白的表达, 通过预实验发现重组表达载体pGCsi-TRAF6-shRNA1, 2的干扰作用较强, 故选择pGCsi-TRAF6-shRNA1, 2进行后继实验.
1.2.3 MTT法检测: 将处于对数生长期的RAW264.7细胞以3×104个/孔的密度接种于96孔培养板, 37 ℃、50 mL/L CO2条件下培养24 h后进行转染, 分别于第二次转染后0、24、48、72 h, 每孔加入MTT(5 g/L)20 μL, 4 h后吸弃孔内培养上清, 每孔再加入二甲基亚砜(DMSO)150 μL, 振荡10 min, 在酶联免疫检测仪上用490 nm波长检测吸光度(A), 每组设6个复孔, 用只含培养液无细胞的空白孔调零, 计算抑制率, 比较各组细胞的存活情况, 抑制率(%) = (1-A实验组/A对照组)×100%.
1.2.4 实验分组及处理: 将细胞接种于培养板上培养24 h后, 转染质粒pGCsi-TRAF6-shRNA1、2, 第2次转染48 h后, 予100 μg/L LPS刺激, 同时设4个对照组: (1)阳性对照组: 用LPS处理的同时加用地塞米松(DM)0.5 mg/L干预; (2)阴性对照组: 转染Negative-shRNA质粒后用LPS处理; (3)空白对照组: 用100 μg/L LPS处理而不用质粒转染; (4)正常对照组: 不用质粒转染也不用LPS处理. 每组3个复孔.
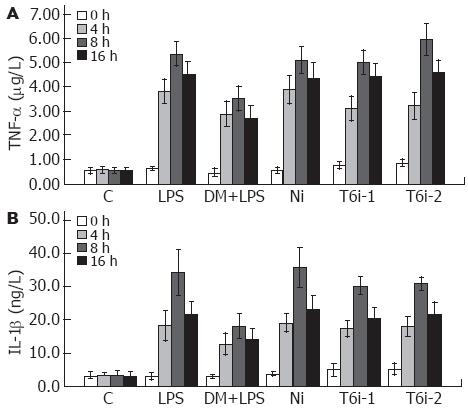
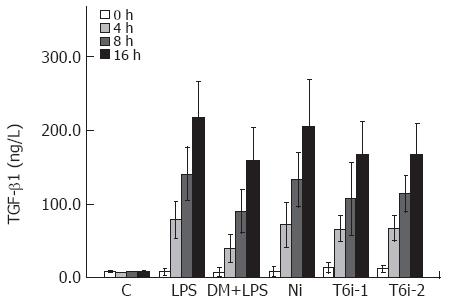
1.2.5 细胞因子TNF-α、IL-1β、TGF-β1检测: LPS刺激0、4、8、16 h后, 分别收集各组细胞上清, -70 ℃贮存待检, 酶联免疫吸附法测定TNF-α、IL-1β及TGF-β1, 按试剂盒说明书要求操作.
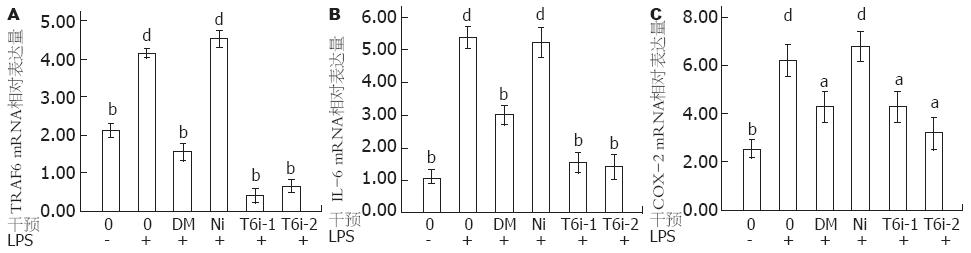
1.2.6 荧光定量PCR检测TRAF6、IL-6、COX-2 mRNA表达: LPS刺激24 h后, 分别收集各组细胞, 提取总RNA, 测定A260/A280为1.75-1.95. 取2 μg RNA, 应用逆转录试剂盒按20 μL逆转录体系合成cDNA. PCR引物由应用软件Prima5.0设计(表1), 由上海生工合成. 荧光定量PCR反应体系为25 μL, 内含500 ng cDNA模板, 终浓度为250 nmol/L的上下游引物及SYBR Green Realtime PCR Master Mix 12.5 μL. 反应条件为95 ℃ 60 s; 95 ℃ 15 s; 退火 15 s; 72 ℃ 45 s, 荧光收集, 40个循环. 每个样本重复3次. 以相对CT值(即2-ΔΔCt)表示目的基因的相对表达量[6], 以空白细胞为对照.
| 基因 | 引物序列 | 退火温度(℃) |
| TRAF6 | forward 5'-AAGATTGGCAACTTTGGGATG-3' | |
| reverse 5'-GTGGGATTGTGGGTCGCTG-3' | 59 | |
| IL-6 | forward5'- CCACGGCCTTCCCTACTTC-3' | |
| reverse 5'- CTCATTTCCACGATTTCCCAG-3' | 58 | |
| COX-2 | forward5'-GAAGTCTTTGGTCTGGTGCCTG-3' | |
| reverse 5'-GTCTGCTGGTTTGGAATAGTTGC-3' | 58 | |
| β-actin | forward 5'-CCGTGAAAAGATGACCCAG-3' | |
| reverse 5'-TAGCCACGCTCGGTCAGG-3' | 60 |
1.2.7 Western blot检测细胞核内NF-κB p65的表达: LPS刺激24 h后, 4 ℃ PBS溶液洗涤细胞3次, 按试剂盒说明提取核蛋白, -70 ℃保存, 考马斯亮蓝法检测样品蛋白浓度. 取20 μg总蛋白, 上样于10% SDS-聚丙烯酰胺凝胶, 电泳后转膜, 5%脱脂奶粉封闭液室温孵育45 min, 分别加入NF-κB p65抗体(1∶500)和β-actin蛋白抗体, 4℃过夜, 辣根过氧化物酶二抗(1∶3 000)室温孵育1 h, 显色后以β-actin为内参照, 用AlphaEaseFC 4.0图像分析软件进行灰度分析.
统计学处理 数据整理后, 所有计量资料均用mean±SD表示, 应用SPSS15.0统计软件处理数据, 两组数据间比较采用配对资料t检验, 多组数据间比较采用单因素方差分析(One-way ANOVA), P<0.05为差异有统计学意义.
T6i-1, 2组与C组、Ni组相比, TRAF6蛋白表达均显著下降(P<0.01), 实验结果表明pGCsi-TRAF6-shRNA1, 2在蛋白水平上显著地抑制TRAF6的表达(图1A, B), 其抑制率(以空白对照组的AVG值为100%)分别为79.17%、68.74%. T6i-3, 4组与C组、Ni组之间的差异均无显著性意义(P>0.05).
转染特异性shRNA重组质粒0、24、48和72 h后, 同时间点Ni组与C组比较, 差异无显著性意义, 同时间点T6i-1, 2组与Ni组比较, 差异也无统计学意义, 表明抑制TRAF6表达的shRNA对体外培养的RAW 264.7的增殖无明显抑制作用(表2, 图1D).
| 时间 (h) | 正常对照(C)组 (A490值) | 阴性对照(Ni)组 | T6i-1组 | T6i-2组 | |||
| A490值 | 抑制率 | A490值 | 抑制率(%) | A490值 | 抑制率(%) | ||
| 0 | 0.23±0.06 | 0.22±0.02 | 4.35±0.06 | 0.23±0.11 | 1.53±0.57 | 0.21±0.13 | 8.69±0.72 |
| 24 | 0.39±0.02 | 0.40±0.08 | 2.26±0.05 | 0.38±0.06 | 2.56±0.14 | 0.40±0.10 | 2.08±0.56 |
| 48 | 0.61±0.07 | 0.57±0.03 | 6.56±0.13 | 0.58±0.07 | 4.92±0.55 | 0.58±0.04 | 4.71±0.17 |
| 72 | 0.98±0.04 | 0.96±0.03 | 2.04±0.07 | 0.94±0.05 | 4.08±0.23 | 0.97±0.08 | 1.02±0.23 |
LPS刺激后, TNF-α、IL-1β分泌量显著增高, 二者均于8 h达高峰. 由于各组细胞在LPS刺激时存在细胞数不同, 数据经转换成增长率后, 即增长率 = (样品含量/对照组含量-1)×100%, 可见T6i-1, 2组经LPS刺激后, 其TNF-α、IL-1β的增长速度明显低于空白对照(LPS)组(P<0.01, 增长率数据未显示), 说明重组质粒pGCsi-TRAF6-shRNA-1, 2转染入RAW264.7细胞后可明显抑制促炎细胞因子TNF-α、IL-1β的分泌(图2).
LPS刺激后, 各组细胞TGF-β1表达变化呈上调趋势, 8 h内与TNF-α、IL-1β比较, 其表达变化趋势相对较缓, 并且TGF-β1表达量于16 h达高峰, 迟于TNF-α、IL-1β. Ni组和LPS组的增长率在8 h和16 h时明显高于T6i-1, 2组(均P<0.01, 增长率数据未显示), 说明TRAF6-shRNA也可明显抑制TGF-β1的分泌(图3).
野生型RAW264.7细胞中TRAF6 mRNA的表达量相对较低, 以LPS刺激后TRAF6 mRNA的表达明显增加(P<0.01), T6i-1组转染后细胞, 其TRAF6 mRNA表达与正常对照组比较明显下降, 证明TRAF6-shRNA1的沉默效应最为显著, 与其蛋白检测结果相似(图1A, B). TRAF6基因沉默可明显下调LPS刺激后IL-6和COX-2 mRNA的表达(P<0.05或0.01, 图4).
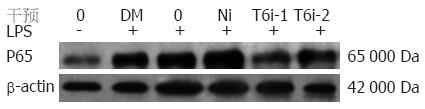
RAW264.7细胞在无LPS刺激时, 细胞核NF-κB p65表达量很少, LPS刺激后NF-κB p65表达显著增高, 阴性对照组和空白对照组的NF-κB p65表达条带明显大于T6i-1和T6i-2组(图5), 提示转染TRAF6-shRNA后, 能明显降低NF-κB p65核转位.
LPS是革兰氏阴性杆菌生长时释放或死亡时裂解出来的细胞壁脂多糖成分, 是最常见的炎症反应激活因子, 主要通过与单核-巨噬细胞系统的TLR4相结合而诱导相应的生物效应. LPS信号首先经TLR4胞内段与髓性分化蛋白88(myeloid differentiation factor 88, MyD88)的TLR结构域相作用[7], 进而寡聚白介素-1受体相关激酶(interleukin-1 receptor associated kinase, IRAK), 导致IRAK-1磷酸化, 活化后的IRAK-1与TRAF6形成复合物, 最终激活NF-κB和AP-1, 导致TNF-α、IL-1、IL-6等一系列炎症细胞因子的大量表达, 引起组织损伤[8-10]. 从LPS导致炎症反应的多条途径看, 阻断MyD88到TRAF6段, 既能一定程度上有效阻断内毒素效应, 又不干扰机体防御细菌感染的正常功能.
TRAF6是LPS/TLR4信号转导通路中的重要衔接蛋白, 他既可激活NF-κB诱导激酶(NF-κB-inducing kinase, NIK), 又可激活Toll信号进化保守中介分子进而激活丝裂素活化蛋白激酶/ERK 激酶激酶(mitogen-activated protein kinase/ERK kinase kinase-1, MEKK-1), 是MyD88依赖性信号转导途径主要蛋白分子[11]. Loniewski等[12]发现TRAF6基因沉默显著降低LPS诱导的c-Jun氨基末端激酶(c-Jun amino terminal kinase, JNK)和I-κB磷酸化. Yang等[13]研究发现TRAF6缺失的肥大细胞IL-6、CCL-9、IL-13合成障碍并且细胞表面的FcεRⅠ型聚集障碍, 从而抑制炎症反应以及肥大细胞脱颗粒释放活性介质. Machado等[14]研究证实脂氧素介导的TRAF6降解可显著抑制树突状细胞产生炎症因子. 因此, TRAF6作为一种重要的NF-κB调节因素, 是LPS信号转导的关键调控分子.
本实验结果显示, 重组质粒pGCsi-TRAF6-shRNA-1, 2能有效抑制TRAF6 mRNA和蛋白表达, 说明重组质粒有效地抑制了TRAF6基因的表达. 有研究发现, TRAF6基因敲除可导致多种组织器官生理功能紊乱, 甚至早亡, Lomaga等[15]发现TRAF6-/-小鼠常在胚胎期或出生后立即死亡, 因此, 分析研究TRAF6基因敲除小鼠存在一定困难. 从本实验MTT检测来看, 重组质粒转染72h内对细胞增殖无明显的抑制, 说明TRAF6沉默基因在短时间内对细胞生存无明显影响.
RNAi是通过双链RNA(dsRNA)在细胞内特异性地诱导与之同源互补的mRNA降解, 从而引发基因转录后水平沉默的现象[16]. RNAi技术可以快速, 方便, 廉价地的提供相关基因的作用功能[17-20]. 因此, 本实验利用RNAi 技术, 观察TRAF6 siRNA对炎症反应的干预作用. 实验发现, 正常RAW264.7细胞中TRAF6 mRNA表达的量相对较低, LPS刺激后, TRAF6 mRNA的表达量明显增加, 说明TRAF6 mRNA表达与LPS刺激存在明确的量效关系.
近年来研究证明, TNF-α作为早期炎症细胞因子, 可通过其他炎症细胞因子(IL-1β、IL-6等)扩大其生物学作用[21], IL-1β和IL-6自分泌或旁分泌方式影响其他细胞因子和炎症介质的分泌, 诱导抗原递呈细胞表面免疫分子的表达, 从而作为T细胞和B细胞的激活和分化因子, 可介导免疫球蛋白的分泌, 激活补体、杀伤细胞和吞噬细胞, 增强免疫反应介导的组织损伤[22]. 虽然, 上调这些细胞因子是机体防御细菌感染的主要机制, 但其过度表达可以造成机体免疫紊乱和炎症损伤. 实验结果显示, 炎症发生过程中, TNF-α、IL-1β表达量都有明显变化, 并在短时间内达高峰. 阻断TRAF6后, TNF-α、IL-1β表达量明显减少, 其增长率也明显下降, 并且LPS刺激后IL-6 mRNA的表达量明显下调.
TGF-β1是重要的免疫调节性细胞因子, 能抑制巨噬细胞激活, 参与炎症组织修复、免疫抑制等[23,24]. 因此, 为了证实阻断TRAF6具有对致炎和抗炎细胞因子的双重调节作用, 本实验选择同时检测TGF-β1水平. 研究发现, 细胞上清中, 正常细胞TGF-β1表达量极少, 随着LPS刺激时间延长, 其分泌量升高, 但升高趋势较缓. TRAF6基因沉默后, TGF-β1增长率明显下降. 结果表明, 部分阻断LPS/TLR4信号通路不仅能抑制促炎症细胞因子(TNF-α、IL-1β、IL-6)增长, 也能抑制抗炎症细胞因子(TGF-β1)的分泌.
NF-κB是参与炎症反应的一类重要转录因子, 在炎症反应中起重要的枢纽作用, 参与调控一系列介导炎症反应的基因表达[25-27], 其中包括诱导型COX-2基因的表达[28,29]. 作为调节前列腺素合成的关键酶, COX-2是病理状态下过度炎症反应的诱导酶类之一[30,31]. 实验结果显示, TRAF6基因沉默能抑制LPS激活的NF-κB核转位, 并能明显下调LPS刺激后COX-2 mRNA的表达, 可见TRAF6可调控炎症反应中的限速酶, 对炎症起控制作用.
由此可见, TRAF6 siRNA对内毒素炎症反应的初始阶段具有明显的抑制效应. 但实验结果显示TRAF6 siRNA对细胞因子(TNF-α、IL-1β)的抑制效应低于地塞米松, 其机制还需进一步探讨, 以期进一步揭示细胞自身对抗炎反应的调控机制. 下一步实验拟在动物体内证实TRAF6 siRNA对内毒素炎症反应的治疗作用, 为深化炎症相关研究提供新思路.
TRAF6作为介导NF-κB信号转导的一个关键衔接蛋白, 在内毒素信号转导通路中起重要作用, 如果能减少TRAF6合成, 就可以减少炎症因子的释放, 既能一定程度上有效阻断内毒素炎症反应, 又不干扰机体防御细菌感染的正常功能. RNAi技术能高效、特异地阻抑细胞内源或外源性靶基因的表达, 已应用于基因功能、肿瘤等的研究.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科
多种信号通路参与炎症反应, 其分子机制复杂, TRAF6是否是LPS/TLR4信号传导通路中的关键靶点有待进一步的研究.
近年研究表明, TRAF6不仅是LPS信号转导的关键调控分子, 还在TLR/IL-1R介导炎症反应和天然免疫信号通路中起重要作用, 2008年Yang等研究发现TRAF6缺失的肥大细胞IL-6、CCL-9、IL-13合成障碍并且细胞表面的FcεRⅠ型聚集障碍, NF-κB p65合成减少, 从而抑制炎症反应.
本研究通过构建靶向抑制小鼠TRAF6 shRNA的真核表达载体, 转染RAW264.7细胞, 采用分子生物学方法检测RAW264.7细胞增殖及LPS/TLR4信号传导通路中相关炎性因子和NF-κB p65蛋白和/或mRNA表达变化, 表明抑制TRAF6功能, 能够显著降低炎性刺激反应, 具有重要的理论参考价值.
在LPS/TLR4信号传导通路中, TRAF6基因沉默明显下调炎性细胞因子(TNF-α、IL-1β、TGF-β1、IL-6、COX-2)和NF-κB p65蛋白和/或mRNA表达, 从而抑制内毒素炎症反应, 为临床治疗多种全身炎症反应性疾病, 寻求更为合适的作用靶点提供新的实验佐证.
本研究通过抑制小鼠TRAF6基因表达, 揭示给予炎性刺激因子LPS刺激后, 能够显著降低炎性刺激反应, 为临床防治炎性因子刺激所致的炎症反应, 具有重要的理论参考价值.
编辑: 李军亮 电编:何基才
| 1. | Doyle SL, O'Neill LA. Toll-like receptors: from the discovery of NFkappaB to new insights into transcriptional regulations in innate immunity. Biochem Pharmacol. 2006;72:1102-1113. [PubMed] [DOI] |
| 2. | Wu H, Arron JR. TRAF6, a molecular bridge spanning adaptive immunity, innate immunity and osteoimmunology. Bioessays. 2003;25:1096-1105. [PubMed] [DOI] |
| 3. | Asagiri M, Takayanagi H. The molecular understanding of osteoclast differentiation. Bone. 2007;40:251-264. [PubMed] [DOI] |
| 4. | Kim KM, Kwon YG, Chung HT, Yun YG, Pae HO, Han JA, Ha KS, Kim TW, Kim YM. Methanol extract of Cordyceps pruinosa inhibits in vitro and in vivo inflammatory mediators by suppressing NF-kappaB activation. Toxicol Appl Pharmacol. 2003;190:1-8. [PubMed] [DOI] |
| 6. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 7. | Hwang TH, Yoon BC, Jeong JS, Seo SY, Lee HJ. A single administration of adenoviral-mediated HGF cDNA permits survival of mice from acute hepatic failure. Life Sci. 2003;72:851-861. [PubMed] [DOI] |
| 8. | Qiu L, Song L, Yu Y, Zhao J, Wang L, Zhang Q. Identification and expression of TRAF6 (TNF receptor-associated factor 6) gene in Zhikong scallop Chlamys farreri. Fish Shellfish Immunol. 2009;26:359-367. [PubMed] [DOI] |
| 9. | Belladonna ML, Vacca C, Volpi C, Giampietri A, Fioretti MC, Puccetti P, Grohmann U, Campanile F. IL-23 neutralization protects mice from Gram-negative endotoxic shock. Cytokine. 2006;34:161-169. [PubMed] [DOI] |
| 10. | Triantafilou M, Brandenburg K, Kusumoto S, Fukase K, Mackie A, Seydel U, Triantafilou K. Combinational clustering of receptors following stimulation by bacterial products determines lipopolysaccharide responses. Biochem J. 2004;381:527-536. [PubMed] [DOI] |
| 11. | Kobayashi T, Kim TS, Jacob A, Walsh MC, Kadono Y, Fuentes-Pananá E, Yoshioka T, Yoshimura A, Yamamoto M, Kaisho T. TRAF6 is required for generation of the B-1a B cell compartment as well as T cell-dependent and -independent humoral immune responses. PLoS One. 2009;4:e4736. [PubMed] [DOI] |
| 12. | Loniewski KJ, Patial S, Parameswaran N. Sensitivity of TLR4- and -7-induced NF kappa B1 p105-TPL2-ERK pathway to TNF-receptor-associated-factor-6 revealed by RNAi in mouse macrophages. Mol Immunol. 2007;44:3715-3723. [PubMed] [DOI] |
| 13. | Yang YJ, Chen W, Carrigan SO, Chen WM, Roth K, Akiyama T, Inoue J, Marshall JS, Berman JN, Lin TJ. TRAF6 specifically contributes to FcepsilonRI-mediated cytokine production but not mast cell degranulation. J Biol Chem. 2008;283:32110-32118. [PubMed] [DOI] |
| 14. | Machado FS, Esper L, Dias A, Madan R, Gu Y, Hildeman D, Serhan CN, Karp CL, Aliberti J. Native and aspirin-triggered lipoxins control innate immunity by inducing proteasomal degradation of TRAF6. J Exp Med. 2008;205:1077-1086. [PubMed] [DOI] |
| 15. | Lomaga MA, Henderson JT, Elia AJ, Robertson J, Noyce RS, Yeh WC, Mak TW. Tumor necrosis factor receptor-associated factor 6 (TRAF6) deficiency results in exencephaly and is required for apoptosis within the developing CNS. J Neurosci. 2000;20:7384-7393. [PubMed] |
| 16. | Tian X, Zhang P, Zamek-Gliszczynski MJ, Brouwer KL. Knocking down transport: applications of RNA interference in the study of drug transport proteins. Drug Metab Rev. 2005;37:705-723. [PubMed] [DOI] |
| 17. | George J, Tsutsumi M. siRNA-mediated knockdown of connective tissue growth factor prevents N-nitrosodimethylamine-induced hepatic fibrosis in rats. Gene Ther. 2007;14:790-803. [PubMed] [DOI] |
| 18. | Song E, Lee SK, Wang J, Ince N, Ouyang N, Min J, Chen J, Shankar P, Lieberman J. RNA interference targeting Fas protects mice from fulminant hepatitis. Nat Med. 2003;9:347-351. [PubMed] [DOI] |
| 19. | Kim KH, Kim HC, Hwang MY, Oh HK, Lee TS, Chang YC, Song HJ, Won NH, Park KK. The antifibrotic effect of TGF-beta1 siRNAs in murine model of liver cirrhosis. Biochem Biophys Res Commun. 2006;343:1072-1078. [PubMed] [DOI] |
| 20. | Gopalakrishnan B, Wolff J. siRNA and DNA transfer to cultured cells. Methods Mol Biol. 2009;480:31-52. [PubMed] [DOI] |
| 21. | Schwabe RF, Brenner DA. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. Am J Physiol Gastrointest Liver Physiol. 2006;290:G583-G589. [PubMed] [DOI] |
| 22. | Navarrete-Reyes AP, Montaña-Alvarez M. [Inflammaging. Aging inflammatory origin]. Rev Invest Clin. 2009;61:327-336. [PubMed] |
| 23. | Huynh ML, Fadok VA, Henson PM. Phosphatidylserine-dependent ingestion of apoptotic cells promotes TGF-beta1 secretion and the resolution of inflammation. J Clin Invest. 2002;109:41-50. [PubMed] |
| 24. | Otsuka M, Negishi Y, Aramaki Y. Involvement of phosphatidylinositol-3-kinase and ERK pathways in the production of TGF-beta1 by macrophages treated with liposomes composed of phosphatidylserine. FEBS Lett. 2007;581:325-330. [PubMed] [DOI] |
| 25. | Viatour P, Merville MP, Bours V, Chariot A. Phosphorylation of NF-kappaB and IkappaB proteins: implications in cancer and inflammation. Trends Biochem Sci. 2005;30:43-52. [PubMed] [DOI] |
| 26. | Zhou Z, Wang L, Song Z, Saari JT, McClain CJ, Kang YJ. Abrogation of nuclear factor-kappaB activation is involved in zinc inhibition of lipopolysaccharide-induced tumor necrosis factor-alpha production and liver injury. Am J Pathol. 2004;164:1547-1556. [PubMed] [DOI] |
| 27. | Dambach DM, Andrews BA, Moulin F. New technologies and screening strategies for hepatotoxicity: use of in vitro models. Toxicol Pathol. 2005;33:17-26. [PubMed] [DOI] |
| 28. | Jamaluddin M, Tian B, Boldogh I, Garofalo RP, Brasier AR. Respiratory syncytial virus infection induces a reactive oxygen species-MSK1-phospho-Ser-276 RelA pathway required for cytokine expression. J Virol. 2009;83:10605-10615. [PubMed] [DOI] |
| 29. | Aggarwal BB, Sung B. The relationship between inflammation and cancer is analogous to that between fuel and fire. Oncology (Williston Park). 2011;25:414-418. [PubMed] |
| 30. | Tsatsanis C, Androulidaki A, Venihaki M, Margioris AN. Signalling networks regulating cyclooxygenase-2. Int J Biochem Cell Biol. 2006;38:1654-1661. [PubMed] [DOI] |
| 31. | Jain S, Chakraborty G, Raja R, Kale S, Kundu GC. Prostaglandin E2 regulates tumor angiogenesis in prostate cancer. Cancer Res. 2008;68:7750-7759. [PubMed] [DOI] |