修回日期: 2011-08-23
接受日期: 2011-08-26
在线出版日期: 2011-08-28
目的: 评价益生菌制剂治疗轻微型肝性脑病(minimal hepatic encephalopathy, MHE)的疗效.
方法: 检索PubMed、EMBASE、Web of Science、The Cochrane Central Register of Controlled Trials、中国期刊全文数据库、中国科技期刊数据库(维普)、万方数字化期刊全文数据库等关于益生菌制剂治疗MHE的临床随机对照试验(RCT), 使用Cochrane图书馆提供的Review Manager 4.3软件对入选试验进行荟萃分析.
结果: 共9项试验满足纳入标准而入选本研究, 荟萃分析表明: 与对照组相比, 益生菌制剂可明显缩短数字连接试验(NCT)反应时间(WMD = 13.60, 95%CI: 1.53-25.66, P = 0.03), 有效降低血氨水平(SMD = 0.98, 95%CI: 0.25-1.71, P = 0.008), 减轻内毒素血症(SMD = 1.03, 95%CI: 0.65-1.42, P<0.00001), 改善ALT 水平(WMD = 11.72, 95%CI: 5.57-17.88, P = 0.0002), 并降低临床肝性脑病的发生率(RR = 0.15, 95%CI: 0.05-0.41, P = 0.0002).
结论: 益生菌制剂可改善MHE患者临床及部分生化指标, 降低MHE发展为临床肝性脑病的几率, 有可能成为MHE治疗的新选择.
引文著录: 汤绍辉, 王旷靖, 吴小娟, 张嫚嫚. 益生菌制剂治疗轻微型肝性脑病的荟萃分析. 世界华人消化杂志 2011; 19(24): 2587-2592
Revised: August 23, 2011
Accepted: August 26, 2011
Published online: August 28, 2011
AIM: To evaluate the efficacy of probiotics in the treatment of minimal hepatic encephalopathy.
METHODS: PUBMED, EMBASE, Web of Science, The Cochrane Central Register of Controlled Trials, Chinese Journals Full-text Database, Chinese Biomedical Database and Wan Fang Digital Journal Full-text database were searched to retrieve randomized controlled trials evaluating the efficacy of probiotics in the treatment of minimal hepatic encephalopathy. Statistical analysis was performed using Review Manager 4.3.
RESULTS: Nine randomized controlled trials were included. Compared to the control group, probiotics significantly decreased serum ammonia (SMD = 0.98, 95%CI: 0.25-1.71, P = 0.008), endotoxin (SMD = 1.03, 95%CI: 0.65-1.42, P < 0.00001) and ALT (WMD = 11.72, 95%CI: 5.57-17.88, P = 0.0002), shortened the time of number connection test (NCT) (WMD = 13.60, 95%CI: 1.53-25.66, P = 0.03), and reduced morbidity of clinical hepatic encephalopathy (RR = 0.15, 95%CI: 0.05-0.41, P = 0.0002).
CONCLUSION: Probiotics can significantly improve some clinical and biochemical parameters in patients with minimal hepatic encephalopathy, decrease the morbidity of clinical hepatic encephalopathy and may become a new choice for the treatment of minimal hepatic encephalopathy.
- Citation: Tang SH, Wang KJ, Wu XJ, Zhang MM. Efficacy of probiotics in the treatment of minimal hepatic encephalopathy: a metaanalysis. Shijie Huaren Xiaohua Zazhi 2011; 19(24): 2587-2592
- URL: https://www.wjgnet.com/1009-3079/full/v19/i24/2587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i24.2587
轻微型肝性脑病(minimal hepatic encephalopathy, MHE)以前被称为隐性或亚临床型肝性脑病, 是指无明显临床表现和生化异常, 仅能用精细的智力试验和(或)电生理检测才可作出诊断的肝性脑病[1]. MHE是肝硬化常见并发症, 国外有报道显示肝硬化患者MHE的发病率为30%-84%[2], 国内曾峥等[3]对409例肝硬化患者进行智力测验发现MHE的发病率达51.3%. MHE患者病情隐蔽性强, 神经认知功能存在障碍, 操作能力及应激能力减低, 尤其对于从事高空作业或机械驾驶者, 存在易发生意外的隐患[4,5]. 因此早期诊断及治疗MHE具有重要意义, 并受到国内外学者广泛重视. MHE的病因和发病机制目前尚不十分明确, 迄今尚无一种治疗方法或药物对所有患者都有肯定的疗效. 近年来, 一些学者开展了应用益生菌制剂进行治疗MHE的临床研究, 但各自报道的疗效并不一致, 且多数研究样本量较小. 为此, 本文通过选择随机对照试验(randomized controlled trial, RCT)进行分析, 探讨益生菌制剂对MHE的治疗价值, 并为临床应用提供客观依据.
中文检索词包括益生菌、轻微型肝性脑病、亚临床型肝性脑病、治疗, 英文检索词包括 probiotics、minimal hepatic encephalopathy、subclinical hepatic encephalopathy、treatment. 采用计算机和手工相结合的方法检索PubMed、EMBase、Web of Science、The Cochrane Central Register of Controlled Trials、CNKI-中国期刊全文数据库、中国科技期刊数据库(维普)、万方数字化期刊全文数据库、中国生物医学文献数据库中于2011-02-28前已发表的关于益生菌制剂治疗轻微型肝性脑病的临床随机对照试验.
1.2.1 纳入标准: 对所查得的文献进行二次选取, 文献纳入标准: (1)公开发表的益生菌与安慰剂、空白对照治疗MHE的临床随机对照试验; (2)研究对象的诊断符合"轻微型肝性脑"或"亚临床型肝性脑病". 文献排除标准: (1)文献综述; (2)非临床随机对照试验; (3)摘要等非全文文献; (4)重复发表的文献.
1.2.2 资料提取与文献质量评价: 由两名评价员分别单独操作计算机和手工检索, 分别选择试验并提取资料, 用统一表格记录所有研究的基本数据, 包括研究的设计者、年份、国家、样本数、治疗方案、疗程、评价指标等. 纳入研究质量评价采用Jadad评分法[6]: (1)作者叙述为随机法; (2)随机方法正确或(和)采用分配隐藏; (3)双盲; (4)描述盲法, 指出对照和研究干预的不可辨别性; (5)全程随访并指出受试完成情况. 每点1分, 总分≥3分为高质量研究, ≤2分为低质量研究. 如意见不一, 双方讨论协商解决.
统计学处理 采用Cochrane协作网提供的Review Manager 4.3版软件进行统计分析. 连续性变量中采用相同标准计算的结局变量应用均差(mean difference, MD) 和均差标准误(standard error of mean difference, SEMD)对结局变量进行比较, 对连续性变量中采用不同标准进行计算的结局变量应用标准均差(standard mean difference, SMD)进行结局变量比较; 对于二分类变量使用相对危险度(relative risk, RR). 两者均采用95%的可信区间(confidence interval, CI)表示, P<0.05表示差异有统计学意义. 试验间的异质性采用统计量I2进行检验, 若试验结果无异质性选择固定效应模型, 有异质性则用随机效应模型.
共检索到文献262篇, 阅读文题、摘要甚至全文后, 有9篇文献符合纳入标准而入选本研究, 英文文献5篇, 中文文献4篇. Jadad评分: 5分3篇, 4分1篇, 3分1篇, 2分4篇(表1). 共有429例患者, 各组基础资料对比无差异, 治疗组使用的益生菌制剂包括单一制剂及复合制剂, 对照组使用安慰剂或空白对照. 疗效评价标准为血氨值, 数字连接试验(number connection test, NCT), 内毒素血症, 肝功能ALT以及临床肝性脑病发生率等指标. 疗程为4-25 wk.
| 研究者 | 受试人数 | 临床用药 | Jadad评分 | 治疗时间(d) | ||
| 益生菌/对照组 | 益生菌组 | 对照组 | 随机方法 | 盲法 总分 | ||
| Liu等[7] 2004 | 20/15 | Synbiotic | 安慰剂 | 随机 | 双盲 4分 | 30 |
| Lat等[8] 2006 | 22/17 | Escherichia coli Nissle | 安慰剂 | 随机数字表 | 双盲 5分 | 84 |
| 刘建生等[9] 2006 | 30/30 | 复合乳酸菌+Vit B | Vit B | 随机 | 非双盲 2分 | 56 |
| Mariano等[10] 2007 | 30/30 | Bifidobacterium+FOS | 安慰剂 | 随机数字表 | 双盲 5分 | 90 |
| 张思泉等[11] 2007 | 25/25 | 贝飞达+常规治疗 | 常规治疗 | 随机 | 非双盲 2分 | 56 |
| Bajaj[12] 2008 | 14/06 | Probiotic yogurt | 安慰剂 | 随机数字表 | 双盲 5分 | 60 |
| Sharma等[13] 2008 | 30/31 | Probiotics + Lactulose | Lactulose | 随机数字表 | 非双盲 3分 | 28 |
| 刘晚珍[14] 2009 | 20/20 | 美常安 +常规治疗 | 常规治疗 | 随机 | 非双盲 2分 | 28 |
| 乔秀玲[15] 2010 | 32/32 | 双歧三联活菌 | Vit B | 随机 | 非双盲 2分 | 175 |
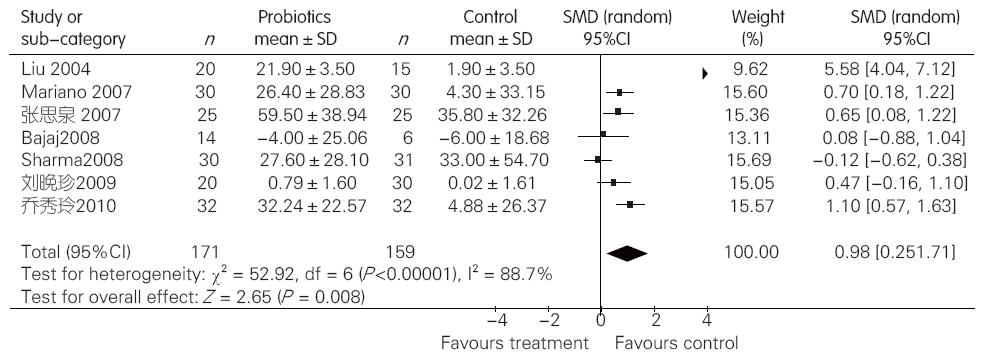
2.2.1 益生菌组与对照组比较对MHE血氨的影响: 7项临床试验提供了益生菌组与对照组对MHE血氨影响的数据. 各研究采用不同血氨检测方法及检测单位, 故采用SMD对血氨指标进行分析. 对纳入的7项临床试验进行异质性检验, 结果显示各研究间存在异质性(I2 = 88.7%, P<0.00001), 于是采用随机效应模型合并效应量. Meta分析结果显示, 与对照组相比, 益生菌制剂可以明显降低MHE患者血氨水平(SMD = 0.98, 95%CI: 0.25-1.71, P = 0.008, 图1).
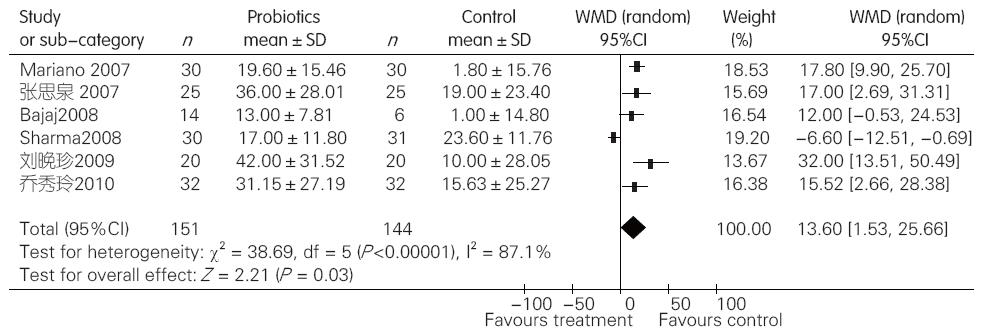
2.2.2 益生菌组与对照组比较对MHE NCT的影响: 对纳入的 6 项临床试验进行异质性检验, 结果显示各研究间存在异质性(I2 = 87.1%, P<0.0001), 于是采用随机效应模型合并效应量. Meta分析结果显示, 与对照组相比, 益生菌制剂可以明显缩短MHE患者数字连接试验(NCT)反应时间(WMD = 13.60, 95%CI: 1.53-25.66, P = 0.03, 图2).
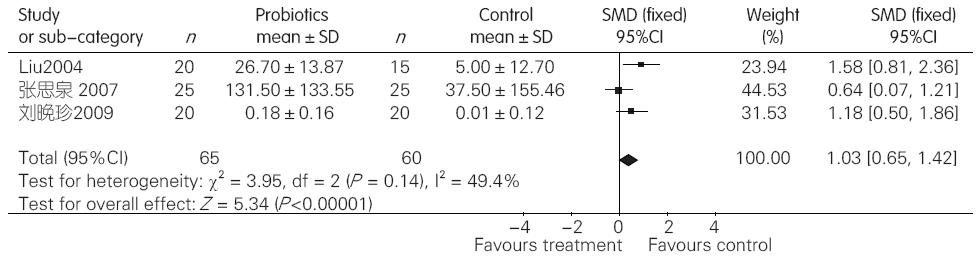
2.2.3 益生菌组与对照组比较对MHE内毒素血症的影响: 3项临床试验提供了益生菌组与对照组对MHE内毒素血症影响的数据. 各研究采用不同内毒素血症检测单位, 故采用SMD对内毒素血症指标进行分析. 对纳入的3项临床试验进行异质性检验, 结果显示各研究间无异质性(I2 = 49.4%, P = 0.14), 于是采用固定效应模型合并效应量. Meta分析结果显示, 与对照组相比, 益生菌制剂可以有效降低MHE患者内毒素水平(SMD = 1.03, 95%CI: 0.65-1.42, P<0.00001, 图3).
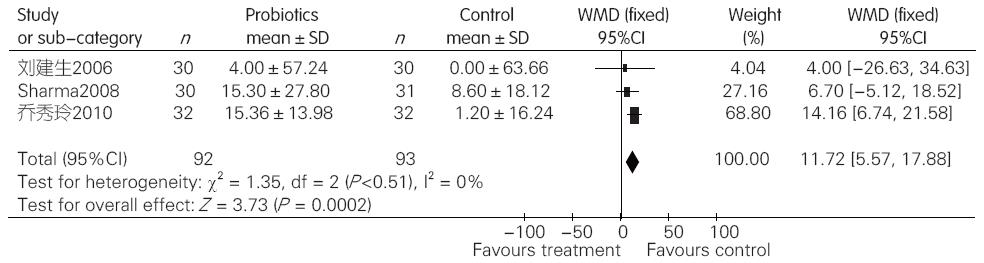
2.2.4 益生菌组与对照组比较对MHE ALT的影响: 对纳入的3项临床试验进行异质性检验, 结果显示各研究间无异质性(I2 = 0%, P = 0.51), 于是采用固定效应模型合并效应量. Meta分析结果显示, 与对照组相比, 益生菌制剂可以改善轻微肝性脑病患者ALT(WMD = 11.72, 95%CI: 5.57-17.88, P = 0.0002, 图4).
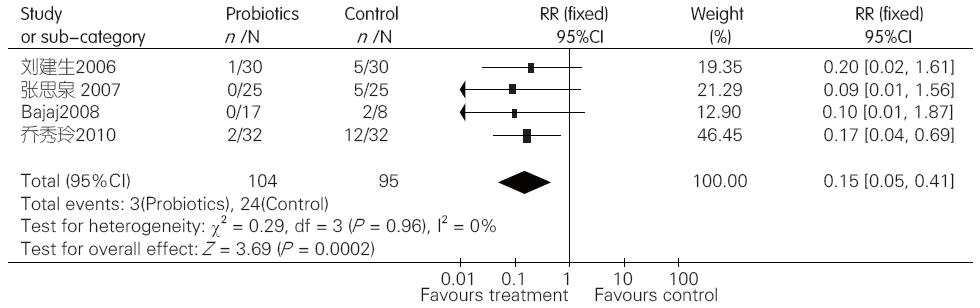
2.2.5 益生菌组与对照组比较对临床肝性脑病发生率的影响: 对纳入的4项临床试验进行异质性检验, 结果显示各研究间无异质性(I2 = 0%, P = 0.96), 于是采用固定效应模型合并效应量. Meta分析结果显示, 益生菌制剂组临床肝性脑病发生率明显低于对照组(RR = 0.15, 95%CI: 0.05-0.41, P = 0.0002, 图5).
肝性脑病是一组连续的病症, 根据其严重性分为不同的层次, 而MHE是其中最轻微的一类. MHE的病因和发病机制较为复杂, 至今尚未完全阐明, 主要有氨中毒、假性神经递质、血浆氨基酸失衡、GABA/苯二氮卓、神经毒物的协同等假说, 其中高氨血症是各种机制的共同通路[16], 肠源性物质引起的神经毒性作用的观点已被普遍接受[17]. 此外有研究显示[18], 在肝硬化合并MHE患者中, 小肠细菌过度生长的发生率明显高于无MHE患者, 提示MHE患者可能存在肠道菌群失调及功能紊乱. 肝硬化时整个胃肠系统瘀血水肿, 蠕动减退, 分泌失调, 容易导致肠道菌群失调, 有害细菌过度生长, 使肠道内毒素产生增加, 局部免疫功能下降; 门体分流使肠道内毒素未经肝脏库否细胞的灭活作用直接进入体循环, 导致血浆内毒素水平升高; 肠道细菌过度繁殖使尿素酶产生增加, 尿素酶分解尿素形成氨, 使血氨升高[19,20]. 肠源性内毒素血症和血氨升高均是MHE发生的重要原因.
目前临床上治疗MHE常采取去除诱因为基础的综合治疗, 主要为减少肠道毒素的产生、吸收以及促进肝脏毒性物质代谢, 应用的药物有乳果糖、门冬氨酸鸟氨酸、谷氨酸盐、利福昔明等, 但临床疗效不明显. 而益生菌是指一组通过调节宿主肠道微生物群生态平衡而发挥生理作用的活菌制剂, 可直接补充人体正常生理菌, 调节肠道菌群平衡, 抑制肠道中的致病菌, 减少肠源性内毒素的产生, 合成机体所需的维生素, 激发机体免疫力, 从而有效维持肠道黏膜屏障, 减少细菌移位和内毒素产生, 以保护肝及神经系统, 减少肝性脑病的发生[21].
近年来国内外一些学者开展了益生菌治疗MHE的临床研究, 有些研究显示益生菌制剂可改善MHE患者血氨水平, 缩短智力测验时间; 但另外有研究认为, 益生菌对MHE的疗效与对照组无显著差异. 于是, Shukla等[22]采用Meta分析评价了微生态制剂(益生菌、益生元、合生元)对MHE的治疗效果, 结果显示微生态制剂能有效改善MHE患者临床症状. 但该研究不仅纳入益生菌同时还包含益生元等文献, 亚组分析时反映益生菌疗效的文献较少(仅2个RCT). 鉴于此, 本文通过全面检索国内外关于益生菌制剂治疗MHE的临床随机对照研究, 以期更为客观地评价其疗效.
我们的结果显示, 与对照组相比, 益生菌制剂可以明显缩短MHE患者智力测验反应时间, 有效降低血氨水平, 减轻内毒素血症, 改善ALT水平并降低临床肝性脑病的发生率. 这些结果提示, 益生菌制剂可改善MHE患者临床及部分生化指标, 降低MHE发展为临床肝性脑病的几率, 有可能成为MHE治疗的新选择.
然而本研究也存在一些局限性: (1)目前临床研究资料有限, 能够纳入的随机对照试验及其样本数不够多; (2)纳入的文献中使用的益生菌制剂的剂型(单一或复合剂型)、菌株的种类、剂量、疗程等不尽相同, 而造成临床试验之间异质性; (3)纳入的文献的质量有待进一步提高. 上述不足之处使本文结论的可靠性受到一定程度的影响, 期待有更多大规模、多中心随机双盲安慰剂对照临床试验以全面评价益生菌制剂治疗MHE的有效性与安全性, 为其临床应用取得可靠的循证医学证据.
轻微型肝性脑病(MHE)是肝硬化常见并发症, 易病情加重进展为临床肝性脑病, 死亡率较高. 国外有报道显示肝硬化患者MHE的发病率为30%-84%, 国内曾峥等对409例肝硬化患者进行智力测验发现MHE的发病率达51.3%. MHE患者病情较隐蔽, 认知功能障碍, 操作应激能力减低, 存在较大的潜在社会隐患.
郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科; 金瑞, 主任医师, 教授, 北京佑安医院; 黄晓东, 副主任医师, 武汉市中心医院消化内科
MHE的病因和发病机制目前尚不十分明确, 主要有氨中毒、假性神经递质、血浆氨基酸失衡、GABA/苯二氮卓、神经毒物的协同等假说. 治疗方面无特异性, 临床应用的药物多样, 主要有乳果糖、门冬氨酸鸟氨酸、谷氨酸盐、利福昔明等, 但临床疗效不明显.
益生菌是指一组通过调节宿主肠道微生物群生态平衡而发挥生理作用的活菌制剂, 可直接补充人体正常生理菌, 调节肠道菌群平衡, 抑制肠道中的致病菌, 减少肠源性内毒素的产生, 合成机体所需的维生素, 激发机体免疫力, 从而有效维持肠道黏膜屏障, 减少细菌移位和内毒素产生, 以保护肝脏及神经系统, 减少肝性脑病的发生. 基于上述理论, 目前国内外一些学者开展了应用益生菌制剂进行治疗MHE的临床研究, 但各自报道的疗效并不一致, 且多数研究样本量较小.
本文通过全面检索国内外关于益生菌制剂治疗MHE的临床随机对照研究, 运用循证医学Meta分析的方法, 客观地评价益生菌制剂进行治疗MHE的疗效. 研究方法得当, 结果结论较可信, 具有一定创新性, 并反映了我国该领域研究的部分研究结果.
本次荟萃分析表明益生菌可明显缩短MHE患者数字连接试验反应时间, 有效降低血氨水平, 减轻内毒素血症, 改善ALT 水平, 并降低临床肝性脑病的发生率, 可以作为临床治疗MHE药物的一种新选择.
本文内容较新颖, 结论客观, 对临床具有一定的指导意义.
编辑: 何基才 电编:何基才
| 2. | Das A, Dhiman RK, Saraswat VA, Verma M, Naik SR. Prevalence and natural history of subclinical hepatic encephalopathy in cirrhosis. J Gastroenterol Hepatol. 2001;16:531-535. [PubMed] [DOI] |
| 4. | Bajaj JS. Minimal hepatic encephalopathy matters in daily life. World J Gastroenterol. 2008;14:3609-3615. [PubMed] [DOI] |
| 5. | Montgomery JY, Bajaj JS. Advances in the evaluation and management of minimal hepatic encephalopathy. Curr Gastroenterol Rep. 2011;13:26-33. [PubMed] [DOI] |
| 6. | Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12. [PubMed] [DOI] |
| 7. | Liu Q, Duan ZP, Ha DK, Bengmark S, Kurtovic J, Riordan SM. Synbiotic modulation of gut flora: effect on minimal hepatic encephalopathy in patients with cirrhosis. Hepatology. 2004;39:1441-1449. [PubMed] [DOI] |
| 8. | Lata J, Juránková J, Príbramská V, Fric P, Senkyrík M, Díte P, Kroupa R. [Effect of administration of Escherichia coli Nissle (Mutaflor) on intestinal colonisation, endo-toxemia, liver function and minimal hepatic encephalopathy in patients with liver cirrhosis]. Vnitr Lek. 2006;52:215-219. [PubMed] |
| 10. | Malaguarnera M, Greco F, Barone G, Gargante MP, Malaguarnera M, Toscano MA. Bifidobacterium longum with fructo-oligosaccharide (FOS) treatment in minimal hepatic encephalopathy: a randomized, double-blind, placebo-controlled study. Dig Dis Sci. 2007;52:3259-3265. [PubMed] [DOI] |
| 12. | Bajaj JS, Saeian K, Christensen KM, Hafeezullah M, Varma RR, Franco J, Pleuss JA, Krakower G, Hoffmann RG, Binion DG. Probiotic yogurt for the treatment of minimal hepatic encephalopathy. Am J Gastroenterol. 2008;103:1707-1715. [PubMed] [DOI] |
| 13. | Sharma P, Sharma BC, Puri V, Sarin SK. An open-label randomized controlled trial of lactulose and probiotics in the treatment of minimal hepatic encephalopathy. Eur J Gastroenterol Hepatol. 2008;20:506-511. [PubMed] [DOI] |
| 17. | Riordan SM, Williams R. Gut flora and hepatic encephalopathy in patients with cirrhosis. N Engl J Med. 2010;362:1140-1142. [PubMed] [DOI] |
| 18. | Gupta A, Dhiman RK, Kumari S, Rana S, Agarwal R, Duseja A, Chawla Y. Role of small intestinal bacterial overgrowth and delayed gastrointestinal transit time in cirrhotic patients with minimal hepatic encephalopathy. J Hepatol. 2010;53:849-855. [PubMed] [DOI] |
| 19. | Moriwaki H, Shiraki M, Iwasa J, Terakura Y. Hepatic encephalopathy as a complication of liver cirrhosis: an Asian perspective. J Gastroenterol Hepatol. 2010;25:858-863. [PubMed] [DOI] |
| 20. | Cesaro C, Tiso A, Del Prete A, Cariello R, Tuccillo C, Cotticelli G, Del Vecchio Blanco C, Loguercio C. Gut microbiota and probiotics in chronic liver diseases. Dig Liver Dis. 2011;43:431-438. [PubMed] [DOI] |
| 22. | Shukla S, Shukla A, Mehboob S, Guha S. Meta-analysis: the effects of gut flora modulation using prebiotics, probiotics and synbiotics on minimal hepatic encephalopathy. Aliment Pharmacol Ther. 2011;33:662-671. [PubMed] [DOI] |