修回日期: 2011-06-27
接受日期: 2011-07-05
在线出版日期: 2011-07-28
目的: 探讨罗格列酮对人胃癌SGC7901、SGC7901/VCR细胞侵袭转移能力及LIMK1基因蛋白表达的影响.
方法: 罗格列酮(40 mg/L)作用SGC7901和SGC7901/VCR细胞24 h后, 采用划痕实验和Transwell实验分别观察罗格列酮对细胞的迁移和侵袭能力. RT-PCR检测LIMK1 mRNA和cofilin-1 mRNA的表达情况; Western blot检测LIMK1和p-cofilin-1的蛋白表达.
结果: 结果显示, 40 mg/L罗格列酮分别作用SGC7901细胞和SGC7901/VCR细胞 24 h后, 细胞的迁移和侵袭能力均被罗格列酮抑制(P<0.05). RT-PCR结果显示LIMK1 mRNA水平明显下降(P<0.05), cofilin-1无明显影响(P>0.05). Western blot检测显示罗格列酮作用SGC7901细胞和SGC7901/VCR细胞24 h后, LIMK1和p-cofilin-1蛋白的表达水平下降(P<0.05).
结论: 罗格列酮可抑制人胃癌SGC7901和SGC7901/VCR细胞迁移与侵袭能力; 罗格列酮抗肿瘤细胞迁移与侵袭的机制可能与其下调LIMK1进而抑制cofilin-1的激活相关.
引文著录: 陈宏辉, 张琍, 刘灿, 欧珍珍, 苏琦. 罗格列酮对人胃癌细胞系迁移侵袭的抑制及其机制. 世界华人消化杂志 2011; 19(21): 2207-2213
Revised: June 27, 2011
Accepted: July 5, 2011
Published online: July 28, 2011
AIM: To investigate the effect of rosiglitazone (ROS) on cell invasion and metastasis in human gastric cancer cell lines SGC7901 and SGC7901/VCR and to explore possible mechanisms involved.
METHODS: Wound healing assay and in vitro invasion assay were used to investigate the antimetastatic activities of ROS in SGC7901 and SGC7901/VCR cells. After treating SGC7901 and SGC7901/VCR cells with ROS (40 μmol/L) for 24 h, the mRNA levels of LIMK1 and cofilin-1 were assessed by reverse transcription-polymerase chain reaction (RT-PCR), and the protein levels of LIMK1, cofilin-1 and p-cofilin-1 were assessed by Western blot.
RESULTS: Treatment with ROS at a concentration of 40 μmol/L for 24 h significantly inhibited cellular invasion and metastasis (P < 0.05), down-regulated the expression of LIMK1 mRNA and protein and the level of p-cofilin-1 (all P < 0.05) but showed no significant impact on cofilin-1-1 mRNA level (P > 0.05).
CONCLUSION: ROS elicited a significant inhibition of in vitro cell migration and invasion in human gastric cancer cell lines SGC7901 and SGC7901/VCR possibly by down-regulating the expression of LIMK1 and inhibiting cofilin-1 activation.
- Citation: Chen HH, Zhang L, Liu C, Ou ZZ, Su Q. Rosiglitazone inhibits cell invasion and metastasis in human gastric cancer cell lines SGC7901 and SGC7901/VCR. Shijie Huaren Xiaohua Zazhi 2011; 19(21): 2207-2213
- URL: https://www.wjgnet.com/1009-3079/full/v19/i21/2207.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i21.2207
过氧化物酶体增殖子激活性受体γ(peroxisome proliferator-activated receptor γ, PPARγ)是PPAR家族成员之一, 是一种新的甾体激素受体, 属于核受体超家族成员, 与其配体结合后可启动核内靶基因的转录. PPARγ具有脂肪组织特性, 其生物学功能复杂, 参与脂肪、糖的代谢、单核细胞激活、炎症反应、肿瘤细胞分化和凋亡等生理病理过程, 尤其与胃肠肿瘤的关系密切[1], 但其抗肿瘤的机制目前并不十分清楚. 本研究通过罗格列酮对人胃癌SGC7901及SGC7901/VCR细胞侵袭转移能力及LIMK1基因蛋白表达的影响, 初步探讨罗格列酮抑制人胃癌SGC7901及SGC7901/VCR细胞侵袭转移的机制.
人胃癌SGC7901及多药耐药细胞株SGC7901/VCR购自中南大学肿瘤研究所. 罗格列酮(武汉远城科技发展有限公司); BCA蛋白定量检测试剂盒为美国Pierce公司产品; TRIzol试剂(Invitrogen公司); Transwell小室(3428型), Corning公司; Matrigel基质胶(5 g/L), BD公司; LIMK1(Q491) Rabbit polyclonal antibody; 美国Abzoom公司产品.
1.2.1 细胞培养: 本实验应用的人胃癌SGC7901及SGC7901/VCR细胞均为贴壁生长细胞, 常规培于37 ℃、50 mL/L CO2培养箱内培养.
1.2.2 药物处理与分组: 取对数生长期细胞, 培养至24 h进行各项试验. 共设置6个组, A、B、C组分别为: SGC7901细胞加培养液为空白组; SGC7901加等体积的DMSO为溶媒组; SGC7901细胞加40 μmol/L的罗格列酮为ROS组; D、E、F组分别为: SGC7901/VCR细胞加培养基为空白组; SGC7901/VCR细胞加等体积的DMSO为溶媒组; SGC7901/VCR细胞加40 μmol/L的罗格列酮为ROS组.
1.2.3 划痕实验: 将2×106个SGC7901和SGC 7901/VCR细胞接种在6孔板, 常规培养至90%的融合状态. 用10 µL Eppendorf Tip在细胞板上划痕, 加入浓度40 mg/L的罗格列酮, 放入37 ℃, 50 mL/L CO2培养箱, 培养24 h. 按0, 24 h取样, 拍照. 计算划痕的距离, 以未加罗格列酮组为对照, 进行组间比较.
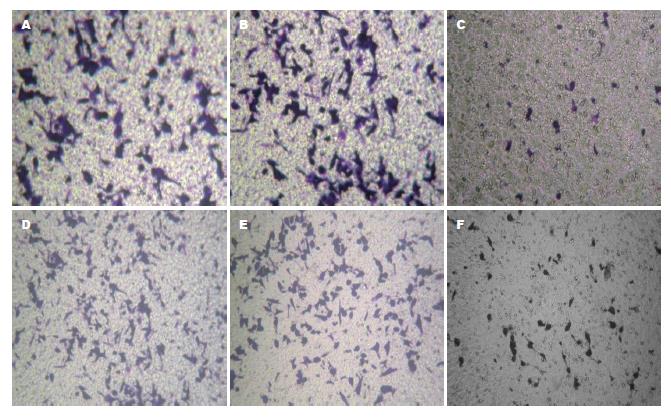
1.2.4 体外细胞侵袭实验: 体外细胞侵袭实验采用Transwell培养板, 步骤: 将Transwell放在24孔板内, BD Matrigel(5 g/L), 在Transwell嵌套上层均匀铺50 μL稀释的Matrigel, 细胞活力计数仪计数, 配置细胞悬液; 在上室每孔加入100 μL DMEM无血清培养基; 下腔室中加入500 μL含有100 mL/L FBS条件培养基; 在上室每孔1.0×105个细胞; 加入浓度40 mg/L罗格列酮, 孵育24 h; 移去Transwells, 倒置, 风干; 结晶紫(0.1%)染色20 min, 显微镜下观察. 以每个200倍高倍视野侵袭至滤膜下表面的细胞数目的反映肿瘤细胞侵袭能力的高低. 随机计数10个视野内的细胞数, 计算平均值进行统计学分析. 以空白组和溶媒组为对照, 进行组间比较. 实验重复3次.
1.2.5 RT-PCR引物设计: 参照GenBank基因序列设计, 设计好后Blast, 比对结果与目的基因相符(表1); 抽提RNA; 逆转录; PCR扩增; 体系25 μL, 加入Master mix 12.5 μL, ddH2O 8.5 µL, 10 μmol的PCR特异引物F 1 μL, 10 μmol的PCR特异引物R 1 μL, cDNA 2 μL. 扩增条件为各反应条件如下: β-actin: 94 ℃, 5 min; 30个PCR循环(94 ℃, 30 s; 55.0 ℃, 30 s; 72 ℃, 60 s); 72 ℃, 5 min. LIMK1: 94 ℃, 5 min; 30个PCR循环(94 ℃, 30 s; 52.3 ℃, 30 s; 72 ℃, 60 s); 电泳; 自动电泳凝胶成像分析仪(Bio-Rad, USA)及Quantity One分析软件(Bio-Rad, USA)进行图像分析. POLD1积分灰度值/β-actin积分灰度值为POLD1 mRNA相对表达值.
| 基因名称 | 双向引物序列 | 退火温度(℃) | 产物长度(bp) |
| β-actin | F 5'-ACACTGTGCCCATCTACGAGGGG-3' | ||
| R 5'-ATGATGGAGTTGAAGGTAGTTTCGTGGAT-3' | 55.0 | 367 | |
| LIMK1 | F 5'-GGGGCATCATCAAGAGCA-3' | ||
| R 5'-TCAGGGTGTTGACGGACC-3' | 52.3 | 138 | |
| cofilin-1 | F 5'-CAAGAAGGCGGTGCTCT-3' | ||
| R 5'-ACAAAGGTGGCGTAGGG-3' | 54.5 | 120 |
1.2.6 Western blot检测LIMK1蛋白含量: 将提取的蛋白样品用BCA蛋白浓度测定试剂盒测定总蛋白浓度, 稀释后用聚丙烯酰胺凝胶电泳法分离, 湿法转印, ECL化学发光显色, 暗室中拍片. 以β-actin作为内参, 将结果扫描成电子图像, 以Quantity One分析软件(Bio-Rad, USA)进行图像分析. POLD1积分灰度值/β-actin积分灰度值为POLD1蛋白相对表达值.
细胞划痕24 h后, 40 μmol/L罗格列酮处理的SGC7901、SGC7901/VCR细胞组分别较各自空白组和溶媒组划痕距离明显增宽(P<0.05, 图1, 表2), 表明罗格列酮可抑制人胃癌SGC7901、SGC7901/VCR细胞迁移.
40 μmol/L罗格列酮分别作用SGC7901与SGC7901/VCR细胞24 h后, 侵袭至滤膜下表面的细胞数目较对照组明显减少(P<0.05, 图2, 表3), 表明罗格列酮可抑制人胃癌SGC7901与SGC7901/VCR细胞的体外侵袭能力.
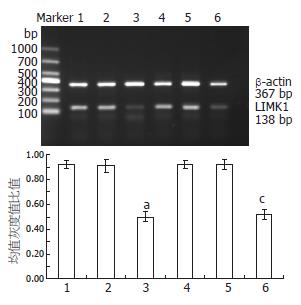
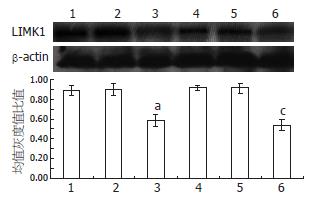
40 μmol/L罗格列酮分别作用于SGC7901、SGC7901/VCR细胞24 h后, C、F组与B、E组的细胞LIMK1 mRNA及蛋白水平明显下调(P<0.05, 图3, 4).
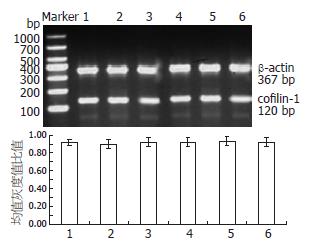
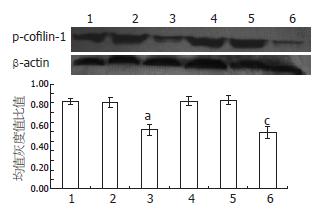
RT-PCR结果显示40 μmol/L罗格列酮分别作用于SGC7901、SGC7901/VCR细胞24 h后, 细胞cofilin-1水平无明显变化, 表明罗格列酮在mRNA水平上不影响cofilin-1的表达(图5). Western blot结果显示, 40 μmol/L罗格列酮分别作用于SGC7901、SGC7901/VCR细胞24 h后, 细胞p-cofilin-1蛋白的表达水平下调(P<0.05, 图6).
胃癌细胞的侵袭转移是使患者丧失手术机会, 导致化疗效果差和致死的主要原因. 因此, 寻找新的高效、低毒及给药方便的药物防治胃癌侵袭转移成为胃癌研究的重要课题. 本研究观察罗格列酮对胃癌细胞SGC7901和SGC7901/VCR迁移、侵袭能力的影响幷通过对LIMK1基因表达的影响, 初步探讨罗格列酮对胃癌侵袭转移的影响及可能的机制.
PPAR是一类与甲状腺激素和维甲酸受体密切相关的核激素受体, 可分PPARα、PPARβ、PPARγ 3个亚族. 其中生物学功能最复杂和研究最多的是PPARγ[2], 量研究证实, PPARγ被激活后能够诱导多种肿瘤细胞凋亡、分化[3,4]. 现发PPARγ与消化道肿瘤关系密切相关, Sato等[5]发现PPARγ不但在不同分化程度胃癌有表达, 即使在伴肠化生的胃黏膜中也有表达. Ban等[6]发现, PPARγ激动曲格列酮可以抑制结肠癌的生长. 本实验应用划痕实验测定肿瘤细胞迁移能及Transwell体外侵袭实验模型测定肿瘤细胞的侵袭能力. 划痕实验结果显示, 与各自对照组及溶媒组相比, 40 μmol/L罗格列酮作用SGC7901、SGC7901/VCR细24 h后细胞的划痕愈合速度减慢, 差异有统计学意义(P<0.05). Transwell实验果显示SGC7901、SGC7901/VCR细胞经40 μmol/L 罗格列酮处理后穿过人工基底侵袭到微孔膜的细胞数分别较其对照组和溶媒组明显减少, 差异有统计学意(P<0.05); 提示罗格列酮能够抑制胃癌SGC7901、SGC7901/VCR细胞的迁移侵袭力.
罗格列酮是一种PPARγ激动剂, 具有低毒廉价性, 具有开发潜力的抗肿瘤药物, 但其具体分子机制目前暂不明确. 近年来, LIMK1在肿瘤发生中的意义成为研究热点. 本研究试图从LIMK1及其下游效应物cofilin-1阐明罗格列酮抗胃癌侵袭转移的机制.
LIMK1是一种丝氨酸-苏氨酸激酶, 主要定位在细胞质中, 在肿瘤细胞侵袭转移过程中, 调节肌动蛋白细胞细胞骨架、微管分解与肌动蛋白聚合[7,8]. 近年来LIMK1在肿瘤发生中的意义引起了广泛关注. 有研究发现, LIMK1在前列腺肿瘤和前列腺癌细胞株中有过度表达, 抑制LIMK1后能遏制前列腺癌细胞的侵袭性[9,10]. 同时, 研究也发现前列腺癌中与转移相关的染色体基因位点在7q11.2, 而人类LIMK1基因也定位在7q11.23, 提示两者具有相关性[9]. 另有报道, 人类乳腺癌细胞中LIMK1在调节溶酶体和内涵体(endosome)的囊泡运输中起着重要作用[11]. 研究发现, Nischarin(PAK抑制剂)可下调乳腺癌细胞中LIMK/cofilin的活性, 从而阻断癌细胞迁移、转移. 这与他抑制了细胞中LIMK磷酸化活化、降低cofilin激活有关[12]. 我们观察了罗格列酮对SGC7901和SGC7901/VCR细胞LIMK1表达的影响. RT-PCR及Western blot结果显示40 mg/L罗格列酮, 作用SGC7901和SGC7901/VCR细胞24 h后, 细胞LIMIK1 mRNA水平及LIMK1蛋白表达明显下降. 提示罗格列酮可抑制肿瘤细胞LIMK1基因而发挥其抗肿瘤的作用, 他可能是引起肿瘤细胞侵袭和转移的关键分子之一. 此外, LIMK1在人恶性胶质瘤细胞[13]、人肺癌细胞系H1299[14]、卵巢癌高表达[15]; LIMK2在恶性黑色素瘤细胞[16]、人纤维肉瘤细胞[12]高表达. 因此, LIMK在肿瘤防治中的意义值得深入研究.
近年来, 大量研究证实, 造成肿瘤细胞迁移、侵袭的基本环节是肌动蛋白骨架重建[17]. 肌动蛋白细胞骨架动力的关键调节剂是肌动蛋白解聚因子(ADF)/cofilins家族蛋白, 其活性决定了癌细胞的恶性程度与侵袭性特性. ADF/cofilins是一种肌动蛋白结合蛋白, 存在于所有的真核细胞生物, 有cofilin-1(非肌特异性亚型), cofilin-2(肌特异性亚型)和destrin(又称ADF)3种类型[17-22]. 有研究表明, cofilin-1不但与细胞分裂相关[23,24], 还能诱发肿瘤迁移、转移[25,26]. cofilin-1被siRNA沉默后, 出现细胞运动性缺损[18,19]. 而过度表达cofilin-1的细胞则表现出异常增强的移动性[27], siRNA沉默了cofilin和LIMK1的表达后, 可使肿瘤细胞迁移明显减弱[17]. 在化学应激和热应激细胞中, 肌动蛋白可能藉cofilin-1向细胞核的定向运动进入细胞核以避免在应激状态下发生变性[28]. 活化的ADF/cofilins可导致层状伪足变宽, 与增强F-actin逆行流动和倒转有关; 免疫荧光、电镜检查及定量荧光斑点显微镜显示, 层状伪足内的ADF/cofilins活性受到Rac1/Pak1/LIMK1信号途径的调控[29]. 另有研究, 利用cDNA芯片技术, 发现幽门螺杆菌引起的胃癌有差异性基因表达, LIMK1基因发生上调, 推测, LIMK是否成为幽门螺杆菌相关发病机制的新靶点, 有待进一步研究[30].
目前可使cofilin-1发生磷酸化的激酶是LIMK1, cofilin-1是唯一已知的LIMK1下游的效应物. 我们观察罗格列酮对cofilin-1及p-cofilin-1的表达是否有影响? 结果显示罗格列酮处理人胃癌SGC7901和SGC7901/VCR细胞24 h后, 不影响cofilin-1的表达, 却明显减弱了p-cofilin-1的表达. 提示在罗格列酮在抑制人胃癌SGC7901和SGC7901/VCR细胞侵袭转移可能抑制了cofilin-1相关信号转导通路, 造成胞内cofilin-1的磷酸化激活受阻, p-cofilin-1受到抑制. 我们推断罗格列酮能够阻断cofilin-1相关信号转导通路的关键, 可能在于其抑制LIMK1表达的效能. 因此, 我们的结果提示LIMK1可作为罗格列酮控制肿瘤细胞迁移及侵袭的关键靶点之一, 为未来胃癌的治疗提供新的线索.
LIMK1是一种丝氨酸-苏氨酸激酶, 在肿瘤细胞侵袭转移过程中, 调节肌动蛋白细胞细胞骨架、微管分解与肌动蛋白聚合, 近年来LIMK1在肿瘤发生中的意义引起了广泛关注.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
罗格列酮是一种PPARγ激动剂, 具有低毒廉价性, 具有开发潜力的抗肿瘤药物, 但其具体分子机制目前暂不明确. 近年来, LIMK1在肿瘤发生中的意义成为研究热点.
研究已发现罗格列酮对胃癌、胰腺癌、结直肠癌等消化系肿瘤有一定的抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡的作用.
本研究发现罗格列酮能抑制胃癌细胞的迁移和侵袭, 可能是通过调节LIMK1和cofilin-1信号通路起作用.
本文学术性和可读性较好, 具有较好的临床参考意义.
编辑: 李军亮 电编:何基才
| 1. | Shimada T, Hiraishi H. [PPARgamma agonists for the diseases of gastrointestinal tract and liver]. Nippon Rinsho. 2010;68:312-316. [PubMed] |
| 2. | Meirhaeghe A, Fajas L, Gouilleux F, Cottel D, Helbecque N, Auwerx J, Amouyel P. A functional polymorphism in a STAT5B site of the human PPAR gamma 3 gene promoter affects height and lipid metabolism in a French population. Arterioscler Thromb Vasc Biol. 2003;23:289-294. [PubMed] [DOI] |
| 3. | Kersten S, Desvergne B, Wahli W. Roles of PPARs in health and disease. Nature. 2000;405:421-424. [PubMed] [DOI] |
| 4. | Elbrecht A, Chen Y, Cullinan CA, Hayes N, Leibowitz M, Moller DE, Berger J. Molecular cloning, expression and characterization of human peroxisome proliferator activated receptors gamma 1 and gamma 2. Biochem Biophys Res Commun. 1996;224:431-437. [PubMed] [DOI] |
| 5. | Sato H, Ishihara S, Kawashima K, Moriyama N, Suetsugu H, Kazumori H, Okuyama T, Rumi MA, Fukuda R, Nagasue N. Expression of peroxisome proliferator-activated receptor (PPAR)gamma in gastric cancer and inhibitory effects of PPARgamma agonists. Br J Cancer. 2000;83:1394-1400. [PubMed] [DOI] |
| 6. | Ban JO, Kwak DH, Oh JH, Park EJ, Cho MC, Song HS, Song MJ, Han SB, Moon DC, Kang KW. Suppression of NF-kappaB and GSK-3beta is involved in colon cancer cell growth inhibition by the PPAR agonist troglitazone. Chem Biol Interact. 2010;188:75-85. [PubMed] [DOI] |
| 7. | 金 懋林. 消化道恶性肿瘤化学治疗. 第1版. 北京: 北京大学医学出版社 2008; 67-75. |
| 8. | Bunting KD. ABC transporters as phenotypic markers and functional regulators of stem cells. Stem Cells. 2002;20:11-20. [PubMed] [DOI] |
| 9. | Scott GA, McClelland LA, Fricke AF, Fender A. Plexin C1, a receptor for semaphorin 7a, inactivates cofilin and is a potential tumor suppressor for melanoma progression. J Invest Dermatol. 2009;129:954-963. [PubMed] [DOI] |
| 10. | Suyama E, Wadhwa R, Kawasaki H, Yaguchi T, Kaul SC, Nakajima M, Taira K. LIM kinase-2 targeting as a possible anti-metastasis therapy. J Gene Med. 2004;6:357-363. [PubMed] [DOI] |
| 11. | Nishimura Y, Yoshioka K, Bernard O, Bereczky B, Itoh K. A role of LIM kinase 1/cofilin pathway in regulating endocytic trafficking of EGF receptor in human breast cancer cells. Histochem Cell Biol. 2006;126:627-638. [PubMed] [DOI] |
| 12. | Ding Y, Milosavljevic T, Alahari SK. Nischarin inhibits LIM kinase to regulate cofilin phosphorylation and cell invasion. Mol Cell Biol. 2008;28:3742-3756. [PubMed] [DOI] |
| 13. | Guo H, Gu F, Li W, Zhang B, Niu R, Fu L, Zhang N, Ma Y. Reduction of protein kinase C zeta inhibits migration and invasion of human glioblastoma cells. J Neurochem. 2009;109:203-213. [PubMed] [DOI] |
| 14. | Lee YJ, Mazzatti DJ, Yun Z, Keng PC. Inhibition of invasiveness of human lung cancer cell line H1299 by over-expression of cofilin. Cell Biol Int. 2005;29:877-883. [PubMed] [DOI] |
| 15. | Wang W, Eddy R, Condeelis J. The cofilin pathway in breast cancer invasion and metastasis. Nat Rev Cancer. 2007;7:429-440. [PubMed] [DOI] |
| 16. | Davila M, Frost AR, Grizzle WE, Chakrabarti R. LIM kinase 1 is essential for the invasive growth of prostate epithelial cells: implications in prostate cancer. J Biol Chem. 2003;278:36868-36875. [PubMed] [DOI] |
| 17. | Horita Y, Ohashi K, Mukai M, Inoue M, Mizuno K. Suppression of the invasive capacity of rat ascites hepatoma cells by knockdown of Slingshot or LIM kinase. J Biol Chem. 2008;283:6013-6021. [PubMed] [DOI] |
| 18. | Van Troys M, Huyck L, Leyman S, Dhaese S, Vandekerkhove J, Ampe C. Ins and outs of ADF/cofilin activity and regulation. Eur J Cell Biol. 2008;87:649-667. [PubMed] [DOI] |
| 19. | Estornes Y, Gay F, Gevrey JC, Navoizat S, Nejjari M, Scoazec JY, Chayvialle JA, Saurin JC, Abello J. Differential involvement of destrin and cofilin-1 in the control of invasive properties of Isreco1 human colon cancer cells. Int J Cancer. 2007;121:2162-2171. [PubMed] [DOI] |
| 20. | Hotulainen P, Paunola E, Vartiainen MK, Lappalainen P. Actin-depolymerizing factor and cofilin-1 play overlapping roles in promoting rapid F-actin depolymerization in mammalian nonmuscle cells. Mol Biol Cell. 2005;16:649-664. [PubMed] [DOI] |
| 21. | Tammana TV, Sahasrabuddhe AA, Mitra K, Bajpai VK, Gupta CM. Actin-depolymerizing factor, ADF/cofilin, is essentially required in assembly of Leishmania flagellum. Mol Microbiol. 2008;70:837-852. [PubMed] |
| 22. | Scott RW, Olson MF. LIM kinases: function, regulation and association with human disease. J Mol Med (Berl). 2007;85:555-568. [PubMed] |
| 23. | Bains NP, Gorbatyuk VY, Nosworthy NJ, Robson SA, Maciejewski MW, dos Remedios CG, King GF. Backbone and side-chain 1H, 15N, and 13C assignments for chick cofilin. J Biomol NMR. 2002;22:193-194. [PubMed] [DOI] |
| 24. | Cameron LA, Footer MJ, van Oudenaarden A, Theriot JA. Motility of ActA protein-coated microspheres driven by actin polymerization. Proc Natl Acad Sci U S A. 1999;96:4908-4913. [PubMed] [DOI] |
| 25. | Yamazaki D, Kurisu S, Takenawa T. Regulation of cancer cell motility through actin reorganization. Cancer Sci. 2005;96:379-386. [PubMed] [DOI] |
| 26. | Wong CC, Wong CM, Tung EK, Man K, Ng IO. Rho-kinase 2 is frequently overexpressed in hepatocellular carcinoma and involved in tumor invasion. Hepatology. 2009;49:1583-1594. [PubMed] [DOI] |
| 27. | Gu C, Yaddanapudi S, Weins A, Osborn T, Reiser J, Pollak M, Hartwig J, Sever S. Direct dynamin-actin interactions regulate the actin cytoskeleton. EMBO J. 2010;29:3593-3606. [PubMed] [DOI] |
| 28. | Carlier MF, Jean C, Rieger KJ, Lenfant M, Pantaloni D. Modulation of the interaction between G-actin and thymosin beta 4 by the ATP/ADP ratio: possible implication in the regulation of actin dynamics. Proc Natl Acad Sci U S A. 1993;90:5034-5038. [PubMed] [DOI] |
| 29. | Delorme V, Machacek M, DerMardirossian C, Anderson KL, Wittmann T, Hanein D, Waterman-Storer C, Danuser G, Bokoch GM. Cofilin activity downstream of Pak1 regulates cell protrusion efficiency by organizing lamellipodium and lamella actin networks. Dev Cell. 2007;13:646-662. [PubMed] [DOI] |
| 30. | Bach S, Makristathis A, Rotter M, Hirschl AM. Gene expression profiling in AGS cells stimulated with Helicobacter pylori isogenic strains (cagA positive or cagA negative). Infect Immun. 2002;70:988-992. [PubMed] [DOI] |