修回日期: 2010-11-15
接受日期: 2010-11-23
在线出版日期: 2011-01-18
目的: 探讨乙型肝炎病毒(HBV)相关性肝病患者血清中小分子差异蛋白在HBV感染后病情发展过程中的意义.
方法: 采用蛋白芯片及表面增强激光解析电离飞行时间质谱(surface-enhanced laser desorption/ionization time-of-flight mass spectrometry, SELDI-TOF-MS)技术对已用乙腈去除高丰度蛋白的正常对照(NC)、乙型肝炎病毒携带者(ASCs)、慢性乙型肝炎(CHB)、肝硬化(LC)及原发性肝细胞癌(HCC)患者术前血清进行检测, 筛选各自的血清小分子差异表达蛋白, 并分别建立诊断模型. 在蛋白数据库expasy寻找相关差异蛋白信息, 对差异蛋白峰的可能结构及功能进行评价.
结果: 与NC组比, ASCs组有63个蛋白质波峰的强度值存在统计学差异(P<0.05), 其中29个上调, 34个下调; CHB组有57个, 其中21个上调, 36个下调; LC组有68个, 其中33个上调, 35个下调; HCC组有74个, 其中28个上调, 46个下调; 通过对比分析, 发现在4个病例组表达均为上调的m/z为15 889.8, 蛋白峰强度值在NC<ASC<CHB<LC组, HCC组较CHB和LC组低; 11 742.2蛋白峰强度值在NC<ASC<CHB<LC组和NC<ASC<CHB<HCC组, 在LC和HCC组最高, 用此蛋白峰诊断HBV感染相关性LC的灵敏度和特异度分别为90%和86.67%, 诊断HCC的灵敏度和特异度分别为93.33%和83.33%.
结论: 成功去除高丰度蛋白和应用SELDI-TOF-MS技术筛选HBV感染相关性肝病患者血清中小分子差异蛋白, m/z为8 709.7、13 759.8、14 004.0、15 361.89、16 072.3、2 746.8、3 449.1、3 941.06、4 098.3、9 445.5的10个蛋白峰可能与HBV感染有关; m/z为15 889.8的蛋白峰可能成为HBV感染后进展为LC早期诊断的标志物, 而m/z为11 742.2的蛋白峰也许是HBV相关性LC或HCC的一个重要标志.
引文著录: 宁秋悦, 吴继周, 李国坚, 臧宁, 胡蝶飞, 吴健林, 陈茂伟, 万裴琦. 小分子差异蛋白在HBV相关性肝病患者血清中的SELDI-TOF-MS筛选. 世界华人消化杂志 2011; 19(2): 143-150
Revised: November 15, 2010
Accepted: November 23, 2010
Published online: January 18, 2011
AIM: To screen differentially expressed low-abundance proteins among serum samples from patients with different HBV-related hepatic diseases and to evaluate their possible value in the diagnosis of these diseases.
METHODS: The surface-enhanced laser desorption or ionization time-of-flight mass spectroscopy (SELDI-TOF-MS) was used to screen differentially expressed proteins among serum samples, in which high-abundance proteins had been removed with acetonitrile, collected from patients with asymptomatic chronic hepatitis B (ASC), chronic hepatitis B (CHB), liver cirrhosis (LC), hepatocellular carcinoma (HCC), and normal controls. Diagnostic models for each disease were then established with differentially expressed proteins. Protein databases were searched to predict the possible structure and function of differentially expressed proteins.
RESULTS: Compared with the normal control group, 63 differentially expressed protein peaks were detected in the ASC group, of which 29 were up-regulated and 34 down-regulated (P < 0.05); 57 in the CHB group, of which 29 up-regulated and 34 down-regulated; 68 in the LC group, of which 33 up-regulated and 35 down-regulated; and 74 in the HCC group, of which 28 up-regulated and 46 down-regulated. A peak with a m/z of 15 889.8 corresponded to a protein whose expression was up-regulated gradually in an order of healthy controls, ASC, CHB and LC patients, and its expression level in the HCC group was lower than those in the CHB group and LC group. The expression of a protein with a m/z of 11 742.2 was higher in the LC group and HCC group than in other groups, and its expression was gradually increased in an order of healthy controls, CHB, and LC patients, or in another order of healthy controls, CHB, and HCC patients. The sensitivity and specificity using the protein peak at 11 742.2 for diagnosis of LC were 90% and 86.67% and for HCC were 93.33% and 83.33%, respectively.
CONCLUSION: Ten protein peaks with m/z values of 8 709.7, 13 759.8, 14 004.0, 15 361.89, 16 072.3, 2 746.8, 3 449.1, 3 941.06, 4 098.3, and 9 445.5 correspond to proteins that might be involved in HBV infection. The protein peak with a m/z of 15 889.8 might be used as a biomarker for early diagnosis of HBV-related liver cirrhosis, while that with a m/z of 11 742.2 might be an important biomarker for the development of HBV-related liver cirrhosis or HCC.
- Citation: Ning QY, Wu JZ, Li GJ, Zang N, Hu DF, Wu JL, Chen MW, Wan PQ. Screening of differentially expressed low-abundance proteins among serum samples from patients with different HBV-related hepatic diseases by SELDI-TOF-MS. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 143-150
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.143
随着人类基因组测序计划的完成, 人类科学研究已经由基因组学转向蛋白质组学, 对蛋白质组的检测技术也日益成熟, 其中表面加强激光解吸电离-飞行时间质谱(surface-enhanced laser desorption/ionization time-of-flight mass spectrometry, SELDI-TOF-MS)技术是近几年迅速发展起来的一种蛋白质组学分析技术. SELDI-TOF-MS技术已被广泛应用于寻找肝癌的的血清肿瘤标志物[1,2], 甚至应用于乙型肝炎肝硬化与乙型肝炎相关性肝癌的鉴定[3,4]. 迄今, 对乙型肝炎病毒(hepatitis B virus, HBV)感染后的相关性肝脏疾病尤其是小分子蛋白的研究鲜见报道. 本研究采用乙腈沉淀法去除血清中高丰度蛋白后, 再应用SELDI-TOF-MS技术、弱型阳离子交换芯片(weak cation exchange chip, WCX2 chip)检测研究对象血清中的小分子蛋白, 以期通过对比分析筛选出从乙型肝炎病毒携带者(chronic asymptomatic hepatitis B virus carrier, ASC)到慢性病毒性乙型肝炎(chronic hepatitis B, CHB)、肝炎肝硬化(liver cirrhosis, LC)、原发性肝细胞癌(hepatocellular carcinoma, HCC)不同阶段的血清小分子蛋白标志物.
所有研究对象均来自2009-06/12广西医科大学肿瘤医院肝胆外科和广西医科大学第一附院感染性疾病科住院患者, 正常对照组(NC组)来自广西医科大学第一附院健康体检中心. 入选标准: NC组既往无肝脏疾病、肝炎病毒标志物均为阴性、肝脏B超和肝功能检查均无异常, 且检查未发现其他疾病; ASC、CHB和LC组均诊断符合2000年西安全国病毒性肝炎会议制定的诊断标准, 并排除合并丙型肝炎、丁型肝炎、药物性肝炎、自身免疫性肝病, 排除可能合并血吸虫肝病和(或)酒精性肝病; HCC组符合第4届全国肝癌学术会议修订的肝癌诊断标准, 且未经手术、化疗、放疗等治疗; LC和HCC组乙型肝炎表面抗原均为阳性. 其中, 正常对照组30例, 其中男14例, 女16例, 平均年龄为32.8±22.4岁; ASC组30例, 其中男17例, 女13例, 平均年龄为26.7±7.4岁; CHB组30例, 其中男24例, 女6例, 平均年龄为28.6±8.4岁; LC组30例, 其中男28例, 女2例, 平均年龄为46.2±11.3岁; HCC组30例, 其中男25例, 女5例, 平均年龄为53.6±11.0岁. 尿素(Urea)、3-环乙胺-1-丙磺酸(CHAPS)、乙腈、二硫苏糖醇(DTT)、醋酸钠(NaAc)、三氟乙酸(TFA)、羟乙基哌嗪乙磺酸(HEPES)、芥子酸(SPA)、HPLC水均购自美国Sigma公司; 蛋白芯片生物系统(PBSIIc)及WCX2芯片购自美国Ciphergen公司; 台式高速冷冻离心机购自美国Thermo Fisher公司; U9缓冲液(9 mol/L Urea, 2% CHAPS, 1% DTT); Na缓冲液(50 mmol/L乙酸钠, pH4.0); HEPES缓冲液(10 mmol/L HEPES, pH4.0)
1.2.1 标本采集: 抽取受检者清晨空腹静脉血2 mL, 3 000 r/min离心10 min, 冰浴上分装血清于-80 ℃低温冰箱保存备用.
1.2.2 乙腈沉淀法去除血清高丰度蛋白并调整蛋白浓度: 将已在冰上冻融的血清12 000 r/min, 4 ℃离心5 min; 取上清200 μL, 加入1.2倍体积乙腈于旋涡振荡器上震荡混匀后以12 000 r/min, 4 ℃离心15 min; 取300 μL上清于真空浓缩机中浓缩至50 μL, 取出5 μL用于BCA法蛋白浓度的测定, 并根据所测定结果将剩余样品的浓度调整至1.5 g/L.
1.2.3 蛋白芯片样品预处理: 将已去除高丰度蛋白血清10 000 r/min, 4 ℃离心2 min; 取上清3 μL, 加入2倍体积U9缓冲液(含DTT)稀释, 样品冰浴震荡30 min; 将9 μL上述变性后样品加入108 μL的50 mmol/L NaAc(pH4.0)缓冲液, 立即混匀以备作为蛋白芯片样品.
1.2.4 芯片预处理、上样和洗脱: 将WCX2芯片装入生物芯片处理器, 每孔加入200 μL NaAc缓冲液, 室温震荡洗涤2次, 每次5 min; 甩干后每孔分别加入100 μL预处理好的样品, 振荡孵育1 h; 弃去未结合样品, 用200 μL的NaAc缓冲液室温震荡洗涤2次, 每次5 min, 甩干; 再用200 μL HEPES洗涤1次, 立刻甩干; 拆开生物芯片处理器, 取出芯片晾干后, 在每个加样孔上加2次0.5 μL SPA, 晾干后即可上机测定结果.
1.2.5 数据采集: 采用PBSIIC型蛋白芯片生物系统对结合在弱阳离子WCX2芯片上的血清蛋白进行读取分析. 仪器用塞弗吉公司提供的ALL-IN-ONE蛋白质标准分子校正, 使系统的质量偏差≤0.1%. 设定激光强度为235, 检测敏感度为9, 最高检测范围为50 000, 优化范围为2-20 000, 芯片上的每个点采集130次. 考虑到基质峰的存在, 将1 000以下的峰滤去, 以免基质峰对结果造成干扰.
统计学处理 原始数据采用Ciphergen Protein Chip Software 3.2.0进行标准化, 以使总离子强度及分子量达到均一, 初始噪音过滤值为5, 二次噪音过滤值为2, 最小阈值为5%, 标准化后的数据用Biomarker Wizard软件快速计算相同相对分子质量的蛋白在各组间峰值差异的表达强度, 并将4个病例组的蛋白峰强度分别与正常对照组进行比较, 从而找出4个病例组共有的差异蛋白及其表达趋势, P<0.05时具有统计学意义, 质荷比用m/z值表示, 所得数据以Excel表的格式导入Biomarker Patterns Software(BPS)进行分析, 选出各组的最佳诊断蛋白质组模型, 最后查询Expasy蛋白数据库以核实相关差异蛋白信息.
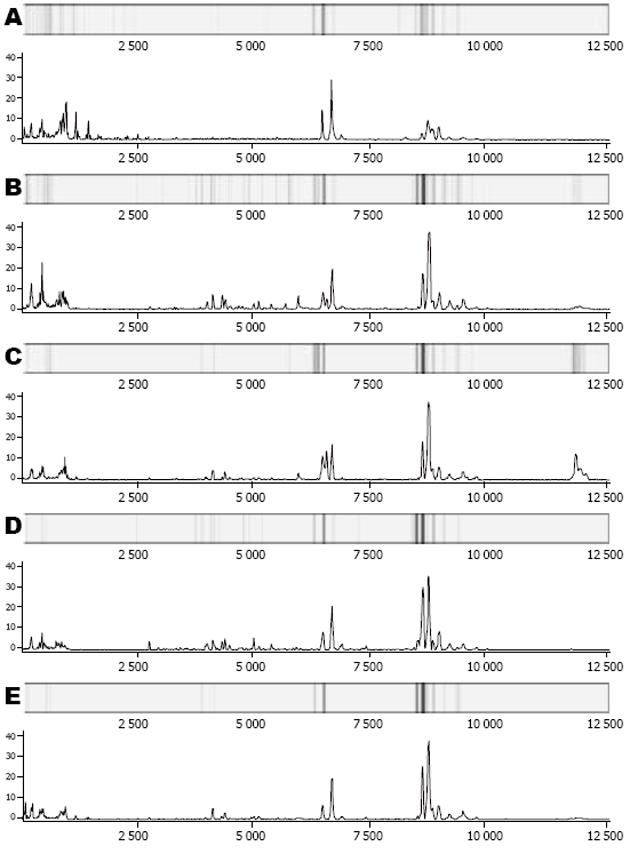
各组原始蛋白指纹图谱标准化后, 在m/z值为1-45 000的范围内共检测到113个蛋白峰, 其中2-20 000有86个, 20-45 000有16个, 在2 000以下者考虑为金属离子及基质影响, 不予纳入统计处理(图1)[5].
以正常人为NC组, 其余各组都与其进行两两比较(P<0.05), ASC组有63个蛋白质波峰强度值存在统计学差异(P<0.05), 其中29个上调, 34个下调; CHB组有57个, 其中21个上调, 36个下调; LC组有68个, 其中33个上调, 35个下调; HCC组有74个, 其中28个上调, 46个下调(表1).
| 差异蛋白 | ASC组 | CHB组 | LC组 | HCC组 |
| 上调 | 29 | 21 | 33 | 28 |
| 下调 | 34 | 36 | 35 | 46 |
| 合计 | 63 | 57 | 68 | 74 |
从4个病例组所有的差异蛋白峰里寻找共有且表达趋势一致的小分子蛋白峰(<20 000), 共找到7个上调的差异蛋白峰, m/z分别为8 709.7、11 742.2、13 759.8、14 004.0、15 361.89、15 889.8、16 072.3, 5个下调差异蛋白峰, m/z分别为2 746.8、3 449.1、3 941.06、4 098.3、9 445.5(表2).
| m/z | 分组 | P值 | mean±SD | 标志蛋白的表达变化 |
| 8 709.70 | NC组 | - | 6.81±5.43 | - |
| ASC组 | <0.01 | 28.94±6.81 | 上调 | |
| CHB组 | <0.01 | 37.77±6.00 | 上调 | |
| LC组 | <0.01 | 33.84±10.01 | 上调 | |
| HCC组 | <0.01 | 37.59±9.16 | 上调 | |
| 11 742.20 | NC组 | - | 0.20±0.19 | - |
| ASC组 | <0.01 | 0.34±0.17 | 上调 | |
| CHB组 | <0.01 | 0.55±0.43 | 上调 | |
| LC组 | <0.01 | 1.30±1.09 | 上调 | |
| HCC组 | <0.01 | 0.81±0.60 | 上调 | |
| 13 759.80 | NC组 | - | 0.16±0.12 | - |
| ASC组 | <0.01 | 1.84±0.95 | 上调 | |
| CHB组 | <0.01 | 1.15±0.77 | 上调 | |
| LC组 | <0.01 | 1.29±0.73 | 上调 | |
| HCC组 | <0.01 | 1.75±1.32 | 上调 | |
| 14 004.00 | NC组 | - | 0.13±0.09 | - |
| ASC组 | <0.01 | 0.49±0.26 | 上调 | |
| CHB组 | <0.01 | 0.37±0.20 | 上调 | |
| LC组 | <0.01 | 0.39±0.21 | 上调 | |
| HCC组 | <0.01 | 0.71±0.48 | 上调 | |
| 15 361.89 | NC组 | - | 0.20±0.16 | - |
| ASC组 | <0.01 | 0.58±0.52 | 上调 | |
| CHB组 | <0.01 | 0.83±0.79 | 上调 | |
| LC组 | <0.01 | 1.00±0.96 | 上调 | |
| HCC组 | <0.01 | 0.87±0.84 | 上调 | |
| 15 889.80 | NC组 | - | 0.13±0.06 | - |
| ASC组 | <0.01 | 1.03±0.98 | 上调 | |
| CHB组 | <0.01 | 2.83±2.56 | 上调 | |
| LC组 | <0.01 | 3.24±2.86 | 上调 | |
| HCC组 | <0.01 | 2.11±1.30 | 上调 | |
| 16 072.30 | NC组 | - | 0.11±0.08 | - |
| ASC组 | <0.01 | 0.44±0.71 | 上调 | |
| CHB组 | <0.01 | 0.74±1.08 | 上调 | |
| LC组 | <0.01 | 1.22±1.40 | 上调 | |
| HCC组 | <0.01 | 0.54±0.73 | 上调 | |
| 2 746.80 | NC组 | - | 6.30±5.47 | - |
| ASC组 | <0.01 | 1.92±1.77 | 下调 | |
| CHB组 | <0.01 | 1.68±1.58 | 下调 | |
| LC组 | <0.01 | 0.94±0.88 | 下调 | |
| HCC组 | <0.01 | 1.44±1.28 | 下调 | |
| 3 449.10 | NC组 | - | 1.04±0.90 | - |
| ASC组 | <0.01 | 0.31±0.27 | 下调 | |
| CHB组 | 0.029 | 0.51±0.43 | 下调 | |
| LC组 | <0.01 | 0.43±0.46 | 下调 | |
| HCC组 | <0.01 | 0.27±0.22 | 下调 | |
| 3 941.06 | NC组 | - | 3.20±2.53 | - |
| ASC组 | <0.01 | 0.55±0.58 | 下调 | |
| CHB组 | <0.01 | 1.17±1.22 | 下调 | |
| LC组 | <0.01 | 1.74±1.58 | 下调 | |
| HCC组 | 0.047 | 0.62±0.47 | 下调 | |
| 4 098.30 | NC组 | - | 12.78±8.76 | - |
| ASC组 | <0.01 | 4.07±2.48 | 下调 | |
| CHB组 | <0.01 | 4.22±1.82 | 下调 | |
| LC组 | <0.01 | 5.37±3.21 | 下调 | |
| HCC组 | <0.01 | 4.35±2.41 | 下调 | |
| 9 445.50 | NC组 | - | 6.12±3.03 | - |
| ASC组 | <0.01 | 3.34±1.51 | 下调 | |
| CHB组 | <0.01 | 3.56±1.71 | 下调 | |
| LC组 | <0.01 | 3.24±1.64 | 下调 | |
| HCC组 | <0.01 | 3.57±1.36 | 下调 |
4个病例组分别与正常对照组进行比较的数据导入BPS分析后, 各自建立一个诊断模型并分别筛选出6个重要蛋白峰, ASC组的m/z分别为13 759.8、14 004.0、3 941.06、4 098.28、3 322.83、5 276.74; CHB组分别为13 759.8、8 709.7、14 004.0、9 311.02、15 889.8、15 145.1; LC组分别为13 759.8、15 889.8、15 145.1、3 322.83、11 742.2、5 167.81; HCC组分别为13 759.8、9 311.02、3 568.40、3 941.06、15 889.8、11 742.2, 具体分值和各自的灵敏度和特异度见表3-6.
| m/z | 分值 | 灵敏度(%) | 特异度(%) |
| M13759_8 | 100.00 | 100.00 | 96.67 |
| M14004_0 | 68.54 | 93.33 | 86.67 |
| M3941_06 | 57.59 | 83.33 | 90.00 |
| M4098_28 | 44.17 | 96.67 | 70.00 |
| M3322_83 | 43.40 | 96.67 | 66.67 |
| M5276_74 | 42.93 | 83.33 | 90.00 |
| m/z | 分值 | 灵敏度(%) | 特异度(%) |
| M13759_8 | 100.00 | 93.33 | 96.67 |
| M8709_70 | 86.20 | 90.00 | 96.67 |
| M14004_0 | 66.44 | 83.33 | 90.00 |
| M9311_02 | 66.44 | 93.33 | 90.00 |
| M15889_8 | 60.82 | 70.00 | 100.00 |
| M15145_1 | 55.31 | 73.33 | 93.33 |
| m/z | 分值 | 灵敏度(%) | 特异度(%) |
| M13759_8 | 100.00 | 96.67 | 96.67 |
| M15889_8 | 93.01 | 90.00 | 100.00 |
| M15145_1 | 73.53 | 86.67 | 93.33 |
| M3322_83 | 68.23 | 100.00 | 80.00 |
| M11742_2 | 67.49 | 90.00 | 86.67 |
| M5167_81 | 61.73 | 86.67 | 86.67 |
| m/z | 分值 | 灵敏度(%) | 特异度(%) |
| M13759_8 | 100.00 | 100.00 | 96.67 |
| M9311_02 | 68.47 | 90.00 | 90.00 |
| M3568_40 | 68.47 | 96.67 | 83.33 |
| M3941_06 | 63.6 | 100.00 | 83.33 |
| M15889_8 | 63.6 | 76.67 | 100.00 |
| M11742_2 | 63.01 | 93.33 | 83.33 |
综合分析表达趋势一致的差异蛋白和诊断模型结果, 发现5个上调蛋白峰8 709.7、13 759.8、14 004.0、15 361.89、16 072.3和5个下调蛋白峰2 746.8、3 449.1、3 941.06、4 098.3、9 445.5的表达虽然在病例组和正常对照组间都存在差异, 但在4个病例组中无逐渐递增或递减趋势. 而其中表现为上调的15 889.8蛋白峰的表达在NC<ASC<CHB<LC组, HCC组较CHB组和LC组都低, 且其在CHB、LC和HCC的诊断中均起重要作用. 11742.2蛋白峰表达在LC和HCC组最高, 在NC<ASC<CHB<LC组和NC<ASC<CHB<HCC组, 用此蛋白峰诊断HBV相关性肝硬化的灵敏度和特异度分别为90%和86.67%, 诊断肝癌的灵敏度和特异度分别为93.33%和83.33%. 进入Expasy蛋白数据库查询后两种差异蛋白峰的信息, 分别找到分子量与本研究中的m/z相近的多种蛋白(表7).
| m/z值 | m/z相近的蛋白英文名称 | 数据库中的MW(Da) | 中文名称 |
| 11 742.2 | Ig kappa chain V-I region Ni (P01613) | 11 745 | 免疫球蛋白链V-I区 |
| Ret finger protein-like 3 antisense gene protein (P0C7P2) | 11 739 | RET指蛋白3 | |
| (P31949) | 11 741 | S100钙结合蛋白A11 | |
| 15 889.8 | Pro epiregulin (O14944) | 15 889 | 表皮调节素 |
| Centromere protein S (Q8N2Z9) | 15 893 | 着丝粒蛋白S | |
| Putative uncharacterized protein FLJ42384 (Q6ZVL8) | 15 891 | 推定非特征性蛋白FLJ42384 | |
| Calcium-regulated heat stable protein 1 (Q9Y2V2) | 15 892 | 钙调节热稳定蛋白 | |
| Zinc finger C4H2 domain-containing protein (Q9NQZ6) | 15 886 | 锌指结合蛋白 |
我国是病毒性乙型肝炎的高流行区, HBV感染后发展成LC, 还可恶变为HCC. 近年来, 许多研究证明[6-8]正常组织或肿瘤, 甚至是肿瘤的微环境都可以释放一些蛋白或肽段到血清中, 而且随着疾病的发生和发展, 血清蛋白可以发生质或量的变化[9-12]. 目前已有多种血清蛋白标志物, 如甲胎蛋白(alpha-fetoprotein, AFP)、前列腺特异性抗原(prostate specific antigen, PSA)、糖抗原125(carbohydrate antigen 125, CA-125)、CA-153、Glypican-3等[13-17]被逐渐应用于临床肿瘤的早期诊断及预后等.
血清蛋白成分极为复杂[18], 65%-97%的成分是白蛋白和免疫球蛋白, 低丰度和极低丰度蛋白的含量极少. 由于高丰度蛋白的存在会掩盖中、低丰度蛋白的特性并影响其被检测, Mehta等还证实了生物标志物往往是疾病发生发展过程中分泌入血液的低分子量蛋白质, 因此血清样品制备的基本内容就是去除高丰度蛋白[8,19,20]. Merrell等认为有机溶剂乙腈在有选择地去除高丰度蛋白质的同时可以提取多肽和低丰度蛋白质, 从而提高蛋白质的特异性, 所以本研究采用1.2倍的乙腈去除血清的高丰度蛋白[18,21]. 芯片共检测到113个蛋白峰, 且m/z均在45 000以下, 除2 000以下的11个蛋白峰考虑为金属离子及基质影响不予纳入研究外[5], 2-20 000之间共有86个, 占有意义蛋白峰的84.3%; 20-45 000之间有16个, 占15.7%, 可见1.2倍的乙腈对于去除高丰度蛋白、保留低、中丰度蛋白效果显著, 这为寻找小分子血清蛋白标志物提供了有利条件, 而这也是本试验未检测到m/z为68 677.57的AFP的原因.
2002年国际人类蛋白质组组织(human proteomic organization, HUPO)启动了人类血浆蛋白质组计划(human plasma proteome project, HPPP)[12], 此后越来越多的研究人员加入到了蛋白质组的研究, 电泳和质谱技术是目前最主要的研究方法, 而快捷、稳定和高通量的SELDI-TOF-MS技术也被Schwegler等[22]证实可用于鉴别肝炎、肝硬化、肝癌疾病的进展, 故本研究选择了此技术对研究对象的血清蛋白进行研究, 并对4个病例组表达趋势一致的差异蛋白峰和各自的诊断模型进行综合分析. 鉴于发现的结果, 考虑5个上调蛋白峰8 709.7、13 759.8、14 004.0、15 361.89、16 072.3和5个下调蛋白峰2 746.8、3 449.1、3 941.06、4 098.3、9 445.5可能与HBV感染有关, 而用于预测HBV相关性肝硬化及肝癌的意义不大, 这结果部分与Cui等[1]一致; 15 889.8蛋白峰的表达在NC<ASC<CHB<LC组, HCC组较CHB组和LC组都低, 其在CHB、LC和HCC的诊断中均起重要作用. 可能会成为HBV感染后进展为肝硬化的早期诊断标志物; 而11742.2蛋白峰表达在LC和HCC组最高, 在NC<ASC<CHB<LC组和NC<ASC<CHB<HCC组, 提示11 742.2蛋白峰也许是HBV相关性肝硬化或肝癌进展过程中的一个重要标志, He等[23]也鉴定出相对分子质量为11 724的蛋白峰与肝癌有关, 而其在诊断肝硬化的灵敏度和特异度分别为90%和86.67%, 诊断肝癌分别为93.33%和83.33%, 这比AFP有较高的灵敏度和特异度[13], 但这都有待于进一步的验证.
蛋白数据库Expasy是由瑞士生物信息学研究所维护, 并提供从序列(Swiss-Prot)到结构(Swiss-Model), 以及2-D Page等蛋白质操作相关的全套服务. 根据蛋白数据库Expasy查询的结果, 15 889.8和11 742.2蛋白峰都找到数个相对分子质量与其m/z相近的蛋白, 但具体的蛋白结构还需进一步的验证. 其中相对分子质量与m/z为15 889.8蛋白峰相近的5种蛋白分别为表皮调节素、着丝粒蛋白S、推定非特征性蛋白FLJ42384、钙调节热稳定蛋白和锌指结合蛋白. Himoto等[24]认为抗着丝粒自身抗体(anticentromere antibody, ACA)的存在预示慢性丙型肝炎纤维化和感染的严重性, 且ACA还是原发性胆汁淤积性肝硬化的一个危险因子[25], 其机制目前涉及HLA-DR及HLA-DQ基因[24,26], 因此身为ACA抗原的着丝粒蛋白就与肝纤维化有关, 其余4种蛋白目前尚未发现他们与纤维化之间的关系, 而15 889.8蛋白峰可能为着丝粒蛋白S, 并可能成为HBV感染后进展为肝硬化的早期诊断指标, 但这还有待于进一步的验证. 相对分子质量与m/z为11 742.2蛋白峰相近的是免疫球蛋白κ链V-I区、RET指蛋白S和S100钙结合蛋白A11. 其中免疫球蛋白κ链在Gazzana等[27]的研究中被发现在患HCC的老鼠血清中呈高表达; RET指蛋白S结构域包括一个环指结构、一个B-盒式结构和一个卷曲结构位点[28], 当RET指蛋白的三分体结构与酪氨酸激酶发生融合时就会变成癌基因[29]; 最后一种S100钙结合蛋白A11不仅在头颈部鳞状细胞癌的组织中高表达[30], 而且在肝癌细胞株(JHH-5)中也呈高表达[31], 提示若11 742.2蛋白峰无论是上述3种蛋白中的任一种, 其表达上调预示HBV感染的患者有可能发展为肝癌. 此外, 虽然目前尚未有足够的证据证明数据库中的3种蛋白与肝硬化之间的关系, 但从本研究结果来看仍不能排除11 742.2蛋白峰与HBV相关性肝硬化的关系, 有待于进一步地深入研究.
我国是乙型肝炎的高发国家, HBV感染后发展成乙型肝炎肝硬化, 最后恶变为乙型肝炎相关性原发性肝细胞癌, 严重危害着人类的健康.
吴君, 主任医师, 贵阳医学院附属医院感染科
Himoto等认为抗着丝粒自身抗体(ACA)的存在预示慢性丙型肝炎纤维化和感染的严重性, 且ACA还是原发性胆汁淤积性肝硬化的一个危险因子.
迄今, 对乙型肝炎病毒(HBV)感染后的相关性肝脏疾病尤其是小分子蛋白的研究鲜见报道. 本研究采用乙腈沉淀法去除血清中高丰度蛋白后, 再应用SELDI-TOF-MS技术、弱型阳离子交换芯片(WCX2 chip)检测研究对象血清中的小分子蛋白
本研究采用SELDI-TOF-MS技术筛选乙型肝炎相关性疾病患者血清中的小分子差异蛋白, 以期寻找HBV感染后循序进展的标志物并进行了初步评价, 有一定的实用价值, 而所发现的蛋白仍有待于后期的验证.
本研究对HBV相关性肝病患者血清中小分子差异蛋白进行筛选, 并进行了初步评价, 有一定的实用价值; 但所筛选出的差异蛋白在肝脏疾病发生中的功能及意义还要进一步深入研究, 需要大量的后期工作才能确定.
编辑: 李薇 电编:何基才
| 1. | Cui JF, Liu YK, Zhou HJ, Kang XN, Huang C, He YF, Tang ZY, Uemura T. Screening serum hepatocellular carcinoma-associated proteins by SELDI-based protein spectrum analysis. World J Gastroenterol. 2008;14:1257-1262. [PubMed] [DOI] |
| 2. | Zinkin NT, Grall F, Bhaskar K, Otu HH, Spentzos D, Kalmowitz B, Wells M, Guerrero M, Asara JM, Libermann TA. Serum proteomics and biomarkers in hepatocellular carcinoma and chronic liver disease. Clin Cancer Res. 2008;14:470-477. [PubMed] [DOI] |
| 3. | Chen L, Ho DW, Lee NP, Sun S, Lam B, Wong KF, Yi X, Lau GK, Ng EW, Poon TC. Enhanced detection of early hepatocellular carcinoma by serum SELDI-TOF proteomic signature combined with alpha-fetoprotein marker. Ann Surg Oncol. 2010;17:2518-2525. [PubMed] [DOI] |
| 4. | Wu C, Wang Z, Liu L, Zhao P, Wang W, Yao D, Shi B, Lu J, Liao P, Yang Y. Surface enhanced laser desorption/ionization profiling: New diagnostic method of HBV-related hepatocellular carcinoma. J Gastroenterol Hepatol. 2009;24:55-62. [PubMed] [DOI] |
| 5. | Bañez LL, Prasanna P, Sun L, Ali A, Zou Z, Adam BL, McLeod DG, Moul JW, Srivastava S. Diagnostic potential of serum proteomic patterns in prostate cancer. J Urol. 2003;170:442-446. [PubMed] [DOI] |
| 6. | Tirumalai RS, Chan KC, Prieto DA, Issaq HJ, Conrads TP, Veenstra TD. Characterization of the low molecular weight human serum proteome. Mol Cell Proteomics. 2003;2:1096-1103. [PubMed] [DOI] |
| 7. | Anderson NL, Anderson NG. The human plasma proteome: history, character, and diagnostic prospects. Mol Cell Proteomics. 2002;1:845-867. [PubMed] [DOI] |
| 8. | Mehta AI, Ross S, Lowenthal MS, Fusaro V, Fishman DA, Petricoin EF 3rd, Liotta LA. Biomarker amplification by serum carrier protein binding. Dis Markers. 2003;19:1-10. [PubMed] |
| 9. | Kim EJ, Jeong SH, Cho JH, Ku HO, Pyo HM, Kang HG, Choi KH. Plasma haptoglobin and immunoglobulins as diagnostic indicators of deoxynivalenol intoxication. J Vet Sci. 2008;9:257-266. [PubMed] [DOI] |
| 10. | Poon TC, Hui AY, Chan HL, Ang IL, Chow SM, Wong N, Sung JJ. Prediction of liver fibrosis and cirrhosis in chronic hepatitis B infection by serum proteomic fingerprinting: a pilot study. Clin Chem. 2005;51:328-335. [PubMed] [DOI] |
| 11. | Adam BL, Qu Y, Davis JW, Ward MD, Clements MA, Cazares LH, Semmes OJ, Schellhammer PF, Yasui Y, Feng Z. Serum protein fingerprinting coupled with a pattern-matching algorithm distinguishes prostate cancer from benign prostate hyperplasia and healthy men. Cancer Res. 2002;62:3609-3614. [PubMed] |
| 12. | Omenn GS, States DJ, Adamski M, Blackwell TW, Menon R, Hermjakob H, Apweiler R, Haab BB, Simpson RJ, Eddes JS. Overview of the HUPO Plasma Proteome Project: results from the pilot phase with 35 collaborating laboratories and multiple analytical groups, generating a core dataset of 3020 proteins and a publicly-available database. Proteomics. 2005;5:3226-3245. [PubMed] [DOI] |
| 13. | Sanai FM, Sobki S, Bzeizi KI, Shaikh SA, Alswat K, Al-Hamoudi W, Almadi M, Al Saif F, Abdo AA. Assessment of alpha-fetoprotein in the diagnosis of hepatocellular carcinoma in Middle Eastern patients. Dig Dis Sci. 2010;55:3568-3575. [PubMed] [DOI] |
| 14. | Grossklaus DJ, Coffey CS, Shappell SB, Jack GS, Chang SS, Cookson MS. Percent of cancer in the biopsy set predicts pathological findings after prostatectomy. J Urol. 2002;167:2032-2035; discussion 2036. [PubMed] [DOI] |
| 15. | Whitehouse C, Solomon E. Current status of the molecular characterization of the ovarian cancer antigen CA125 and implications for its use in clinical screening. Gynecol Oncol. 2003;88:S152-S157. [PubMed] [DOI] |
| 16. | Zheng H, Luo RC. [Diagnostic value of combined detection of TPS, CA153 and CEA in breast cancer]. Diyi Junyi Daxue Xuebao. 2005;25:1293-1294, 1298. [PubMed] |
| 17. | Liu H, Li P, Zhai Y, Qu CF, Zhang LJ, Tan YF, Li N, Ding HG. Diagnostic value of glypican-3 in serum and liver for primary hepatocellular carcinoma. World J Gastroenterol. 2010;16:4410-4415. [PubMed] [DOI] |
| 18. | Merrell K, Southwick K, Graves SW, Esplin MS, Lewis NE, Thulin CD. Analysis of low-abundance, low-molecular-weight serum proteins using mass spectrometry. J Biomol Tech. 2004;15:238-248. [PubMed] |
| 19. | Bagheri-Yarmand R, Biernacka A, Hunt KK, Keyomarsi K. Low molecular weight cyclin E overexpression shortens mitosis, leading to chromosome missegregation and centrosome amplification. Cancer Res. 2010;70:5074-5084. [PubMed] [DOI] |
| 20. | Cao J, Hu Y, Shen C, Yao J, Wei L, Yang F, Nie A, Wang H, Shen H, Liu Y. Nanozeolite-driven approach for enrichment of secretory proteins in human hepatocellular carcinoma cells. Proteomics. 2009;9:4881-4888. [PubMed] [DOI] |
| 21. | Chertov O, Biragyn A, Kwak LW, Simpson JT, Boronina T, Hoang VM, Prieto DA, Conrads TP, Veenstra TD, Fisher RJ. Organic solvent extraction of proteins and peptides from serum as an effective sample preparation for detection and identification of biomarkers by mass spectrometry. Proteomics. 2004;4:1195-1203. [PubMed] [DOI] |
| 22. | Schwegler EE, Cazares L, Steel LF, Adam BL, Johnson DA, Semmes OJ, Block TM, Marrero JA, Drake RR. SELDI-TOF MS profiling of serum for detection of the progression of chronic hepatitis C to hepatocellular carcinoma. Hepatology. 2005;41:634-642. [PubMed] [DOI] |
| 23. | He QY, Zhu R, Lei T, Ng MY, Luk JM, Sham P, Lau GK, Chiu JF. Toward the proteomic identification of biomarkers for the prediction of HBV related hepatocellular carcinoma. J Cell Biochem. 2008;103:740-752. [PubMed] [DOI] |
| 24. | Himoto T, Nakai S, Kinekawa F, Yoneyama H, Deguchi A, Kurokochi K, Masaki T, Senda S, Haba R, Watanabe S. Clinical characteristics of patients with hepatitis C virus-related chronic liver disease seropositive for anticentromere antibody. Dig Dis Sci. 2009;54:360-368. [PubMed] [DOI] |
| 25. | Nakamura M, Kondo H, Mori T, Komori A, Matsuyama M, Ito M, Takii Y, Koyabu M, Yokoyama T, Migita K. Anti-gp210 and anti-centromere antibodies are different risk factors for the progression of primary biliary cirrhosis. Hepatology. 2007;45:118-127. [PubMed] [DOI] |
| 26. | Nakamura M, Kondo H, Mori T, Komori A, Matsuyama M, Ito M, Takii Y, Koyabu M, Yokoyama T, Migita K. Anti-gp210 and anti-centromere antibodies are different risk factors for the progression of primary biliary cirrhosis. Hepatology. 2007;45:118-127. [PubMed] [DOI] |
| 27. | Gazzana G, Borlak J. Mapping of the serum proteome of hepatocellular carcinoma induced by targeted overexpression of epidermal growth factor to liver cells of transgenic mice. J Proteome Res. 2008;7:928-937. [PubMed] [DOI] |
| 28. | Chang GT, Steenbeek M, Schippers E, Blok LJ, van Weerden WM, van Alewijk DC, Eussen BH, van Steenbrugge GJ, Brinkmann AO. A novel gene on human chromosome 2p24 is differentially expressed between androgen-dependent and androgen-independent prostate cancer cells. Eur J Cancer. 2001;37:2129-2134. [PubMed] [DOI] |
| 29. | Schaner P, Richards N, Wadhwa A, Aksentijevich I, Kastner D, Tucker P, Gumucio D. Episodic evolution of pyrin in primates: human mutations recapitulate ancestral amino acid states. Nat Genet. 2001;27:318-321. [PubMed] [DOI] |
| 30. | Ralhan R, Desouza LV, Matta A, Chandra Tripathi S, Ghanny S, Datta Gupta S, Bahadur S, Siu KW. Discovery and verification of head-and-neck cancer biomarkers by differential protein expression analysis using iTRAQ labeling, multidimensional liquid chromatography, and tandem mass spectrometry. Mol Cell Proteomics. 2008;7:1162-1173. [PubMed] [DOI] |
| 31. | Miyazaki M, Sakaguchi M, Akiyama I, Sakaguchi Y, Nagamori S, Huh NH. Involvement of interferon regulatory factor 1 and S100C/A11 in growth inhibition by transforming growth factor beta 1 in human hepatocellular carcinoma cells. Cancer Res. 2004;64:4155-4161. [PubMed] [DOI] |