修回日期: 2010-11-04
接受日期: 2010-11-10
在线出版日期: 2011-01-18
目的: 探讨转化生长因子β1Ⅱ型受体(TβRⅡ)在慢性胰腺炎(CP)纤维化病理进程中的作用, 研究氧化苦参碱(OM)对胰腺纤维化的作用机制.
方法: 40只Wistar♂大鼠随机分为4组, 即阴性对照组(NC组, n = 10), CP模型组(CP组, n = 10), OM干预组(OP组, n = 10)和OM治疗组(OT组, n = 10). NC组隔日给予腹腔注射生理盐水300 mg/kg; 其他每组均隔日腹腔注射二乙基硫代氨基甲酸盐(DDC)700 mg/kg, 30 d停止. 另外OP组于注射DDC同日开始每日腹腔注射OM 100 mg/kg, OT组于注射DDC 1 wk后开始每日腹腔注射OM 100 mg/kg, 分别于注射DDC 20 d、40 d后处死动物. 胰腺组织行HE染色和Masson胶原染色并进行病理学评分, Western blot检测胰腺组织TβRⅡ的表达.
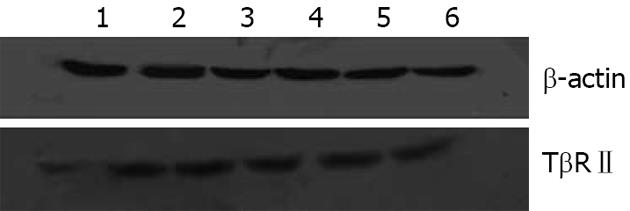
结果: Masson染色测定结果显示, 在20 d、40 d时CP组胶原纤维含量显著高于其余各组(20 d: 22.54%±4.45% vs 13.16%±1.84%, 19.58%±2.78%, 2.45±0.24%; 40 d: 35.14%±3.27% vs 25.14%±3.67%, 28.68%±2.55%, 3.0%±0.32%; 均P<0.05), OP组和OT组在40 d时的胶原纤维面积百分比均比同组20 d时增高(25.14%±3.67% vs 13.16%±1.84%; 28.68%±2.55% vs 19.58%±2.78%; 均P<0.05). Western blot结果显示, 在20 d、40 d时, CP组胰腺组织TβRⅡ表达显著高于其余各组(20 d: 0.74±0.05 vs 0.47±0.03, 0.61±0.03, 0.21±0.02; 40 d: 1.01±0.14 vs 0.64±0.08, 0.75±0.04, 0.23±0.03; 均P<0.05), OP组和OT组在40 d时胰腺组织TβRⅡ的表达均比20 d时明显增高(0.64±0.08 vs 0.47±0.03; 0.75±0.04 vs 0.61±0.03; 均P<0.05).
结论: 腹腔注射DDC建立大鼠胰腺纤维化模型, 方法有效. OM有显著的抗胰腺纤维化作用, 可能与其降低TβRⅡ含量, 抑制TGF-β信号转导通路有关.
引文著录: 苏丽婷, 夏时海, 郑永青. 转化生长因子β1Ⅱ型受体在大鼠慢性胰腺炎中的表达及氧化苦参碱对其的影响. 世界华人消化杂志 2011; 19(2): 121-125
Revised: November 4, 2010
Accepted: November 10, 2010
Published online: January 18, 2011
AIM: To investigate the effect of treatment with oxymatrine on the expression of transforming growth factor β1 type II receptor (TGFβRII) in chronic pancreatitis (CP) in rats and to explore the potential anti-fibrotic mechanism of oxymatrine.
METHODS: Forty male Wistar rats were randomly and equally assigned to four groups: negative control group (NC), CP group, oxymatrine treatment group (OT), and oxymatrine prevention group (OP). Each group was further divided into two subgroups for detection at different time points. Except the NC group, pancreatic fibrosis was induced in rats of the other groups by intraperitoneal injections of diethyldithiocarbamate (DDC 700 mg/kg). Preventive and therapeutic oxymatrine (100 mg/kg) was given to rats of the OT and OP group, respectively. Pancreatic tissue samples were taken for HE and Masson staining to evaluate histological alterations. The expression of TGFβRII in pancreatic tissue was detected by Western blot.
RESULTS: The contents of collagen fibers in the CP group were significantly higher than those in the other groups (day 20: 22.54% ± 4.45% vs 13.16% ± 1.84%, 19.58% ± 2.78%, 2.45% ± 0.24%; day 40: 35.14% ± 3.27% vs 25.14% ± 3.67%, 28.68% ± 2.55%, 3.0% ± 0.32%; all P < 0.05), and the percentages of collagen area in the OP and OT groups on day 40 were significantly higher than those on day 20 (25.14% ± 3.67% vs 13.16% ± 1.84%; 28.68% ± 2.55% vs 19.58% ± 2.78%; all P < 0.05) The expression level of TGFβRII in the CP group was significantly higher than those in the other groups (day 20: 0.74 ± 0.05 vs 0.47 ± 0.03, 0.61 ± 0.03, 0.21 ± 0.02; day 40: 1.01 ± 0.14 vs 0.64 ± 0.08, 0.75 ± 0.04, 0.23 ± 0.03; all P < 0.05). The expression levels of TGFβRII in the OP and OT groups on day 40 were significantly higher than those on day 20 (0.64 ± 0.08 vs 0.47 ± 0.03; 0.75 ± 0.04 vs 0.61 ± 0.03; all P < 0.05).
CONCLUSION: Treatment with oxymatrine exerts beneficial effects against CP possibly by inhibiting TGFβRII signaling.
- Citation: Su LT, Xia SH, Zheng YQ. Treatment with oxymatrine down-regulates TGFβRII expression in chronic pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 121-125
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/121.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.121
慢性胰腺炎(chronic pancreatitis, CP)最主要的病理改变是胰腺实质的纤维化, 目前公认转化生长因子β1(transforming growth factor-β1, TGF-β1)是致组织纤维化的最关键因子之一[1], 在其信号转导的受体传递过程中, 首先与TGF-β1Ⅱ型受体(transforming growth factor-β1 typeⅡreceptor, TβRⅡ)结合[2]. 近年来, 大量证据表明氧化苦参碱(oxymatrine, OM)对肝、肾等器官纤维化有较好的治疗作用, 由于胰腺纤维化与肝纤维化病理发展过程相似, 因此本文通过研究TβRⅡ在CP病程中的表达变化, 探讨其在胰腺纤维化病理进程中的作用, 并研究OM对胰腺纤维化的干预作用, 为其临床应用提供实验依据.
清洁级远交群Wistar♂大鼠40只, 购自中国军事医学科学院动物实验中心, 7-8 wk龄, 体质量220-250 g. 二乙基硫代氨基甲酸盐(diethyldithiocarbamate, DDC)购自上海国药集团化学试剂公司, OM由江苏正大天晴药业股份有限公司惠赠, 抗TβRⅡ蛋白抗体购自美国Santa Cruz公司, 预染蛋白质标准购自北京天为时代科技有限公司, 蛋白相对分子质量标准购自宝生物工程(大连)有限公司, 辣根过氧化物酶标记山羊抗兔IgG(H+L)购自武汉博士德生物技术有限公司.
1.2.1 分组: Wistar♂大鼠40只随机分为阴性对照组(NC组, n = 10)、CP模型组(CP组, n = 10)、OM干预组(OP组, n = 10)和OM治疗组(OT组, n = 10), 每组根据时间点不同, 再随机分为20和40 d两个小组, 每小组5只.
1.2.2 模型制备与取材: 参照Matsumura等[3]造模方法并改进, 采用腹腔注射DDC的方法建立大鼠CP模型. CP、OP、OT各组均隔日腹腔注射DDC 700 mg/kg, 30 d停止; NC组以隔日腹腔注射生理盐水300 mg/kg; OP组于注射DDC同日开始每日腹腔注射OM 100 mg/kg, OT组于注射DDC 1 wk后开始每日腹腔注射OM 100 mg/kg, 根据实验分组, 分别于实验开始后20 d、40 d处死动物, 取血及胰腺组织.
1.2.3 观测指标与检测方法: (1)胰腺病理学检查: 胰腺组织常规石蜡包埋, 5 μm切片, 分别行HE染色和Masson染色: 参考有关文献, 制定病理评分标准[4,5](表1), 每张切片任选5个低倍镜视野进行评分, 5次分数之和为该片的组织病理学分值. Masson染色判定: 高倍镜下选取5个视野, 测定每一视野中胶原纤维占视野面积的百分比, Image Pro Plus 5.0专业彩色图像分析软件进行分析, 取其平均值; (2)Western blot检测TβRⅡ蛋白含量: 将提取的蛋白样品用BCA蛋白浓度测定试剂盒测定总蛋白浓度, 稀释蛋白浓度为5 g/L, 用聚丙烯酰胺凝胶电泳法分离, 积层胶电压80 V, 持续30 min, 分离胶电压120 V, 持续150 min; 湿法转印, PVDF膜用5%脱脂奶粉PBS液封闭; 抗TβRⅡ蛋白兔抗鼠多克隆抗体(1∶200稀释), 4 ℃孵育过夜, 二抗为辣根过氧化物酶标记山羊抗兔IgG (1∶3 000稀释); ECL化学发光显色, 暗室中拍片. 以β-actin作为内参, 将结果扫描成电子图像, 以Image Pro Plus 5.0图像分析软件分析, 计算出积分吸光度(IA), 以同一张膜上TβRⅡ与β-actin吸光度值的比值作为目的蛋白相对表达量.
| 评分 | 病理改变 |
| 0分 | 胰管周围及小叶内无炎症改变, 胰管无扩张 |
| 1分 | 胰管周围及小叶内炎症改变(≤50%), 胰管扩张, 周围组织纤维化改变 |
| 2分 | 胰管周围及小叶内较广泛炎症改变(>50%)和灶状坏死, 小叶纤维化改变 |
| 3分 | 上述改变广泛存在于小叶间和小叶内, 小叶结构破坏, 出现萎缩 |
统计学处理 用SPSS12.0软件统计, 计量数据以用mean±SD表示, 计数资料采用χ2检验, 组间差异采用方差分析, LSD法两两比较, P<0.05有统计学意义.
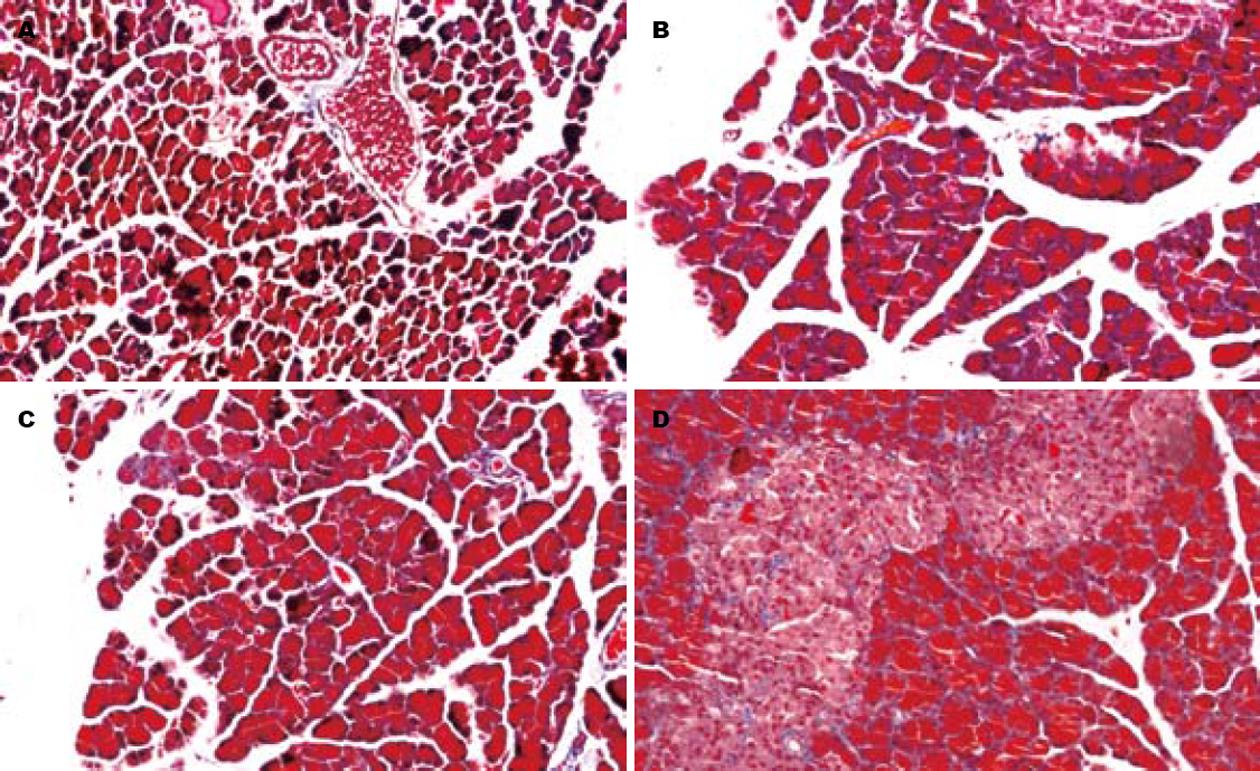
NC组大鼠胰腺组织无明显病理改变, 胰腺小叶轮廓清晰, 个别大鼠的胰腺有轻微充血. CP组胰腺部分腺泡萎缩变形, 炎细胞浸润, 小叶内和小叶间纤维组织增生, 部分小叶间结构消失. OP组和OT组胰腺小部分腺泡细胞浸润、部分小叶间纤维组织增生, 小叶结构尚完整. 胰腺病理评分: NC组为0.52±0.35、CP组为6.87±2.24、OT组为5.31±1.82、OP组为4.49±1.76, 统计学结果显示: OP组病理学评分较CP组明显降低(P<0.05), 但仍显著高于NC组(P<0.05). Masson染色胶原纤维含量测定结果显示: OP、OT以及CP组与NC组比较, 其胶原纤维含量均显著增高, 有统计学意义(P<0.05), 而OP组的胶原纤维含量比CP组明显减少, 有统计学意义(P<0.05, 表2, 图1).
CP病因复杂, 发病机制尚未完全阐明, 其主要病理表现为胰腺纤维化[6], 实质是细胞外基质(extracellular matrix, ECM)的合成与沉积增加, 降解减少, 两者失去了平衡所致[7]. 目前胰腺组织纤维化的发病机制研究表明, 胰腺星状细胞(pancreatic stellate cell, PSC)的活化在胰腺纤维化过程中发挥核心作用, 是ECM的主要来源细胞[8]. PSC分为静息型和激活型两种状态. 在正常胰腺组织中, PSC处于静止状态, 当其受到氧化应激时, PSC被激活转化为成肌纤维细胞, 合成和分泌多种ECM成分如Ⅰ型、Ⅲ型胶原和纤维连接蛋白等[9]. 而TGF-β1可以刺激I、Ⅲ、Ⅳ、Ⅴ等多型胶原表达[10], 并抑制基质金属蛋白酶和促进蛋白酶抑制因子的分泌[11], 促进ECM的合成和减少降解. 作为促使PSC发生转化激活的最重要细胞因子, TGF-β1成为公认的治疗器官纤维化的靶标[12,13], 而如何消除纤维化过程中产生的过多的TGF-β1, 成为治疗组织纤维化的研究热点[14,15].
TGF-β1是指调节细胞增殖、分化及细胞间基质产生和凋亡的一类多功能细胞生长因子, 是目前已知的与纤维化关系最密切、最具有代表性的生长因子[16,17]. TGF-β1的信号转导通过Ⅰ、Ⅱ型受体传递[2,18]. TGF-β1首先与TβRⅡ结合, 形成复合物, 此时TGF-β1构象发生改变, 从而可被TβRⅠ识别并结合, 形成TβRⅡ-TGF-β1-TβRⅠ异源四聚体复合物, 启动下游转导信号Smad蛋白, 发挥调节细胞生长增殖、分化等一系列生物学作用[19,20]. 在TβRⅡ不存在的情况下, TβRⅠ无法单独与TGF-β1结合, 不能启动信号的传导. 本研究选取TβRⅡ作为研究目的蛋白, 初步证实了OM具有抗胰腺纤维化作用.
在TGF-β信号传导过程中, TβRⅡ的启动作用不容忽视. 在TGF-β1信号通路研究中表明, 可溶性TβRⅡ能抑制TGF-β1信号传导[21-23]. 有研究证实, 给动物活体内注入不含胞内激酶区的TβRⅡ, 可致TGF-β1作用在受体水平阻断, 信号不能下传, 在肝纤维化形成早期可以预防肝纤维化的形成[24]. Petersen等[25]发现下调TβRⅡ含量, 降低其目的基因的表达, 可有效抑制肾脏纤维化的进展. Inagaki等[26]发现抑制TβRⅡ的表达, 可抑制星状细胞的激活及肝纤维化的进展. 本实验结果显示, CP组的TβRⅡ表达在发病晚期(40 d)时候较发病初期(20 d)含量增多, 提示TβRⅡ参与了胰腺纤维化的发展过程. 实验显示, OP组的胶原纤维面积含量较同时期的CP组明显减少(P<0.05), 其TβRⅡ表达与CP组比较亦有明显较少, 有统计学意义(P<0.05). 以上表明, 下调TβRⅡ含量可能成为今后治疗组织纤维化的一个方向.
OM是苦参的有效生物成分, 有研究表明苦参碱可有效减少胶原纤维在肝组织中的沉积[27], 减轻肝组织损伤[28], 能有效抑制单纯培养激活的肝星状细胞向肌成纤维母细胞转化[29], 抑制肝纤维化的形成[30]. 在本研究中, OM对CP的治疗效果值得探讨, 在治疗时间开始较早的OP组, 其胶原面积百分比较CP和OT组均有明显减少(P<0.05), TβRⅡ的含量亦较CP组和OT组有明显降低(P<0.05); 这说明OM对CP有治疗作用, 与其调节TβRⅡ含量降低有关. 而在OM在介入治疗时间较晚的情况下(OT组), 在20 d时间点上, 其胶原面积百分比上与CP组比较并无显著性差异(P>0.05); 而TβRⅡ定量分析的结果显示, TβRⅡ表达量较CP组降低有统计学意义(P<0.05), 虽然TβRⅡ的表达量在不同的时间点(20, 40 d)上均较CP组同期降低有统计学意义(P<0.05), 但是随着病情的发展, 这种作用明显不及较早介入的效果(OP组). 实验表明OM对CP有一定的治疗作用, 可能机制是OM下调TβRⅡ表达量, 阻滞TGF-β1信号通路的转导, 使CP胰腺纤维化的进程减缓. 同时实验结果显示, OM治疗CP的作用目前只能延缓进程, 不能逆转, 这可能与CP本身发病机制和病理机制的复杂性有关, 提示我们在临床上治疗应及时联合用药.
慢性胰腺炎临床表现为反复发作或持续性的腹痛、体质量减轻、脂肪泻和糖尿病等, 可发生胰腺假性囊肿、上消化系出血、脾静脉血栓等并发症, 约5%可发展至胰腺癌. 典型病理表现为胰腺纤维化, 流行病学调查结果显示在我国其发病率大幅增长, 目前临床上尚无特异的诊断方法和有效的治疗措施, 导致慢性胰腺炎仍是医学界的一类难题. OM已广泛应用于治疗肝炎肝纤维化方面的疾病.
刘改芳, 主任医师, 河北医科大学第三医院消化内科
通过对TβRⅡ的调控, 消除胰腺纤维化发展过程中产生的过多TGF-β1, 以TGF-β1为治疗的靶目标, 预防或阻断纤维化的发展, 已成为胰腺纤维化防治研究的最新热点.
Yamada等发现利用转染可溶性转化生长因子Ⅱ型受体(sTGF-βRⅡ)可有效阻滞TGF-β信号传导通路, 从而拮抗肺组织纤维化进程.
OM可能降低TβRⅡ的表达量, 阻滞TGF-β1信号通路的转导, 使CP胰腺纤维化的进程减缓, 为OM在抗纤维化的应用方面提供依据.
本研究选题有一定的创新性, 方法科学, 学术价值较好.
编辑: 李薇 电编: 何基才
| 1. | Verrecchia F, Mauviel A. Transforming growth factor-beta and fibrosis. World J Gastroenterol. 2007;13:3056-3062. [PubMed] |
| 2. | Chen C, Wang XF, Sun L. Expression of transforming growth factor beta (TGFbeta) type III receptor restores autocrine TGFbeta1 activity in human breast cancer MCF-7 cells. J Biol Chem. 1997;272:12862-12867. [PubMed] [DOI] |
| 3. | Matsumura N, Ochi K, Ichimura M, Mizushima T, Harada H, Harada M. Study on free radicals and pancreatic fibrosis--pancreatic fibrosis induced by repeated injections of superoxide dismutase inhibitor. Pancreas. 2001;22:53-57. [PubMed] [DOI] |
| 6. | Yadav D, Hawes RH, Brand RE, Anderson MA, Money ME, Banks PA, Bishop MD, Baillie J, Sherman S, DiSario J. Alcohol consumption, cigarette smoking, and the risk of recurrent acute and chronic pancreatitis. Arch Intern Med. 2009;169:1035-1045. [PubMed] [DOI] |
| 7. | Witt H, Apte MV, Keim V, Wilson JS. Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis, and therapy. Gastroenterology. 2007;132:1557-1573. [PubMed] [DOI] |
| 8. | Ellenrieder V, Schneiderhan W, Bachem M, Adler G. Fibrogenesis in the pancreas. Rocz Akad Med Bialymst. 2004;49:40-46. [PubMed] |
| 9. | Marastoni S, Ligresti G, Lorenzon E, Colombatti A, Mongiat M. Extracellular matrix: a matter of life and death. Connect Tissue Res. 2008;49:203-206. [PubMed] [DOI] |
| 11. | Talukdar R, Tandon RK. Pancreatic stellate cells: new target in the treatment of chronic pancreatitis. J Gastroenterol Hepatol. 2008;23:34-41. [PubMed] |
| 12. | Vogelmann R, Ruf D, Wagner M, Adler G, Menke A. Effects of fibrogenic mediators on the development of pancreatic fibrosis in a TGF-beta1 transgenic mouse model. Am J Physiol Gastrointest Liver Physiol. 2001;280:G164-G172. [PubMed] |
| 13. | Zion O, Genin O, Kawada N, Yoshizato K, Roffe S, Nagler A, Iovanna JL, Halevy O, Pines M. Inhibition of transforming growth factor beta signaling by halofuginone as a modality for pancreas fibrosis prevention. Pancreas. 2009;38:427-435. [PubMed] [DOI] |
| 14. | Wynn TA. Cellular and molecular mechanisms of fibrosis. J Pathol. 2008;214:199-210. [PubMed] [DOI] |
| 15. | Gressner OA, Rizk MS, Kovalenko E, Weiskirchen R, Gressner AM. Changing the pathogenetic roadmap of liver fibrosis? Where did it start; where will it go? J Gastroenterol Hepatol. 2008;23:1024-1035. [PubMed] [DOI] |
| 17. | Huang SS, Huang JS. TGF-beta control of cell proliferation. J Cell Biochem. 2005;96:447-462. [PubMed] [DOI] |
| 19. | Gordon KJ, Blobe GC. Role of transforming growth factor-beta superfamily signaling pathways in human disease. Biochim Biophys Acta. 2008;1782:197-228. [PubMed] |
| 20. | Itoh S, ten Dijke P. Negative regulation of TGF-beta receptor/Smad signal transduction. Curr Opin Cell Biol. 2007;19:176-184. [PubMed] [DOI] |
| 21. | Rowland-Goldsmith MA, Maruyama H, Kusama T, Ralli S, Korc M. Soluble type II transforming growth factor-beta (TGF-beta) receptor inhibits TGF-beta signaling in COLO-357 pancreatic cancer cells in vitro and attenuates tumor formation. Clin Cancer Res. 2001;7:2931-2940. [PubMed] |
| 22. | Rowland-Goldsmith MA, Maruyama H, Matsuda K, Idezawa T, Ralli M, Ralli S, Korc M. Soluble type II transforming growth factor-beta receptor attenuates expression of metastasis-associated genes and suppresses pancreatic cancer cell metastasis. Mol Cancer Ther. 2002;1:161-167. [PubMed] |
| 23. | Yamada M, Kuwano K, Maeyama T, Yoshimi M, Hamada N, Fukumoto J, Egashira K, Hiasa K, Takayama K, Nakanishi Y. Gene transfer of soluble transforming growth factor type II receptor by in vivo electroporation attenuates lung injury and fibrosis. J Clin Pathol. 2007;60:916-920. [PubMed] [DOI] |
| 25. | Petersen M, Thorikay M, Deckers M, van Dinther M, Grygielko ET, Gellibert F, de Gouville AC, Huet S, ten Dijke P, Laping NJ. Oral administration of GW788388, an inhibitor of TGF-beta type I and II receptor kinases, decreases renal fibrosis. Kidney Int. 2008;73:705-715. [PubMed] [DOI] |
| 26. | Inagaki Y, Okazaki I. Emerging insights into Transforming growth factor beta Smad signal in hepatic fibrogenesis. Gut. 2007;56:284-292. [PubMed] |
| 27. | Wu XL, Zeng WZ, Jiang MD, Qin JP, Xu H. Effect of Oxymatrine on the TGFbeta-Smad signaling pathway in rats with CCl4-induced hepatic fibrosis. World J Gastroenterol. 2008;14:2100-2105. [PubMed] [DOI] |
| 28. | 马 宁芳, 黄 宏森, 张 超, 郭 晓珍, 李 叶莉, 郭 晓才. 苦参碱对四氯化碳所致小鼠慢性肝纤维化肝组织一氧化氮合酶表达的干预及意义. 世界华人消化杂志. 2007;15:3367-3371. [DOI] |
| 29. | 陈 源文, 李 定国, 吴 建新, 陈 颖伟, 陆 汉明. 氧化苦参碱对转化生长因子-β1促肝星状细胞活化及跨膜信号转导影响. 胃肠病学和肝病学杂志. 2005;14:31-35. |
| 30. | Shi GF, Li Q. Effects of oxymatrine on experimental hepatic fibrosis and its mechanism in vivo. World J Gastroenterol. 2005;11:268-271. [PubMed] |