修回日期: 2011-05-18
接受日期: 2011-05-24
在线出版日期: 2011-06-08
目的: 研究Peutz-Jeghers综合征(PJS)患者体内β-catenin基因突变及其蛋白表达, 探讨β-catenin在PJS息肉发生及恶变中的作用.
方法: 收集PJS息肉、癌旁正常黏膜各12例, 结肠腺瘤、结肠癌组织各14例, 及相应PJS血液标本, 检测β-catenin基因外显子3突变及mRNA表达水平. 选取PJS息肉、结肠腺瘤、结肠癌、结肠正常黏膜组织石蜡标本各20例, 通过免疫组织化学SP法检测β-catenin蛋白表达情况.
结果: PJS息肉组织RT-PCR β-catenin IA/GAPDH IA与结肠腺瘤、结肠癌、癌旁正常组织相比, 差异无显著性. 7例(70%)PJS息肉组织、2例(66.7%)PJS肠道正常黏膜、3例(50%)PJS血液白细胞出现编码区431位碱基缺失突变; 8例(80%)PJS息肉组织、1(33.3%)例PJS肠道正常黏膜、4例(66.7%)PJS血液白细胞、2例(100%)PJS家族正常成员出现非编码区184位插入突变; 1(50%)例PJS家族正常成员、2例(33.3%)PJS血液白细胞编码区421位缺失突变; 2(20%)例PJS息肉组织非编码区189位插入突变. PJS、腺瘤、腺癌及正常组织中, β-catenin膜表达缺失率分别为30.0%、45.0%、75.0%和5.0%; 细胞质阳性表达率和表达强度呈增加趋势; 胞核阳性表达率分别为60.0%、30.0%、80.0%、5.0%; 总的异位表达率分别为60.0%、50.0%、90.0%、5.0%, 差异均具有显著性(P<0.05).
结论: PJS患者β-catenin蛋白胞质内异常聚集并非mRNA表达量增高所致. PJS息肉组织中β-catenin基因突变较为常见, PJS不仅存在体系突变, 也存在胚系突变, 431、421、184、189这4个碱基位点可能是PJS有别于其他肿瘤的新的突变位点. β-catenin蛋白表达异常可能是PJS息肉形成及恶变的特征之一.
引文著录: 占春玲, 吴保平, 张亚历. β-catenin基因在Peutz-Jeghers综合征组织中的突变及表达. 世界华人消化杂志 2011; 19(16): 1739-1744
Revised: May 18, 2011
Accepted: May 24, 2011
Published online: June 8, 2011
AIM: To detect the gene mutation and protein expression of β-catenin in Peutz-Jeghers syndrome (PJS) to understand the role of β-catenin in the development, progression and canceration of PJS polyps.
METHODS: (1) The β-catenin mRNA expression and mutations in exon 3 of the β-catenin gene were detected by RT-PCR and sequencing in 12 PJS polyp specimens, 14 colon adenoma specimens, 14 colon cancer specimens, and 12 normal colon tissue specimens. (2) The expression of β-catenin protein was examined immunohistochemically in 20 cases of PJS polyps, 20 cases of colon adenoma, 20 cases of colon carcinoma, and 20 cases of normal colon tissue.
RESULTS: (1) The mRNA expression level of β-catenin relative to GAPDH in PJS showed no significant difference with those in colon adenoma, colon cancer, and normal colon tissue. (2) Gene deletion and insertion mutations were detected in PJS polyps. A deletion mutation at nucleotide 431, which might result in a frameshift or a premature stop codon, was detected in 70% of PJS patients. A T insertion mutation at nucleotide 184, which might result in abnormal regulation of protein synthesis, was detected in 80% of PJS patients. Similar mutations were also detected in the blood and normal colonic mucosa of PJS patients and health PJS family members. (3) Reduced membrane, cytoplasmic and nuclear expression of β-catenin was found in PJS polyps, colon adenoma, and carcinoma tissue. The overall rate of ectopic expression of β-catenin was 60.0% in PJS, which was significantly different from those in colon adenoma (50.0%), carcinoma (90.0%) and normal mucosa (5.0%) (all P < 0.05).
CONCLUSION: The abnormal cytoplasmic accumulation of β-catenin was not related with the elevation of β-catenin mRNA expression in PJS polyps. β-catenin gene mutations were common in PJS, especially the deletion mutation at nucleotide 431 and T insertion mutation at nucleotide 184. Abnormal β-catenin protein expression might be one of the characteristics of PJS polyps.
- Citation: Zhan CL, Wu BP, Zhang YL. Mutation and expression of the β-catenin gene in Peutz-Jeghers syndrome. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1739-1744
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1739.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1739
Peutz-Jeghers综合征(Peutz-Jeghers syndrome, PJS)是一种少见的常染色体显性遗传性综合征, 其特征为皮肤黏膜色素沉着及胃肠道多发息肉. 其息肉复发率高, 治疗往往依赖于反复多次内镜下息肉切除或外科胃肠大部或全部切除, 患者生活质量极低, 预后主要同PJS的并发症及恶变危险性有关. 目前研究认为, PJS是一种中等度癌变风险的遗传性结直肠癌综合征, 多器官系统易患癌是本综合征的一个重要特点. STK11基因是目前较为公认的PJS相关致病基因[1], 但只有50%-70%的PJS存在STK11基因突变, 提示PJS息肉的发生及恶变可能还有其他因素参与[2,3]. 近年来, 分子生物学研究发现, Wnt通路中癌基因、抑癌基因异常与结直肠癌的发生、发展密切相关. β-catenin是这一途径中的关键分子. 其致癌的机制是β-catenin降解障碍致使细胞质内游离的β-catenin积聚, 并进入到细胞核与转录因子TCF/LEF结合, 激活下游靶基因c-myc等的转录, 引起细胞增殖和分化失控, 在细胞水平上表现为过度增殖, 在组织水平上表现为肠黏膜上皮转化为腺瘤性息肉. β-catenin基因的改变在大肠腺瘤发生, 特别是腺瘤癌变过程中发挥着重要的作用, β-catenin蛋白的异常表达可能是大肠腺瘤癌变的早期重要环节. 目前, β-catenin已成为众多癌症治疗研究的新靶点, 对其进行干预在结直肠癌的诊断和治疗中具有很大潜力. 目前国内外对PJS发生及恶变过程中β-catenin基因突变及其蛋白表达研究较少, 如果证实在PJS中也存在β-catenin基因及蛋白的变化, β-catenin也将有望成为PJS药物治疗的新靶点, 为PJS患者带来福音. 本课题通过研究家族性、散发性PJS与正常对照、大肠腺瘤组及结直肠癌组β-catenin基因突变及其蛋白表达差异, 结合临床病理特征, 探讨β-catenin在PJS息肉发生、发展及恶变中的作用, 为进一步临床诊治及预后判断提供实验依据, 建立更完善的随访计划.
PJS息肉组织12例, 来源于2006-2007南方医科大学附属南方医院消化内科及普外科就诊患者, PJS的诊断标准参照2003年全国遗传性大肠癌协作组制定的中国人遗传性大肠癌筛检标准的实施方案[4]: 消化道多发错构瘤性息肉伴皮肤, 黏膜色素沉着, 可有或无家族史. 结肠腺瘤14例, 来源于同期南方医院消化科内镜手术患者. 结肠腺癌14例及其相应癌旁正常组织12例, 来源于同期南方医院普外科手术及消化科内镜检查患者. RNase-Free生理盐水漂洗, 去除血渍和污物后, 放入sample protector液体中-800 ℃保存. 经患者及家属知情同意后, 抽取相应7例PJS患者静脉血3 mL(2% EDTA抗凝), 即时分离白细胞, 提取RNA. 另选取南方医科大学附属南方医院消化科及普外科2001-2007年切除的20例PJS息肉, 20例结肠腺瘤性息肉, 20例结肠腺癌, 20例正常肠道黏膜. 所有标本均经常规40 g/L甲醛溶液固定, 石蜡包埋.
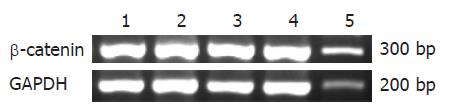
冻存组织解冻后, 提取RNA, 针对β-catenin基因第3外显子设计引物, 采用针对第3外显子设计的引物[5]: Sense: 5' -ACAAACTGTTTTGAAAATCCA-3', Antisense: 5'-CGAGTCATTGCATACTGTCC-3', 预计扩增长度298 bp; 内参引物(GAPDH)[6]: Sense 5'- CCATGGAGAAGGCTGGGG-3', Antisense 5' -CAAAGTTGTCATGGATGACC-3'预计扩增长度197 bp, 以上两对引物均由Invitrogen公司合成, 采用RT试剂盒(TaKaRa公司)通过PT-PCR(PCR反应条件: 94 ℃ 2 min, 1个循环; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 35个循环; 72 ℃ 8 min, 1个循环), PCR反应产物经1.5%琼脂糖凝胶电泳, 通过Image-Pro Plus软件分析凝胶图像目的及内参的IA比值, 委托Invitrogen公司完成DNA序列分析, 将测序得到的序列与GenBank数据库对照(http://www.ncbi.nlm.nih.gov/blast/). 检测PJS β-catenin基因突变. 免疫组织化学染色: 标本石蜡包埋, 4 μm连续切片, 采用DAB方法进行免疫组织化学染色, 第一抗体为β-catenin鼠抗人单克隆抗体(Zymed公司1:100)苏木素复染细胞核, 在光镜下观察结果. 用已知的乳腺癌阳性片作为阳性对照, 以PBS液代替一抗作为阴性对照.
统计学处理 采用SPSS13.0软件包进行统计学分析, RT-PCR凝胶分析IA比值进行单向方差分析(One-way ANOVA), 以F为统计量, 以双侧α = 0.05作为检验水准, 检验标准以P<0.05为有显著性差异. 计数资料蛋白膜表达, 核表达差异采用R×C χ2检验方法, 以χ2为统计量, 以双侧α = 0.05作为检验水准; 等级资料蛋白细胞质表达差异采用多组等级资料的秩和检验方法(Kruskal-Wallis H), 以χ2统计量, 以双侧α = 0.05作为检验水准. 检验标准以P<0.05为有显著性差异.
PJS息肉组织中β-catenin IA/GAPDH IA为1.044±0.331, 与结肠腺瘤(0.917±0.207), 结肠癌(1.109±0.283), 癌旁正常组织(1.000±0.386)相比, 经Oneway Anova分析, 差异无显著性(F = 0.972, P = 0.414, 图1).
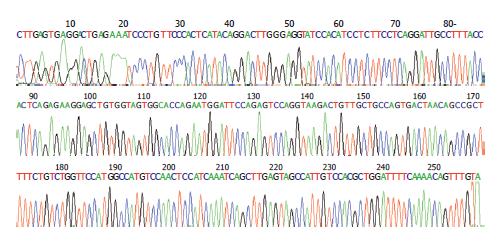
与RT-PCR产物经测序鉴定, 通过权威网站美国国家生物技术信息中心(NCBI)在线比对, 发现送检10例PJS组织样品RT-PCR扩增产物中, 7例(70%)出现编码区431位碱基缺失突变(缺失A), 8例(80%)非编码区184位插入突变(插入T), 2例(20%)非编码区189位插入突变(插入A); 3例PJS肠道正常黏膜中, 2(66.7%)例编码区431位碱基缺失突变(缺失A), 1(33.3%)例非编码区184位插入突变(插入T). 2例PJS家族正常成员中, 1(50%)例编码区421位碱基缺失突变(缺失A), 2例(100%)非编码区184位插入突变(插入T). 送检6例血液白细胞RT-PCR扩增产物中, 3例(50%)出现编码区431位碱基缺失突变(缺失A), 2例(33.3%)编码区421位碱基缺失突变(缺失A), 4例(66.7%)出现非编码区184位插入突变(插入T). 所有编码区突变均导致框移突变, 使得终止密码子提前出现, 非编码区突变可能使得蛋白合成调节异常(图2, 表1).
| PJS患者 | 突变位点 | 可能突变意义 |
| (1)LJM 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 肠道正常黏膜 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| (2)XWH 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| LJY 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| 血液白细胞 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 421缺失A | 框移突变, 终止密码子提前出现 | |
| 184插入T | 蛋白合成调节异常 | |
| (3)LY 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| 血液白细胞 | 184插入T | 蛋白合成调节异常 |
| (4)LYF 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 血液白细胞 | 无发现 | |
| (5)LTJ 息肉组织 | 184插入T | 蛋白合成调节异常 |
| 血液白细胞 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 421缺失A | 框移突变, 终止密码子提前出现 | |
| 184插入T | 蛋白合成调节异常 | |
| LCY(F) 息肉组织 | 184插入T | 蛋白合成调节异常 |
| LJH(F) 息肉组织 | 421缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| (6)WCF 息肉组织 | 184插入T | 蛋白合成调节异常 |
| 189插入A | 蛋白合成调节异常 | |
| (7)RZL 息肉组织 | 184插入T | 蛋白合成调节异常 |
| 189插入A | 蛋白合成调节异常 | |
| 血液白细胞 | 无发现 | |
| 肠道正常黏膜 | 无发现 | |
| RYS 肠道正常黏膜 | 431缺失A | 框移突变, 终止密码子提前出现 |
| (8)ZWY 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| ZWB 息肉组织 | 431缺失A | 框移突变, 终止密码子提前出现 |
| 184插入T | 蛋白合成调节异常 | |
| (9)SL 血液白细胞 | 184插入T | 蛋白合成调节异常 |
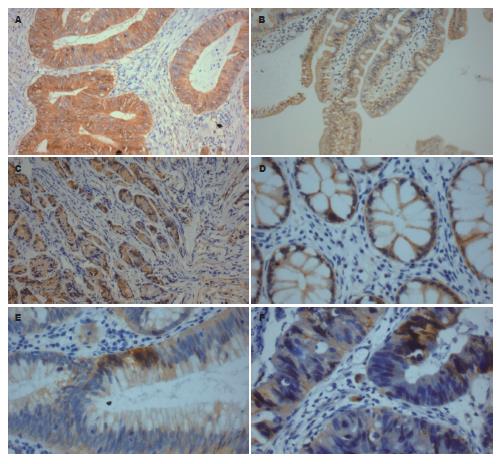
在正常黏膜中, β-catenin阳性染色主要位于细胞膜, 部分细胞质呈弱阳性染色, 在PJS、腺瘤及腺癌中, 其阳性染色主要位于细胞质及部分细胞核. 正常组织、PJS息肉、腺瘤、腺癌中, 膜表达缺失率分别5.0%、30.0%、45.0%和75.0%, 经R×C χ2检验, 差异具有显著性(α = 21.646, P = 0.000<0.05). 正常组织、PJS息肉、腺瘤、腺癌中, 胞质阳性表达率和表达强度呈增加趋势, 经多组等级资料的秩和检验方法(Kruskal-Wallis H), 差异具有显著性(α = 30.584, P = 0.000<0.05). 正常组织、PJS息肉、腺瘤、腺癌中, 胞核阳性表达率分别为5.0%、60.0%、30.0%、80.0%, 经R×C χ2检验, 差异具有显著性(α = 26.565, P = 0.000<0.05). 正常组织、PJS息肉、腺瘤、腺癌中, 总的异位表达率分别为5.0%、60.0%、50.0%、90.0%, 经R×C χ2检验, 差异具有显著性(α = 29.769, P = 0.000<0.05, 图3).
在遗传性结直肠癌综合征中, PJS属于中等度癌变风险综合征. 多器官系统易患癌是本综合征的一个重要特点. PJS综合征患者胃肠道和非胃肠道癌的发生率是一般人群的10-18倍, 总的肿瘤发生率在20%左右, 其家族恶性肿瘤发病率也较普通人群高15倍[7]. β-catenin作为Wnt信号传导过程中的重要成分及参与细胞间黏附作用的重要物质, 与肿瘤的发生、发展关系密切. 在对多种肿瘤的研究中已经发现癌细胞细胞质内有β-catenin表达的增加, 原因尚不十分清楚. 本研究发现, 在PJS组织中, β-catenin基因mRNA转录水平, 与腺瘤组织、腺癌组织及癌旁正常组织相比, 并无显著差异. 提示在PJS组织中, β-catenin的高表达可能与其降解减缓有关, 而非生成增加. Benjamin AA、Hermann A、臧桐等在对肾癌等肿瘤细胞的研究也发现在β-catenin的表达量增加的同时, mRNA水平并无变化[8-10]. 影响降解的因素很多, 目前研究发现主要有Wnt信号增强, APC的突变以及β-catenin本身的突变等. 编码β-catenin的基因称CTNNB1, 定位于染色体3p21, 全长23.2 kb, 共有16个外显子. 而第3号外显子是目前研究的突变热点, 其中密码子Ser33、Ser37、Ser45、Thr41等所编码蛋白质区是GSK3β磷酸化位点. 在一些肿瘤组织中常可检测到这些位点的缺失或突变. Morin等[11]对4株结肠癌细胞株CTNNB1的序列分析发现, TCT116和SW48结肠癌细胞株均存在CTNNB1突变, TCT116细胞株中存在Ser45密码子的缺失, 而SW48细胞株则存在33密码子的点突变, Ser33→Tyr, 对5例结肠癌标本检测发现, 有3例检测到CTNNB1突变存在, 所有突变均集中在外显子3所编码的GSK3β结合磷酸化位点上. 目前, 国内外对于PJS β-catenin基因突变尚无系统性研究. 本实验中, 针对β-catenin基因突变热点的第3外显子, 设计引物, 通过RT-PCR、产物序列分析发现, 在PJS患者息肉组织, 密码子Ser33、Ser37、Ser45、Thr41等其他肿瘤的突变热点并未检测到基因突变. 但在编码区的431, 421位碱基检测到缺失突变(缺失A), 其突变可使得终止密码子提前出现; 在非编码区184, 189碱基也检测到插入突变(插入T), 这可能会影响到蛋白合成的调节, 使得蛋白合成和表达异常. 在对应的PJS患者正常肠道黏膜和全血白细胞中以及PJS家族正常成员组织中也检测到相应部分碱基突变, 提示, PJS的β-catenin突变不仅有体系突变, 也存在胚系突变. 431、421、184、189这4个碱基位点可能是PJS有别于其他肿瘤的新的突变位点.
在正常上皮细胞中, β-catenin的水平极低, 主要分布于细胞与细胞接触间的细胞膜上, β-catenin降解复合体异常(如APC或Axin突变等)和β-catenin基因本身突变均可致β-catenin降解障碍, 异位聚集于细胞质和细胞核上[12-17]. 研究发现, 许多肿瘤, 如乳腺癌、原发性肝癌、结直肠癌都涉及β-catenin的基因突变、表达异常、转位等. 并有研究发现β-catenin蛋白的异常表达可能是大肠腺瘤癌变的早期重要环节. 在遗传性结直肠癌综合征中, PJS属于中度癌变风险的综合征. 目前国内外对PJS形成及恶变中β-catenin蛋白的表达变化尚不清楚. 本研究通过比较PJS、腺瘤性息肉、腺癌、正常组织中β-catenin蛋白表达部位及阳性率. 发现正常黏膜及癌旁正常黏膜中β-catenin阳性染色主要位于细胞膜, 可有部分胞质淡染, 但在PJS中, 其阳性染色主要位于细胞质, 并有部分细胞核阳性的出现, 而细胞膜的阳性却明显下降. 且在正常黏膜、PJS息肉、腺瘤、腺癌中, 其蛋白异常表达呈现一定的倾向性, 提示PJS是一种具某种程度恶性倾向的病变. β-catenin蛋白表达异常可能是PJS息肉形成及恶变的机制之一. 目前β-catenin的表达与细胞内定位已经用于消化系肿瘤的诊断与预后评估, 结直肠息肉中如果β-catenin在胞核内染色较强, 那么他恶性进展为腺癌的危险性更大[18,19]. 推而广之, 检测β-catenin在PJS组织细胞中的定位, 也可为患者的诊断及预后估计提供参考, 如果胞核内染色较强, 那么进展为恶性的可能性就大, 应加强随访.
Peutz-Jeghers综合征是一种具有中等度癌变风险的少见遗传性结直肠癌综合征. 最新研究表明, β-catenin基因的改变在大肠腺瘤发生, 特别是腺瘤癌变过程中发挥着重要的作用, β-catenin蛋白的异常表达可能是大肠腺瘤癌变的早期重要环节. 目前国内外对于PJS发生、恶变过程中β-catenin基因突变及蛋白表达的研究较少.
颜宏利, 教授, 中国人民解放军第二军医大学遗传学教研室
对PJS息肉的发生、恶变的遗传及基因变化研究已成为目前研究的热点.
张卫、孟荣贵等应用免疫组织化学的方法, 检测PJS错构瘤、结直肠癌患者及正常大肠黏膜组织中β-catenin、P53、PCNA的表达, 认为错构瘤中多因素作用使细胞增殖活性显著提高, P53及β-catenin在错构瘤-腺瘤-腺瘤形成过程的早期发挥了作用, 但可能与在结肠直肠癌中作用机制不同.
本文通过研究PJS患者组织中β-catenin基因突变及其蛋白表达, 结合临床病理特征, 探讨β-catenin在PJS息肉发生及恶变中的作用, 为进一步临床诊治及预后判断提供实验依据.
本文选题较好, 具有一定的可读性和临床参考价值.
编辑: 李薇 电编:何基才
| 1. | Hemminki A, Tomlinson I, Markie D, Järvinen H, Sistonen P, Björkqvist AM, Knuutila S, Salovaara R, Bodmer W, Shibata D. Localization of a susceptibility locus for Peutz-Jeghers syndrome to 19p using comparative genomic hybridization and targeted linkage analysis. Nat Genet. 1997;15:87-90. [PubMed] [DOI] |
| 3. | Olschwang S, Markie D, Seal S, Neale K, Phillips R, Cottrell S, Ellis I, Hodgson S, Zauber P, Spigelman A. Peutz-Jeghers disease: most, but not all, families are compatible with linkage to 19p13.3. J Med Genet. 1998;35:42-44. [PubMed] [DOI] |
| 5. | Ebert MP, Fei G, Kahmann S, Müller O, Yu J, Sung JJ, Malfertheiner P. Increased beta-catenin mRNA levels and mutational alterations of the APC and beta-catenin gene are present in intestinal-type gastric cancer. Carcinogenesis. 2002;23:87-91. [PubMed] [DOI] |
| 6. | Tokunaga K, Nakamura Y, Sakata K, Fujimori K, Ohkubo M, Sawada K, Sakiyama S. Enhanced expression of a glyceraldehyde-3-phosphate dehydrogenase gene in human lung cancers. Cancer Res. 1987;47:5616-5619. [PubMed] |
| 7. | Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, Cruz-Correa M, Offerhaus JA. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology. 2000;119:1447-1453. [PubMed] [DOI] |
| 8. | Alman BA, Li C, Pajerski ME, Diaz-Cano S, Wolfe HJ. Increased beta-catenin protein and somatic APC mutations in sporadic aggressive fibromatoses (desmoid tumors). Am J Pathol. 1997;151:329-334. [PubMed] |
| 9. | Aberle H, Bauer A, Stappert J, Kispert A, Kemler R. beta-catenin is a target for the ubiquitin-proteasome pathway. EMBO J. 1997;16:3797-3804. [PubMed] [DOI] |
| 11. | Morin PJ, Sparks AB, Korinek V, Barker N, Clevers H, Vogelstein B, Kinzler KW. Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC. Science. 1997;275:1787-1790. [PubMed] [DOI] |
| 12. | Taketo MM. Shutting down Wnt signal-activated cancer. Nat Genet. 2004;36:320-322. [PubMed] [DOI] |
| 13. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] [DOI] |
| 14. | Shtutman M, Zhurinsky J, Simcha I, Albanese C, D'Amico M, Pestell R, Ben-Ze'ev A. The cyclin D1 gene is a target of the beta-catenin/LEF-1 pathway. Proc Natl Acad Sci U S A. 1999;96:5522-5527. [PubMed] [DOI] |
| 15. | Shimokawa T, Furukawa Y, Sakai M, Li M, Miwa N, Lin YM, Nakamura Y. Involvement of the FGF18 gene in colorectal carcinogenesis, as a novel downstream target of the beta-catenin/T-cell factor complex. Cancer Res. 2003;63:6116-6120. [PubMed] |
| 16. | Tan X, Apte U, Micsenyi A, Kotsagrelos E, Luo JH, Ranganathan S, Monga DK, Bell A, Michalopoulos GK, Monga SP. Epidermal growth factor receptor: a novel target of the Wnt/beta-catenin pathway in liver. Gastroenterology. 2005;129:285-302. [PubMed] [DOI] |
| 17. | Li YJ, Wei ZM, Meng YX, Ji XR. Beta-catenin up-regulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis. World J Gastroenterol. 2005;11:2117-2123. [PubMed] |
| 18. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 19. | Wong SC, Lo ES, Chan AK, Lee KC, Hsiao WL. Nuclear beta catenin as a potential prognostic and diagnostic marker in patients with colorectal cancer from Hong Kong. Mol Pathol. 2003;56:347-352. [PubMed] [DOI] |