修回日期: 2011-05-17
接受日期: 2011-05-24
在线出版日期: 2011-06-08
目的: 建立小鼠肝癌细胞肺高转移株, 为研究转移相关分子机制提供合适的模型.
方法: 将H22肝癌腹水瘤细胞(简称M0)经尾静脉注入昆明小鼠, 获取肺转移结节, 再制备腹水瘤、尾静脉注射、形成肺转移瘤. 重复操作获得第4代肺高转移株(简称M4), 检测其小鼠肺转移能力和体外增殖能力、细胞分裂指数、染色体形态及细胞周期比例, 并用RT-PCR方法测定RhoC基因mRNA的表达来进一步加以验证.
结果: 经尾静脉注射, M4较早出现肺转移, 肺转移结节数多、体积大. M4与M0体外结果比较: 倍增时间缩短了38.73%; 细胞分裂指数是4.11%±0.11%, 明显多于M0的4.70%±0.19%(P = 0.014); S期比例是56.10±4.76%, 明显高于M0的46.98±4.49%(P = 0.022); 二者染色体数目相同, 但M4异型性明显; RhoC基因表达分别是1.011±0.163和0.486±0.045, M4的表达显著增高(P = 0.0029).
结论: 建立了小鼠肝癌细胞肺高转移细胞株, 其RhoC基因表达明显上调.
引文著录: 王士勇, 张璐, 张晖, 杜微丽, 张哲, 王佳玲, 武秀艳, 何英, 曾雪, 刘畅, 焦雪. 小鼠肝癌细胞肺高转移株的建立及鉴定. 世界华人消化杂志 2011; 19(16): 1674-1679
Revised: May 17, 2011
Accepted: May 24, 2011
Published online: June 8, 2011
AIM: To establish a mouse H22 hepatocellular carcinoma cell line with high metastatic potential to the lung to provide a suitable model for the study of metastasis-related molecular mechanisms.
METHODS: H22 hepatocellular ascitic tumor cells (M0) were inoculated into mice via the vena caudalis, and pulmonary metastatic lesions were harvested to refabricate ascitic tumor cells. The obtained cells were inoculated into mice again via the vena caudalis to form pulmonary metastatic nodes. The same procedure was repeated four times to obtain a cell line with high metastatic potential to the lung (M4). The metastatic ability in vivo, proliferation capability in vitro, cell division index, and cell cycle distribution of M4 cells were measured. The mRNA expression of the RhoC gene in M4 cells was detected by RT-PCR.
RESULTS: After injection via the vena caudalis, M4 cells produced pulmonary metastasis earlier and formed more and larger nodes. Compared to M0 cells, the doubling time of M4 cells was shortened by 38.73%; cell division index significantly increased (P = 0.014); and the proportion of cells in S phase was significantly higher (P = 0.022). The number of chromatosomes was comparable between M0 and M4 cells, while heteromorphism was more obvious in M4 cells. The mRNA expression of the RhoC gene was significantly higher in M4 cells than in M0 cells (1.011 ± 0.163 vs 0.486 ± 0.045, P = 0.0029).
CONCLUSION: A mouse hepatocellular carcinoma cell line with high metastatic potential to the lung has been established successfully.
- Citation: Wang SY, Zhang L, Zhang H, Du WL, Zhang Z, Wang JL, Wu XY, He Y, Zeng X, Liu C, Jiao X. Establishment and preliminary identification of a mouse hepatocellular carcinoma cell line with high metastatic potential to the lung. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1674-1679
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1674.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1674
侵袭、转移是恶性肿瘤的主要生物学特征, 也是导致肿瘤患者死亡的主要原因. 肿瘤转移是步骤繁杂且连续的过程, 肿瘤细胞及微环境通过复杂多样的途径来介导肿瘤在原发部位的生长、侵袭及入血, 并在远处侵袭性生长[1]. 在此过程中, 多种基因及蛋白的异常表达可能引起多条信号传导通路激活或失活. 理解这些途径及相互作用, 有助于识别肿瘤治疗中重要的分子靶点, 控制肿瘤的进展.
目前, 关于恶性肿瘤转移的分子机制尚未完全了解, 多种人肿瘤细胞转移模型正在逐步地建立, 但这些模型的建立常常需要在裸鼠、SCID等免疫缺陷动物体内完成, 耗资大、耗时长、实验条件严苛. 因此, 建立一个经济实用的小鼠高转移肿瘤细胞株, 可为肿瘤转移机制的初期研究提供便利的基础模型, 具有重要的意义. 本研究反复通过小鼠尾静脉注射H22肝癌细胞, 获得肺高转移细胞株, 并对其体内成瘤、体外增殖能力及细胞周期等进行测定, 同时检测肿瘤转移相关基因RhoC在mRNA水平的表达, 证实其确有较高的转移能力, 为研究肿瘤转移相关分子机制提供了经济便利的模型.
SPF级昆明小鼠, ♀, 体质量18-22 g, 购于中国医科大学实验动物中心, 合格证号为0099476. H22肝癌细胞系, 由中国医科大学附属第四医院生物治疗室冻存[2]. 流式细胞仪(美国BD公司)、细胞培养箱(上海力新仪器设备公司)、低速离心机(科大创新股份有限公司)、台式低温超速离心机(Sigma公司)、PCR扩增仪(宝生物工程有限公司)、凝胶成像仪(美国Wealtec公司)、电泳仪(美国Wealtec公司)等. RPMI 1640培养基(美国英杰生命技术有限公司)、细胞周期试剂盒(凯基生物)、琼脂糖(宝生物工程有限公司)、总RNA提取试剂盒(天根生化技术有限公司)、反转录试剂盒(杭州博日科技有限公司)、DL1000 DNA Marker(宝生物工程有限公司)等.
1.2.1 小鼠H22肝癌高转移细胞株的建立: 将H22肝癌细胞(简称M0)经无菌PBS液稀释后接种于小鼠腹腔, 7-10 d后可见小鼠腹水形成. 取腹水瘤细胞, 调整细胞浓度为1×1010/L. 经尾静脉注入小鼠0.2 mL/只, 30 d后解剖小鼠肺脏, 取其肺转移瘤结节, 研磨、过滤制成单细胞后注入小鼠腹腔, 其腹水瘤细胞为M1. 重复上述操作至第4代(简称M4).
1.2.2 M0与M4肺转移情况: 将M0及M4腹水瘤细胞液稀释至1×1010/L, 经小鼠尾静脉注入, 每组12只小鼠, 0.2 mL/只. 每隔10 d解剖3只, 观察肺转移情况, 计数其肺表面转移结节的数量、测量其体积, 并计算总体积. 取小鼠肺转移结节, 行HE染色.
1.2.3 M0与M4代细胞增殖能力: 取增殖旺盛的M0及M4小鼠腹水瘤细胞, 用含100 mL/L小牛血清的RPMI 1640培养液调节至相同细胞浓度(1×108/L), 置24孔板中培养, 每孔2 mL. 从0-72 h, 每12 h计数3孔, 每孔计数7次, 计算平均值作为每个时间点的细胞浓度. 绘制细胞生长曲线, 根据公式TD = 0.693(T2-T1)/ln(N2/N1)计算细胞倍增时间.
1.2.4 M0与M4代细胞分裂指数: 取增殖旺盛的小鼠腹水中M0及M4瘤细胞, 用PBS稀释后滴片, 自然晾干, 醋酸甲醇固定液固定后行Giemsa染色, 封片. 每张涂片于400倍光学显微镜下观察1 000个左右细胞, 重复3次, 求平均值, 计算分裂期细胞的比例.
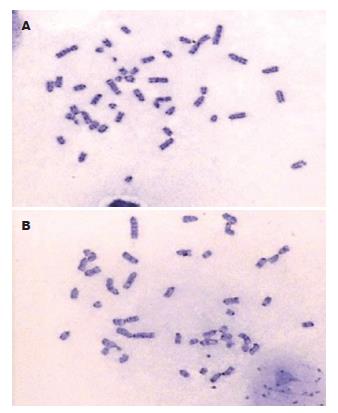
1.2.5 M0与M4染色体: 取生长旺盛的M0及M4腹水瘤细胞, 用含100 mL/L小牛血清的RPMI 1640培养基中培养56 h, 加入终浓度为0.2 mmol/L秋水仙素溶液. 继续培养4 h后终止培养, 收集细胞, 加入37 ℃预热的0.075 mmol/L氯化钾溶液, 于37 ℃恒温箱低渗处理30 min. 醋酸甲醇固定液固定, 于70-80 cm高处滴置-20 ℃预冷的载玻片, 78 ℃烤箱烘干, 在胰蛋白酶/Tris(0.025%胰蛋白酶液中加入5滴3% Tris溶液)中进行消化1 min, 行Giemsa染色. 镜下观察染色体形态并计数.
1.2.6 M0与M4代细胞周期的测定: 生长旺盛的M0及M4腹水瘤细胞, 洗涤后700 mL/L乙醇4 ℃固定30 min, 200目细胞过滤筛过滤, 0.1% Triton-100/PBS液洗涤, 用PBS调节细胞至1×109/L, 取2 mL样品, 加入100 μL RNaseA, 37 ℃水浴30 min, 加入400 μL碘化丙啶染色, 4 ℃避光30 min, 流式细胞仪上测定细胞周期. 取健康小鼠血, 经淋巴细胞分离液分离后, 取单核细胞测细胞周期作为对照组.
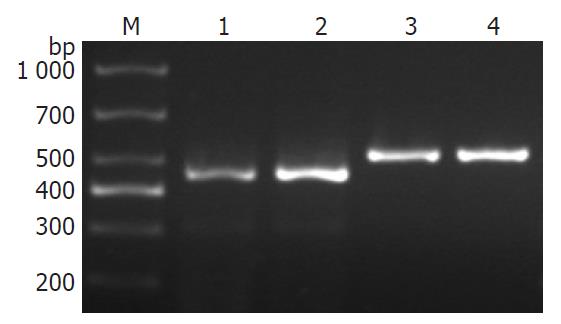
1.2.7 RhoC基因mRNA表达水平的测定: 分别收集1×107个M0及M4细胞, 提取总RNA, 取1 μg RNA行逆转录, 反应总体系为10 μL. 反应条件: 52 ℃ 45 min, 95 ℃ 5 min, 4 ℃ 5 min. 取5 μL逆转录产物cDNA用于PCR反应. 引物序列: RhoC基因上游序列为5'-TACGATCGCCTGCGGCCTCT-3', 下游序列为5'-AAGGATGGCGTGGGGGAGGG-3', 产物长度为461 bp; GAPDH基因上游序列为5'-AGGCCGGTGCTGAGTATGTC-3';下游序列为5'-TGCCTGCTTCACCACCTTCT-3', 产物长度为530 bp. 引物均由宝生物工程(大连)有限公司合成. PCR扩增反应终体积为25 μL, RhoC反应条件为98 ℃ 10 s, 58 ℃ 30 s, 72 ℃ 1 min, 共30个循环, GAPDH反应条件为98 ℃ 10 s, 58.7 ℃ 30 s, 72 ℃ 1 min, 共30个循环. PCR产物在含0.5 mg/L溴化乙锭的2%琼脂糖凝胶上电泳, 用凝胶成像仪对条带进行扫描. 实验重复3次, 应用Imagequant软件分析电泳条带灰度值, 对mRNA表达进行半定量.
统计学处理 应用Office Excel统计软件进行统计处理, 实验数据以mean±SD表示, 采用双侧t检验分析, P<0.05表明差异有统计学意义.
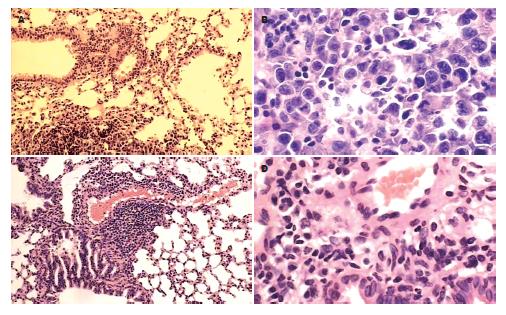
M0与M4代腹水瘤细胞经尾静脉注射, 出现肺转移的时间、数量和大小明显不同, 结果见表1. M0和M4分别于第30、第20天始出现肺转移, M4早于M0, M4转移结节数目多, 体积也明显大于M0. 图1是发生转移的小鼠肺, 图2是肺转移结节的HE染色结果, 可见细胞排列紊乱, 细胞核浓染, 核浆比增大, 证实确为转移的肿瘤细胞.
| 时间(d) | 结节数(个) | 总体积(mm3) | ||
| M0 | M4 | M0 | M4 | |
| 10 | 0 | 0 | 0.00 | 0.00 |
| 20 | 0 | 1 | 0.00 | 4.85 |
| 30 | 4 | 3 | 29.87 | 328.88 |
| 40 | 6 | 20 | 141.54 | 937.14 |
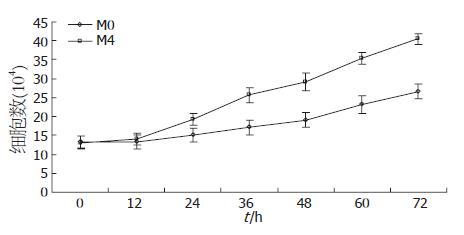
将M0和M4代细胞体外培养, 每隔12 h计数细胞数, 可见M4细胞体外生长速度明显快于M0, 24 h以后的每一时间点均存在统计学差异(t = 7.57-26.26, P<0.01). M0和M4的倍增时间分别为71.98 h和44.10 h. M4的倍增时间缩短了38.73%(表2, 图3).
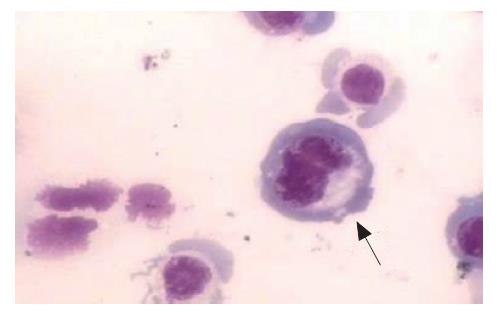
显微镜下寻找有丝分裂的特征, 如浓缩的核物质或核膜的细胞(图4). 分别计数M0及M4代细胞核分裂象数量, 分别为4.11%±0.11%和4.70%±0.19%, M4明显多于M0细胞(t = 4.797, P = 0.014).
M0的G0/G1期比例明显高于M4细胞株(t = 2.51, P = 0.024), 而S期明显低于M4(t = 2.50, P = 0.022), 二者G2/M期比例无统计学差异(t = 0.06, P = 0.196). M0、M4与对照组细胞间各期均具有统计学差异(P<0.05, 表3), 对照组细胞主要处于G0/G1期.
M0是0.486±0.045, M4是1.011±0.163, M4细胞明显高于M0细胞(t = 14.638, P = 0.0029, 图6).
肿瘤转移模型可以分为自发性转移模型和实验性转移模型两大类. 自发性转移模型模拟了肿瘤转移的整个过程, 耗时长, 不易成瘤. 实验性转移模型虽不能完全模拟肿瘤转移的整个过程, 但方便快捷, 容易成瘤. 目前人们常用的转移模型为人肿瘤细胞在裸鼠体内的转移研究, 实验要求苛刻, 耗费较多. 小鼠与人类同为哺乳动物, 二者基因高度同源. 在许多情况下, 可应用小鼠模型作为初步实验研究的基础, 这样省时、省力, 并减少实验成本. 本实验采用尾静脉注射, 在较短的时间筛出肺转移细胞株, 为进一步研究转移机制和治疗提供了便利的模型.
本实验初步建立鼠高转移细胞癌株M4, 分别检测其在小鼠体内转移能力及肿瘤细胞体外增殖能力, 可见其体内高转移及体外高增殖能力. M4细胞处于分裂期的细胞数目较多. 观察其染色体形态异型性明显. 细胞周期分布测定可见S期比例增多, 表示有更多的肿瘤细胞越过检测点而进入蛋白合成期, 为有丝分裂做准备. 通过测定细胞的相关生物学特性, 验证了新建立的M4细胞具有高转移细胞主要特点.
RhoC基因是1985年自海参中分离出来的,定位于染色体1p13-p21, 全长6 768 bp, 编码的蛋白具有GTP酶活性[3], 可调节细胞骨架、细胞周期、细胞极性及细胞迁移能力等. Rho GTP酶存在活化(与GTP结合)及失活(与GDP结合)状态[4]. 其在许多肿瘤中表达上调, 如乳腺癌和皮肤鳞状细胞癌[5-8]. 在胰管腺癌[9]、肝细胞癌[10,11]、卵巢癌[12]、膀胱癌[13]、胃癌[14,15]、食管鳞状细胞癌[16]、头颈部鳞状细胞癌[17]、前列腺癌[18]及非小细胞肺癌[19]中RhoC高表达与肿瘤进展及不良预后相关.
通过对RhoC缺失的转基因鼠模型研究发现, RhoC与肿瘤发生不相关, 仅在肿瘤转移过程中起重要作用. 下调RhoC的表达对胃癌细胞的增殖无影响, 但可明显抑制胃癌细胞的侵袭和转移[20]. 因为RhoC基因是目前常见的较为公认的肿瘤转移相关基因, 本实验测定高转移细胞RhoC基因的表达上调, 进一步证明了高转移细胞M4具有高转移潜能.
有关肿瘤转移机制的研究还存在许多未知的领域. 有研究发现肿瘤间质细胞在肿瘤转移中起到一定的作用, 显微切分的乳腺癌细胞与大块的肿瘤组织进行比较发现, 大块的肿瘤组织细胞中1/3 ER阴性与ER阳性的差异表达在显微切割的肿瘤细胞中并无差异[21]. 原发肿瘤的转移是多种因子相互作用的结果, 包括原发肿瘤亚群的初始转化及突变、机体的遗传因素、肿瘤细胞类型、宿主对肿瘤的天然免疫以及间质的组成等. 多数情况下, 上述任何单一因素都不能决定转移的发生. 仅仅分析原发肿瘤是不能预示临床预后的. 肿瘤微环境在肿瘤转移中同样具有重要作用, 一些"低危"肿瘤侵入对其有强促进作用的微环境中可发生转移, 相反"高危"肿瘤侵入对其有强抑制作用的微环境中较难发生转移[22].
目前对肿瘤转移的研究, 已经不能停留于细胞水平, 其机制复杂, 涉及基因学、蛋白组学、细胞因子、肿瘤微环境及人体免疫状态等诸多因素. 在错综复杂的肿瘤转移领域, 建立经济适用的肿瘤模型是研究肿瘤转移的物质基础.
侵袭、转移是恶性肿瘤的主要生物学特征, 也是导致肿瘤患者死亡的主要原因. 为了解其分子机制, 需要建立相应的转移模型, 目前建立的模型难度大、不易成功、不实用.
唐南洪, 教授, 福建医科大学附属协和医院省肝胆外科研究所
有研究发现肿瘤间质细胞在肿瘤转移中起到一定的作用, 显微切分的乳腺癌细胞与大块的肿瘤组织进行比较发现, 大块的肿瘤组织细胞中1/3 ER阴性与ER阳性的差异表达在显微切割的肿瘤细胞中并无差异.
将腹水瘤由尾静脉注入, 形成肺转移的肝癌细胞结节, 再将肺转移结节的瘤细胞形成腹水瘤, 重复上述步骤, 筛选出肺高转移细胞株, 操作相对简单、实验周期短、成功率高, 是一种经济、实用、便于初期研究肿瘤转移机制的模型.
本实验建立的高转移细胞株可应用于临床抗转移药物的筛选以及机制的研究.
本文建立的小鼠肝癌细胞肺高转移株属小鼠模型应用范畴, 可作为肝癌细胞转移机制和实验性治疗的初步应用, 有较好的便利性和一定的实用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges. Nat Med. 2006;12:895-904. [PubMed] [DOI] |
| 2. | 王 士勇, 杨 振君, 于 环, 杜 微丽, 刘 飒, 张 哲, 张 远, 邓 英杰. β-榄香烯脂质体体内外对消化系肿瘤的抑制作用. 世界华人消化杂志. 2008;16:1059-1063. [DOI] |
| 3. | Morris SW, Valentine MB, Kirstein MN, Huebner K. Reassignment of the human ARH9 RAS-related gene to chromosome 1p13-p21. Genomics. 1993;15:677-679. [PubMed] [DOI] |
| 4. | Jaffe AB, Hall A. Rho GTPases: biochemistry and biology. Annu Rev Cell Dev Biol. 2005;21:247-269. [PubMed] [DOI] |
| 5. | van Golen KL, Davies S, Wu ZF, Wang Y, Bucana CD, Root H, Chandrasekharappa S, Strawderman M, Ethier SP, Merajver SD. A novel putative low-affinity insulin-like growth factor-binding protein, LIBC (lost in inflammatory breast cancer), and RhoC GTPase correlate with the inflammatory breast cancer phenotype. Clin Cancer Res. 1999;5:2511-2519. [PubMed] |
| 6. | Marionnet C, Lalou C, Mollier K, Chazal M, Delestaing G, Compan D, Verola O, Vilmer C, Cuminet J, Dubertret L. Differential molecular profiling between skin carcinomas reveals four newly reported genes potentially implicated in squamous cell carcinoma development. Oncogene. 2003;22:3500-3505. [PubMed] [DOI] |
| 7. | Fritz G, Brachetti C, Bahlmann F, Schmidt M, Kaina B. Rho GTPases in human breast tumours: expression and mutation analyses and correlation with clinical parameters. Br J Cancer. 2002;87:635-644. [PubMed] [DOI] |
| 8. | Kleer CG, Griffith KA, Sabel MS, Gallagher G, van Golen KL, Wu ZF, Merajver SD. RhoC-GTPase is a novel tissue biomarker associated with biologically aggressive carcinomas of the breast. Breast Cancer Res Treat. 2005;93:101-110. [PubMed] [DOI] |
| 9. | Suwa H, Ohshio G, Imamura T, Watanabe G, Arii S, Imamura M, Narumiya S, Hiai H, Fukumoto M. Overexpression of the rhoC gene correlates with progression of ductal adenocarcinoma of the pancreas. Br J Cancer. 1998;77:147-152. [PubMed] [DOI] |
| 10. | Wang W, Yang LY, Huang GW, Lu WQ, Yang ZL, Yang JQ, Liu HL. Genomic analysis reveals RhoC as a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 2004;90:2349-2355. [PubMed] |
| 11. | Wang W, Yang LY, Yang ZL, Huang GW, Lu WQ. Expression and significance of RhoC gene in hepatocellular carcinoma. World J Gastroenterol. 2003;9:1950-1953. [PubMed] |
| 12. | Horiuchi A, Imai T, Wang C, Ohira S, Feng Y, Nikaido T, Konishi I. Up-regulation of small GTPases, RhoA and RhoC, is associated with tumor progression in ovarian carcinoma. Lab Invest. 2003;83:861-870. [PubMed] |
| 13. | Kamai T, Tsujii T, Arai K, Takagi K, Asami H, Ito Y, Oshima H. Significant association of Rho/ROCK pathway with invasion and metastasis of bladder cancer. Clin Cancer Res. 2003;9:2632-2641. [PubMed] |
| 14. | Liu N, Zhang G, Bi F, Pan Y, Xue Y, Shi Y, Yao L, Zhao L, Zheng Y, Fan D. RhoC is essential for the metastasis of gastric cancer. J Mol Med. 2007;85:1149-1156. [PubMed] [DOI] |
| 15. | Kondo T, Sentani K, Oue N, Yoshida K, Nakayama H, Yasui W. Expression of RHOC is associated with metastasis of gastric carcinomas. Pathobiology. 2004;71:19-25. [PubMed] [DOI] |
| 16. | Faried A, Faried LS, Usman N, Kato H, Kuwano H. Clinical and prognostic significance of RhoA and RhoC gene expression in esophageal squamous cell carcinoma. Ann Surg Oncol. 2007;14:3593-3601. [PubMed] [DOI] |
| 17. | Kleer CG, Teknos TN, Islam M, Marcus B, Lee JS, Pan Q, Merajver SD. RhoC GTPase expression as a potential marker of lymph node metastasis in squamous cell carcinomas of the head and neck. Clin Cancer Res. 2006;12:4485-4490. [PubMed] [DOI] |
| 18. | Iiizumi M, Bandyopadhyay S, Pai SK, Watabe M, Hirota S, Hosobe S, Tsukada T, Miura K, Saito K, Furuta E. RhoC promotes metastasis via activation of the Pyk2 pathway in prostate cancer. Cancer Res. 2008;68:7613-7620. [PubMed] [DOI] |
| 19. | Shikada Y, Yoshino I, Okamoto T, Fukuyama S, Kameyama T, Maehara Y. Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin Cancer Res. 2003;9:5282-5286. [PubMed] |
| 20. | Hakem A, Sanchez-Sweatman O, You-Ten A, Duncan G, Wakeham A, Khokha R, Mak TW. RhoC is dispensable for embryogenesis and tumor initiation but essential for metastasis. Genes Dev. 2005;19:1974-1979. [PubMed] [DOI] |
| 21. | Yang F, Foekens JA, Yu J, Sieuwerts AM, Timmermans M, Klijn JG, Atkins D, Wang Y, Jiang Y. Laser microdissection and microarray analysis of breast tumors reveal ER-alpha related genes and pathways. Oncogene. 2006;25:1413-1419. [PubMed] [DOI] |
| 22. | Albini A, Mirisola V, Pfeffer U. Metastasis signatures: genes regulating tumor-microenvironment interactions predict metastatic behavior. Cancer Metastasis Rev. 2008;27:75-83. [PubMed] [DOI] |