修回日期: 2011-03-16
接受日期: 2011-03-23
在线出版日期: 2011-06-08
目的: 研究转化生长因子β1(TGF-β1)对大鼠肝细胞系BRL-3A凋亡和细胞周期的影响.
方法: MTT法检测TGF-β1对细胞增殖的影响: 将BRL-3A细胞分为6组, 分别给予不同浓度的TGF-β1(0、2、4、6、8、10 μg/L), 检测各组细胞24、36、48 h时的增殖活性; 进一步将BRL-3A细胞分为TGF-β1处理组和对照组, 分别给予和不予TGF-β1(8 μg/L), 进行如下检测: 流式细胞仪检测两组细胞24、36、48 h时的凋亡情况和细胞周期分布; 实时定量RT-PCR检测两组细胞24、36、48 h时Cyclin E、Cdk-2、EGF、HGF、Bcl-2、c-Myc、MMP9、NF-κB基因的表达变化.
结果: MTT结果显示, 各浓度TGF-β1组在24、36、48 h时的细胞增殖活性差异无统计学意义; 流式细胞仪分析结果显示, TGF-β1处理组24、36、48 h时的细胞凋亡率和细胞周期分布与对照组间的差异均无统计学意义; 实时定量RT-PCR发现, TGF-β1处理组相对于对照组, Cyclin E mRNA、Cdk2 mRNA、EGF mRNA在24 h时分别下调至0.194±0.103、0.181±0.064、0.634±0.116倍, 36 h时分别下调至0.379±0.173、0.457±0.123、0.619±0.112倍, 48 h时分别上调至1.956±0.215、2.17±0.471、7.66±0.437倍; HGF mRNA在24、36、48 h时均明显下调, 分别至0.152±0.068、0.146±0.053、0.158±0.061倍; Bcl-2 mRNA在24、36 h时无统计学差异, 48 h时上调至1.567±0.115倍; c-Myc mRNA、MMP9 mRNA、NF-κB mRNA在3个时刻均上调, 24 h时分别至1.742±0.389、3.484±0.411、1.625±0.369倍, 36 h时分别至2.292±0.361、1.563±0.323、1.486±0.494倍, 48 h时分别至2.499±0.475、2.233±0.493、3.612±0.364倍. 以上基因表达差异均有统计学意义(P<0.05).
结论: 大鼠肝细胞系BRL-3A对TGF-β1促凋亡和细胞周期阻滞作用的敏感性低下, 可能与非Smads途径的激活, NF-κB、Bcl-2、c-Myc、MMP9表达的上调有关.
引文著录: 王世美, 郑素军, 邢欣悦, 邓志华, 刘梅, 俞豪, 李长勇, 段钟平. TGF-β1对大鼠肝细胞系BRL-3A凋亡和细胞周期的影响. 世界华人消化杂志 2011; 19(16): 1659-1665
Revised: March 16, 2011
Accepted: March 23, 2011
Published online: June 8, 2011
AIM: To explore whether exogenous transforming growth factor-beta 1 (TGF-β1) affects rat liver cell line BRL-3A in terms of cell cycle progression and apoptosis.
METHODS: (1) BRL-3A cells were divided into six groups and exposed to different concentrations of TGF-β1 (0, 2, 4, 6, 8, 10 μg/L), and cell proliferation was detected by MTT assay at 24, 36 and 48 h after treatment. (2) After BRL-3A cells were treated with TGF-β1 (8 μg/L) for 24, 36 or 48 h, flow cytometry was performed to measure cell cycle progression and apoptosis and real-time quantitative RT-PCR was used to quantify the mRNA expression of Cyclin E, Cdk-2, EGF, HGF, Bcl-2, c-Myc, MMP9, and NF-κB genes.
RESULTS: (1) There was no statistical difference in cell proliferation among cells treated with six different concentrations of TGF-β1 for 24, 36 or 48 h (all P > 0.05). (2) Cell cycle progression and apoptosis rate also showed no statistical difference between cells treated with 8 μg/L TGF-β1 and control cells at 24, 36 and 48 h (all P > 0.05). Compared to control cells, the mRNA expression of Cyclin E, Cdk-2, and EGF in cells treated with 8 μg/L TGF-β1 significantly decreased at 24 and 36 h but significantly increased at 48 h (all P < 0.05); that of HGF significantly declined at all three time points (all P < 0.05); that of Bcl-2 showed no significant changes at 24 and 36 h but increased at 48 h; and that of c-Myc, MMP9 and NF-κB was up-regulated at all three time points (all P < 0.05).
CONCLUSION: The insensitivity of BRL-3A cells to TGF-β1-induced apoptosis and cell cycle arrest may be related to activation of non-SMAD pathway and up-regulation of NF-κB, Bcl-2, c-Myc, and MMP9 expression.
- Citation: Wang SM, Zheng SJ, Xing XY, Deng ZH, Liu M, Yu H, Li CY, Duan ZP. YImpact of exogenous TGF-β1 on cell cycle progression and apoptosis in rat liver cell line BRL-3A. Shijie Huaren Xiaohua Zazhi 2011; 19(16): 1659-1665
- URL: https://www.wjgnet.com/1009-3079/full/v19/i16/1659.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i16.1659
转化生长因子β1(transforming growth factor-beta 1, TGF-β1)具有多种生物学功能, 可调控细胞增殖、分化和细胞外基质形成, 参与血管形成、免疫调节、组织修复、胚胎发育、肿瘤发生等生理病理过程[1,2]. TGF-β1是肝细胞增殖的强抑制剂[3], 但其具体作用机制目前尚未完全阐明[4]. 有研究显示, 抑制TGF-β1的作用可促进肝细胞再生[5,6], 这为肝切除术后、重型肝炎肝衰竭等疾病的治疗提供了新的思路. 本实验选择大鼠肝细胞系BRL-3A为研究对象, 探讨TGF-β1对BRL-3A细胞凋亡和细胞周期的影响, 并初步研究其可能的作用机制, 为以后设计基于TGF-β1通路、以促进肝再生为治疗目的的相应研究奠定基础.
DMEM培养基, 胎牛血清(fetal bovine serum, FBS)购自Hyclone公司; 大鼠肝细胞系BRL-3A购自中国科学院; TGF-β1购自美国Peprotech INC公司; MTT购自美国Sigma公司; Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基公司; 实时定量RT-PCR所需的TaKaRa RNA PCR Kit(AMV)Ver. 3.0和SYBR®Premix Ex TaqTM(Perfect Real Time)购自宝生物工程(大连)有限公司; PCR引物由上海生工生物工程技术服务有限公司合成.
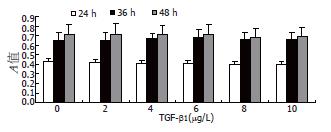
1.2.1 MTT法测定TGF-β1不同作用时间、不同作用浓度下对BRL-3A增殖的影响: 接种BRL-3A入96孔板, 4×103/孔. 24 h后, 更换1% FBS/DMEM培养, 并予TGF-β1梯度处理, 终浓度依次为0、2、4、6、8、10 μg/L, 每个浓度设立10个复孔. 孵育24 h后, 换含10% MTT溶液(5 g/L)的培养基, 继续培养4 h, 小心弃上清, 每孔加入150 μL二甲基亚砜(DMSO)溶解结晶, 测量吸光值A490. 按上述操作检测予TGF-β1后36、48 h的细胞增殖情况. 计算细胞生长抑制率(生长抑制率 = 1-TGF-β1组A值/对照组A值), 由抑制率确定后续实验适宜的TGF-β1作用浓度.
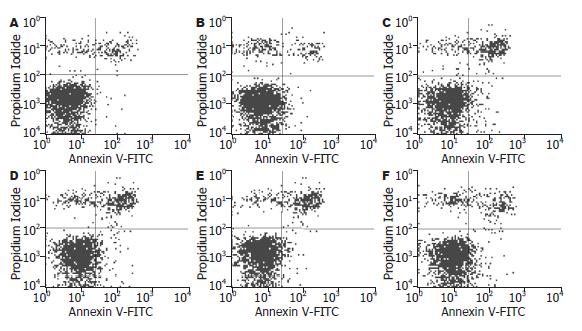
1.2.2 Annexin V-FITC双染法流式细胞仪分析细胞凋亡: 接种BRL-3A入6孔板, 1.5×105/孔, 分2组, 3孔/组, 24 h后分别更换含或不含TGF-β1(8 μg/L)的1% FBS/DMEM. 每隔12 h倒置显微镜下对比观察两组细胞生长状况. 于24 h时收集细胞, 按Annexin V-FITC试剂盒说明书操作, 上流式细胞仪分析细胞凋亡率. 同样, 按上述操作检测予TGF-β1后36、48 h的细胞凋亡率.
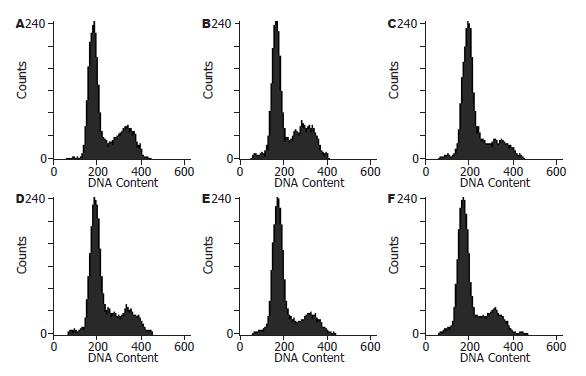
1.2.3 PI法流式细胞仪检测细胞周期: 细胞铺板及收集同1.2.2, 用1 mL PBS重悬细胞, 逐滴加入3 mL冷无水乙醇中, 边加边震荡, -20 ℃冰箱固定过夜待检. 上机前取出离心, 1 500 r/min×5 min, 弃上清, 用5 mL PBS重悬后室温放置15 min, 然后再次离心, 1 500 r/min×5 min, 弃上清, 依次加入100 μL PBS, 10 μL RNase(终浓度为100 mg/L), 400 μL PI, 混匀后避光反应30 min, 上机检测.
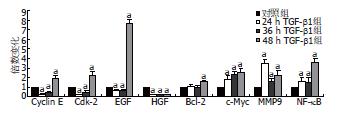
1.2.4 实时定量RT-PCR检测凋亡和细胞周期相关基因的表达变化: 细胞分组及处理方法同1.2.2, 用TRIzol法提取两组细胞总RNA. 用琼脂糖凝胶电泳及分光光度计检测RNA的纯度及浓度后按RT-PCR试剂盒说明书进行反转录. 将所得的cDNA进行实时定量PCR, 每组设立3个复孔, 反应体系为20 μL, 各组分为: SYBR Premix Ex Taq 10 μL, 上下游引物(序列见表1)各0.4 μL, ROX Reverse DyeⅡ 0.4 μL, cDNA 2.0 μL, ddH2O 6.8 μL. 按两步法扩增: 预变性: 95 ℃ 30 s; PCR反应: 95 ℃ 5 s, 60 ℃ 30 s, 循环40次, 反应结束后确认扩增曲线和溶解曲线, 以GAPDH为内参, 相对于对照组, TGF-β1处理组中靶基因的表达相对于内参的改变倍数(RQ)为分析值.
| 基因名称 | 扩增位置 | 上游引物 | 下游引物 |
| c-Myc | 1201-1417 | 5'-TGATGTGGTGTCTGTGGAAA-3' | 5'-TGCTGATCTGTTTCAGGACC-3' |
| Bcl-2 | 171-372 | 5'-TGAATGAGTCTGGGCTTTGA-3' | 5'-TTGCTCTCTCACAGCCAGTG-3' |
| Cyclin E | 201-431 | 5'-CAAGGGAGAGGAAGGAGAGA-3' | 5'-TAGGGGTGGGGATGAAAGAG-3' |
| Cdk-2 | 401-627 | 5'-ACCAGGACCTCAAGAAGTTT-3' | 5'-GTAAGTACGGACAGGGACTC-3' |
| EGF | 1802-2047 | 5'-TGTGCAGCTTCAGGACCGCA-3' | 5'-TGGCGTGTCTACTCCTTCCG-3' |
| HGF | 1401-1625 | 5'-TGGAGGATTTACACCGTCAT-3' | 5'-GCAGTTGTTTTGTTTTGGCA-3' |
| NF-κB | 601-825 | 5'-GCCATTCACATAGCTGTGAT-3' | 5'-TCCAGCCGCTATGTGTAGAG-3' |
| MMP9 | 1001-1234 | 5'-CCGACGTCACTGTAACTGGG-3' | 5'-GATCTAAGCCCAGCGCATGG3' |
| GAPDH | 411-650 | 5'-GCACCACCAACTGCTTAGC-3' | 5'-TCCACGATGCCAAAGTTGTCAT -3' |
统计学处理 以上所有实验均重复3次, 结果取平均值. 计量数据以mean±SD表示, 采用SPSS16.0统计软件进行统计处理, 统计方法同一时刻多组间的比较采用单因素方差分析, 两组间比较采用t检验. 以P<0.05表示差异有统计学意义.
MTT结果表明24、36、48 h时TGF-β1各浓度组之间无明显差异(F = 1.399、2.111、0.240, P = 0.262、0.078、0.943, 图1). 虽然从MTT结果尚不能认为TGF-β1对BRL-3A增殖有抑制作用, 但8 μg/L组在3个时刻与其他浓度组相比细胞活性略低, 故选择该浓度进行后续实验.
2.2.1 Annexin V-FITC双染法检测细胞凋亡结果: TGF-β1处理组与对照组细胞在24、36、48 h时均有部分细胞发生了凋亡(图2), 24 h时的凋亡率分别为9.00%±1.03%和7.18%±0.85%(t = -2.357, P = 0.08), 36 h时为11.43%±1.29%和8.94%±1.12%(t = -2.529, P = 0.066), 48 h时为13.8%±1.25%和10.55%±1.81%(t = -2.555, P = 0.063).
2.2.2 PI法检测细胞周期结果: 两组细胞在3个时刻各期细胞所占比例差异无统计学意义(P>0.05, 图3, 表2).
| 分组 | G0-G1期 | S期 | G2-M期 |
| 24 h | |||
| 对照组 | 53.30±7.02 | 26.53±6.21 | 20.17±1.19 |
| TGF-β1组 | 51.27±5.37 | 26.90±5.05 | 21.83±1.89 |
| 36 h | |||
| 对照组 | 65.53±1.17 | 20.60±2.36 | 13.87±3.40 |
| TGF-β1组 | 64.67±2.99 | 23.80±4.16 | 11.53±1.27 |
| 48 h | |||
| 对照组 | 66.80±3.82 | 21.47±2.49 | 11.73±1.50 |
| TGF-β1组 | 66.20±4.10 | 21.40±2.04 | 12.40±2.23 |
TGF-β1处理组较对照组相比, Cyclin E mRNA、Cdk-2 mRNA、EGF mRNA在24、36 h均下调, 48 h上调; HGF mRNA在3个时刻均明显下调; Bcl-2 mRNA在24、36 h时无明显变化, 48 h上调; c-Myc mRNA、MMP9 mRNA、NF-κB mRNA在3个时刻均上调, 以上基因表达改变均有统计学意义(P<0.05, 图4).
如何促进肝再生是现今研究的一大热点和难题. 众多研究表明阻断TGF-β1通路可有力地促进肝再生[5,7,8], 但由于TGF-β1的多功能性, 完全阻断则可能造成严重的不良反应[9]. 要实现有效阻断TGF-β1以促进肝再生, 并减小其可能附带的不良反应这一目标, 明确TGF-β1抑制肝再生的具体机制成为必要解决的问题.
TGF-β1在体内、外都能高效抑制肝细胞增殖[3], 可将细胞阻滞在G1期或诱导细胞凋亡[10-13]. Smads通路是TGF-β1发挥抗增殖和促凋亡作用的主要途径[12,14]. 除此之外, TGF-β1还存在非Smads途径, 包括MAPK通路的分支如Erk、TRAF6-TAK1-JNK/p38, 以及Rho-like GTPase, PI3K/Akt通路等. TGF-β受体可通过磷酸化或直接作用激活非Smads途径, 发挥增强或减弱Smads途径以及其他的调节作用[2]. 细胞对TGF-β的应答效应是Smads和非Smads途径共同作用的结果[2]. 目前大多数该方面的体外研究都是以原代培养的肝细胞为主, 由于细胞分离培养工作的繁琐和细胞生长时限的制约, 进行长久而深入地研究有很大的困难, 寻找对TGF-β1敏感或耐受的细胞株并将其作为深入研究的对象有重要意义. 本实验选择大鼠正常肝细胞系BRL-3A为研究对象, 从细胞凋亡和细胞周期两方面来探索其对TGF-β1的敏感性, 并初步探索其作用机制, 为以后深入的体外实验研究奠定基础.
该实验中发现BRL-3A不能耐受无血清培养, 根据研究TGF-β1体外作用文献提示的低血清含量范围(0.3%-2%)[15-17], 我们用0.2%、0.4%、0.8%、1.0%、1.2%、1.4%、1.6%、1.8%、2.0% FBS/DMEM进行了探索, 通过Annexin V-FITC双染法流式细胞仪分析发现1.0% FBS/DMEM培养BRL-3A 48 h细胞没有明显死亡, 故选择该血清含量进行后续实验. 本实验通过MTT法检测细胞增殖活性、流式细胞仪检测细胞凋亡和周期分布, 所得结果从统计学来说尚不能认为存在差异, 证明BRL-3A对TGF-β1敏感性低下. 为初步探索BRL-3A对TGF-β1敏感性低下的机制, 我们检测了一些与细胞增殖或凋亡相关的基因表达变化.
本研究发现TGF-β1处理组在没有表现出明显的增殖受抑或凋亡现象的同时, 伴随着NF-κB mRNA表达的上调. 转录因子NF-κB是肝再生中的一个抗凋亡剂[18-21], 可诱导IAPs、Caspase 8-FLICE等大量抗凋亡分子的基因表达[22]; 同时, NF-κB激活后还可诱导Smad7的表达[23], 后者可通过抑制R-Smads磷酸化而抑制其发挥作用. 一些研究显示, TGF-β1可通过非Smads途径, 例如通过ROS依赖方式激活ERK1/2-NF-κB和JNK-NF-κB通路[24], 或通过TAK1/IKK激酶途径短暂激活NF-κB[25], 使细胞逃逸TGF-β1诱导的凋亡. 由上可见, BRL-3A对TGF-β1作用敏感性低下考虑与TGF-β1可能通过非Smads途径, 导致NF-κB表达上调有关. 由于NF-κB可上调Bcl-2表达[26,27], 并参与c-Myc转录的调控[28], 本实验中Bcl-2 mRNA在48 h的上调和c-Myc mRNA在3个时刻的上调可能是NF-κB表达上调后的直接后果; 而Bcl-2、c-Myc表达上调, 进一步发挥了抗细胞凋亡作用.
MMP9介导的基质重建为肝细胞再生提供了周围环境调节作用[29,30]. Olle等[30]研究报道, 敲除MMP9的小鼠与野生小鼠相比, 肝大部切除术后肝再生延迟, 并且术后2-3 d VEGF、HGF、TNF-α表达明显少于野生小鼠. 本研究发现TGF-β1处理组MMP9 mRNA在3个时刻均上调, 由于NF-κB可通过直接作用于MMP9启动子5'端的顺式作用元件来上调MMP9的表达[24,31,32], 考虑TGF-β1通过非Smads途径上调NF-κB, 再通过NF-κB上调MMP9, MMP9在该实验中可能发挥了促细胞增殖、抗凋亡作用.
细胞增殖是通过细胞周期实现的, Cyclin E/Cdk-2复合体对细胞周期转录因子E2F的活化及G1期向S期的转换起着至关重要的作用, TGF-β1可诱导CDI如P15、P12、P27的表达[33]来降低CyclinE/Cdk-2复合体的活性, 在一些细胞中也可直接下调Cyclin E、Cdk2的表达[34], 发挥周期阻滞作用. 与此理论相应, 本实验发现, TGF-β1给药24、36 h后, 诱导了Cyclin E、Cdk-2 mRNA表达下调. 但由于c-Myc可上调Cyclin E/Cdk-2, c-Myc过表达可克服TGF-β1诱导的周期阻滞[35], 本实验中, 由NF-κB表达增高引起的c-Myc表达上调, 是Cyclin E、Cdk-2 mRNA在48 h上调的可能原因, 细胞并没有发生明显的细胞周期抑制.
HGF和EGF具有促进肝细胞DNA合成的作用. 给予TGF-β1后, HGF mRNA、EGF mRNA的表达下调并未引起BRL-3A增殖的明显改变, 表明BRL-3A细胞与原代培养肝细胞不同, 细胞内NF-κB、 Bcl-2、c-Myc、MMP9等因子上调后产生的促细胞增殖作用, 抵消了因HGF和EGF表达下降而产生的抗增殖作用, 最终抗增殖与促增殖力量得到新的平衡.
总之, 大鼠肝细胞系BRL-3A对TGF-β1促凋亡和细胞周期阻滞作用的敏感性低下, 这可能与非Smads途径的激活, NF-κB、Bcl-2、c-Myc、MMP9表达的上调有关; 而进一步深入研究该机制将为促进肝再生的研究扩展更多的方向, 有利于为肝大部分切除术后、重型肝炎肝衰竭等疾病寻找到更为特异、有效的治疗靶点.
如何促进肝再生是现今研究的一大热点和难题. TGF-β1在体内、外都能高效抑制肝细胞增殖, 可将细胞阻滞在G1期或诱导细胞凋亡, 众多研究表明阻断TGF-β1通路可有力地促进肝再生, 探索TGF-β1的具体作用机制可为以后设计基于TGF-β1通路、以促进肝再生为治疗目的的相应研究奠定基础.
徐可树, 教授, 华中科技大学同济医学院附属协和医院消化内科
TGF-β1具有多种生物学功能, 可调控细胞增殖、分化和细胞外基质形成, 参与血管形成、免疫调节、组织修复、胚胎发育、肿瘤发生等. 但由于TGF-β1作用的复杂性和多样性, 非选择性阻断TGF-β1通路可能带来严重的不良反应. 用不同的方法阻断该通路中的不同分子以观察其对各种功能的影响是近年的研究热点, TGF-β1的具体作用机制尚未完全明确, 他成为研究中的重点和难点.
Olle等研究报道, 敲除MMP9的小鼠与野生小鼠相比, 肝大部切除术(PH)后肝再生延迟, 并且术后2-3 d VEGF、HGF、TNF-α表达明显少于野生小鼠.
本文首次以大鼠正常肝细胞系BRL-3A作为TGF-β1体外作用的研究对象, 用MTT、流式细胞仪测凋亡和细胞周期的方法, 充分证明了BRL-3A对TGF-β1的不敏感性, 初步研究该特性的机制发现非Smads途径的激活, NF-κB、Bcl-2、c-Myc、MMP9表达的上调是其可能的原因. 用正常的肝细胞系和从不敏感机制的角度进行研究是创新点.
BRL-3A对TGF-β1不敏感机制的深入研究将为促进肝再生的研究扩展更多的方向, 有利于为肝大部分切除术后、重型肝炎肝衰竭等疾病寻找到更为特异、有效的治疗靶点.
本文内容丰富, 数据详实, 结果可信, 有一定的创新性及研究参考价值.
编辑: 李军亮 电编:李薇
| 1. | Feagins LA. Role of transforming growth factor-β in inflammatory bowel disease and colitis-associated colon cancer. Inflamm Bowel Dis. 2010;16:1963-1968. [PubMed] [DOI] |
| 3. | Turányi E, Dezso K, Bugyik E, Szurián K, Paku S, Nagy P. The primary mitogen (TCPOBOP)-induced hepatocyte proliferation is resistant to transforming growth factor- β-1 inhibition. Liver Int. 2010;30:1505-1510. [PubMed] |
| 5. | Zhong Z, Tsukada S, Rehman H, Parsons CJ, Theruvath TP, Rippe RA, Brenner DA, Lemasters JJ. Inhibition of transforming growth factor-beta/Smad signaling improves regeneration of small-for-size rat liver grafts. Liver Transpl. 2010;16:181-190. [PubMed] [DOI] |
| 6. | Ohara K, Kusano M. Anti-transforming growth factor-beta1 antibody improves survival rate following partial hepatectomy in cirrhotic rats. Hepatol Res. 2002;24:174. [PubMed] [DOI] |
| 7. | Mayoral R, Valverde AM, Llorente Izquierdo C, González-Rodríguez A, Boscá L, Martín-Sanz P. Impairment of transforming growth factor beta signaling in caveolin-1-deficient hepatocytes: role in liver regeneration. J Biol Chem. 2010;285:3633-3642. [PubMed] [DOI] |
| 8. | Romero-Gallo J, Sozmen EG, Chytil A, Russell WE, Whitehead R, Parks WT, Holdren MS, Her MF, Gautam S, Magnuson M. Inactivation of TGF-beta signaling in hepatocytes results in an increased proliferative response after partial hepatectomy. Oncogene. 2005;24:3028-3041. [PubMed] [DOI] |
| 9. | Yang YA, Zhang GM, Feigenbaum L, Zhang YE. Smad3 reduces susceptibility to hepatocarcinoma by sensitizing hepatocytes to apoptosis through downregulation of Bcl-2. Cancer Cell. 2006;9:445-457. [PubMed] [DOI] |
| 10. | Díez-Fernández C, Andrés D, Cascales M. Attenuating effects of heat shock against TGF-beta1-induced apoptosis in cultured rat hepatocytes. Free Radic Biol Med. 2002;33:835-846. [PubMed] [DOI] |
| 11. | Kim KS, Jung HS, Chung YJ, Jung TS, Jang HW, Lee MS, Kim KW, Chung JH. Overexpression of USF increases TGF-beta1 protein levels, but G1 phase arrest was not induced in FRTL-5 cells. J Korean Med Sci. 2008;23:870-876. [PubMed] [DOI] |
| 12. | Lee KY, Bae SC. TGF-beta-dependent cell growth arrest and apoptosis. J Biochem Mol Biol. 2002;35:47-53. [PubMed] [DOI] |
| 13. | Schuster N, Krieglstein K. Mechanisms of TGF-beta-mediated apoptosis. Cell Tissue Res. 2002;307:1-14. [PubMed] [DOI] |
| 14. | Heldin CH, Landström M, Moustakas A. Mechanism of TGF-beta signaling to growth arrest, apoptosis, and epithelial-mesenchymal transition. Curr Opin Cell Biol. 2009;21:166-176. [PubMed] [DOI] |
| 15. | Nam HJ, Park YY, Yoon G, Cho H, Lee JH. Co-treatment with hepatocyte growth factor and TGF-beta1 enhances migration of HaCaT cells through NADPH oxidase-dependent ROS generation. Exp Mol Med. 2010;42:270-279. [PubMed] [DOI] |
| 16. | Piscaglia F, Dudás J, Knittel T, Di Rocco P, Kobold D, Saile B, Zocco MA, Timpl R, Ramadori G. Expression of ECM proteins fibulin-1 and -2 in acute and chronic liver disease and in cultured rat liver cells. Cell Tissue Res. 2009;337:449-462. [PubMed] [DOI] |
| 17. | 陈 源文, 徐 雷鸣, 董 国芳, 吴 建新, 汪 余勤. 李定国. 粉防己碱对大鼠静止期肝星状细胞细胞周期的影响. 胃肠病学和肝病学杂志. 2009;18:800-803. |
| 18. | Cavin LG, Romieu-Mourez R, Panta GR, Sun J, Factor VM, Thorgeirsson SS, Sonenshein GE, Arsura M. Inhibition of CK2 activity by TGF-beta1 promotes IkappaB-alpha protein stabilization and apoptosis of immortalized hepatocytes. Hepatology. 2003;38:1540-1551. [PubMed] |
| 19. | Iimuro Y, Nishiura T, Hellerbrand C, Behrns KE, Schoonhoven R, Grisham JW, Brenner DA. NFkappaB prevents apoptosis and liver dysfunction during liver regeneration. J Clin Invest. 1998;101:802-811. [PubMed] [DOI] |
| 20. | Chaisson ML, Brooling JT, Ladiges W, Tsai S, Fausto N. Hepatocyte-specific inhibition of NF-kappaB leads to apoptosis after TNF treatment, but not after partial hepatectomy. J Clin Invest. 2002;110:193-202. [PubMed] |
| 21. | Iimuro Y, Fujimoto J. TLRs, NF-κB, JNK, and Liver Regeneration. Gastroenterol Res Pract. 2010;2010:pii: 598109. [PubMed] |
| 22. | Yang LQ, Fang DC, Wang RQ, Yang SM. Effect of NF-kappaB, survivin, Bcl-2 and Caspase3 on apoptosis of gastric cancer cells induced by tumor necrosis factor related apoptosis inducing ligand. World J Gastroenterol. 2004;10:22-25. [PubMed] |
| 23. | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling. Nature. 2003;425:577-584. [PubMed] [DOI] |
| 24. | Hsieh HL, Wang HH, Wu WB, Chu PJ, Yang CM. Transforming growth factor-β1 induces matrix metalloproteinase-9 and cell migration in astrocytes: roles of ROS-dependent ERK- and JNK-NF-κB pathways. J Neuroinflammation. 2010;7:88. [PubMed] [DOI] |
| 25. | Arsura M, Panta GR, Bilyeu JD, Cavin LG, Sovak MA, Oliver AA, Factor V, Heuchel R, Mercurio F, Thorgeirsson SS. Transient activation of NF-kappaB through a TAK1/IKK kinase pathway by TGF-beta1 inhibits AP-1/SMAD signaling and apoptosis: implications in liver tumor formation. Oncogene. 2003;22:412-425. [PubMed] [DOI] |
| 26. | Tamatani M, Mitsuda N, Matsuzaki H, Okado H, Miyake S, Vitek MP, Yamaguchi A, Tohyama M. A pathway of neuronal apoptosis induced by hypoxia/reoxygenation: roles of nuclear factor-kappaB and Bcl-2. J Neurochem. 2000;75:683-693. [PubMed] [DOI] |
| 27. | Luqman S, Pezzuto JM. NFkappaB: a promising target for natural products in cancer chemoprevention. Phytother Res. 2010;24:949-963. [PubMed] |
| 28. | Yang GF, Deng CS, Xiong YY, Luo J, Wang BC, Tian SF, Xu K. [Expression of NFkappaB p65 and its target genes in gastric cancer and precancerous lesions]. Zhonghua Zhongliu Zazhi. 2004;26:551-553. [PubMed] |
| 29. | Kim TH, Mars WM, Stolz DB, Michalopoulos GK. Expression and activation of pro-MMP-2 and pro-MMP-9 during rat liver regeneration. Hepatology. 2000;31:75-82. [PubMed] [DOI] |
| 30. | Olle EW, Ren X, McClintock SD, Warner RL, Deogracias MP, Johnson KJ, Colletti LM. Matrix metalloproteinase-9 is an important factor in hepatic regeneration after partial hepatectomy in mice. Hepatology. 2006;44:540-549. [PubMed] [DOI] |
| 31. | Shin M, Yan C, Boyd D. An inhibitor of c-jun aminoterminal kinase (SP600125) represses c-Jun activation, DNA-binding and PMA-inducible 92-kDa type IV collagenase expression. Biochim Biophys Acta. 2002;1589:311-316. [PubMed] [DOI] |
| 32. | Zhou L, Yan C, Gieling RG, Kida Y, Garner W, Li W, Han YP. Tumor necrosis factor-alpha induced expression of matrix metalloproteinase-9 through p21-activated kinase-1. BMC Immunol. 2009;10:15. [PubMed] [DOI] |
| 33. | Massagué J, Blain SW, Lo RS. TGFbeta signaling in growth control, cancer, and heritable disorders. Cell. 2000;103:295-309. [PubMed] [DOI] |
| 34. | Ye L, Zhang HY, Wang H, Yang GH, Bu H, Zhang L, Wang SL. Effects of transforming growth factor beta 1 on the growth of rhabdomyosarcoma cell line RD. Chin Med J (Engl). 2005;118:678-686. [PubMed] |
| 35. | Claassen GF, Hann SR. A role for transcriptional repression of p21CIP1 by c-Myc in overcoming transforming growth factor beta -induced cell-cycle arrest. Proc Natl Acad Sci U S A. 2000;97:9498-9503. [PubMed] [DOI] |