修回日期: 2011-05-12
接受日期: 2011-05-24
在线出版日期: 2011-05-28
随着人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染率快速增长, 乙型肝炎病毒(hepatitis B virus, HBV)/HIV重叠感染成为一种临床易见疾病. HBV/HIV重叠感染使HBV和HIV的生物学行为发生改变, 进而相互影响病情进展, 使得HBV/HIV重叠感染患者的抗病毒治疗更为复杂. 干扰素治疗HBV/HIV重叠感染患者HBeAg血清学转换发生率<10%,一般只用于可能发生血清学转换的患者. 阿德福韦酯(ADV)无抗HIV活性, 也不诱导HIV耐药, 可用于不需高效抗逆转录病毒疗法(HAART)的患者. 拉米夫定(LAM)、恩曲他滨(FTC)、替诺福韦(TDF)和恩替卡韦(ETV)对HBV和HIV都具有活性, 用于两者都需要治疗时组成HAART, 首选包括TDF+LAM或TDF+FTC的HAART方案, 如果LAM/FTC耐药, 可以加用或换用ETV或ADV挽救治疗. 替比夫定(LdT)虽无抗HIV活性, 但可以选择rtM204I耐药, 不单独用于HBV/HIV重叠感染患者抗HBV治疗.
引文著录: 柳龙根, 邵幼林. HBV/HIV重叠感染的抗病毒治疗. 世界华人消化杂志 2011; 19(15): 1609-1613
Revised: May 12, 2011
Accepted: May 24, 2011
Published online: May 28, 2011
The rapid spread of human immunodeficiency virus (HIV) in China has made hepatitis B virus (HBV)/HIV co-infection become a common clinical condition. HBV/HIV co-infection substantially alters the natural course of HBV or HIV mono-infection as well as their management. Therapy for HBV infection in HIV-co-infected patients is based on whether or not there is an indication for anti-HIV therapy. In patients with no indication for anti-HIV therapy, interferon-α(IFN-α) or adefovir dipivoxil (ADV) is recommended. In patients with an indication of anti-HIV therapy, a backbone of highly active anti-retroviral therapy should include tenofovir disoproxil fumarate (TDF) in combination with lamivudine (LAM) or emtricitabine (FTC). Switching to or adding ETV/ADV is recommended in patients who develop LAM/FTC resistance. LdT has no activity against HIV and is therefore not recommended for anti-HBV therapy in patients with HBV/HIV co-infection.
- Citation: Liu LG, Shao YL. Antiviral therapy in patients co-infected with hepatitis B virus and human immunodeficiency virus. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1609-1613
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1609.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1609
高效抗逆转录病毒疗法(highly active antiretroviral therapy, HAART)使人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染的预后得到了改善, 但是慢性乙型肝炎(chronic hepatitis B, CHB)却成为影响乙型肝炎病毒(hepatitis B virus, HBV)/HIV重叠感染患者预后的重要因素. 由于HIV和HBV所用的抗病毒药物和耐药特征等具有相似性, 使HBV/HIV重叠感染的治疗非常复杂, 成为临床治疗的难点和研究的热点.
全球约4千万人感染HIV, 3.6亿人感染HBV, 其中HIV感染者重叠HBV感染约为5%-20%[1]. 截止2009年底我国现存HIV感染者约74万人[2]. 我国现有的慢性HBV感染者约9300万人[3]. 且我国HBV感染以垂直传播为主, 我国HIV患者重叠感染HBV的比率较西方国家高. 马建新等[4]研究显示HIV感染者中, HBsAg阳性率为11.2%, HBsAg阴性感染者中, HBV DNA阳性率为30.5%. 据此估计我国有HBV/HIV重叠感染者约22万, 包括14万重叠隐性HBV感染者.
HBV/HIV重叠感染可通过反式激活作用和重组作用相互影响, HBV感染细胞所产生的"X"蛋白可触发HIV基因合成, 加速重叠感染AIDS患者的病程进展[5]. 在HIV感染时CD4细胞耗竭, 损害机体先天性和获得性免疫, 从而影响CHB自然史的各阶段. HBV/HIV重叠感染患者HBV呈高水平复制, HBsAg和HBeAg转阴率和血清转换率降低, 增加肝病相关死亡率[6]. 一项在5 293例男性同性恋患者中的研究发现, HBV/HIV重叠感染者肝病相关性年死亡率为14.2/1 000人, 明显高于单独HIV-1感染者(1.7/1000)或HBsAg阳性者(0.8/1000), 特别是引入HAART之后, HBV/HIV重叠感染患者肝病相关死亡风险更高[7]. Iser等[8]通过研究HIV重叠感染HBV感染肝细胞系发现HIV再感染显著增加细胞内HBsAg, 认为HIV感染通过改变HBV的生物特征而加速肝病进展. 随着HAART应用, 机会性感染和肿瘤的发病率显著下降, 降低了AIDS的发生率, 但是HAART可以通过直接的药物肝毒性、免疫重建炎性反应综合征[9]、HBV耐药导致肝脏炎症"再活化"等机制引起肝脏损害. 从而使HBV/HIV重叠感染患者更有可能发展至严重肝病阶段.
HBV/HIV重叠感染患者抗HBV治疗目的在于减少进展至肝硬化和肝细胞癌的风险, 为此, 应尽量把HBV DNA抑制到最低值并减少/延缓HBV耐药发生. HBV/HIV重叠感染患者抗HBV治疗难以获得持续应答(sustained response), 即使发生HBeAg血清转换后也可出现HBeAg阳转, 所以应终生治疗[10]. 目前用于HBV/HIV重叠感染患者抗HBV药物可根据抗HBV/HIV活性分为两类: (1)只有抗HBV活性的药物: 干扰素(interferon, IFN)和阿德福韦酯(adefovir dipivoxil, ADV); (2)同时兼有抗HBV和HIV活性的药物: 拉米夫定(lamivudine, LAM)、恩曲他滨(emtricitabine, FTC)、替诺福韦(tenofovir disoproxil fumarate, TDF)和恩替卡韦(entecavir, ETV).
3.1.1 IFN-α: 虽然有研究显示IFN具有抗HIV活性[11], 但因可致白细胞下降而不用于抗HIV治疗. IFN-α治疗HBV/HIV重叠感染患者HBeAg血清学转换发生率小于10%, 并且可引起CD4细胞减少[12]. Peg-IFN-α+ADV治疗LAM耐药HBV/HIV重叠感染患者48 wk显示, 只在治疗时ALT/AST维持正常, 停药后全部发生HBV病毒学突破、没有发生血清学转换[13]. Peg-IFN-α+TDF治疗HBV/HIV重叠感染, 与TDF单药治疗相比HBV DNA水平和血清学转换率无差别[14]. 因此, 标准IFN-α和peg-IFN-α一般只用于不需HAART且可能发生HBeAg血清学转换的HBV/HIV重叠感染患者(女性、<40岁、高ALT水平、低HBV DNA载量基因A型).
3.1.2 ADV: ADV治疗CHB推荐的剂量为10 mg/d, 此剂量对HIV无明显抑制作用, 也没发现HIV耐药[15]. HAART后出现LAM耐药, 加用ADV可显著降低HBV/HIV重叠感染患者HBV DNA水平, 治疗144 wk后45%患者获得病毒学应答[16]. HBV对ADV耐药主要发生rtA181V/T和rtN236T变异[17]. 因此ADV可用于不需HAART的HBV/HIV重叠感染患者, 且可用于挽救治疗HAART后LAM耐药患者.
3.2.1 LAM和FTC: LAM治疗CHB剂量为100 mg/d, 用于抑制HIV复制剂量为300 mg/d, HBV/HIV重叠感染患者使用300 mg/d. LAM单药治疗HBV单独感染和HBV/HIV重叠感染患者都能显著的抑制病毒复制. LAM单药治疗HBV/HIV重叠感染患者HBV DNA应答率为86%(24 mo)[18], 高于单独HBV感染患者的40%-44%[19], 可能因为采取杂交分析检测方法(108 copies/L)和治疗剂量(300 mg/d)有关. 然而不幸的是LAM单药治疗HBV/HIV重叠感染患者不但可以选择HIV和HBV耐药, 而且选择HBV的耐药的速度较HBV单独感染者更快, 2年和4年HBV耐药率分别达50%和90%[18]. HBV对LAM耐药主要常见的变异为rtM204V/I和rtL180M. FTC和LAM有相似的结构, FTC治疗HBV单独感染患者48 wk HBV DNA阴转率为54%, 耐药率为13%[20]. 当前指南认为二者可以互换, 由于高耐药率和诱导HBV和HIV耐药, 二者不单独用于HBV/HIV重叠感染患者的治疗.
3.2.2 TDF: TDF结构和ADV相似, 300 mg TDF抗HBV效能更高, 毒性更低. TDF治疗HBV/HIV重叠感染5年的研究显示, 92% HBeAg阳性和95% HBeAg阴性患者维持HBV应答, 仅3%患者因血清肌酐水平升高而停止使用TDF治疗, 提示TDF治疗HBV/HIV重叠感染长期安全有效[21]. 含有TDF的HAART方案有效抑制HBV/HIV重叠感染的患者体内野生HBV、前C区变异HBV和LAM耐药变异HBV复制[22]. TDF+FTC较FTC单药治疗HAART初治的HBV/HIV重叠感染患者HBV DNA阴转更高, 48 wk两组阴转率分别为90%和33%[23]. TDF+LAM和TDF单药治疗LAM耐药的HBV/HIV重叠感染患者病毒学应答情况相似, 治疗116 wk TDF+LAM组和TDF单药组HBV DNA阴转率19/25(76%)和42/50(84%)[24]. 然而最近一项关于122例LAM暴露的HBV/HIV重叠感染患者横向研究结果与此相反, 在HAART中包含TDF+LAM或TDF+FTC较TDF单药治疗HBV能获得更多HBV DNA阴转. 根据这项结果, LAM暴露的HBV/HIV重叠感染患者的HAART方案中应含有TDF+LAM或TDF+FTC[25]. TDF治疗HBV/HIV重叠感染患者耐药率较低, 一项长达34 mo的研究显示无论该患者之前是否接受LAM治疗, 仅5%患者发生病毒学突破[26]. HBV对TDF耐药主要为rtA194T变异, 体外实验显示该变异HBV毒株对TDF耐药, 该变异可单独存在也可和LAM耐药相关变异一起出现[27].
3.2.3 ETV: ETV初治CHB患者的剂量为0.5 mg/d, 对HBV有很强抑制作用,并有良好的安全性. 因为ETV具有抗HIV活性、选择rtM184V变异、并可导致LAM的敏感性下降, 因此ETV不推荐用于不需要HAART的HBV/HIV重叠感染患者[28]. 在LAM耐药HBV/HIV重叠感染患者, 使用1.0 mg/d ETV作为HAART的组成部分挽救治疗安全有效, 但更易出现ETV耐药[29].
3.2.4 替比夫定: 体外实验研究显示替比夫定(LdT)没有抑制HIV活性[30], 但因可选择与LAM交叉耐药的rtM204I变异, 因此不需要HAART时不建议用于抗HBV治疗[6], 由于LAM耐药后, LdT的敏感性也明显下降, LdT也不建议用于LAM耐药的挽救治疗.
多数指南推荐当HIV感染患者CD4 T细胞<350×106 cells/L时采取HAART, 但目前只有少数几个指南介绍了关于HBV/HIV重叠感染患者抗病毒治疗, 认为应采取个体化抗病毒治疗[19,31].
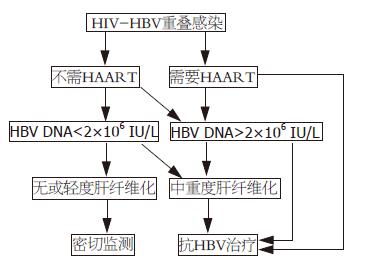
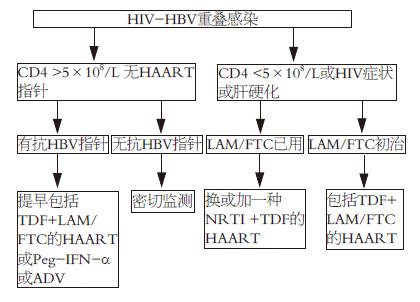
HBV/HIV重叠感染患者在HIV需要HAART之前, 当HBV需要治疗时, 可以选用对HIV无效的药物, 这样可避免诱导HIV耐药, 如标准IFN-α、peg-IFN-α或ADV. IFN-α和peg-IFN-α可用于CD4细胞>500×106 cells/L的HBeAg阳性患者, CD4细胞数更低和HBeAg阴性患者可考虑选用ADV. 尽管LdT无抗HIV活性, 但可选择rtM204I变异; ETV具有抗HIV活性, 且可选择rtM184V变异, 因此对HBV/HIV重叠感染患者不应单独使用LdT和ETV抗HBV治疗[30,32]. 对活动性肝炎及进展的肝病可依据2010年制订的慢性乙型肝炎防治指南治疗[33], 对于无明显炎症活动的患者, 可因后续的HAART直接的药物肝毒性、免疫炎症重建综合征引起肝损害, 因此抗HBV治疗显得尤为重要, 可参考Iser等提供的方案进行抗HBV治疗[34](图1). 当HBV和HIV进展至都需要治疗的时候, 不管HBV DNA水平和肝纤维化程度如何, 应慎重选用对HBV有效药物的HAART方案以减少病毒耐药. 首选包括了TDF+LAM或TDF+FTC的HAART方案. 如果在此HAART基础上仍出现LAM或FTC耐药可加用ETV或ADV治疗挽救治疗, 然而这些联合治疗还有待进一步研究. 欧洲艾滋病临床协会2009推荐的HBV/HIV重叠感染患者治疗方案可供参考[35](图2).
由于HIV和HBV的病毒学、使用抗病毒药物和耐药特征等具有相似性, 使HBV/HIV重叠感染的抗病毒治疗变得极为复杂和困难. 目前用于HBV/HIV重叠感染患者抗HBV药物可根据抗HBV/HIV活性分为两类: (1)只有抗HBV活性的药物: IFN和ADV; (2)同时兼有抗HBV和HIV活性的药物: LAM、FTC、TDF和ETV. HBV/HIV重叠感染患者, 进行抗病毒治疗时应考虑只有HBV需要治疗时, 可以选用对HIV无效的药物, 如标准IFN-α、peg-IFN-α或ADV. IFN-α和peg-IFN-α可用于CD4细胞>500×106 cells/L的HBeAg阳性患者, CD4细胞数更低和HBeAg阴性患者可考虑选用ADV, 对HBV/HIV重叠感染患者不应单独使用LdT和ETV抗HBV治疗. 对于无明显炎症活动的患者, 可参考Iser等提供的方案进行抗HBV治疗. 当HBV和HIV进展至都需要治疗的时候, 首选包括了TDF+LAM或TDF+FTC的HAART方案. 如果在此HAART基础上出现LAM或FTC耐药可加用ETV或ADV进行挽救治疗.
HBV和HIV感染都会导致严重的后果, 到将来很长一段时间难以有根治的方法, 抗病毒是二者目前唯一有效控制病情的治疗方法, HBV/HIV重叠感染使问题变得更加复杂, 对HBV/HIV重叠感染患者采用科学、合理和有效的抗病毒治疗极为必要.
靳雪源, 副主任医师, 中国人民解放军第302医院消化内科
HBV/HIV重叠感染使HBV和HIV的生物学行为发生改变, 二者如何相互影响病情进展、如何采取有效的治疗成为研究的热点和难点.
鉴于抗HBV和HIV药物的相似性, 本文从抗病毒药物是否对HBV和HIV均有效的角度分类阐述了不同药物特点和使用时机, 并通过流程图的形式清晰的反应了治疗时机和治疗方案的选择.
目前我国现有的慢性HBV感染者约9300万人, HIV感染者约74万人, HBV/HIV重叠感染者约22万人.对该部分重叠感染者进行抗病毒治疗较单独感染更加复杂, 各级医务人员应依据循证医学证据进行科学施治.
高效抗逆转录病毒治疗: 由于HIV具有高复制性和高变异性, 单药治疗很容易诱导病毒变异, 产生耐药, 导致临床治疗失败和后续治疗难度加大, 1996年温哥华第10届国际艾滋病大会上美籍华裔科学家何大一发表了所谓的"鸡尾酒"式的多种抗病毒药物联合治疗法, 即高效抗逆转录病毒治疗(highly active antiretroviral therapy, HAART), 又称HAART疗法.
本文对HBV/HIV重叠感染的抗病毒治疗进行了较充分的分析, 具有较好的科学性、创新性和可读性, 较好地反映我国或国际胃肠病学临床和基础研究的先进水平, 具有较重要的指导意义.
编辑: 李军亮 电编:李薇
| 1. | Zhou J, Dore GJ, Zhang F, Lim PL, Chen YM. Hepatitis B and C virus coinfection in The TREAT Asia HIV Observational Database. J Gastroenterol Hepatol. 2007;22:1510-1518. [PubMed] [DOI] |
| 2. | 中华人民共和国卫生部, 联合国艾滋病规划署, 世界卫生组织. 2009年中国艾滋病疫情估计工作报告 2010. . |
| 3. | Lu FM, Zhuang H. Management of hepatitis B in China. Chin Med J (Engl). 2009;122:3-4. [PubMed] |
| 4. | 马 建新, 卢 洪洲, 王 江蓉, 张 仁芳, 郑 毓芳, 刘 莉, 齐 唐凯, 沈 银忠. 人类免疫缺陷病毒感染者合并隐匿性乙型肝炎病毒感染的现状调查. 中华内科杂志. 2008;47:574-577. |
| 6. | Soriano V, Puoti M, Peters M, Benhamou Y, Sulkowski M, Zoulim F, Mauss S, Rockstroh J. Care of HIV patients with chronic hepatitis B: updated recommendations from the HIV-Hepatitis B Virus International Panel. AIDS. 2008;22:1399-1410. [PubMed] [DOI] |
| 7. | Thio CL, Seaberg EC, Skolasky R, Phair J, Visscher B, Muñoz A, Thomas DL. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet. 2002;360:1921-1926. [PubMed] [DOI] |
| 8. | Iser DM, Warner N, Revill PA, Solomon A, Wightman F, Saleh S, Crane M, Cameron PU, Bowden S, Nguyen T. Coinfection of hepatic cell lines with human immunodeficiency virus and hepatitis B virus leads to an increase in intracellular hepatitis B surface antigen. J Virol. 2010;84:5860-5867. [PubMed] [DOI] |
| 9. | Wursthorn K, Wedemeyer H, Manns MP. Republished paper: Managing HBV in patients with impaired immunity. Postgrad Med J. 2011;87:223-238. [PubMed] [DOI] |
| 10. | Hoffmann CJ, Thio CL. Clinical implications of HIV and hepatitis B co-infection in Asia and Africa. Lancet Infect Dis. 2007;7:402-409. [PubMed] [DOI] |
| 11. | Barr SD, Smiley JR, Bushman FD. The interferon response inhibits HIV particle production by induction of TRIM22. PLoS Pathog. 2008;4:e1000007. [PubMed] [DOI] |
| 12. | Di Martino V, Thevenot T, Colin JF, Boyer N, Martinot M, Degos F, Coulaud JP, Vilde JL, Vachon F, Degott C. Influence of HIV infection on the response to interferon therapy and the long-term outcome of chronic hepatitis B. Gastroenterology. 2002;123:1812-1822. [PubMed] [DOI] |
| 13. | Ingiliz P, Valantin MA, Thibault V, Duvivier C, Dominguez S, Katlama C, Poynard T, Benhamou Y. Efficacy and safety of adefovir dipivoxil plus pegylated interferon-alpha2a for the treatment of lamivudine-resistant hepatitis B virus infection in HIV-infected patients. Antivir Ther. 2008;13:895-900. [PubMed] |
| 14. | Johnson RM, Ristig MB, Overton ET, Lisker-Melman M, Cummings OW, Aberg JA. Safety and tolerability of sequential pegylated IFN-alpha2a and tenofovir for hepatitis B infection in HIV(+) individuals. HIV Clin Trials. 2007;8:173-181. [PubMed] [DOI] |
| 15. | Delaugerre C, Marcelin AG, Thibault V, Peytavin G, Bombled T, Bochet MV, Katlama C, Benhamou Y, Calvez V. Human immunodeficiency virus (HIV) Type 1 reverse transcriptase resistance mutations in hepatitis B virus (HBV)-HIV-coinfected patients treated for HBV chronic infection once daily with 10 milligrams of adefovir dipivoxil combined with lamivudine. Antimicrob Agents Chemother. 2002;46:1586-1588. [PubMed] [DOI] |
| 16. | Benhamou Y. Treatment algorithm for chronic hepatitis B in HIV-infected patients. J Hepatol. 2006;44:S90-S94. [PubMed] [DOI] |
| 18. | Benhamou Y, Bochet M, Thibault V, Di Martino V, Caumes E, Bricaire F, Opolon P, Katlama C, Poynard T. Long-term incidence of hepatitis B virus resistance to lamivudine in human immunodeficiency virus-infected patients. Hepatology. 1999;30:1302-1306. [PubMed] [DOI] |
| 19. | Lock ASF, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology. 2009;50:1-36. [PubMed] |
| 20. | Lim SG, Ng TM, Kung N, Krastev Z, Volfova M, Husa P, Lee SS, Chan S, Shiffman ML, Washington MK. A double-blind placebo-controlled study of emtricitabine in chronic hepatitis B. Arch Intern Med. 2006;166:49-56. [PubMed] [DOI] |
| 21. | de Vries-Sluijs TE, Reijnders JG, Hansen BE, Zaaijer HL, Prins JM, Pas SD, Schutten M, Hoepelman AI, Richter C, Mulder JW. Long-term therapy with tenofovir is effective for patients co-infected with human immunodeficiency virus and hepatitis B virus. Gastroenterology. 2010;139:1934-1941. [PubMed] [DOI] |
| 22. | Benhamou Y, Fleury H, Trimoulet P, Pellegrin I, Urbinelli R, Katlama C, Rozenbaum W, Le Teuff G, Trylesinski A, Piketty C. Anti-hepatitis B virus efficacy of tenofovir disoproxil fumarate in HIV-infected patients. Hepatology. 2006;43:548-555. [PubMed] [DOI] |
| 23. | Avihingsanon A, Lewin SR, Kerr S, Chang JJ, Piyawat K, Napissanant N, Matthews GV, Dore GJ, Bowden S, Lange J. Efficacy of tenofovir disoproxil fumarate/emtricitabine compared with emtricitabine alone in antiretroviral-naive HIV-HBV coinfection in Thailand. Antivir Ther. 2010;15:917-922. [PubMed] [DOI] |
| 24. | Schmutz G, Nelson M, Lutz T, Sheldon J, Bruno R, von Boemmel F, Hoffmann C, Rockstroh J, Stoehr A, Wolf E. Combination of tenofovir and lamivudine versus tenofovir after lamivudine failure for therapy of hepatitis B in HIV-coinfection. AIDS. 2006;20:1951-1954. [PubMed] [DOI] |
| 25. | Matthews GV, Seaberg E, Dore GJ, Bowden S, Lewin SR, Sasadeusz J, Marks P, Goodman Z, Philp FH, Tang Y. Combination HBV therapy is linked to greater HBV DNA suppression in a cohort of lamivudine-experienced HIV/HBV coinfected individuals. AIDS. 2009;23:1707-1715. [PubMed] [DOI] |
| 26. | Alvarez-Uria G, Ratcliffe L, Vilar J. Long-term outcome of tenofovir disoproxil fumarate use against hepatitis B in an HIV-coinfected cohort. HIV Med. 2009;10:269-273. [PubMed] [DOI] |
| 27. | Amini-Bavil-Olyaee S, Herbers U, Sheldon J, Luedde T, Trautwein C, Tacke F. The rtA194T polymerase mutation impacts viral replication and susceptibility to tenofovir in hepatitis B e antigen-positive and hepatitis B e antigen-negative hepatitis B virus strains. Hepatology. 2009;49:1158-1165. [PubMed] [DOI] |
| 28. | Sasadeusz J, Audsley J, Mijch A, Baden R, Caro J, Hunter H, Matthews G, McMahon MA, Olender SA, Siliciano RF. The anti-HIV activity of entecavir: a multicentre evaluation of lamivudine-experienced and lamivudine-naive patients. AIDS. 2008;22:947-955. [PubMed] [DOI] |
| 29. | Pessôa MG, Gazzard B, Huang AK, Brandão-Mello CE, Cassetti I, Mendes-Corrêa MC, Soriano V, Phiri P, Hall A, Brett-Smith H. Efficacy and safety of entecavir for chronic HBV in HIV/HBV coinfected patients receiving lamivudine as part of antiretroviral therapy. AIDS. 2008;22:1779-1787. [PubMed] [DOI] |
| 30. | Lin K, Karwowska S, Lam E, Limoli K, Evans TG, Avila C. Telbivudine exhibits no inhibitory activity against HIV-1 clinical isolates in vitro. Antimicrob Agents Chemother. 2010;54:2670-2673. [PubMed] [DOI] |
| 31. | Hammer SM, Eron JJ Jr, Reiss P, Schooley RT, Thompson MA, Walmsley S, Cahn P, Fischl MA, Gatell JM, Hirsch MS, Jacobsen DM, Montaner JS, Richman DD, Yeni PG, Volberding PA. Antiretroviral treatment of adult HIV infection: 2008 recommendations of the International AIDS Society-USA panel. JAMA. 2008;300:555-570. [PubMed] [DOI] |
| 32. | Sasadeusz J, Audsley J, Mijch A, Baden R, Caro J, Hunter H, Matthews G, McMahon MA, Olender SA, Siliciano RF. The anti-HIV activity of entecavir: a multicentre evaluation of lamivudine-experienced and lamivudine-naive patients. AIDS. 2008;22:947-955. [PubMed] [DOI] |
| 34. | Iser DM, Lewin SR. Treatment of hepatitis B virus (HBV) in the setting of HIV-HBV co-infection. Asian Biomed. 2009;3:15-27. |
| 35. | EACS guidelines 2009. Available from: http://www.europeanaidsclinicalsociety.org/guidelines.asp. |