修回日期: 2011-05-16
接受日期: 2011-05-24
在线出版日期: 2011-05-28
乙型肝炎病毒(hepatitis B virus, HBV)感染者接受化疗时HBV再激活已成为肿瘤化疗的常见并发症, 其特征是HBV DNA水平升高, 肝功能异常甚至肝功能衰竭. HBV再激活能导致化疗中断及严重的不良临床后果, 核苷(酸)类似物在预防和减少HBV再激活方面发挥了重要作用. 本文系统阐述了HBV再激活的定义、发生机制和危险因素, 提出了HBV再激活时抗病毒治疗的策略和操作流程, 分析了HBV再激活抗病毒治疗中存在的问题, 进一步强调对所有患者化疗前应进行HBV血清标志物筛查, 加强病毒水平监测, 合并HBV感染的个体化疗前或化疗中应预防性使用核苷(酸)类似物抗病毒治疗, 选择有效低耐药的抗病毒药物个体化治疗.
引文著录: 黄利华, 姚悦萍. HBV感染者化疗时的抗病毒治疗. 世界华人消化杂志 2011; 19(15): 1604-1608
Revised: May 16, 2011
Accepted: May 24, 2011
Published online: May 28, 2011
Reactivation of hepatitis B virus (HBV) is a frequent complication of chemotherapy in patients with HBV infection. Reactivation is characterized by increased levels of serum HBV DNA, abnormal liver function and hepatic failure. HBV reactivation inevitably leads to disruption of chemotherapy and severe clinical results in some cases. Nucleoside analogues play an important role in preventing and reducing the risk for HBV reactivation and HBV-associated morbidity and mortality. This paper gives a systematic review of the definition, mechanism and causes of HBV reactivation and summarizes the principles and problems for antiviral treatment in patients with HBV reactivation. It is strongly recommended that all patients should be screened for HBV serum markers before chemotherapy and preventive therapy with nucleoside analogues be given in patients with HBV. The use of potent antiviral drugs with low resistance potential and close viral monitoring during therapy are important for patients with HBV infection undergoing chemotherapy.
- Citation: Huang LH, Yao YP. Antiviral treatment in patients with hepatitis B virus infection receiving chemotherapy. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1604-1608
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1604.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1604
据世界卫生组织报道, 全球超过1/3的人口感染过乙型肝炎病毒 (hepatitis B virus, HBV), 其中3.5亿为慢性感染者. 随着肿瘤发病率的提高及有效细胞毒性化疗药物的广泛应用, 肿瘤合并HBV感染的患者接受化疗时HBV再激活已成为常见的临床问题而引起人们的重视[1-4]. 过去的十年中, 临床资料显示实体瘤患者HBV再激活率不断升高, 其中肝细胞癌患者HBV再激活率达60%, 其他癌症患者HBV再激活率在25%-40%, 造血干细胞移植的患者HBV再激活率超过50%[5]. 因此, 合并HBV感染的肿瘤患者在接受化疗时的抗病毒治疗已受到高度重视[6,7].
早在1975年, Wands等[8]首先报道20例淋巴瘤及骨髓增殖性疾病患者化疗中出现HBV复发, 表现为肝功能恶化, 此后逐渐引入了HBV再激活的概念. HBV再激活是指在非活动性HBsAg携带者或已治愈的乙型肝炎患者中再次出现肝炎活动, 其特征是转氨酶水平的升高, 血清中再次检测到HBV DNA或其水平增高, 临床上表现出肝炎症状. Koo等[9]明确提出化疗期间或之后立即出现肝炎, 伴随HBV DNA水平高于基线10倍以上或绝对值大于40 000 IU/mL,并排除其他病毒感染, 即可诊断为HBV再激活. HBV再激活的机制尚未完全清楚, 多数学者[10-12]认为其过程分为两个阶段: 第一阶段化疗药物的应用免疫系统被抑制, 特别是抑制T细胞功能, 导致病毒复制增强, 感染HBV肝细胞数目增加, 表现为血清中检测到HBV DNA或其水平升高、血清HBeAg释放; 第二阶段是停用细胞毒性药物后, 随着T细胞介导的免疫功能恢复, 免疫细胞攻击受病毒感染的肝细胞, 导致肝细胞的快速损伤, 临床表现为肝炎, 甚至肝功能衰竭. 这种HBV再激活发生的概率和严重程度往往是难以预料的.
HBV再激活取决于病毒复制水平和机体免疫反应的平衡. 一些多因素分析研究结果已经显示HBV再激活相关的危险因素包括: 男性、青年人、化疗前ALT水平高、HBeAg阳性等[10-12]. 目前认为再激活与下列因素有关: (1)再激活与原发病有关, 淋巴瘤、乳腺癌等HBV再激活风险较高, 由于大多数肿瘤本身就有免疫抑制作用, 特别是淋巴瘤本身免疫抑制现象突出, 再加上化疗药物的免疫抑制作用[10,13], 所以这些患者免疫抑制表现更为显著, HBV再激活风险高; (2)再激活与药物有关, 不论是传统的细胞毒性药物还是抗B淋巴细胞或抗T淋巴细胞单克隆抗体[14]等生物应答调节剂均有不同程度免疫抑制功能, 细胞毒化疗方法和化疗药物剂量、疗程与再激活有关. 蒽环类能刺激HepG2.2.15分泌HBV DNA, HBV DNA含有糖皮质激素的应答元件, 激素能促进HBV转录, 使得DNA和RNA生成增多, 病毒复制再度活跃, 因此含糖皮质激素和蒽环类的细胞毒性化疗更能导致HBV再激活, 当然多种化疗药物的联合使用, 显著抑制机体免疫功能是引起HBV再激活的主要原因; (3)再激活与HBV感染状态有关, 化疗前HBV DNA水平, HBV DNA>2 000 IU/mL是HBV激活的独立危险因素[15]; HBsAg阳性HBV再激活风险大; 乙肝病毒核心相关抗原(HBcrAg)与肝脏cccDNA水平密切相关, HBcrAg水平高再激活风险大[10]; 抗-HBs阴性或小于10 IU/L以及治疗中抗-HBs水平进行性下降提示再激活风险大[10,13]; HBeAg阳性或治疗中进行性升高再激活可能大[13]; 隐匿性肝炎即HBsAg阴性而抗-HBs、抗-HBc阳性的肿瘤患者也会出现HBV再激活[16,17], 此时HBsAg的消失并不意味着HBV从机体的清除, HBVDNA可以在肝脏和外周血单个核细胞中检测出来[18], 化疗时免疫抑制促使HBV复制, 诱发肝功能损害; (4)再激活与病毒基因型有关, B和C基因型的患者容易发生HBV再激活[10]; (5)再激活与基因变异有关, Awerkiew等[19]报道1例非霍奇金淋巴瘤患者在接受免疫抑制治疗前血清学检查显示只有抗HBs阳性, 化疗后发生HBV再激活, 该患者无疫苗接种史, 抗HBs阳性是感染所致, 经HBV基因序列分析发现S基因有突变, S蛋白氨基酸发生置换(L109R, G137W, G145R), 改变了HBsAg抗原性, 致使HBsAg出现假阴性. 目前有报道在一些HBV再激活的患者中发现了S蛋白53、126、134、194、210、144、145位氨基酸置换[17], 由于HBsAg与HBV逆转录酶区部分重叠, HBsAg的变异也可影响HBV逆转录酶的序列. HBV前C区和基本核心启动子的变异在亚洲乙肝感染者B、C基因中占优势, 变异导致HBeAg阴性, 但病毒复制能力增强, 这样的HBeAg阴性肿瘤患者, HBV再激活危险性增加并可诱导重症肝炎[10].
HBV再激活可发生在化疗中及化疗结束后, 常见化疗开始后4-36 wk(中位数16 wk)[13]. HBV再激活后患者可以表现为无症状病毒复制状态、急性肝炎、肝功能失代偿、肝衰竭甚至死亡[20]. 鉴于临床后果的严重性, 预防和减少化疗时HBV再激活是临床上急需解决的实际问题. 根据化疗时HBV再激活的危险因素, 重视化疗前HBV血清标志物检测; 化疗时慎用或尽量不用糖皮质激素, 如必须应用, 化疗结束时注意逐渐减量, 以防止因免疫反跳而诱导重型肝炎的发生; 对高危人群积极的预防性使用抗病毒药物注射. 上述种种观点逐渐得到临床医务人员的重视和认同, 人们已经意识到HBV感染者化疗时应该采取一种动态、个体、优化的综合治疗策略.
目前获得批准并应用于临床的抗病毒药物包括干扰素和核苷(酸)类似物(nucleos/tide analogues, NAs). 曾有人提出应用干扰素来预防和治疗HBV再激活, 干扰素不仅具有直接抗病毒作用同时又有免疫调节作用, 从理论上说是可行的, 但临床发现常规干扰素治疗可以加重肝细胞破坏而能导致严重肝损害, 此外由于其不良反应(骨髓抑制)限制了干扰素的临床应用.
近年来, NAs在预防和治疗HBV再激活上发挥了重要作用.NAs通过抑制HBV逆转录酶, 有效减少HBV病毒血症, 而且NAs不良反应与细胞毒性药物不重叠, 两者可以同时使用. Loomba等[21]报道预防性服用拉米夫定(LAM)能够减少那些HBsAg阳性患者化疗期间HBV的再激活, 并且将HBV相关性肝炎减少79%甚至更高, LAM的应用明显减少HBV相关性肝衰竭和死亡. 有多项资料提示LAM能降低HBV感染者化疗时HBV再激活, 以及HBV相关疾病的发病率与死亡率[22-24]. HBV感染者化疗时服用LAM发生YMDD变异率与普通慢性乙肝的比例是相似的, 而且一旦耐药换用恩替卡韦、阿德福韦仍然有效[25]. Lubel等[25]报道如果HBsAg阳性血液病患者化疗结束3 mo内停用LAM, 29%发生LAM撤离后HBV再激活, 基线HBVDNA大于2 000 IU/L再激活风险更高. 由于隐匿性乙肝的存在, HBsAg阴性、抗-HBs和/或抗-HBc阳性肿瘤患者接受化疗时同样可以发生HBV再激活[9,26,27]. Marignani等[27]报道隐匿性肝炎HBVDNA水平低, LAM抗病毒疗效好且性价比更高, 对高病毒载量患者建议使用抗病毒效价高耐药发生低的药物如恩替卡韦等, 并建议预防性使用抗病毒药物防治隐匿性乙肝HBV再激活.
尽管预防性服用NAs能有效预防HBV感染者化疗时HBV再激活, 但NAs长期使用后病毒基因变异和停药后的反弹等因素, 因此严密的临床检测还是必须的. You等[28]报道1例51岁的男性肝癌患者接受了预防性LAM抗病毒治疗, 由于YMDD变异而导致重型肝炎, 所以对于接受抗肿瘤化疗的HBV携带者来说, 优先选择一个有效低耐药的抗病毒药物是非常重要的. Mimura等[29]报道3例HBsAg阳性B细胞型淋巴瘤的患者接受利妥昔单抗和CHOP方案(R-CHOP)治疗, 2例进行了8次R-CHOP治疗, 还有1例在接受利妥昔单抗治疗后再进行两次R-CHOP治疗, 3例均预防性服用LAM治疗, 在LAM治疗终止后的2-4 mo, 所有的患者都发生了HBV再激活. 除LAM有较好的预防HBV再激活的作用外, 其他NAs因其各自的药理特点也发挥了不同的作用. 恩替卡韦的抗病毒活性高于阿德福韦、LAM, 其在防治化疗患者HBV再激活方面有较好疗效[30-32], 阿德福韦与其他NAs无交叉耐药位点还可用于耐药后的挽救治疗. 因此, 对于接受化疗的HBV感染者而言, 应该根据个体的不同背景选择合适的抗病毒药物.
NAs预防和治疗肿瘤患者HBV再激活有3种方式: (1)预防用药, 只要患者HBsAg阳性, 不管ALT、HBV DNA水平如何, 一律在化疗开始前1 wk开始一直持续到化疗结束后一段时间服用NAs; (2)早期疗法, 每2 wk检测HBV DNA、ALT, 如果发现HBV DNA 升高, 在ALT尚未升高前立即给予NAs治疗; (3)延迟干预, 就是HBV DNA、ALT升高后再接受治疗. 现有的研究认为预防治疗优于早期治疗和延迟治疗[25].
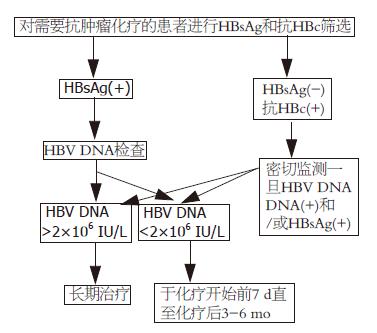
鉴于此, 亚太地区、美国、中国专家均推荐, 对于HBsAg阳性肿瘤患者接受化疗时应预防性使用NAs抗病毒治疗. 2010年版《中国慢性乙型肝炎防治指南》[33]建议: 接受化疗、免疫抑制剂治疗的患者, 应常规筛查HBsAg. 若为阳性, 即使HBV DNA阴性和ALT正常, 也应在治疗前1 wk开始服用LAM或其他NAs. 对HBsAg阴性、抗HBc阳性患者, 在给予长期或大剂量免疫抑制剂或细胞毒药物(特别是针对B或T淋巴细胞单克隆抗体)治疗时, 应密切监测HBV DNA和HBsAg, 若出现阳转则应及时加用抗病毒治疗. 在化疗和免疫抑制剂治疗停止后, 应根据患者病情决定停药时间: (1)对于基线HBV DNA<2 000 IU/L的患者, 在完成化疗或免疫抑制剂治疗后, 应当继续治疗6 mo; (2)基线HBV DNA水平较高(>2 000 IU/L)的患者, 应当持续治疗到和免疫功能正常慢性乙型肝炎患者同样的停药标准; (3)对于预期疗程≤12 mo的患者, 可以选用LAM或替比夫定; (4)对于预期疗程更长的患者, 美国肝病协会指南(2007年)和欧洲肝病协会指南(2009年)一致认为应优先选用恩替卡韦或阿德福韦酯[34]; (5)NAs停用后可出现病毒复发, 甚至病情恶化, 应予以高度重视; (6)干扰素有骨髓抑制作用, 应当避免选用. 具体操作流程可参考图1[33-35].
慢性乙型肝炎是一种难治性疾病, 其治疗具有长期性、复杂性、个体化的特点. HBsAg阳性肿瘤患者进行化疗时, 由于细胞毒性药物和免疫抑制剂的应用, 使得处于静息状态或低复制状态的HBV再激活, 从而引起病情恶化并有可能导致死亡. 有报道美国20%的肿瘤科医生在化疗前从不筛查HBV[35], 我国情况也不容乐观. 随着新型NAs抗病毒药物的问世, 合并HBV感染的肿瘤患者化疗时HBV再激活机制研究的深入, 临床资料证实NAs能降低HBV再激活, 减少HBV相关死亡率, 我们相信对这些特殊患者的抗病毒治疗必将被大家接受. 为此, 我们要求对所有接受化疗的肿瘤患者都应该筛查HBV标志物; 所有对HBV无免疫的, 均应尽快注射乙肝疫苗(0, 1, 6方案), 在化疗前注射两针, 第三针在化疗结束后进行, 末次注射疫苗后数周检测抗-HBs应答水平, 保持抗-HBs>10 IU/L, 无免疫应答者可以加大免疫接种剂量. 由于化疗患者免疫低下, 对疫苗无应答是常见的, 但57%的肿瘤患者仍会有抗-HBs血清转换[16]; 化疗时HBsAg 阳性患者, 不管ALT和HBV DNA水平如何, 均应预防使用NAs, 预防治疗疗效好于早期治疗; 根据基线HBV DNA水平预测治疗疗程并选择合适的NAs; HBsAg阴性、抗HBc阳性患者, 密切监测HBV DNA和HBsAg, 阳转时迅速加用抗病毒治疗. 虽然NAs能降低化疗时HBV的再激活, 但还有很多问题尚待研究, 比如: 预防治疗在化疗开始前1 wk时间是否足够? 预防治疗后抗病毒药物的适宜疗程如何? 治疗中耐药的处理及初始联合治疗是否可行? HBV再激活有无预测模式? 种种问题都有待临床研究论证. 相信随着对HBV再激活知识的普及, 对HBV再激活发机制的了解, 大量临床资料的积累, 我们会有以循证医学为依据的答案. 多个学科综合考虑的治疗策略必将进一步预防和减少肿瘤患者化疗时HBV再激活, 以完成多疗程化疗, 延长生命, 提高生活质量.
HBV感染者化疗时HBV再激活导致化疗中断, 肝功能恶化, 部分患者甚至肝衰竭而死亡, 医务人员在临床工作中如何判断HBV再激活、预防HBV再激活、防治再激活是亟待解决的问题.
吴君, 主任医师, 贵阳医学院附属医院感染科
虽然NAs能降低化疗时HBV的再激活, 但还有很多问题尚待研究, 比如: 预防治疗在化疗开始前1 wk时间是否足够? 预防治疗后抗病毒药物的适宜疗程如何? 治疗中耐药的处理及初始联合治疗是否可行? HBV再激活有无预测模式? 种种问题都有待临床研究论证.
Wands等首先报道20例淋巴瘤及骨髓增殖性疾病患者化疗中出现HBV复发, 表现为肝功能恶化, 此后逐渐引入了HBV再激活的概念.
本文作者从再激活的发病机理和高危因素分析着手, 强调了抗病治疗的重要性, 着重规范医务人员临床诊疗工作流程, 提出了防治肿瘤患者HBV再激活的策略, 对医务人员临床工作有实际的指导意义. 审稿专家认为作者对乙型肝炎病毒感染者化疗时抗病毒治疗的重要性、必要性进行了综述, 并提出了操作流程图, 有一定的实用价值.
本文有一定的实用价值, 但新颖性一般.
编辑: 李军亮 电编:李薇
| 1. | Ferraro D, Pizzillo P, Di Marco V, Vultaggio A, Iannitto E, Venezia G, Craxì A, Di Stefano R. Evaluating the risk of hepatitis B reactivation in patients with haematological malignancies: is the serum hepatitis B virus profile reliable? Liver Int. 2009;29:1171-1177. [PubMed] [DOI] |
| 2. | Wasmuth JC, Fischer HP, Sauerbruch T, Dumoulin FL. Fatal acute liver failure due to reactivation of hepatitis B following treatment with fludarabine/cyclophosphamide/rituximab for low grade non-Hodgkin's lymphoma. Eur J Med Res. 2008;13:483-486. [PubMed] |
| 3. | Power JP, El Chaar M, Temple J, Thomas M, Spillane D, Candotti D, Allain JP. HBV reactivation after fludarabine chemotherapy identified on investigation of suspected transfusion-transmitted Hepatitis B virus. J Hepatol. 2010;53:780-787. [PubMed] [DOI] |
| 4. | Muñoz Bertrán E, Pérez Ceballos E, Gómez Espín R, Ortega González I. [Hepatitis B reactivation in an HbsAg-negative/anti-HBc-positive patient with B-cell non-Hodgkin lymphoma receiving chemotherapy with rituximab]. Gastroenterol Hepatol. 2010;33:377-381. [PubMed] [DOI] |
| 5. | Yeo W, Johnson PJ. Diagnosis, prevention and management of hepatitis B virus reactivation during anticancer therapy. Hepatology. 2006;43:209-220. [PubMed] [DOI] |
| 6. | Hoofnagle JH. Reactivation of hepatitis B. Hepatology. 2009;49:S156-S165. [PubMed] [DOI] |
| 7. | Khokhar OS, Farhadi A, McGrail L, Lewis JH. Oncologists and hepatitis B: a survey to determine current level of awareness and practice of antiviral prophylaxis to prevent reactivation. Chemotherapy. 2009;55:69-75. [PubMed] [DOI] |
| 8. | Wands JR, Chura CM, Roll FJ, Maddrey WC. Serial studies of hepatitis-associated antigen and antibody in patients receiving antitumor chemotherapy for myeloproliferative and lymphoproliferative disorders. Gastroenterology. 1975;68:105-112. [PubMed] |
| 9. | Koo YX, Tan DS, Tan IB, Tao M, Chow WC, Lim ST. Hepatitis B virus reactivation and role of antiviral prophylaxis in lymphoma patients with past hepatitis B virus infection who are receiving chemoimmunotherapy. Cancer. 2010;116:115-121. [PubMed] |
| 10. | Kusumoto S, Tanaka Y, Ueda R, Mizokami M. Reactivation of hepatitis B virus following rituximab-plus-steroid combination chemotherapy. J Gastroenterol. 2011;46:9-16. [PubMed] [DOI] |
| 11. | Roche B, Samuel D. The difficulties of managing severe hepatitis B virus reactivation. Liver Int. 2011;31 Suppl 1:104-110. [PubMed] [DOI] |
| 12. | Fukushima N, Mizuta T, Tanaka M, Yokoo M, Ide M, Hisatomi T, Kuwahara N, Tomimasu R, Tsuneyoshi N, Funai N. Retrospective and prospective studies of hepatitis B virus reactivation in malignant lymphoma with occult HBV carrier. Ann Oncol. 2009;20:2013-2017. [PubMed] [DOI] |
| 13. | Lalazar G, Rund D, Shouval D. Screening, prevention and treatment of viral hepatitis B reactivation in patients with haematological malignancies. Br J Haematol. 2007;136:699-712. [PubMed] [DOI] |
| 14. | Yeo W, Chan TC, Leung NW, Lam WY, Mo FK, Chu MT, Chan HL, Hui EP, Lei KI, Mok TS. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol. 2009;27:605-611. [PubMed] [DOI] |
| 15. | Jang JW, Choi JY, Bae SH, Yoon SK, Chang UI, Kim CW, Cho SH, Han JY, Lee YS. A randomized controlled study of preemptive lamivudine in patients receiving transarterial chemo-lipiodolization. Hepatology. 2006;43:233-240. [PubMed] [DOI] |
| 16. | Kusumoto S, Tanaka Y, Mizokami M, Ueda R. Reactivation of hepatitis B virus following systemic chemotherapy for malignant lymphoma. Int J Hematol. 2009;90:13-23. [PubMed] [DOI] |
| 17. | Borentain P, Colson P, Coso D, Bories E, Charbonnier A, Stoppa AM, Auran T, Loundou A, Motte A, Ressiot E. Clinical and virological factors associated with hepatitis B virus reactivation in HBsAg-negative and anti-HBc antibodies-positive patients undergoing chemotherapy and/or autologous stem cell transplantation for cancer. J Viral Hepat. 2010;17:807-815. [PubMed] [DOI] |
| 18. | Cheung WI, Chan HL, Leung VK, Tse CH, Fung K, Lin SY, Wong A, Wong VW, Chau TN. Reactivation of hepatitis B virus infection with persistently negative HBsAg on three HBsAg assays in a lymphoma patient undergoing chemotherapy. J Clin Virol. 2010;47:193-195. [PubMed] [DOI] |
| 19. | Awerkiew S, Däumer M, Reiser M, Wend UC, Pfister H, Kaiser R, Willems WR, Gerlich WH. Reactivation of an occult hepatitis B virus escape mutant in an anti-HBs positive, anti-HBc negative lymphoma patient. J Clin Virol. 2007;38:83-86. [PubMed] [DOI] |
| 20. | Manzano-Alonso ML, Castellano-Tortajada G. Reactivation of hepatitis B virus infection after cytotoxic chemotherapy or immunosuppressive therapy. World J Gastroenterol. 2011;17:1531-1537. [PubMed] [DOI] |
| 21. | Loomba R, Rowley A, Wesley R, Liang TJ, Hoofnagle JH, Pucino F, Csako G. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy. Ann Intern Med. 2008;148:519-528. [PubMed] |
| 22. | Cil T, Altintas A, Pasa S, Bayan K, Ozekinci T, Isikdogan A. Lamivudine for the prevention of hepatitis B virus reactivation in hepatitis-B surface antigen (HBSAG) seropositive cancer patients undergoing cytotoxic chemotherapy. Leuk Lymphoma. 2008;49:939-947. [PubMed] [DOI] |
| 23. | Yun J, Kim KH, Kang ES, Gwak GY, Choi MS, Lee JE, Nam SJ, Yang JH, Park YH, Ahn JS. Prophylactic use of lamivudine for hepatitis B exacerbation in post-operative breast cancer patients receiving anthracycline-based adjuvant chemotherapy. Br J Cancer. 2011;104:559-563. [PubMed] [DOI] |
| 24. | Ziakas PD, Karsaliakos P, Mylonakis E. Effect of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in lymphoma: a meta-analysis of published clinical trials and a decision tree addressing prolonged prophylaxis and maintenance. Haematologica. 2009;94:998-1005. [PubMed] [DOI] |
| 25. | Lubel JS, Angus PW. Hepatitis B reactivation in patients receiving cytotoxic chemotherapy: diagnosis and management. J Gastroenterol Hepatol. 2010;25:864-871. [PubMed] [DOI] |
| 26. | Pei SN, Chen CH, Lee CM, Wang MC, Ma MC, Hu TH, Kuo CY. Reactivation of hepatitis B virus following rituximab-based regimens: a serious complication in both HBsAg-positive and HBsAg-negative patients. Ann Hematol. 2010;89:255-262. [PubMed] [DOI] |
| 27. | Marignani M, Marzano A. Surveillance and treatment protocols to detect and treat hepatitis B virus reactivation in hepatitis B surface antigen-negative/antibody to hepatitis B core antigen-positive patients receiving chemotherapy for onco-hematologic malignancies. J Clin Oncol. 2011;29:e210; author reply e211. [PubMed] |
| 28. | You CR, Jang JW, Choi JK, Bae SH, Yoon SK, Kay CS, Choi JY. Hepatic Failure Caused by Reactivation of YMDD Mutants Occurring during Preemptive Lamivudine Therapy. Gut Liver. 2010;4:262-265. [PubMed] [DOI] |
| 29. | Mimura N, Tsujimura H, Ise M, Sakai C, Kojima H, Fukai K, Yokosuka O, Takagi T, Kumagai K. [Hepatitis B virus reactivation after cessation of prophylactic lamivudine therapy in B-cell lymphoma patients treated with rituximab combined CHOP therapy]. Rinsho Ketsueki. 2009;50:1715-1719. [PubMed] |
| 30. | Watanabe M, Shibuya A, Takada J, Tanaka Y, Okuwaki Y, Minamino T, Hidaka H, Nakazawa T, Koizumi W. Entecavir is an optional agent to prevent hepatitis B virus (HBV) reactivation: a review of 16 patients. Eur J Intern Med. 2010;21:333-337. [PubMed] [DOI] |
| 33. | Chung SJ, Kim JK, Park MC, Park YB, Lee SK. Reactivation of hepatitis B viral infection in inactive HBsAg carriers following anti-tumor necrosis factor-alpha therapy. J Rheumatol. 2009;36:2416-2420. [PubMed] [DOI] |
| 34. | Villadolid J, Laplant KD, Markham MJ, Nelson DR, George TJ. Hepatitis B reactivation and rituximab in the oncology practice. Oncologist. 2010;15:1113-1121. [PubMed] [DOI] |
| 35. | Tran TT, Rakoski MO, Martin P, Poordad F. Screening for hepatitis B in chemotherapy patients: survey of current oncology practices. Aliment Pharmacol Ther. 2010;31:240-246. [PubMed] |