修回日期: 2011-05-09
接受日期: 2011-05-17
在线出版日期: 2011-05-28
目的: 研究三叶因子3(TFF3)和β-catenin在不同大肠黏膜组织中的表达及其相互关系, 探讨其在大肠腺癌及腺瘤发生、发展中的作用.
方法: 采用免疫组织化学PV6000法检测20例正常大肠黏膜、30例非腺瘤性息肉、20例大肠腺瘤、20例大肠腺瘤伴不典型增生和40例大肠腺癌组织中TFF3和β-catenin的表达, 分析二者表达的差异及其相关性.
结果: TFF3在大肠腺瘤、不典型增生组织表达下降(P<0.05), 腺癌表达增加. β-catenin的异常表达率随腺瘤→腺瘤伴不典型增生→腺癌逐渐增加, 腺癌组的膜表达缺失及异位表达均高于非腺瘤性息肉和腺瘤组(60.00% vs 0.00%, 15.00%; 75.00% vs 0.00%, 40.00%, 均P<0.05). TFF3在腺癌中的表达与部位、分化程度无关, 与淋巴结转移和Duke's分期密切相关(均P<0.05); β-catenin异常表达与部位、淋巴结转移无关, 与肿瘤分化程度相关, 异位表达尚与Duke's分期相关(均P<0.05). TFF3在腺癌中的表达与β-catenin膜表达缺失、异位表达均呈显著正相关(r = 0.427, P = 0.006; r = 0.577, P = 0.000), 腺瘤中无相关(r = 0.015, P =0.951; r = 0.385, P = 0.094); 腺癌和腺瘤中β-catenin的膜表达缺失、异位表达两者间均呈显著正相关(r = 0.638, P = 0.000; r = 0.514, P = 0.020).
结论: TFF3和β-catenin的表达与大肠腺癌的发生、发展密切相关, 是肿瘤发生的早期分子事件. TFF3与β-catenin的异常表达相关, 可能在大肠腺癌的发生、发展中存在共同作用.
引文著录: 于大中, 于亚男, 田字彬, 赵清喜, 孔心涓, 张翠萍, 魏良洲. TFF3和β-catenin在不同大肠黏膜组织中的表达. 世界华人消化杂志 2011; 19(15): 1579-1584
Revised: May 9, 2011
Accepted: May 17, 2011
Published online: May 28, 2011
AIM: To analyze the expression of trefoil factor family-3 (TFF3) and β-catenin in different types of colorectal mucosal lesions and to explore their role in the development and progression of colorectal adenocarcinoma and adenoma.
METHODS: The expression of TFF3 and β-catenin was detected by immunohistochemistry in 20 normal colorectal mucosa specimens, 30 colorectal polyp specimens, 20 colorectal adenoma (CRA) specimens, 20 colorectal adenoma (with atypical hyperplasia, CRAAH) specimens, and 40 colorectal adenocarcinoma (CRCA) specimens. The differences in the expression of TFF3 and β-catenin in different types of colorectal mucosal lesions were compared.
RESULTS: The positive rate of TFF3 expression was significantly lower in CRA and CRAAH (P < 0.05), but higher in CRCA. The abnormal expression of β-catenin were gradually increasing along with the sequence of CRA→CRAAH→CRAC, the membrane expressing deletion and ectopic expression were both higher in CRAC than in CRCP and CRA (60.00% vs 0.00%, 15.00%; 75.00% vs 0.00%, 40.00%, all P < 0.05). TFF3 expression was not correlated with tumor location or differentiation in CRAC, but was related to lymph node metastasis and Duke's stage (both P < 0.05). β-catenin expression was not correlated with tumor location or lymph node metastasis, but was related to tumor differentiation. Ectopic expression of β-catenin was related to Duke's stage (P < 0.05). There were significantly positive correlations between TFF3 expression and abnormal expression and loss of membrane expression of β-catenin in CRA (r = 0.427, P = 0.006; r = 0.577, P = 0.000) but not in CRAC (r = 0.015, P = 0.951; r = 0.385, P = 0.094). There was a significantly positive correlation between loss of membrane expression and ectopic expression of β-catenin in CRAC and CRA (r = 0.638, P = 0.000; r = 0.514, P = 0.020).
CONCLUSION: The expression of TFF3 and β-catenin is closely related with the development and progression of CRAC. They may be involved in an early event in colorectal carcinogenesis. TFF3 is related to the abnormal expression of β-catenin, both of which may be involved in the development and progression of CRAC.
- Citation: Yu DZ, Yu YN, Tian ZB, Zhao QX, Kong XJ, Zhang CP, Wei LZ. Expression of trefoil factor family-3 and β-catenin in different types of colorectal mucosal lesions. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1579-1584
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1579.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1579
三叶因子3(trefoil factor family-3, TFF3)主要在小肠及结直肠杯状细胞中表达, 其能诱导细胞迁移而与肿瘤的发生关系密切. β-连接素(β-catenin)是一个多功能蛋白, 其在肠干细胞中的过度积累是导致肠干细胞过度克隆增殖、肠息肉和肿瘤形成的主要因素. 我们采用免疫组织化学方法, 检测结直肠正常黏膜组织、非腺瘤性息肉、腺瘤性息肉及腺癌中TFF3及β-catenin的表达, 并探讨二者与结直肠息肉及腺癌发生发展的关系.
选取青岛大学医学院附属医院2008-12/2009-12病理室存档的结肠镜活检(未电切组织)及结肠癌根治术后标本蜡块110例, 其中非腺瘤性息肉30例、腺瘤性息肉20例、腺瘤伴不典型增生20例及结直肠腺癌40例. 结肠癌病例术前均未接受放、化疗, 并选取远端正常结直肠黏膜20例作对照. 实验选用与HE染色一致的蜡块制成4 μm切片行免疫组织化学方法.
1.2.1 免疫组织化学(PV6000)法: 兔抗人TFF3多克隆抗体(工作浓度为1:200)购自北京博奥森生物技术有限公司; 鼠抗人β-catenin单克隆抗体(工作浓度为1:200), PV6000试剂盒, 柠檬酸抗原修复缓冲液, PBS缓冲液, DAB显色剂均购自北京中杉金桥生物技术有限公司. 切片染色前根据要求行柠檬酸缓冲液高温高压抗原修复, 余具体操作过程均按试剂盒说明书完成. 阴性对照中的一抗以PBS缓冲液代替.
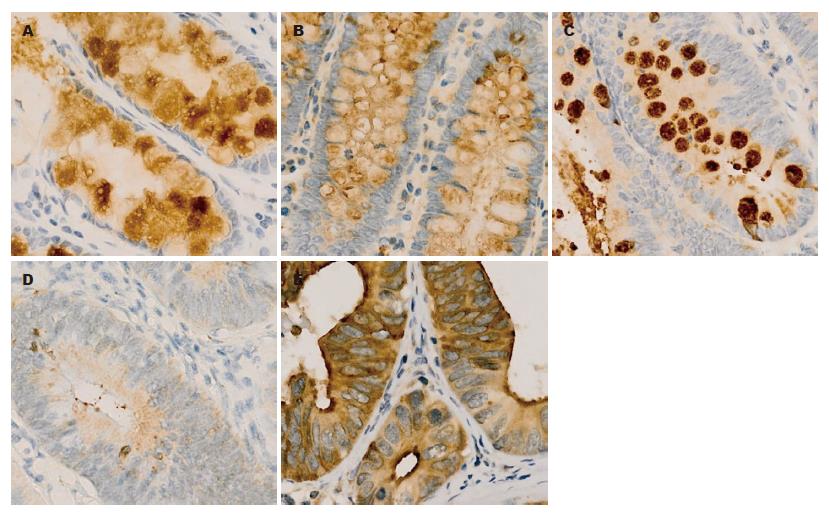
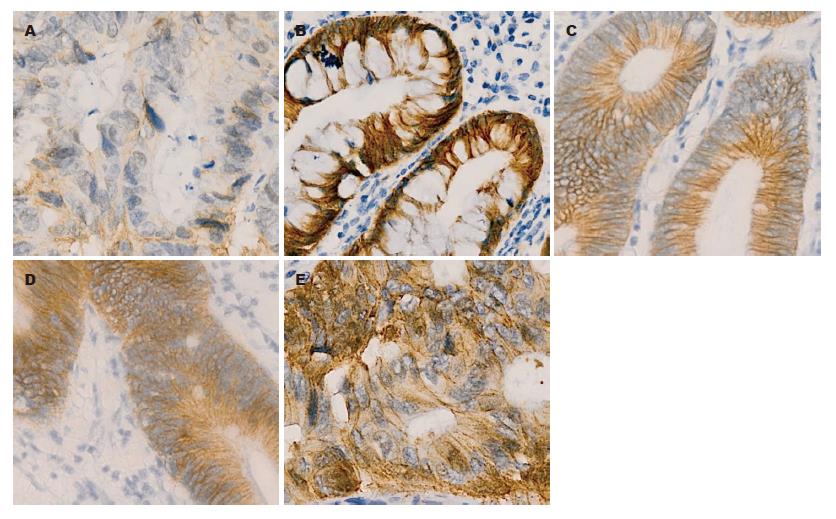
1.2.2 结果判定: (1)TFF3判断标准: 以胞质内出现淡黄色至棕黄色染色视为阳性细胞, 根据细胞染色强度和染色细胞所占面积之和来判断. 染色强度积分为: 无染色0分, 弱染色1分, 中等染色2分, 强染色3分; 染色面积积分为: 阳性范围≤10%为0分, 11%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 若两者积分之和≥3分则为阳性, ≤2分则为阴性; (2)β-catenin判断标准: 在正常黏膜中, β-catenin免疫组织化学阳性反应为棕黄色细小颗粒状, 主要定位于细胞膜, 微量定位于细胞质; 在腺瘤与腺癌中, 其阳性染色主要定位于细胞质, 并有部分细胞核阳性. 按照Maruyama等方法, 分别从细胞膜、细胞质、细胞核三方面判断其在细胞内的分布情况. 细胞膜>70%细胞阳性为正常表达, 反之为膜表达缺失; 细胞质或细胞核>10%细胞阳性为胞质或胞核阳性表达, 即异位表达. 细胞膜表达缺失、胞质或胞核表达统称为表达异常.
统计学处理 采用SPSS13.0软件进行统计学处理, TFF3和β-catenin在不同结直肠黏膜组织中的表达之间的关系以及在结直肠腺癌不同临床病理特征之间的关系用χ2检验, TFF3和β-catenin在不同结直肠黏膜中的表达相关用Spearman相关分析. P<0.05为差异有统计学意义.
TFF3在正常结直肠黏膜和非腺瘤性息肉中表达位于细胞质中(图1), 腺瘤、腺瘤伴不典型增生组织中TFF3表达下降, 而在结直肠腺癌中表达增加, 其TFF3阳性表达分别为95.00%、93.33%、65.00%、60.00%和80.00%. 与正常结直肠黏膜相比, 非腺瘤性息肉TFF3表达相同, 腺瘤及腺瘤伴不典型增生组织中表达下降(均P<0.05, 表1), 而结直肠腺癌中TFF3表达与正常结直肠黏膜无显著差异. β-catenin在正常结直肠黏膜和非腺瘤性息肉的表达主要定位于细胞膜(图2), 无膜表达缺失及异位表达, 而在腺瘤、腺瘤伴不典型增生和结直肠腺癌中呈不同程度的膜表达缺失和异位表达. β-catenin的膜表达缺失和异位表达随着腺瘤→腺瘤伴不典型增生→腺癌均呈逐渐增加, 其膜表达缺失率分别为15.00%、25.00%、60.00%, 其中腺瘤伴不典型增生和腺癌组膜表达缺失率较正常结直肠黏膜组高(均P<0.05), 腺瘤组无明显差异; β-catenin异位表达分别为40.00%、55.00%、75.00%, 均比正常结直肠黏膜组异位表达增加(均P<0.05). 而与结直肠腺癌组比较, 非腺瘤性息肉和腺瘤组β-catenin的膜表达缺失和异位表达均降低(均P<0.05, 表1), 腺瘤伴不典型增生无显著性差异.
TFF3在结直肠腺癌中的表达与部位、分化程度无明显关系, 与淋巴结转移和Duke's分期密切相关(均P<0.05); β-catenin膜表达缺失和异位表达与部位、淋巴结转移均无明显关系, 而与肿瘤分化程度相关, 异位表达尚与Duke's分期相关(均P<0.05, 表2). 随着结直肠腺癌恶性程度的增高, TFF3表达逐渐下降, β-catenin异位表达越来越明显.
| n | TFF3阳性表达 | β-catenin | ||
| 膜表达缺失 | 异位表达 | |||
| 部位 | ||||
| 结肠 | 24 | 19(79.17) | 11(45.83) | 18(75.00) |
| 直肠 | 16 | 13(81.25) | 11(68.75) | 12(75.00) |
| P值 | >0.05 | >0.05 | >0.05 | |
| 分化程度 | ||||
| 高分化 | 13 | 10(76.92) | 4(30.77) | 6(46.15) |
| 中分化 | 14 | 13(92.86) | 7(50.00) | 11(78.57) |
| 低分化 | 13 | 9(69.23) | 11(84.62) | 13(100.00) |
| P值 | >0.05 | <0.05 | <0.05 | |
| 淋巴结转移 | ||||
| 无 | 27 | 25(92.59) | 14(51.85) | 21(77.78) |
| 有 | 13 | 7(53.85) | 8(61.54) | 9(69.23) |
| P值 | <0.05 | >0.05 | >0.05 | |
| Duke's分期 | ||||
| A | 16 | 15(93.75) | 8(50.00) | 9(56.25) |
| B | 11 | 9(81.82) | 6(54.54) | 8(72.73) |
| C+D | 13 | 7(53.85) | 8(61.54) | 13(100.00) |
| P值 | <0.05 | >0.05 | <0.05 | |
Spearman相关分析显示, 腺癌中TFF3的表达与β-catenin膜表达缺失、异位表达均呈显著正相关(r = 0.427, P =0.006; r = 0.577, P = 0.000); 腺瘤中无相关(r = 0.015, P = 0.951; r =0.385, P = 0.094); 腺癌和腺瘤中β-catenin的膜表达缺失、异位表达两者间均呈显著正相关(r = 0.638, P = 0.000; r = 0.514, P = 0.020).
结直肠癌(colorectal cancer, CRC)是常见的消化系统恶性肿瘤, 近年来随着生活水平的提高、饮食习惯以及环境因素的改变, 其发病率呈逐渐上升趋势, 在欧洲处于恶性肿瘤的第2位[1,2], 在我国也处于第3-4位[3,4]. CRC的发生是一个多因素多阶段漫长的过程, 其发生有三种途径: 经典的腺瘤→腺癌途径、"锯齿状途径"和De Novo途径, 一般认为从正常结直肠黏膜→腺瘤→腺癌途径最为重要[5,6].
TFF3, 是近年来研究较多的小分子多肽三叶因子家族成员之一, 1991年由Suemori等[7]首次在大鼠空肠发现, 其基因与TFF1及TFF2基因密集于染色体21q22.3上. TFF3分子由59个氨基酸组成, 含有1个P结构域, 存在单聚体(6 692 kDa)及二聚体(13 146.8 kDa)两种形式, 其同源二聚体由2个Cys58形成的分子间二硫键连接而成[8]. 正常情况下主要在小肠及结肠杯状细胞中表达, 由杯状细胞分泌, 特异分布于肠黏膜表面, 在哺乳动物体内具有黏膜保护、损伤愈合修复作用[9,10]. 研究报道结直肠腺瘤中TFF3的表达与其发育不良进展程度之间呈显著正相关[11]. John等[12]研究结肠癌演变过程时发现, TFF3在腺瘤中表达明显降低, 而在黏液癌和腺癌中呈高表达状态; TFF3表达尚与结肠肿瘤的分期有关, Dukes A期表达明显高于Dukes B、C、D期. 已经证明TFF3能诱导HT29结肠癌细胞系细胞凋亡的特征, 随后肿瘤细胞对TFF3产生抵抗、表达减少, 可能使他们逃脱正常的细胞凋亡控制; 还发现TFF3过度表达可抑制结肠癌细胞株LoVo和SW837在体外和体内的生长[12,13]. 本研究检测不同结直肠黏膜组织中TFF3的表达, 发现其在非腺瘤性息肉与正常结直肠黏膜表达相同, 腺瘤及腺瘤伴不典型增生中表达降低, 而腺癌中表达增加; TFF3在结直肠腺癌中的表达与部位、分化程度无明显关系, 而与淋巴结转移和Duke's分期密切相关, Duke's A期90%以上表达阳性, Duke's C+D期表达明显下降. 这一结果提示TFF3在结直肠肿瘤发生、发展过程中的作用, 其可能是结直肠黏膜癌变过程中的早期分子事件; TFF3表达与恶性肿瘤临床病理特征的相关性, 可能反映了肿瘤分化的最终丧失. TFF3在早期结直肠腺癌中表达增加可能与其抑制细胞黏附、促进肿瘤细胞侵袭、抑制细胞凋亡以及促进新生血管生成作用有关.
β-catenin是细胞膜黏附蛋白复合物的成员, 也是重要的细胞信号分子, 在上皮型钙黏蛋白(E-cadherin, E-cad)介导的细胞黏附和Wnt信号转导通路中发挥着关键作用[14,15]. β-catenin在肿瘤发展过程中伴随蛋白从胞质向胞核转移, 这一变化被认为是腺瘤-腺癌序列进展的重要标志[16,17]. Wnt/β-catenin信号转导通路在肿瘤的发生、发展、侵袭以及转移中起着非常重要的作用, 其异常活化与结直肠肿瘤的发生、发展密切相关[18-20]. 许多研究发现, β-catenin异常表达与结直肠癌分化程度、侵犯深度, 是否转移、分期增高等有相关性[21-25], 提示β-catenin异常表达与恶性肿瘤侵袭和转移存在相关性. 这可能由于β-catenin从胞膜移位导致β-catenin-E-cadherin复合体解离, 同型细胞间黏附能力下降, 从而增强了肿瘤细胞的转移能力[26], 核内β-catenin高表达可使癌细胞具备上皮-间质转化及干细胞形成的能力, 进而导致肿瘤的侵袭与转移[27]. 本研究中β-catenin在正常结直肠黏膜和非腺瘤性息肉的表达主要定位于细胞膜, 无膜表达缺失及胞质或胞核异位表达, 而随腺瘤→腺瘤伴不典型增生→腺癌过程其异常表达率逐渐增加, 腺癌的异常表达较非腺瘤性息肉和腺瘤均增加. 本研究还发现β-catenin异常表达与腺癌部位、淋巴结转移无明显关系, 而与肿瘤分化程度相关; β-catenin异位表达尚与Duke's分期相关, 随结直肠腺癌恶性程度的增高, β-catenin异位表达越来越明显. 这也提示β-catenin是结直肠肿瘤发生中的早期分子事件, 其异常表达可致Wnt/β-catenin信号转导通路活化, 从而在肿瘤发生、发展过程中发挥重要作用.
另外, 本研究还发现TFF3在结直肠腺癌中的表达与β-catenin的异常表达呈显著正相关, 而腺瘤中则无这种相关; 腺癌和腺瘤中β-catenin的膜表达缺失与异位表达两者间均呈显著正相关. 这一结果提示TFF3与β-catenin在结直肠腺瘤→腺癌的发展过程中可能存在共同作用. 已经证明TFF3可诱导HT29结肠癌细胞的β-catenin和表皮生长因子受体(epidermal growth factor receptor, EGFR)的酪氨酸磷酸化, 导致细胞间粘连破坏, 使上皮细胞互相分离, 从而增加HT29结肠癌细胞的迁移力[28]. TFF3可通过扰乱β-catenin-E-cadherin复合体及相关蛋白的表达, 上调β-catenin和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)的mRNA表达, 下调E-cadherin和基质金属蛋白酶抑制因子-1(inhibitor of matrix metalloproteinase-1, TIMP-1)的表达, 并最终影响细胞的黏附、转移、侵袭过程[29,30].
本研究结果表明TFF3与β-catenin作为结直肠腺癌发生过程中的重要因子, 参与了结直肠黏膜腺瘤形成和恶性转化的过程, 是结直肠黏膜癌变过程中的早期分子事件, 其影响肿瘤细胞的黏附、转移和侵袭过程. 因此, 检测TFF3和β-catenin对结直肠肿瘤早期诊断、评估预后及治疗模式的选择有着重要的临床参考价值. 但TFF3的细胞内作用机制、具体信号转导途径的相关研究尚处于起始阶段, 尚需进一步研究证明其与结直肠癌发生、发展过程的关系, 从而有利于结直肠癌的早期诊断和治疗.
随着生活水平的不断提高及饮食习惯的改变, 结直肠癌的发病率呈逐渐上升趋势. 结直肠癌的发生是一个多因素多阶段漫长的过程, 目前尚且缺乏有效的早期诊断指标. 近年来研究表明TFF3与β-catenin在肿瘤发生发展中起重要作用.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
TFF3与β-catenin在肿瘤中异常表达, 其在癌前状态是否也有表达及其在肿瘤发生、浸润和转移中的作用机制是当前研究的热点问题.
John等研究结肠癌演变过程时发现, TFF3在腺瘤中表达明显降低, 而在腺癌和黏液癌中呈高表达状态. 提示TFF3的表达与细胞增殖呈负相关,可能对结直肠癌的发生起到保护作用.
本研究发现TFF3在结直肠腺癌中的表达与β-catenin的异常表达呈显著正相关, 而腺瘤中则无这种相关. 提示TFF3与β-catenin在结直肠腺瘤→腺癌的发展过程中可能存在共同作用.
本研究结果表明TFF3与β-catenin是结直肠黏膜癌变过程中的早期分子事件, 在结直肠黏膜癌变及癌变后的恶性演进过程中起作用, 进一步了解二者表达与结直肠癌发生、发展的关系, 可为结直肠癌的早期诊断、预后评估及临床治疗提供新的思路和前景.
本文研究了TFF3和β-catenin在不同大肠黏膜组织的表达, 对结直肠癌的早期诊断、预后评估及治疗方式的选择有一定参考价值, 学术价值较好.
编辑: 李薇 电编:何基才
| 1. | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of the cancer incidence and mortality in Europe in 2006. Ann Oncol. 2007;18:581-592. [PubMed] [DOI] |
| 2. | Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008. Eur J Cancer. 2010;46:765-781. [PubMed] [DOI] |
| 5. | Buecher B, Bezieau S, Dufilhol C, Cauchin E, Heymann MF, Mosnier JF. [Emerging concepts in colorectal serrated polyps]. Gastroenterol Clin Biol. 2007;31:39-54. [PubMed] [DOI] |
| 7. | Suemori S, Lynch-Devaney K, Podolsky DK. Identification and characterization of rat intestinal trefoil factor: tissue- and cell-specific member of the trefoil protein family. Proc Natl Acad Sci U S A. 1991;88:11017-11021. [PubMed] [DOI] |
| 8. | Thim L, Wöldike HF, Nielsen PF, Christensen M, Lynch-Devaney K, Podolsky DK. Characterization of human and rat intestinal trefoil factor produced in yeast. Biochemistry. 1995;34:4757-4764. [PubMed] [DOI] |
| 9. | Kouznetsova I, Kalinski T, Peitz U, Mönkemüller KE, Kalbacher H, Vieth M, Meyer F, Roessner A, Malfertheiner P, Lippert H. Localization of TFF3 peptide in human esophageal submucosal glands and gastric cardia: differentiation of two types of gastric pit cells along the rostro-caudal axis. Cell Tissue Res. 2007;328:365-374. [PubMed] [DOI] |
| 11. | Hinz M, Schwegler H, Chwieralski CE, Laube G, Linke R, Pohle W, Hoffmann W. Trefoil factor family (TFF) expression in the mouse brain and pituitary: changes in the developing cerebellum. Peptides. 2004;25:827-832. [PubMed] [DOI] |
| 12. | John R, El-Rouby NM, Tomasetto C, Rio MC, Karam SM. Expression of TFF3 during multistep colon carcinogenesis. Histol Histopathol. 2007;22:743-751. [PubMed] |
| 13. | Uchino H, Kataoka H, Itoh H, Hamasuna R, Koono M. Overexpression of intestinal trefoil factor in human colon carcinoma cells reduces cellular growth in vitro and in vivo. Gastroenterology. 2000;118:60-69. [PubMed] [DOI] |
| 14. | Nelson WJ, Nusse R. Convergence of Wnt, beta-catenin, and cadherin pathways. Science. 2004;303:1483-1487. [PubMed] [DOI] |
| 15. | Bright-Thomas RM, Hargest R. APC, beta-Catenin and hTCF-4; an unholy trinity in the genesis of colorectal cancer. Eur J Surg Oncol. 2003;29:107-117. [PubMed] [DOI] |
| 17. | Kikuchi A. Regulation of beta-catenin signaling in the Wnt pathway. Biochem Biophys Res Commun. 2000;268:243-248. [PubMed] [DOI] |
| 18. | Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature. 2005;434:843-850. [PubMed] [DOI] |
| 20. | Kawasaki T, Nosho K, Ohnishi M, Suemoto Y, Kirkner GJ, Dehari R, Meyerhardt JA, Fuchs CS, Ogino S. Correlation of beta-catenin localization with cyclooxygenase-2 expression and CpG island methylator phenotype (CIMP) in colorectal cancer. Neoplasia. 2007;9:569-577. [PubMed] [DOI] |
| 21. | 顾 国利, 魏 学明, 王 石林, 任 力, 郑 爱民, 黄 蓉蓉, 胡 益云. 大肠癌E-cadherin, β-catenin, MMP-7表达及其临床意义. 世界华人消化杂志. 2007;15:375-380. [DOI] |
| 23. | Brabletz T, Jung A, Kirchner T. Beta-catenin and the morphogenesis of colorectal cancer. Virchows Arch. 2002;441:1-11. [PubMed] [DOI] |
| 25. | Wong SC, Lo ES, Lee KC, Chan JK, Hsiao WL. Prognostic and diagnostic significance of beta-catenin nuclear immunostaining in colorectal cancer. Clin Cancer Res. 2004;10:1401-1408. [PubMed] [DOI] |
| 26. | Bonitsis N, Batistatou A, Karantima S, Charalabopoulos K. The role of cadherin/catenin complex in malignant melanoma. Exp Oncol. 2006;28:187-193. [PubMed] |
| 27. | Brabletz T, Hlubek F, Spaderna S, Schmalhofer O, Hiendlmeyer E, Jung A, Kirchner T. Invasion and metastasis in colorectal cancer: epithelial-mesenchymal transition, mesenchymal-epithelial transition, stem cells and beta-catenin. Cells Tissues Organs. 2005;179:56-65. [PubMed] [DOI] |
| 28. | Meyer zum Büschenfelde D, Hoschützky H, Tauber R, Huber O. Molecular mechanisms involved in TFF3 peptide-mediated modulation of the E-cadherin/catenin cell adhesion complex. Peptides. 2004;25:873-883. [PubMed] [DOI] |
| 29. | Efstathiou JA, Noda M, Rowan A, Dixon C, Chinery R, Jawhari A, Hattori T, Wright NA, Bodmer WF, Pignatelli M. Intestinal trefoil factor controls the expression of the adenomatous polyposis coli-catenin and the E-cadherin-catenin complexes in human colon carcinoma cells. Proc Natl Acad Sci U S A. 1998;95:3122-3127. [PubMed] [DOI] |
| 30. | Chan VY, Chan MW, Leung WK, Leung PS, Sung JJ, Chan FK. Intestinal trefoil factor promotes invasion in non-tumorigenic Rat-2 fibroblast cell. Regul Pept. 2005;127:87-94. [PubMed] [DOI] |