修回日期: 2011-05-09
接受日期: 2011-05-17
在线出版日期: 2011-05-28
目的: 探讨香芹酚(carvacrol, CV)对人肝癌细胞(HepG2)的抗癌作用及其分子机制.
方法: 予以不同浓度的香芹酚(0.00、0.05、0.10、0.20、0.40 mmol/L)处理肝癌细胞HepG2后, 采用四甲基偶氮唑蓝(MTT)比色法检测细胞活力; Hoechst33258染色法及流式细胞仪(FCM)技术检测细胞凋亡; Western blot检测MAPK蛋白水平的变化.
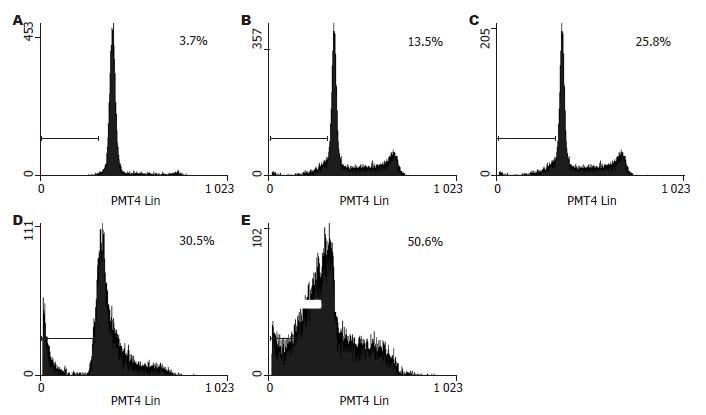
结果: 香芹酚对肝癌细胞株HepG2的抑制作用呈浓度依赖性及时间依赖性; 在作用24 h后, 随着浓度的递增, 细胞数目减少, 凋亡细胞逐步增多, 流式细胞仪检测的细胞凋亡率逐步升高, 随着香芹酚浓度的增加(0.00、0.05、0.10、0.2、0.40 mmol/L)细胞的凋亡比率明显升高, 依次为: 3.70%±0.22%、13.50%±1.59%、25.80%±2.18%、30.50%±0.25%、50.60%±3.81%. 进一步的Western blot实验表明, 香芹酚选择性地改变了MAPK家族成员的磷酸化, 对磷酸化ERK有明显的浓度依赖性抑制作用, 同时能激活p38的磷酸化, 而JNK激酶磷酸化却没有改变.
结论: 香芹酚可通过MAPK信号通路诱导肝癌细胞株HepG2凋亡.
引文著录: 殷清华, 庄英帜. 香芹酚对肝细胞癌HepG2细胞凋亡的诱导作用及其分子机制. 世界华人消化杂志 2011; 19(15): 1555-1560
Revised: May 9, 2011
Accepted: May 17, 2011
Published online: May 28, 2011
AIM: To investigate whether carvacrol induces apoptosis in human hepatocellular carcinoma cell line HepG2 and to explore possible molecular mechanism involved.
METHODS: After cultured HepG2 cells were incubated with different concentrations of carvacrol (0.00, 0.05, 0.10, 0.20, 0.40 mmol/L) for 24 or 48 h, cell viability was analyzed by MTT assay; cellular morphological alterations were observed after Hoechst33258 staining; apoptosis was detected by flow cytometry (FCM); and protein expression of mitogen-activated protein kinase (MAPK) was detected by Western blot.
RESULTS: Carvacrol suppressed the proliferation of HepG2 cells in a dose- and time-dependent manner. After treatment with carvacrol for 24 h, the number of apoptotic HepG2 cells increased with elevation of the concentration of carvacrol. Apoptotic cells showed typical ultrastructural features. FCM analysis indicated that the apoptosis rate of HepG2 cells increased with the increase in the concentration of carvacrol (0.00 mmol/L: 3.70% ± 0.22%; 0.05 mmol/L: 13.50% ± 1.59%; 0.10 mmol/L: 25.80% ± 2.18 %; 0.20 mmol/L: 30.50% ± 0.25%, 0.40 mmol/L: 50.60% ± 3.81%). Carvacrol selectively altered the phosphorylation levels of MAPK members: significantly inhibiting phosphorylation of ERK1/2 in a dose-dependent manner, increasing phosphorylation of p38, but not affecting that of JNK.
CONCLUSION: Carvacrol induces apoptosis of HepG2 cells via the MAPK signal transduction pathway.
- Citation: Yin QH, Zhuang YZ. Molecular mechanisms involved in carvacrol-induced apoptosis in human hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2011; 19(15): 1555-1560
- URL: https://www.wjgnet.com/1009-3079/full/v19/i15/1555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i15.1555
香芹酚(carvacrol, CV), 化学名为5-异丙基-2-甲基苯酚, 是一种单帖酚, 又称香荆芥酚、异麝香草酚、异丙基甲苯酚等, 普遍存在于各种天然植物挥发油中, 如百里香油、牛至油、香薷精油等[1-3]. 早在20世纪初国外就将其作为一种香料开始在食品中使用, 至今仍作为香料用于口腔用品、牙膏、爽身粉、香皂等日用品. 过去的研究表明, CV是一种广谱的抗真菌剂及抗细菌剂, 且具有抗氧化及驱虫等作用, 被用于饲料添加剂、抗氧剂、卫生杀菌剂、驱虫剂、防腐剂等[4-6], 又因其具有百里香的香味, 对人体无毒、无过敏, 用于食品添加剂、脱味剂等[4-6]. 近年来的研究发现, CV对黑色素瘤[7]、肺癌[8]、平滑肌肉瘤[9]、白血病[10]、乳腺癌[11]等多种肿瘤细胞的具有抑制增殖及诱导凋亡作用, 而目前对CV抗肿瘤的机制仍不清楚. 而CV对肝癌的凋亡诱导作用, 国内外尚未见文献报道. 我们通过研究CV对肝癌细胞系HepG2的诱导凋亡作用, 并初步探讨其诱导肿瘤细胞凋亡机制, 为临床应用的提供可靠的理论依据.
CV(CAS: 499-75-2)和四甲基偶氮盐购自美国Sigma公司; 1640培养基购自美国Gibco公司; 胎牛血清购自中国杭州四季青公司; Hoechst33258染色剂、细胞裂解液和BCA蛋白含量测定试剂购自江苏碧云天公司; 聚偏二氟乙烯印迹膜(PVDF膜)购自Millipore公司; ERK、p-ERK、JNK、p-JNK、p38、p-p38抗体均购自美国Cell Signaling Technology公司; 兔抗人β-actin IgG购自中国武汉博士德; Western blot荧光检测试剂盒(A, B液)购自中国北京中杉公司.
1.2.1 细胞培养: 人肝细胞癌细胞株HepG2系南华大学肿瘤研究所惠赠. 用含有100 mL/L胎牛血清的1640培养基培养, 同时加入100 U/L链霉素和100 U/L青霉素, 在37 ℃﹑50 mL/L CO2饱和湿度的CO2培养箱中培养, 用2.5 g/L胰蛋白酶进行消化传代. 取对数生长期细胞进行实验.
1.2.2 MTT法检测细胞存活率: 取对数生长期细胞消化, 计数, 6 000个/孔接种于96孔培养板(每孔100 μL), 置于37 ℃、50 mL/L CO2恒温培养箱中培养, 待细胞贴壁生长至90%融合后药物处理24或48 h, 弃原培养液, 每孔加入MTT (5 μg/L)20 μL培养4 h后, 弃培养液上清, 加入二甲基亚砜150 μL, 振荡10 min至结晶完全溶解后, 将96孔板放入酶标仪, 在570 nm波长处测定吸光度(A)值, 并根据吸光度, 计算细胞存活率, 同法重复3块培养板, 取A值均值, (细胞存活率 = 给药组吸光度/空白组吸光度×100%).
1.2.3 Hoechst33258核染色观察细胞凋亡形态: 将细胞接种于6孔板内, 给予不同药物浓度处理后, 加入新鲜配制的4%多聚甲醛于4 ℃固定细胞15 min, 用PBS洗2次, 加入5 g/L Hoechst33258染色液染色15 min, 用PBS洗1次, 立即于荧光显微镜下观察、照相.
1.2.4 流式细胞术检测细胞凋亡率: 不同浓度的CV(0.00、0.05、0.10、0.20、0.40 mmol/L)处理HepG2细胞24 h后, 离心收集细胞, PBS洗2次, 加入预冷的70%乙醇4 ℃固定过夜. 1 000 r/min离心弃去乙醇, PBS洗1次, 加入含100 mg/L碘化丙啶(PI)和2×104 U/L RNaseA染色液, 室温避光染色30 min, 过400目尼龙网, 用流式细胞仪测定细胞DNA含量, 以上实验重复3次.
1.2.5 Western blot检测蛋白变化: 经药物处理后的细胞, 用预冷的PBS洗涤2次, 收集细胞加入裂解缓冲液4 ℃裂解15 min, 收集细胞裂解液, 离心, 收集上清液. BCA试剂测定蛋白含量. 1×SDS凝胶加样缓冲液调蛋白浓度使各组一致, 上样于SDS-PAGE聚丙烯酰胺凝胶, 每孔20 μL蛋白进行电泳分离. 将蛋白转至PVDF膜(Millipore公司). 加入含5%脱脂奶粉封闭液过夜, 一抗(ERK、p-ERK、JNK、p-JNK、p38、p-p38 1:1 000, β-actin 1:500)4 ℃过夜, TBST洗膜3次, 每次20 min, 二抗(1:1 000)室温孵育4 h, TBST洗5遍, 用化学发光试剂盒检测蛋白的表达. 图片结果用图像分析软件(AlphaimagerTM 2200)分析, 以处理组灰度面积的乘积/总蛋白(ERK、p-ERK、JNK)灰度面积的乘积反映相对蛋白表达丰度或蛋白质磷酸化水平. 以上实验重复3次.
统计学处理 所有实验结果以mean±SD表示, 实验组间统计学差异显著性用SPSS13.0统计软件作单因素方差分析(ANOVA), 对照组均数与实验组均数间的比较用LSD法, 各组均数间的两两比较用SNK法, P<0.05表示统计学上有差异显著性.
HepG2细胞经不同浓度的CV(0.00、0.05、0.10、0.20、0.40 mmol/L)作用24及48 h后, MTT试验结果显示(表1), 随药物浓度及培养时间的增加, 细胞存活率逐渐降低, 与对照组比较, 差异有统计学意义(n = 5, P<0.05). 结果表明CV对肝癌细胞株HepG2细胞的抑制作用呈浓度依赖性及时间依赖性.
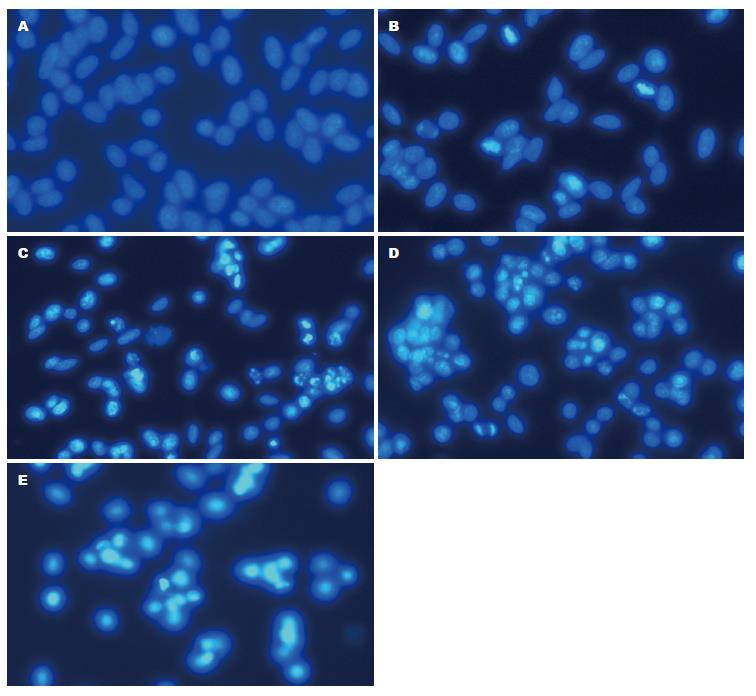
Hoechst33258核染色的结果显示, 正常的HepG2细胞染色质分布均匀, 为低强度蓝色荧光. 经不同浓度的CV处理后的HepG2细胞呈现典型的凋亡特征, 随着浓度的增加, 细胞数量明显减少, 细胞生长密度逐渐变疏, 呈现浓缩致密的固缩形态或颗粒状态的凋亡细胞数增加(图1). 与Hoechst33258核染色的结果相同, PI染色流式细胞仪(FCM)检测细胞凋亡率的结果显示, 不同浓度的CV(0.00、0.05、0.10、0.20、0.40 mmol/L)作用于HepG2细胞24 h, 其亚二倍体DNA含量细胞百分率明显升高, 依次为: 3.70%±0.22%、13.50%±1.59%、25.80%±2.18%、30.50%±0.25%、50.60%±3.81%(图2).
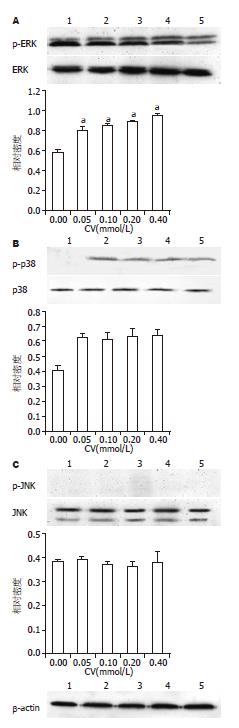
CV浓度依赖性抑制了ERK的磷酸化, 同时激活p38的磷酸化, 而JNK的磷酸化水平未见明显变化, 表明ERK及p38通路参与了CV对肝癌细胞的增殖与凋亡的调控(图3).
肿瘤的病因非常复杂, 细胞信号转导系统异常与肿瘤的发生发展密切相关[12]. 丝裂原活化的蛋白激酶(mitogen-activated protein kinase, MAPK)是一组可被多种信号激活的丝/苏氨酸激酶. 经双重磷酸化激活后可参与细胞的多种生物活性, 如调节基因转录, 诱导细胞凋亡、调节细胞周期等. 而MAPK对细胞凋亡的诱导作用, 是近年来研究的重点, 尤其是对肿瘤细胞凋亡的诱导作用, 更是人们关注的焦点[13,14]. 因此, 以此信号途径为靶点, 可以干预肿瘤进程, 作为肿瘤治疗的策略之一[15].
丝裂原活化的蛋白激酶(mitogen-activated protein kinase, MAPK)信号转导通路是细胞信号转导中的重要组成部分, 具有调节细胞增殖、凋亡以及分化的功能[16]. 其中最重要的3条通路为ERK、JNK以及P38通路[17,18]. MAPK级联具有高度保守性, 采用三级激酶级联传递信号: 细胞外刺激通过某些环节使MAPK激酶激酶(mitogen-activated protein kinases kinase kinase, MAPKKK)激活, 转而激活MAPK激酶(mitogen-activated protein kinases kinase, MAPKK), 然后再通过双位点磷酸化激活MAPK. MAPK活化后, 磷酸化其下游底一转录因子、蛋白激酶、酶、结黏附、迁移等过程, 继而诱导肿瘤细胞的凋亡. ERK通路的激活具有抗凋亡作用, ERK活性的降低具有促进肿瘤细胞凋亡的作用, 在许多肿瘤组织中ERK通路都处于异常激活状态[19,20]. JNK及p38信号转导通路参与多种凋亡反应[21-26], 活化的p38可增强c-Myc表达[27]、磷酸化p53[28]、参与Fas/FasL[29]介导的凋亡. 而如今已临床中已有大量以MAPK通路为靶点的颇有前景的抗肿瘤药物[30-32].
CV, 又名异麝香草酚, 是牛至油及百里香油等的主要成分[2,3]. 通常作为一种安全的食品添加剂, 例如糖果, 饮料和口香糖等[2]. 已有报道CV具有广泛的生物学活性, 如抗炎[33]、抗肿瘤[34]及抗氧化作用[35]. 先已证实CV具有抗鼠黑色素瘤细胞B16[7]、慢性髓性白血病细胞K562[10]、非小细胞肺癌A549[8]及转移性乳腺癌MDA-MB231[11]等增殖及诱导凋亡作用. 对于其机制的研究仅一篇文献报道CV可通过下调Bcl-2及上调Bax的表达诱导转移性乳腺癌细胞MDA-MB321细胞凋亡[11]. 由于CV具有多效、低毒的特性, 并广泛存在于植物界, 他在医学上越来越多的研究受到人们的关注. 目前国内外还未见文献报道CV对肝癌的研究, 在此基础上, 我们大胆选择Bcl-2的上游信号转导通路MAPK信号转导通路为靶点, 以肝癌细胞株HepG2为研究对象, 来研究CV酸对肝癌胞的诱导凋亡作用.
本研究表明, CV可以抑制肝癌HepG2细胞的增殖, 并呈一定的浓度-效应和时间-效应依赖关系, 核染色及流式细胞仪分析显示CV可以明显地诱导HepG2细胞凋亡, 随着浓度的增加, 细胞数量逐渐减少, 产生明显的染色质凝聚和核裂解的凋亡细胞逐渐增加, 细胞凋亡率逐渐增高. 在进一步探讨CV诱导HepG2细胞凋亡的机制时, 我们选择了MAPK信号转导通路进行研究. 通过Western blot分析观察CV作用于HepG2细胞后对该信号分子活性变化的影响, 来研究他是否可能通过这一途径引起HepG2细胞的凋亡, 在不同浓度药物作用15 min后, 3种激酶的表达水平都没有明显的改变, 而是改变了他们磷酸化的程度. 其中ERK的磷酸化受到明显的抑制, 且呈现出浓度依赖性; 在本实验的浓度范围内p38 MAPK只是被激活, 而其作用是否具有浓度依赖性抑或激活时间有关需要进一步探讨; JNKMAPK在本实验中没有发生磷酸化改变. 由此可推测CV的作用抑制了ERK的活性, 并通过激活p38诱导肝癌HepG2细胞凋亡, 而JNK信号通路的没有参与. 而是否有其他信号转导通路或其他有关其诱导肿瘤细胞凋亡的其他机制有待于后期的实验研究进一步探讨.
总之, 本实验证实CV能诱导肝癌细胞凋亡, ERK及p38 MAPK信号通路可能部分参与了CV诱导肿瘤细胞凋亡的过程, 为进一步其用于临床应用提供了实验依据, 更深的机制需进一步的实验研究.
研究表明香芹酚对多种肿瘤均有抑制作用. 丝裂原活化的蛋白激酶(MAPK)信号转导通路是细胞信号转导中的重要组成部分, 具有调节细胞增殖、凋亡以及分化的功能, 已成为抗肿瘤治疗的一个新靶点. 探讨香芹酚诱导肝癌细胞凋亡与其影响磷酸化MAPK激酶蛋白表达的关系有助于揭示香芹酚的抗癌机制, 为将来香芹酚应用临床治疗肝癌提供理论依据.
程斌, 教授, 华中科技大学同济医学院附属同济医院消化内科
香芹酚抗肿瘤效应在早期就被证实, 经过一系列的实验研究表明香芹酚对多种肿瘤细胞均具有抑制作用, 但其作用机制并不明确, 研究香芹酚对肿瘤细胞中信号传导途径的调节作用可成为研究其抗癌活性机制的一个重要环节.
研究已发现香芹酚具有抗鼠黑色素瘤细胞B16、慢性髓性白血病细胞K562、非小细胞肺癌A549及转移性乳腺癌MDA-MB231等细胞增殖及诱导凋亡作用.
本研究发现ERK及p38 MAPK信号通路可能部分参与了香芹酚诱导肿瘤细胞凋亡的过程, 从而抑制肝癌细胞的增殖.
探讨香芹酚诱导肝癌细胞凋亡及其与MAPK信号通路激酶蛋白表达的关系有助于揭示香芹酚抗癌的机制, 为进一步其用于临床应用提供了实验依据.
本研究选题新颖, 思路明确, 方法较先进, 结论较明确, 有较好的学术价值.
编辑: 李薇 电编:何基才
| 1. | Martins R, Neves M, Silvestre A, Silva A, Cavaleiro J. Oxidation of aromatic monoterpenes with hydrogen peroxide catalysed by Mn (III) porphyrin complexes. J Mol Catal A Chem. 1999;137:41-47. [DOI] |
| 2. | Lampronti I, Saab AM, Gambari R. Antiproliferative activity of essential oils derived from plants belonging to the Magnoliophyta division. Int J Oncol. 2006;29:989-995. [PubMed] |
| 3. | Kiskó G, Roller S. Carvacrol and p-cymene inactivate Escherichia coli O157: H7 in apple juice. BMC Microbiol. 2005;5:36. [PubMed] [DOI] |
| 4. | Baser KH. Biological and pharmacological activities of carvacrol and carvacrol bearing essential oils. Curr Pharm Des. 2008;14:3106-3119. [PubMed] [DOI] |
| 5. | Aligiannis N, Kalpoutzakis E, Mitaku S, Chinou IB. Composition and antimicrobial activity of the essential oils of two Origanum species. J Agric Food Chem. 2001;49:4168-4170. [PubMed] [DOI] |
| 6. | Sökmen M, Serkedjieva J, Daferera D, Gulluce M, Polissiou M, Tepe B, Akpulat HA, Sahin F, Sokmen A. In vitro antioxidant, antimicrobial, and antiviral activities of the essential oil and various extracts from herbal parts and callus cultures of Origanum acutidens. J Agric Food Chem. 2004;52:3309-3312. [PubMed] [DOI] |
| 7. | He L, Mo H, Hadisusilo S, Qureshi AA, Elson CE. Isoprenoids suppress the growth of murine B16 melanomas in vitro and in vivo. J Nutr. 1997;127:668-674. [PubMed] |
| 8. | Koparal AT, Zeytinoglu M. Effects of Carvacrol on a Human Non-Small Cell Lung Cancer (NSCLC) Cell Line, A549. Cytotechnology. 2003;43:149-154. [PubMed] [DOI] |
| 9. | Karkabounas S, Kostoula OK, Daskalou T, Veltsistas P, Karamouzis M, Zelovitis I, Metsios A, Lekkas P, Evangelou AM, Kotsis N. Anticarcinogenic and antiplatelet effects of carvacrol. Exp Oncol. 2006;28:121-125. [PubMed] |
| 10. | Horvathova E, Turcaniova V, Slamenova D. Comparative study of DNA-damaging and DNA-protective effects of selected components of essential plant oils in human leukemic cells K562. Neoplasma. 2007;54:478-483. [PubMed] |
| 11. | Arunasree KM. Anti-proliferative effects of carvacrol on a human metastatic breast cancer cell line, MDA-MB 231. Phytomedicine. 2010;17:581-588. [PubMed] [DOI] |
| 13. | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26:3291-3310. [PubMed] [DOI] |
| 14. | Wong KK. Recent developments in anti-cancer agents targeting the Ras/Raf/ MEK/ERK pathway. Recent Pat Anticancer Drug Discov. 2009;4:28-35. [PubMed] [DOI] |
| 16. | Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science. 2002;298:1911-1912. [PubMed] [DOI] |
| 17. | Fecher LA, Amaravadi RK, Flaherty KT. The MAPK pathway in melanoma. Curr Opin Oncol. 2008;20:183-189. [PubMed] [DOI] |
| 18. | Junttila MR, Li SP, Westermarck J. Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival. FASEB J. 2008;22:954-965. [PubMed] [DOI] |
| 19. | Huynh H, Nguyen TT, Chow KH, Tan PH, Soo KC, Tran E. Over-expression of the mitogen-activated protein kinase (MAPK) kinase (MEK)-MAPK in hepatocellular carcinoma: its role in tumor progression and apoptosis. BMC Gastroenterol. 2003;3:19. [PubMed] [DOI] |
| 20. | Tommasi S, Pinto R, Pilato B, Paradiso A. Molecular pathways and related target therapies in liver carcinoma. Curr Pharm Des. 2007;13:3279-3287. [PubMed] [DOI] |
| 21. | Bogoyevitch MA, Kobe B. Uses for JNK: the many and varied substrates of the c-Jun N-terminal kinases. Microbiol Mol Biol Rev. 2006;70:1061-1095. [PubMed] [DOI] |
| 22. | Dhanasekaran DN, Reddy EP. JNK signaling in apoptosis. Oncogene. 2008;27:6245-6251. [PubMed] [DOI] |
| 23. | Kalra N, Kumar V. c-Fos is a mediator of the c-myc-induced apoptotic signaling in serum-deprived hepatoma cells via the p38 mitogen-activated protein kinase pathway. J Biol Chem. 2004;279:25313-25319. [PubMed] [DOI] |
| 24. | Han J, Jiang Y, Li Z, Kravchenko VV, Ulevitch RJ. Activation of the transcription factor MEF2C by the MAP kinase p38 in inflammation. Nature. 1997;386:296-299. [PubMed] [DOI] |
| 25. | Ghatan S, Larner S, Kinoshita Y, Hetman M, Patel L, Xia Z, Youle RJ, Morrison RS. p38 MAP kinase mediates bax translocation in nitric oxide-induced apoptosis in neurons. J Cell Biol. 2000;150:335-347. [PubMed] [DOI] |
| 26. | Jiang DJ, Jia SJ, Dai Z, Li YJ. Asymmetric dimethylarginine induces apoptosis via p38 MAPK/caspase-3-dependent signaling pathway in endothelial cells. J Mol Cell Cardiol. 2006;40:529-539. [PubMed] [DOI] |
| 27. | Stoneley M, Chappell SA, Jopling CL, Dickens M, MacFarlane M, Willis AE. c-Myc protein synthesis is initiated from the internal ribosome entry segment during apoptosis. Mol Cell Biol. 2000;20:1162-1169. [PubMed] [DOI] |
| 28. | Bulavin DV, Saito S, Hollander MC, Sakaguchi K, Anderson CW, Appella E, Fornace AJ. Phosphorylation of human p53 by p38 kinase coordinates N-terminal phosphorylation and apoptosis in response to UV radiation. EMBO J. 1999;18:6845-6854. [PubMed] [DOI] |
| 29. | Kornmann M, Ishiwata T, Kleeff J, Beger HG, Korc M. Fas and Fas-ligand expression in human pancreatic cancer. Ann Surg. 2000;231:368-379. [PubMed] [DOI] |
| 30. | Johnston SR, Leary A. Lapatinib: a novel EGFR/HER2 tyrosine kinase inhibitor for cancer. Drugs Today (Barc). 2006;42:441-453. [PubMed] [DOI] |
| 31. | Wilhelm SM, Carter C, Tang L, Wilkie D, McNabola A, Rong H, Chen C, Zhang X, Vincent P, McHugh M. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res. 2004;64:7099-7109. [PubMed] [DOI] |
| 33. | Periago PM, Moezelaar R. Combined effect of nisin and carvacrol at different pH and temperature levels on the viability of different strains of Bacillus cereus. Int J Food Microbiol. 2001;68:141-148. [PubMed] [DOI] |
| 34. | Stammati A, Bonsi P, Zucco F, Moezelaar R, Alakomi HL, von Wright A. Toxicity of selected plant volatiles in microbial and mammalian short-term assays. Food Chem Toxicol. 1999;37:813-823. [PubMed] [DOI] |
| 35. | Mastelić J, Jerković I, Blazević I, Poljak-Blazi M, Borović S, Ivancić-Baće I, Smrecki V, Zarković N, Brcić-Kostic K, Vikić-Topić D. Comparative study on the antioxidant and biological activities of carvacrol, thymol, and eugenol derivatives. J Agric Food Chem. 2008;56:3989-3996. [PubMed] [DOI] |