修回日期: 2011-04-26
接受日期: 2011-05-05
在线出版日期: 2011-05-18
目的: 研究蛋白酶体抑制剂硼替佐米对胃癌SGC7901细胞凋亡及细胞周期分布的影响, 并进一步探讨其作用机制.
方法: 1-500 nmol/L的硼替佐米作用于人胃癌SGC7901细胞24-48 h, MTT法检测细胞存活率, 流式细胞术PI染色检测细胞凋亡. Western blot检测多聚ADP-核糖聚合酶(PARP)和caspase-3裂解及p-Akt表达水平的变化.
结果: 硼替佐米以浓度和时间依赖方式抑制SGC7901细胞增殖, 48 h的IC50值为67.39 nmol/L. 细胞凋亡及周期分析显示, 硼替佐米作用24、48 h均可诱导细胞发生G2/M期阻滞. 硼替佐米作用细胞24 h时细胞凋亡不明显, 48 h可见明显细胞凋亡. Western blot结果发现, 60、180 nmol/L硼替佐米在24 h仅轻度裂解caspase-3和PARP, 48 h时caspase-3和PARP明显被裂解. 进一步研究发现, 硼替佐米作用细胞48 h可明显抑制p-Akt水平.
结论: 硼替佐米可抑制SGC7901细胞增殖, 诱导细胞凋亡及发生G2/M期阻滞, 其抗肿瘤活性可能与抑制PI3K/Akt通路活性有关.
引文著录: 刘静, 詹运洪, 刘云鹏, 曲秀娟, 徐玲, 张晔, 侯科佐, 胡雪君. 蛋白酶体抑制剂硼替佐米对胃癌SGC7901细胞的抗肿瘤作用及其机制. 世界华人消化杂志 2011; 19(14): 1441-1445
Revised: April 26, 2011
Accepted: May 5, 2011
Published online: May 18, 2011
AIM: To investigate the anti-tumor effect of bortezomib, a proteasome inhibitor, on human gastric cancer SGC7901 cells and to explore possible mechanism involved.
METHODS: Human gastric cancer SGC7901 cells were cultured and treated with different concentrations of bortezomib (1-500 nmol/L) for 24-48 h. Cell viability was determined by MTT assay. Apoptosis was detected by flow cytometry. The cleavage of PARP and caspase-3 and level of phosphor-Akt were determined by Western blot.
RESULTS: Bortezomib inhibited the viability of SGC7901 cells in a dose- and time-dependent manner. The IC50 value at 48 h was 67.39 nmol/L. Treatment with 60 or 180 nmol/L of bortezomib induced cell cycle arrest at G2/M phase at both 24 and 48 h but induced apoptosis only at 48 h. The cleavage of caspase-3 and PARP was observed in cells treated with 60 or 180 nmol/L of bortezomib for 48 h. Treatment with bortezomib for 48 h down-regulated the level of phosphor-Akt in SGC7901 cells.
CONCLUSION: Bortezomib induced apoptosis and cell cycle arrest at G2/M phase by inhibiting the activity of the PI3K/Akt signaling pathway in human gastric cancer SGC7901 cells.
- Citation: Liu J, Zhan YH, Liu YP, Qu XJ, Xu L, Zhang Y, Hou KZ, Hu XJ. In vitro antitumor effect of the proteasome inhibitor bortezomib on human gastric cancer SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1441-1445
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1441.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1441
硼替佐米(bortezomib)是一种新型蛋白酶体抑制剂, 可通过抑制26S蛋白酶体功能, 阻止蛋白质经泛素-蛋白酶体途径降解, 调控多种细胞的生理及病理过程[1]. 既往研究结果提示硼替佐米对多种肿瘤细胞有很好的抗肿瘤活性[2-4]. 目前硼替佐米已被美国食品与药品管理局批准用于多发性骨髓瘤和套细胞淋巴瘤的治疗[5]. 除多发性骨髓瘤和淋巴瘤外, 硼替佐米单独或与化疗药联合治疗晚期胃癌的Ⅱ期临床试验结果也显示出较好的疗效[6,7]. 我们之前的研究发现低剂量的硼替佐米可增强胃癌细胞对肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor -related apoptosis-inducing ligand, TRAIL)诱导凋亡的敏感性, 逆转耐药[8,9]. 但关于硼替佐米单独对胃癌细胞的抗肿瘤作用及机制国内尚无报道. 本研究探讨了硼替佐米对胃癌SGC7901细胞增殖、凋亡及细胞周期分布的影响, 并探讨了对PI3K/Akt通路活性的影响, 进而探讨硼替佐米诱导胃癌细胞凋亡的机制.
硼替佐米购自Millennium Pharmaceuticals公司, RPMI 1640培养基购自Gibco公司; 胎牛血清购自天津血液研究所; 碘化丙啶(PI)购自Sigma-Aldrich公司; RNaseA购自Amresco公司; 抗caspase-3、PARP及p-Akt抗体购自Cell signaling公司, 抗Akt及actin抗体购自Santa Cruz公司. 辣根过氧化物酶标记的二抗购于北京中杉金桥生物技术有限公司; ECL试剂盒购于PIERCE公司.
1.2.1 细胞培养: 人胃癌SGC7901细胞株为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清, 青霉素(100 kU/L)和链霉素(100 g/L)的RPMI 1640培养基中, 于37 ℃, 50 mL/L CO2, 饱和湿度的培养箱内培养. 细胞常规每2-3 d传代1次, 采用对数生长期细胞用于实验.
1.2.2 MTT法测定细胞活力: 取对数生长期细胞, 常规胰酶消化成单个细胞悬液, 将细胞浓度调至5×107/L, 接种于96孔板, 于培养箱内孵育过夜后, 每孔加入不同浓度的硼替佐米孵育24或48 h, 之后加入20 μL MTT(5 g/L), 继续孵育4 h. 吸走上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长测定吸光度(A)值. 按照下列公式计算细胞活力: 细胞活力(%) = (实验组A值/对照组A值)×100%.
1.2.3 流式细胞术检测细胞凋亡: 细胞以2×105个/孔的密度接种于6孔板, 孵育过夜后加入不同浓度的硼替佐米, 孵育24或48 h后收集细胞, 冷PBS洗2次, 700 mL/L冷乙醇固定过夜. 之后再用PBS洗两次, 加入20 mg/L RNaseA, 37 ℃孵育30 min, 之后加入10 mg/L PI, 避光孵育30 min. 使用流式细胞术进行检测, FL2-A代表DNA含量, WinMDI软件进行数据分析.
1.2.4 Western blot检测蛋白表达变化: 收集细胞, PBS洗2次, 加入1% Triton裂解液[1% Triton X-100, 50 mmol/L Tris-Cl(pH7.4), 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4, 1 mmol/L PMSF, 2 mg/L aprotinin], 冰上裂解30 min, 之后高速离心(15 000 g)30 min, 取上清, Lowry法进行蛋白定量. 将样品与3×样品缓冲液混合后, 煮沸5 min, 于10%-12%的SDS-聚丙烯凝胶中进行电泳, 之后电转移至PVDF膜上, 5%脱脂牛奶封闭1 h, 加入一抗4 ℃孵育过夜. TBST[10 mmol/L Tris (pH7.4), 150 mmol/L NaCl, 0.1% Tween 20]洗4次后, 加入辣根过氧化物酶标记的二抗, 室温下孵育30 min, TBST洗后, ECL法显色.
统计学处理 采用SPSS13.0统计软件进行统计学分析. 所有数据均为3次独立实验结果, 以mean±SD表示. 两组间差异采用t检验, P<0.05 认为有统计学意义.
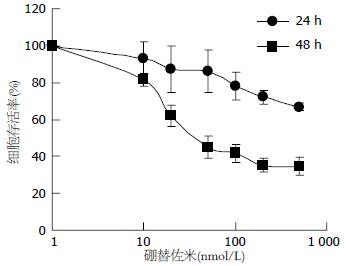
1-500 nmol/L硼替佐米作用于SGC7901细胞24、48 h, 随着药物浓度的增大, 细胞活力逐渐下降, 作用24 h细胞活力抑制率未达到50%, 作用48 h的IC50值为67.39 nmol/L(图1). 这些数据提示硼替佐米以剂量及时间依赖方式抑制SGC7901细胞增殖.
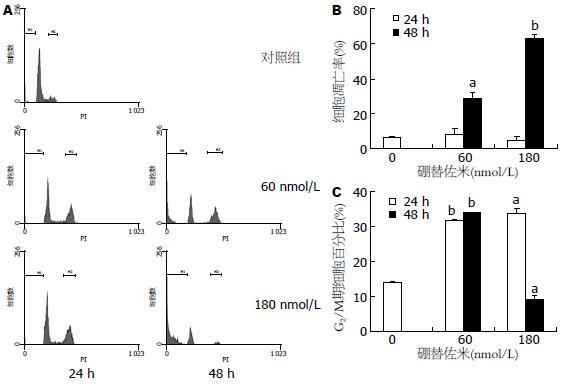
采用60、180 nmol/L硼替佐米分别作用细胞24、48 h, 在24 h时凋亡细胞百分比无明显升高, 48 h 的细胞凋亡率分别为29.13±2.71%和62.71%±2.27%, 明显高于对照组(P<0.05或P<0.01, 图2). 60及180 nmol/L硼替佐米分别作用细胞24 h后, G2/M期细胞比例明显升高(P<0.01或<0.05). 60 nmol/L硼替佐米作用细胞48 h, G2/M期细胞比例也明显高于对照组(P<0.01); 180 nmol/L硼替佐米作用48 h后, G2/M期细胞比例低于正常对照组(P<0.05).
60、180 nmol/L硼替佐米作用细胞24 h, caspase-3和PARP无明显裂解, caspase-3前体无明显变化. 药物作用细胞48 h后, caspase-3和PARP明显被裂解, 同时caspase-3及PARP前体明显减少(图3). 这些数据提示硼替佐米可诱导SGC7901细胞凋亡.
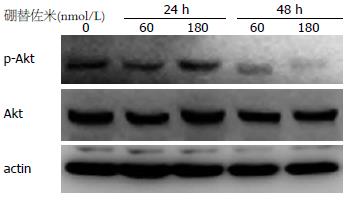
60及180 nmol/L硼替佐米作用细胞24及48 h, 在24 h时p-Akt水平无明显变化, 48 h时p-Akt水平明显下降(图4), 提示Akt通路活性受抑.
泛素-蛋白酶体通路是细胞内蛋白质降解的主要途径, 细胞内80%以上的蛋白质经此途径降解[10]. 在泛素分子和酶的作用下, 细胞周期调控因子、转录因子、细胞表面受体以及突变或受损蛋白质等均可发生多聚泛素化, 经蛋白酶体降解[10]. 近年来的研究表明, 抑制蛋白酶体功能可抑制肿瘤细胞增殖、诱导凋亡, 蛋白酶体抑制剂因此成为抗肿瘤药物研发的热点[11-14]. 目前开发出来的蛋白酶体抑制剂从结构上大致可分为5类, 包括: 醛基肽类(peptide aldehydes)、乙烯砜肽类(peptide vinyl sulfones)、硼酸肽类(peptide boronates)、环氧酮肽类及β-内酯类[15]. 硼替佐米属于硼酸肽类化合物, 可选择性作用于26S蛋白酶体, 可逆性地抑制蛋白酶体活性, 阻断多种蛋白的降解过程, 最终影响细胞周期进程, 诱导细胞凋亡[16-18]. 除单独作用以外, 硼替佐米还可与其他抗肿瘤药联用, 增强药物的抗肿瘤活性[19-23]. 但是有关硼替佐米对胃癌细胞的抗肿瘤作用研究较少. 在本研究中, 我们报道了硼替佐米对胃癌SGC7901细胞有明显的抗肿瘤作用, 提示硼替佐米很可能成为胃癌的有效治疗药物.
有报道揭示, 硼替佐米主要通过诱导细胞凋亡和周期阻滞发挥抗肿瘤作用[24,25]. 有报道称, 硼替佐米可抑制神经母细胞瘤和胶质瘤细胞增殖, 诱导细胞凋亡和G2/M期阻滞[26,27]. 本研究中60及180 nmol/L硼替佐米作用细胞24 h时, 细胞活力仅轻度下降, 细胞凋亡不明显, 以G2/M期阻滞为主; 继续作用至48 h, 细胞活力明显受抑, 低剂量(60 nmol/L)硼替佐米可同时诱导G2/M期阻滞和凋亡, 而高剂量(180 nmol/L)硼替佐米作用下大多数细胞发生凋亡, 因此G2/M期细胞比例减少, 周期阻滞消失. 这些研究结果提示, 在胃癌细胞中硼替佐米诱导的G2/M期阻滞是凋亡发生的前提条件, 短时间作用下细胞以周期阻滞为主, 随着作用时间的延长, 发生周期阻滞的细胞逐渐走向凋亡.
虽然硼替佐米的抗肿瘤作用已经在多种肿瘤细胞中证实, 但是其作用机制非常复杂, 在不同的细胞中可能涉及不同的分子机制[28]. 既往研究认为硼替佐米主要通过抑制核因子-κB(nuclear factor-kappa B, NF-κB)通路活性, 发挥其抗肿瘤作用[29,30]. 近年来的研究表明, 除NF-κB通路之外, PI3K/Akt通路也参与了硼替佐米的抗肿瘤过程[31,32]. PI3K/Akt通路是细胞内调控增殖及凋亡的重要信号传导通路, 该通路的过度活化可导致细胞对抗肿瘤药物诱导的凋亡耐药[33]. 有报道表明, 硼替佐米可以通过抑制细胞内Akt通路活性, 诱导肝癌细胞凋亡, 提示Akt可能是硼替佐米的作用靶点之一[34,35]. 本研究中静息状态下的胃癌细胞内可检测到的Akt的磷酸化, 硼替佐米作用24 h磷酸化Akt水平变化不明显, 此时细胞凋亡也不明显; 继续作用至48 h后, Akt的磷酸化水平被明显抑制, 同时细胞凋亡明显增加. 这些结果强烈提示硼替佐米可能通过抑制胃癌细胞内PI3K/Akt通路活性, 诱导细胞凋亡.
总之, 我们的研究证实了在胃癌SGC7901细胞中, 硼替佐米可抑制细胞增殖, 诱导细胞发生G2/M期阻滞, 进而诱导细胞凋亡. 这种抗肿瘤作用可能与其抑制PI3K/Akt通路活性有关. 本研究结果为进一步明确硼替佐米的抗肿瘤作用机制 提供理论依据, 并有可能为晚期胃癌提供新的治疗手段.
硼替佐米作为一种新型蛋白酶体抑制剂, 临床研究结果提示单药或与化疗联合对晚期胃癌有较好的疗效. 研究硼替佐米对胃癌的抗肿瘤作用机制, 对于进一步提高硼替佐米治疗胃癌的疗效, 将其更好的应用于临床具有重要意义.
陈其奎, 教授, 中山大学附属第二医院消化内科
近年来的研究表明, 抑制蛋白酶体功能可抑制肿瘤细胞增殖、诱导凋亡, 蛋白酶体抑制剂因此成为抗肿瘤药物研发的热点.
既往研究报道低剂量硼替佐米可增强肿瘤坏死因子相关凋亡诱导配体(TRAIL)对胃癌细胞的抗肿瘤作用, 但硼替佐米单药对胃癌细胞的影响尚不清楚.
本研究首次报道了硼替佐米可诱导胃癌SGC7901细胞凋亡及细胞周期阻滞, 并对PI3K/Akt通路活性有抑制作用, 提示PI3K/Akt通路参与了硼替佐米对胃癌细胞的抗肿瘤过程.
本研究结果为硼替佐米治疗胃癌提供新的理论基础, 为将硼替佐米更好的用于胃癌的临床治疗提供依据.
本文选题恰当, 内容详实, 具有较好的理论价值.
编辑: 李薇 电编:何基才
| 1. | Adams J. Development of the proteasome inhibitor PS-341. Oncologist. 2002;7:9-16. [PubMed] [DOI] |
| 2. | Luo P, Lin M, Lin M, Zhu D, Wang Z, Shen J, Yang B, He Q. Bortezomib induces apoptosis in human neuroblastoma CHP126 cells. Pharmazie. 2010;65:213-218. [PubMed] |
| 3. | Ling X, Calinski D, Chanan-Khan AA, Zhou M, Li F. Cancer cell sensitivity to bortezomib is associated with survivin expression and p53 status but not cancer cell types. J Exp Clin Cancer Res. 2010;29:8. [PubMed] [DOI] |
| 4. | Wang Y, Rishi AK, Puliyappadamba VT, Sharma S, Yang H, Tarca A, Dou QP, Lonardo F, Ruckdeschel JC, Pass HI. Targeted proteasome inhibition by Velcade induces apoptosis in human mesothelioma and breast cancer cell lines. Cancer Chemother Pharmacol. 2010;66:455-466. [PubMed] [DOI] |
| 5. | Sterz J, von Metzler I, Hahne JC, Lamottke B, Rademacher J, Heider U, Terpos E, Sezer O. The potential of proteasome inhibitors in cancer therapy. Expert Opin Investig Drugs. 2008;17:879-895. [PubMed] [DOI] |
| 6. | Shah MA, Power DG, Kindler HL, Holen KD, Kemeny MM, Ilson DH, Tang L, Capanu M, Wright JJ, Kelsen DP. A multicenter, phase II study of Bortezomib (PS-341) in patients with unresectable or metastatic gastric and gastroesophageal junction adenocarcinoma. Invest New Drugs. 2010; Jun 25. [Epub ahead of print]. [PubMed] |
| 7. | Jatoi A, Dakhil SR, Foster NR, Ma C, Rowland KM, Moore DF, Jaslowski AJ, Thomas SP, Hauge MD, Flynn PJ. Bortezomib, paclitaxel, and carboplatin as a first-line regimen for patients with metastatic esophageal, gastric, and gastroesophageal cancer: phase II results from the North Central Cancer Treatment Group (N044B). J Thorac Oncol. 2008;3:516-520. [PubMed] [DOI] |
| 8. | Liu J, Qu XJ, Xu L, Zang Y, Qu JL, Hou KZ, Liu YP. Bortezomib synergizes TRAIL-induced apoptosis in gastric cancer cells. Dig Dis Sci. 2010;55:3361-3368. [PubMed] [DOI] |
| 9. | 刘 静, 徐 玲, 刘 云鹏, 曲 秀娟, 张 晔, 侯 科佐, 胡 雪君, 姜 又红. 硼替佐米抑制PI3K/Akt通路增强胃癌细胞对TRAIL诱导凋亡的敏感性. 世界华人消化杂志. 2010;18:1854-1859. [DOI] |
| 10. | Sorokin AV, Kim ER, Ovchinnikov LP. Proteasome system of protein degradation and processing. Biochemistry (Mosc). 2009;74:1411-1442. [PubMed] [DOI] |
| 11. | Testa U. Proteasome inhibitors in cancer therapy. Curr Drug Targets. 2009;10:968-981. [PubMed] [DOI] |
| 12. | You BR, Park WH. Proteasome inhibition by MG132 induces growth inhibition and death of human pulmonary fibroblast cells in a caspase-independent manner. Oncol Rep. 2011;25:1705-1712. [PubMed] |
| 13. | Driscoll JJ, Minter A, Driscoll DA, Burris JK. The ubiquitin+proteasome protein degradation pathway as a therapeutic strategy in the treatment of solid tumor malignancies. Anticancer Agents Med Chem. 2011;11:242-246. [PubMed] |
| 14. | Kuhn DJ, Z Orlowski R, C Bjorklund C. Second generation proteasome inhibitors: carfilzomib and immunoproteasome-specific inhibitors (IPSIs). Curr Cancer Drug Targets. 2011;11:285-295. [PubMed] [DOI] |
| 15. | Adams J. The development of proteasome inhibitors as anticancer drugs. Cancer Cell. 2004;5:417-421. [PubMed] [DOI] |
| 16. | Russo A, Bronte G, Fulfaro F, Cicero G, Adamo V, Gebbia N, Rizzo S. Bortezomib: a new pro-apoptotic agent in cancer treatment. Curr Cancer Drug Targets. 2010;10:55-67. [PubMed] [DOI] |
| 18. | Shen L, Au WY, Wong KY, Shimizu N, Tsuchiyama J, Kwong YL, Liang RH, Srivastava G. Cell death by bortezomib-induced mitotic catastrophe in natural killer lymphoma cells. Mol Cancer Ther. 2008;7:3807-3815. [PubMed] [DOI] |
| 19. | Seki N, Toh U, Sayers TJ, Fujii T, Miyagi M, Akagi Y, Kusukawa J, Kage M, Shirouzu K, Yamana H. Bortezomib sensitizes human esophageal squamous cell carcinoma cells to TRAIL-mediated apoptosis via activation of both extrinsic and intrinsic apoptosis pathways. Mol Cancer Ther. 2010;9:1842-1851. [PubMed] [DOI] |
| 20. | Pasquini L, Petronelli A, Petrucci E, Saulle E, Mariani G, Scambia G, Benedetti-Panici P, Greggi S, Cognetti F, Testa U. Primary ovarian cancer cells are sensitive to the proaptotic effects of proteasome inhibitors. Int J Oncol. 2010;36:707-713. [PubMed] |
| 21. | Pitts TM, Morrow M, Kaufman SA, Tentler JJ, Eckhardt SG. Vorinostat and bortezomib exert synergistic antiproliferative and proapoptotic effects in colon cancer cell models. Mol Cancer Ther. 2009;8:342-349. [PubMed] [DOI] |
| 22. | Combined effects of the proteasome inhibitor bortezomib and Hsp70 inhibitors on the B16F10 melanoma cell line. Mol Med Report. 2010;3:333-339. [PubMed] |
| 23. | Ishii Y, Papa L, Bahadur U, Yue Z, Aguirre-Ghiso J, Shioda T, Waxman S, Germain D. Bortezomib enhances the efficacy of fulvestrant by amplifying the aggregation of the estrogen receptor, which leads to a proapoptotic unfolded protein response. Clin Cancer Res. 2011;17:2292-2300. [PubMed] [DOI] |
| 24. | Tamura D, Arao T, Tanaka K, Kaneda H, Matsumoto K, Kudo K, Aomatsu K, Fujita Y, Watanabe T, Saijo N. Bortezomib potentially inhibits cellular growth of vascular endothelial cells through suppression of G2/M transition. Cancer Sci. 2010;101:1403-1408. [PubMed] [DOI] |
| 25. | Albero MP, Vaquer JM, Andreu EJ, Villanueva JJ, Franch L, Ivorra C, Poch E, Agirre X, Prosper F, Pérez-Roger I. Bortezomib decreases Rb phosphorylation and induces caspase-dependent apoptosis in Imatinib-sensitive and -resistant Bcr-Abl1-expressing cells. Oncogene. 2010;29:3276-3286. [PubMed] [DOI] |
| 26. | Brignole C, Marimpietri D, Pastorino F, Nico B, Di Paolo D, Cioni M, Piccardi F, Cilli M, Pezzolo A, Corrias MV. Effect of bortezomib on human neuroblastoma cell growth, apoptosis, and angiogenesis. J Natl Cancer Inst. 2006;98:1142-1157. [PubMed] [DOI] |
| 27. | Yin D, Zhou H, Kumagai T, Liu G, Ong JM, Black KL, Koeffler HP. Proteasome inhibitor PS-341 causes cell growth arrest and apoptosis in human glioblastoma multiforme (GBM). Oncogene. 2005;24:344-354. [PubMed] [DOI] |
| 28. | McConkey DJ, Zhu K. Mechanisms of proteasome inhibitor action and resistance in cancer. Drug Resist Updat. 2008;11:164-179. [PubMed] [DOI] |
| 30. | Sung MH, Bagain L, Chen Z, Karpova T, Yang X, Silvin C, Voss TC, McNally JG, Van Waes C, Hager GL. Dynamic effect of bortezomib on nuclear factor-kappaB activity and gene expression in tumor cells. Mol Pharmacol. 2008;74:1215-1222. [PubMed] [DOI] |
| 31. | Huang J, Ding T, Yang M, Liu H, Sun X, Jin J. Antitumor activity and drug interactions of proteasome inhibitor Bortezomib in human high-risk myelodysplastic syndrome cells. Int J Hematol. 2011;93:482-493. [PubMed] [DOI] |
| 32. | Chung EJ, Moon SW, Jung SA, Cho YJ, Kim SW, Lee JH. Potentiation of bortezomib-induced apoptosis by TGF-beta in cultured human Tenon's fibroblasts: contribution of the PI3K/Akt signaling pathway. Invest Ophthalmol Vis Sci. 2010;51:6232-6237. [PubMed] [DOI] |
| 33. | 张 利, 于 红刚, 于 皆平, 罗 和生. PI3K/Akt/p27kip1通道介导胃癌细胞对阿霉素、足叶乙甙化疗的耐药性及其机制. 世界华人消化杂志. 2008;16:575-581. [DOI] |
| 34. | Chen KF, Yeh PY, Yeh KH, Lu YS, Huang SY, Cheng AL. Down-regulation of phospho-Akt is a major molecular determinant of bortezomib-induced apoptosis in hepatocellular carcinoma cells. Cancer Res. 2008;68:6698-6707. [PubMed] [DOI] |
| 35. | Chen KF, Yeh PY, Hsu C, Hsu CH, Lu YS, Hsieh HP, Chen PJ, Cheng AL. Bortezomib overcomes tumor necrosis factor-related apoptosis-inducing ligand resistance in hepatocellular carcinoma cells in part through the inhibition of the phosphatidylinositol 3-kinase/Akt pathway. J Biol Chem. 2009;284:11121-11133. [PubMed] [DOI] |