修回日期: 2011-04-12
接受日期: 2011-04-21
在线出版日期: 2011-05-08
目的: 探讨塞来昔布对人肝癌HepG2细胞增殖、凋亡以及KAI1/CD82蛋白表达的影响.
方法: 用不同浓度的塞来昔布(12.5、25.0、50.0、100.0、200.0 μmol/L)干预人肝癌HepG2细胞24、48、72 h后. 采用CCK-8法测定HepG2细胞体外增殖活性; 利用流式细胞术检测细胞凋亡率; 应用Western blot检测KAI1/CD82蛋白表达变化.
结果: CCK-8法证实塞来昔布可呈时间与剂量依赖性抑制肝癌HepG2细胞增殖, 200.0 μmol/L塞来昔布作用72 h后, 抑制率达到最大(69.23%). 流式细胞术检测发现12.5、50.0、200.0 μmol/L塞来昔布干预肝癌HepG2细胞48 h后, 塞来昔布可呈剂量依赖性诱导肝癌HepG2细胞凋亡, 凋亡率均高于对照组(18.79%±2.37%, 46.94%±0.78%, 69.48%±0.63% vs 16.72%±1.54%, 均P<0.05). Western blot结果显示塞来昔布可呈剂量依赖性增加KAI1/CD82表达, 较对照组明显升高, 差异有统计学差异(48 h: 0.394±0.007, 0.886±0.057, 1.099±0.079 vs 0.321±0.020, 均P<0.05).
结论: 塞来昔布可通过上调KAI1/CD82蛋白的表达, 诱导肝癌HepG2细胞凋亡, 抑制肿瘤细胞增殖.
引文著录: 崔荣花, 陈剑群, 孙旻, 孙忠志. 塞来昔布对肝癌HepG2细胞生长及KAI1/CD82蛋白表达的影响. 世界华人消化杂志 2011; 19(13): 1336-1341
Revised: April 12, 2011
Accepted: April 21, 2011
Published online: May 8, 2011
AIM: To investigate the effect of celecoxib on cell proliferation, apoptosis and KAI1/CD82 expression in human hepatocellular carcinoma cell line HepG2.
METHODS: After HepG2 cells were treated with different concentrations of celecoxib (12.5, 25.0, 50.0, 100.0, 200.0 μmol/L), cell proliferation was measured by CCK-8 assay, cell apoptosis was detected by flow cytometry, and the expression of KAI1/CD82 protein was detected by Western blot.
RESULTS: Treatment with celecoxib significantly inhibited the proliferation of HepG2 cells (P < 0.05) in a dose- and time-dependent manner, and the reduced rate of growth of HepG2 cells treated with 200.0 μmol/L celecoxib for 72 h was 69.23%. Treatment with celecoxib induced apoptosis of HepG2 cells in a dose-dependent manner. The apoptosis rates of cells treated with 12.5, 50.0, or 200.0 μmol/L celecoxib for 48 h were significantly higher than that of control cells (18.79% ± 2.37%, 46.94% ± 0.78%, 69.48% ± 0.63% vs 16.72% ± 1.54%, all P < 0.05). Treatment with celecoxib significantly up-regulated the expression of KAI1/CD82 protein in a dose-dependent manner (48 h: 0.394 ± 0.007, 0.886 ± 0.057, 1.099 ± 0.079 vs 0.321 ± 0.020, all P < 0.05).
CONCLUSION: Celecoxib inhibits cell proliferation and induces apoptosis possibly by up-regulating KAI1/CD82 protein expression in human hepatocellular carcinoma cell line HepG2.
- Citation: Cui RH, Chen JQ, Sun M, Sun ZZ. Celecoxib inhibits cell growth and up-regulates KAI1/CD82 protein expression in human hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1336-1341
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1336.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1336
环氧合酶(cyclooxygenase, Cox)又称前列腺素内过氧化物合成酶(prostaglandin H synthase, PGHS), 参与了恶性肿瘤发生、发展、侵袭、转移的全过程[1,2], 其中COX-2是一种诱导酶, 在胃癌、肝癌、乳腺癌等多种恶性肿瘤中均有表达[3], 塞来昔布作为高选择性COX-2抑制剂的一种, 与传统非甾体类消炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)相比具有高效低毒特点. NSAIDs抗肿瘤增殖和诱导肿瘤细胞凋亡作用已经为国内外研究所证实[4], 已成为结肠癌、肝癌、肺癌等多种恶性肿瘤药物治疗的新选择. 已有研究证实塞来昔布能够抑制肿瘤细胞增殖、诱导其凋亡、抑制肿瘤细胞新生血管形成及肿瘤细胞的迁移和黏附等[5,6], 但其具体机制仍不能明确. KAI1/CD82是近几年国内外研究比较热的一种特异性肿瘤抑制基因, 最初在研究前列腺癌时发现[7], 研究证实其能够通参与细胞内信号通路等抑制肿瘤侵袭转移[8]. 而早在1998年Guo等[9]就已经证实, KAI1/CD82基因的表达与肝癌细胞的浸润、转移呈负相关. 因此我们以塞来昔布作用于肝癌HepG2细胞, 观察其对肝癌细胞的增殖抑制、诱导凋亡等作用, 并观察KAI1/CD82蛋白的表达变化情况, 为塞来昔布的体内研究提供更多的实验和理论依据, 亦为肝癌的治疗提供新的思路.
人肝癌HepG2细胞株由徐州医学院肿瘤科实验室保存; 塞来昔布购于美国Sigma公司; CCK-8为日本同仁化学研究所产品; 兔抗人KAI1/CD82单克隆抗体为北京博奥森公司产品; Annexin V-FITC/PI凋亡检测试剂盒为Biovision公司产品; RPMI 1640为美国Gibco公司产品; 胰酶、DMSO为美国Sigma公司产品; 小牛血清购于杭州四季青公司.
1.2.1 细胞培养: 细胞常规培养于含有100 mL/L小牛血清、青霉素-链霉素溶液(100×)的RPMI 1640的培养液中, 在37 ℃, 50 mL/L CO2条件下培养, 2-3 d更换细胞培养液, 待细胞铺满瓶底时, 以2.5 g/L胰酶消化、传代. 取对数生长期细胞进行实验.
1.2.2 分组: 塞来昔布溶解于DMSO, 用RPMI 1640培养液稀释到12.5、25.0、50.0、100.0、200.0 μmol/L, 并确保DMSO浓度最终<0.1%, 并设阴性对照组(0 μmol/L).
1.2.3 CCK-8法检测肝癌细胞增殖抑制率: 取对数生长期HepG2细胞以1×108个/L接种于96孔培养板, 每孔100 μL, 置37 ℃、50 mL/L CO2及饱和湿度条件下待24 h细胞贴壁生长后, 弃上清, 按照1.2.2实验分组设计分组, 加入含有不同浓度塞来昔布的培养液, 每组设6个复孔, 重复2板, 分别培养至24、48、72 h弃上清, 每孔加入CCK-8溶液10 μL, 继续培养4 h, 取出培养板, 酶标仪测定450 nm处的吸光度, 计算抑制率: 抑制率 = (1-给药组A值/阳性对照组A值)×100%.
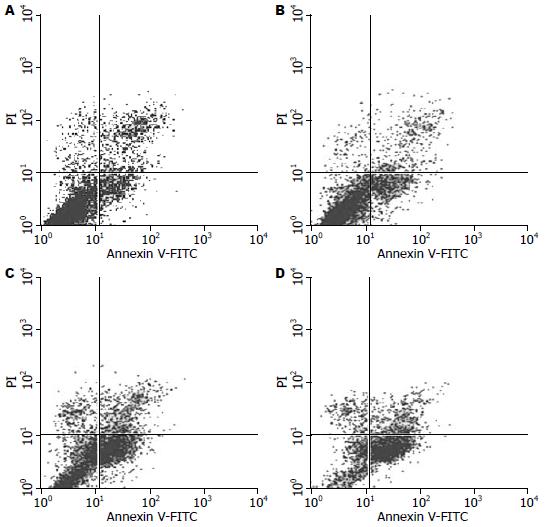
1.2.4 流式细胞术检测细胞凋亡率: 取对数生长期HepG2细胞以每孔2×108个/L的细胞密度接种于6孔板, 分设阴性对照组(0 μmol/L), 塞来昔布组(12.5、50.0、200.0 μmol/L), 干预48 h后收集细胞, 用2.5 g/L胰酶+0.02% EDTA消化离心细胞, 1 000 r/min, 4 ℃离心5 min, 弃上清, PBS洗涤2次后, 将细胞重悬于500 μL Binding Buffer中, 加入10 μL Annexin V-FITC和5 μL PI, 轻轻混匀, 室温避光5 min, 流式细胞仪检测肝癌HepG2细胞凋亡率.
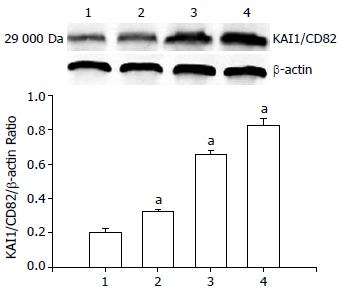
1.2.5 Western blot检测KAI1/CD82蛋白表达: 收集对数生长期肝癌HepG2细胞以每孔2×108个/L的细胞密度接种于6孔板, 分设阴性对照组(0 μmol/L), 塞来昔布组(12.5、50.0、200.0 μmol/L), 分别加药干预48 h后, 置于冰上提取蛋白, 采用Forlin法测蛋白浓度后, 上样于SDS-PAGE电泳分离后转移至硝酸纤维素滤膜, 经抗原抗体反应、显色后于ODSEEY上机扫描, Image J软件半定量分析, 测定其A值. 实验过程中, 以β-actin作为内参进行检测, 保证实验结果的准确性.
统计学处理 采用SPASS16.0进行统计分析, 各组数据以mean±SD表示, 组间比较采用单因素方差分析(One-way ANOVA), P<0.05为差异具有统计学意义.
不同浓度的塞来昔布作用于肝癌HepG2细胞24、48、72 h后, CCK-8结果检测显示: 12.5 μmol/L塞来昔布作用肝癌HepG2细胞24 h后细胞增殖抑制率高于对照组(P<0.05), 且随塞来昔布作用时间的延长和浓度的增加, 细胞抑制率增强, 与对照组相比差异具有统计学意义(P<0.01). 即塞来昔布可呈时间和剂量依赖性抑制肝癌HepG2细胞的增殖(表1).
| 分组 | 24 h | 48 h | 72 h | |||
| A450 | 抑制率(%) | A450 | 抑制率(%) | A450 | 抑制率(%) | |
| 阴性对照组 | 0.720±0.039 | 0.00 | 0.785±0.021 | 0.00 | 0.722±0.028 | 0.00 |
| 塞来昔布 | ||||||
| 12.5 μmol/L | 0.599±0.016a | 16.20 | 0.574±0.029b | 21.64 | 0.564±0.037b | 26.16 |
| 25.0 μmol/L | 0.524±0.026b | 26.89 | 0.507±0.011b | 33.08 | 0.494±0.025b | 34.82 |
| 50.0 μmol/L | 0.449±0.042b | 37.06 | 0.465±0.035b | 39.90 | 0.432±0.033b | 40.03 |
| 100.0 μmol/L | 0.376±0.027b | 47.49 | 0.363±0.037b | 53.52 | 0.325±0.030b | 54.89 |
| 200.0 μmol/L | 0.269±0.028b | 62.41 | 0.245±0.029b | 68.57 | 0.222±0.016b | 69.23 |
12.5、50.0、200.0 μmol/L浓度塞来昔布作用于肝癌HepG2细胞48 h后, 细胞凋亡率均高于对照组(18.79%±2.37%, 46.94%±0.78%, 69.48%±0.63% vs 16.72%±1.54%, 均P<0.05, 图1).
肝癌HepG2细胞经12.5、50.0、200.0 μmol/L塞来昔布处理48 h后, KAI1/CD82蛋白表达量较对照组明显提高, 差异具有统计学意义(0.394±0.007, 0.886±0.057, 1.099±0.079 vs 0.321±0.020, 均P<0.05, 图2).
肝细胞癌(hepatocellular carcinoma, HCC)是恶性肿瘤致死的最常见原因之一, 发病率约每年30/10万. 近二十年来许多国家肝癌的发病率呈上升趋势, 手术切除是主要治疗手段, 但预后差. 且很多患者明确诊断时已是晚期, 患者5年生存率不足5%. 因此积极探索新的治疗方法具有重要的临床意义[10,11].
KAI1/CD82是近几年来发现的特异性肿瘤抑制基因, 首先从前列腺癌细胞杂交出并命名, 其定位于人类染色体11p11.2-13上, 全长约80 kb, 包含10个外显子, 9个内含子以及外显子10之后的DNA的8 kb, 该基因一个显著的特点是: 在9个内含子当中, 内含子5最小, 约0.2 kb, 内含子1最长, 约29 kb, 相当于其他内含子长度之和. KAI1/CD82属于跨膜4超家族(transmembrane 4 superfamily, TM4SF)成员[12,13], 他与其他TM4SF成员如CD9、CD63等在分子的重排和细胞的形态、聚集、黏附、迁移等生理及病理活动中发挥重要作用[14,15], 其下调与许多恶性肿瘤发生、发展、转移等密切相关[16]. KAI1/CD82抑制食管癌[17]、胃癌[18]、胰腺癌[19]、大肠腺癌[20]细胞等侵袭和转移已为国内外研究所证实. 而与原发性肝癌的相关研究成为近几年的热点.
塞来昔布是一种新型NSAIDs, 属于高选择性COX-2抑制剂的一种, 因其在对抗肿瘤的同时能够克服传统非甾体类药物长期使用所导致的胃肠道出血、消化性溃疡等不良反应而为研究者所关注, 塞来昔布在各种恶性肿瘤细胞凋亡, 抑制肿瘤侵袭、转移方面国内外已有所研究, 如Tsutsumi等[21]研究发现选择性COX-2抑制剂塞来昔布能抑制胃癌的凋亡, 其机制是通过上调一种内质网伴侣蛋白的表达, 而这种内质网伴侣蛋白能够抑制塞来昔布所诱导的肿瘤细胞凋亡. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一组锌离子依赖性内肽酶, 他可通过水解细胞外基质促进肿瘤细胞的侵袭和转移, 而其抑制剂TIMP-2能特异地抑制MMP-2的酶原激活和酶活性, 阻止肿瘤细胞的侵袭, 两者是评价肝癌细胞转移能力的良好指标之一. 殷积彬等[22]将肝癌细胞株接种于裸鼠肝脏组织中, 以塞来昔布灌胃法观察裸鼠体内选择性COX-2抑制剂塞来昔布的抗肿瘤效果, 结果显示塞来昔布能够通过抑制肝癌细胞内MMP-2表达, 又增加TIMP-2的表达, 从而使TIMP-2/MMP-2比例增加, 导致肿瘤细胞降解细胞外基质的作用下降, 达到抑制肿瘤细胞转移的作用. 塞来昔布还能够通过抑制NF-κB及VEGF蛋白的表达来抑制胃癌细胞增殖, 促进细胞凋亡, 抑制肿瘤新生血管形成[23]. Xu等研究证实塞来昔布可以通过花生四烯酸代谢途径以剂量和时间依赖方式抑制小鼠肝癌H22细胞增殖[24], 而卢栋等通过Western blot等实验方法证实塞来昔布能够促进肝癌HepG2细胞凋亡, 而其途径是通过抑制细胞NF-κB DNA结合活性和NF-κB p65蛋白表达来实现的[25], 另有报道研究证实塞来昔布能够增强肝癌细胞株HepG2对抗肿瘤药物多柔比星的敏感性, 其机制是通过COX-2所介导的下调多重耐药基因MDR1的表达[26], 可见塞来昔布在诱导肿瘤细胞凋亡, 抑制其转移的途径研究不一, 而其与肿瘤抑制基因的报道甚少.
本实验我们以肝癌细胞系HepG2为靶细胞, 探讨塞来昔布对肝癌细胞的增殖抑制、诱导凋亡及对KAI1/CD82蛋白表达作用的影响. 通过增殖抑制实验发现, 12.5 μmol/L塞来昔布持续作用48 h抑制率为21.64%, 作用72 h抑制率为26.16%, 而浓度递增到200.0 μmol/L时, 抑制率达68.57%, 塞来昔布对肝癌HepG2的增殖抑制呈剂量和时间依赖效应. 这和王智等研究塞来昔布对肝癌SMMC7721细胞的生长抑制作用相一致[27]. 细胞凋亡是细胞在生理或病理条件下, 由基因调控的主动方面的自我消亡过程. 相关研究表明细胞凋亡与肿瘤的发生、发展及转归密切相关, 诱导肿瘤细胞发生凋亡是部分抗肿瘤化疗药物的作用机制之一[28]. 我们选用12.5、50.0、200.0 μmol/L低中高3个浓度塞来昔布通过流式细胞仪检测发现细胞凋亡率与药物浓度成正比, 200.0 μmol/L凋亡率为69.48%, 同时Western blot法观察到12.5、50.0、200.0 μmol/L剂量组塞来昔布均能促进人KAI1/CD82蛋白的表达, 据此我们推测塞来昔布也可通过上调KAI1/CD82蛋白的表达而发挥抗肿瘤作用. 但其具体诱导途径国内外研究不一, Zhou等[29]研究认为KAI1/CD82本身的糖基化和软酯酸化是其抑制肿瘤细胞黏附、运动和侵袭转移作用的重要因素. 其还可以通过控制细胞表面分子活动和信号传导影响细胞转移, 抑制肿瘤细胞的运动[30]; 而Zhang等[31]研究证实KAI1/CD82能够通过FAK-Lyn-p130CAS-CrKⅡ信号通路(FAK为局部黏附激酶, Lyn为Src酪氨酸激酶, 为反应的底物)抑制制肿瘤细胞转移, 具有趋触性和趋化性的FAK-Lyn-p130CAS-CrKⅡ路径是细胞活动的分子开关, 其通过调节肌动蛋白细胞骨架的组织结构而决定细胞的运动方向, 而KAIl通过抑制活化的p130CAS-CrKⅡ复合物的形成而抑制细胞的活动性; 而另有研究发现KAI1/CD82也可通过干预介导肿瘤病理过程的PI3K/Akt/mTOR信号通路下调Rac1蛋白的表达从而抑制细胞转移和肿瘤的浸润[32]. 通过本实验研究我们认为, 塞来昔布能够通过上调KAI1/CD82蛋白的表达而抑制肝癌细胞侵袭转移, 这为肝癌的临床治疗提供了可靠的理论依据, 但其具体诱导途径复杂, 需更深入的研究.
感谢王青勋、张志峰等同志在实验中给予的大力帮助.
原发性肝癌具有起病隐匿、发病率高, 侵袭性强、预后差等特点, 手术治疗是目前最佳治疗手段, 但患者5年总生存率仍低于5%. 传统的全身化疗药物不良反应较大, 临床疗效欠佳, 因此寻找对肝癌有效的治疗方法对于降低肝癌的发病率和死亡率具有十分重要的意义, 塞来昔布是一种新型非甾体类消炎药, 其抗肿瘤作用备受关注, 但其具体作用机制国内外研究尚不够全面.
郑鹏远, 教授, 郑州大学第二附属医院消化科
塞来昔布抗肿瘤的作用机制是国内外研究热点, 且以体外实验居多, 因此体内实验抗肿瘤效果、临床合适应用剂量及其不良反应问题仍需进一步证实.
Roy等研究证实塞来昔布能够增强肝癌细胞株HepG2对抗肿瘤药物多柔比星的敏感性, 其机制是通过COX-2所介导的下调MDR1的表达, 而MDR1是一种多重耐药基因. 这为塞来昔布与其他药物联合应用抗肿瘤提供了新的思路.
KAI1/CD82是近几年来发现的特异性肿瘤抑制基因, 其下调与肝癌发生、发展、转移等密切相关, 本研究探讨塞来昔布可以通过上调KAI1/CD82的表达而达到抗肝癌目的, 这为塞来昔布肿瘤治疗提供新的作用靶点.
本实验为肝癌的临床治疗提供了新的思路和可靠的理论依据, 但本实验就塞来昔布抑制肿瘤细胞增殖的具体细胞因子及是否存在其他作用途径, 体内实验最适药物浓度均值得进一步研究.
本文思路清晰, 设计合理, 有一定的理论意义和潜在的临床价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Smakman N, Kranenburg O, Vogten JM, Bloemendaal AL, van Diest P, Borel Rinkes IH. Cyclooxygenase-2 is a target of KRASD12, which facilitates the outgrowth of murine C26 colorectal liver metastases. Clin Cancer Res. 2005;11:41-48. [PubMed] |
| 2. | Castells A, Balaguer F, Gonzalo V, Castellví-Bel S. [Cyclooxygenase 2 and colorectal cancer: therapeutic implications]. Gastroenterol Hepatol. 2007;30:280-284. [PubMed] [DOI] |
| 3. | Ghosh N, Chaki R, Mandal V, Mandal SC. COX-2 as a target for cancer chemotherapy. Pharmacol Rep. 2010;62:233-244. [PubMed] |
| 4. | Koga H. Hepatocellular carcinoma: is there a potential for chemoprevention using cyclooxygenase-2 inhibitors? Cancer. 2003;98:661-667. [PubMed] [DOI] |
| 5. | Sahin M, Sahin E, Gümüslü S. Cyclooxygenase-2 in cancer and angiogenesis. Angiology. 2009;60:242-253. [PubMed] |
| 6. | 刘 江伟, 张 永久, 李 开宗, 窦 科峰, 许 永华, 张 东, 闰 兵. COX-2抑制剂联合survivin反义寡核苷酸抗胰腺癌BxPC-3细胞的效应. 世界华人消化杂志. 2007;15:3178-3183. [DOI] |
| 7. | Ueda T, Ichikawa T, Tamaru J, Mikata A, Akakura K, Akimoto S, Imai T, Yoshie O, Shiraishi T, Yatani R. Expression of the KAI1 protein in benign prostatic hyperplasia and prostate cancer. Am J Pathol. 1996;149:1435-1440. [PubMed] |
| 8. | Yang JM, Peng ZH, Si SH, Liu WW, Luo YH, Ye ZY. KAI1 gene suppresses invasion and metastasis of hepatocellular carcinoma MHCC97-H cells in vitro and in animal models. Liver Int. 2008;28:132-139. [PubMed] [DOI] |
| 9. | Guo XZ, Friess H, Di Mola FF, Heinicke JM, Abou-Shady M, Graber HU, Baer HU, Zimmermann A, Korc M, Büchler MW. KAI1, a new metastasis suppressor gene, is reduced in metastatic hepatocellular carcinoma. Hepatology. 1998;28:1481-1488. [PubMed] [DOI] |
| 11. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 12. | Dong JT, Lamb PW, Rinker-Schaeffer CW, Vukanovic J, Ichikawa T, Isaacs JT, Barrett JC. KAI1, a metastasis suppressor gene for prostate cancer on human chromosome 11p11.2. Science. 1995;268:884-886. [PubMed] [DOI] |
| 13. | Malik FA, Sanders AJ, Jiang WG. KAI-1/CD82, the molecule and clinical implication in cancer and cancer metastasis. Histol Histopathol. 2009;24:519-530. [PubMed] |
| 14. | Liu WM, Zhang XA. KAI1/CD82, a tumor metastasis suppressor. Cancer Lett. 2006;240:183-194. [PubMed] [DOI] |
| 15. | Gao AC, Lou W, Dong JT, Barrett JC, Danielpour D, Isaacs JT. Defining regulatory elements in the human KAI1 (CD 82) metastasis suppressor gene. Prostate. 2003;57:256-260. [PubMed] [DOI] |
| 16. | Bari R, Zhang YH, Zhang F, Wang NX, Stipp CS, Zheng JJ, Zhang XA. Transmembrane interactions are needed for KAI1/CD82-mediated suppression of cancer invasion and metastasis. Am J Pathol. 2009;174:647-660. [PubMed] [DOI] |
| 17. | Uchida S, Shimada Y, Watanabe G, Li ZG, Hong T, Miyake M, Imamura M. Motility-related protein (MRP-1/CD9) and KAI1/CD82 expression inversely correlate with lymph node metastasis in oesophageal squamous cell carcinoma. Br J Cancer. 1999;79:1168-1173. [PubMed] [DOI] |
| 18. | Zhao ZS, Wang YY, Ye ZY, Tao HQ. Prognostic value of tumor-related molecular expression in gastric carcinoma. Pathol Oncol Res. 2009;15:589-596. [PubMed] [DOI] |
| 19. | Xu JH, Guo XZ, Ren LN, Shao LC, Liu MP. KAI1 is a potential target for anti-metastasis in pancreatic cancer cells. World J Gastroenterol. 2008;14:1126-1132. [PubMed] [DOI] |
| 20. | Liu L, Wu DH, Li ZG, Yang GZ, Ding YQ. Effects of KAI1/CD82 on biological behavior of human colorectal carcinoma cell line. World J Gastroenterol. 2003;9:1231-1236. [PubMed] |
| 21. | Tsutsumi S, Namba T, Tanaka KI, Arai Y, Ishihara T, Aburaya M, Mima S, Hoshino T, Mizushima T. Celecoxib upregulates endoplasmic reticulum chaperones that inhibit celecoxib-induced apoptosis in human gastric cells. Oncogene. 2006;25:1018-1029. [PubMed] [DOI] |
| 22. | 殷 积彬, 李 宝馨, 谢 新玉, 刘 冰熔, 吕 志武, 关 景明, 高 善玲. MMP-2和ICAM-1在裸鼠体内塞来昔布抑制肝癌组织中的表达. 世界华人消化杂志. 2010;18:1206-1210. [DOI] |
| 23. | 王 云峰, 李 健, 葛 成华, 王 世伟, 张 建军, 夏 强, 郭 克建. 塞来昔布对不表达环氧合酶-2的胃癌细胞生长的影响. 世界华人消化杂志. 2009;17:3583-3589. [DOI] |
| 24. | Xu Z, Zhang M, Lv X, Xiang D, Zhang X, Chen L. The inhibitory effect of celecoxib on mouse hepatoma H22 cell line on the arachidonic acid metabolic pathway. Biochem Cell Biol. 2010;88:603-609. [PubMed] [DOI] |
| 25. | 卢 栋, 杜 玉开, 李 永华, 纪 龙, 李 龙嫚, 余 红平. 塞来昔布对人肝癌细胞株HepG2细胞核转录因子-κB活性及蛋白表达的抑制. 世界华人消化杂志. 2008;16:1793-1796. [DOI] |
| 26. | Roy KR, Reddy GV, Maitreyi L, Agarwal S, Achari C, Vali S, Reddanna P. Celecoxib inhibits MDR1 expression through COX-2-dependent mechanism in human hepatocellular carcinoma (HepG2) cell line. Cancer Chemother Pharmacol. 2010;65:903-911. [PubMed] [DOI] |
| 28. | Hunter AM, LaCasse EC, Korneluk RG. The inhibitors of apoptosis (IAPs) as cancer targets. Apoptosis. 2007;12:1543-1568. [PubMed] [DOI] |
| 29. | Zhou B, Liu L, Reddivari M, Zhang XA. The palmitoylation of metastasis suppressor KAI1/CD82 is important for its motility- and invasiveness-inhibitory activity. Cancer Res. 2004;64:7455-7463. [PubMed] [DOI] |
| 30. | Miranti CK. Controlling cell surface dynamics and signaling: how CD82/KAI1 suppresses metastasis. Cell Signal. 2009;21:196-211. [PubMed] [DOI] |
| 31. | Zhang XA, He B, Zhou B, Liu L. Requirement of the p130CAS-Crk coupling for metastasis suppressor KAI1/CD82-mediated inhibition of cell migration. J Biol Chem. 2003;278:27319-27328. [PubMed] [DOI] |
| 32. | Sakai O, Kanda K, Takamizawa K, Sato T, Yaku H, Nakayama Y. Faster and stronger vascular & quot; Biotube& quot; graft fabrication in vivo using a novel nicotine-containing mold. J Biomed Mater Res B Appl Biomater. 2009;90:412-420. [PubMed] |