修回日期: 2011-03-12
接受日期: 2011-03-16
在线出版日期: 2011-04-28
目的: 探讨胃癌耐药细胞系SGC7901/OXA获得性耐药的发生机制.
方法: 利用间歇增加剂量方法诱导成功的SGC7901/OXA细胞株作为观察组, 亲代细胞株SGC7901为对照组, 采用MTT的方法观察OXA对两组的抑制率, 计算IC50和耐药指数(RI); 采用RT-PCR和Western blot的方法分别检测两组多药耐药1(Mdr1) mRNA浓度和切除修复交叉互补基因组1(ERCC1)的蛋白浓度; 采用流式细胞仪检测两组细胞中侧群(SP)细胞的比例.
结果: SGC7901/OXA细胞各浓度抑制率较SGC7901明显降低, 两者IC50分别为38.23 μmol/L和7.12 μmol/L, RI为5.37; Mdr1 mRNA与β-actin mRNA光密度比值在两组中分别为0.468±0.147和0.427±0.136(n = 5), 两者差异无明显统计学意义(P = 0.079); ERCC1蛋白浓度在SGC7901/OXA细胞较SGC7901细胞中明显增加; SGC7901中SP细胞的比例为1.8%, SGC7901/OXA中SP细胞的比例达到了6.1%, 较SGC7901细胞明显升高(P<0.05).
结论: SGC7901/OXA较SGC7901对OXA明显耐药, 其获得性耐药的机制可能与ERCC1蛋白浓度以及SP细胞比例的变化有关, 而Mdr1基因的作用不明显.
引文著录: 陈刚, 王清睿, 邱红, 柯善栋, 向莹, 胡少明. 胃癌SGC7901/OXA细胞耐药与侧群细胞比例及Mdr1、ERCC1基因表达的关系. 世界华人消化杂志 2011; 19(12): 1219-1224
Revised: March 12, 2011
Accepted: March 16, 2011
Published online: April 28, 2011
AIM: To investigate the mechanism of acquired drug resistance in human gastric cancer cell line SGC7901/OXA.
METHODS: SGC7901/OXA cell line was obtained by exposure of SGC7901 cells to increasing doses of oxaliplatin (OXA). The parental cell line SGC7901 was used as a control. The reduced rate of cell growth, half maximal inhibitory concentration (IC50), and resistance index (RI) were measured by MTT assay and compared between the two groups of cells. The expression of multidrug resistance 1 (Mdr1) mRNA and excision repair cross-complementing group 1 (ERCC1) protein was detected by RT-PCR and Western blot, respectively. The proportion of side population (SP) cells was determined by flow cytometry.
RESULTS: The reduced rate of cell growth significantly decreased and IC50 increased (38.23 μmol/L vs 7.12 μmol/L) in SGC7901/OXA cells compared to parental SGC7901 cells. The RI was 5.37 in SGC7901/OXA cells. There was no significant difference in the relative expression level of Mdr1 mRNA (0.468 ± 0.147 vs 0.427 ± 0.136, P = 0.079) between the two groups. ERCC1 protein level was significantly higher in SGC7901/OXA cells than in SGC7901 cells. The proportion of SP cells was also significantly higher in SGC7901/OXA cells than in SGC7901 cells (6.1% vs 1.8%, P < 0.05).
CONCLUSION: SGC7901/OXA cells were more significantly resistant to OXA than SGC7901. The mechanism of acquired resistance of SGC7901/OXA cells may be associated with changes in ERCC1 protein expression and proportion of SP cells.
- Citation: Chen G, Wang QR, Qiu H, Ke SD, Xiang Y, Hu SM. Relationship of cellular drug resistance to proportion of side population cells and expression of Mdr1 and ERCC1 in human gastric cell line SGC7901/OXA. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1219-1224
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1219.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1219
胃癌是我国高发病率、高死亡率的恶性肿瘤之一[1]. 草酸铂作为目前胃癌临床运用广泛的药物之一, 其获得性耐药往往是胃癌治疗失败的主要原因之一, 其机制有待进一步明确. 目前有关胃癌获得性耐药的机制大都从ATP结合盒(ATP binding cassette, ABC)转运蛋白[2]及苷酸切除修复(nucleotide excision repair, NER)途径[3]着手. 但有证据表明胃癌组织细胞中存在极少量瘤细胞, 充当着干细胞的角色, 通过自我更新维持着肿瘤的持续生长, 虽然来源于正常的胃干细胞或者是骨髓来源的干细胞尚无定论[4]. 由于常规的治疗手段只能消灭处于增殖阶段的已分化的肿瘤细胞, 肿瘤干细胞具有与成体干细胞相同的抗凋亡、耐药、免疫耐受等特点, 并不能被清除而成为肿瘤继续生长、复发及转移的根源[5]. 侧群(side population, SP)细胞作为一类更具有外排Hoechst33342作用而使其低染从而用流式细胞仪得以分离的亚群细胞[6], 因为具有干细胞特性被广泛用来研究肿瘤干细胞的特性[7]. 本文试图从胃癌耐药细胞株SGC7901/OXA SP细胞比例变化和多药耐药1(multidrug resistance 1, Mdr1)和切除修复交叉互补基因组1(excision repair cross-complementing group 1, ERCC1)基因表达方面着手探讨SGC7901/OXA耐药的发生机理.
人胃癌细胞系SGC7901为本实验室保存. DMEM高糖细胞培养液、胎牛血清FBS购自杭州四季青公司, Hoechst33342、维拉帕米(verapamil)、草酸铂(oxaliplatin, OXA)购自Sigma公司, MTT检测试剂盒TRIzol试剂购自武汉谷歌生物, Mdr1及β-actin引物由上海生物工程技术有限公司合成. 细胞在50 mL/L CO2, 37 ℃培养条件下培养, 培养液为含100 mL/L FBS的DMEM.
1.2.1 胃癌耐药细胞株SGC7901/OXA的建立: 采用间歇增加剂量方法诱导方法. 取对数生长期的SGC7901加入含起始剂量为0.5 μmol/L的OXA培养液培养24 h后, PBS清洗, 更换为正常培养基培养待其恢复生长后, 重复给予上述含OXA培养液, 待其耐受后逐步增加OXA浓度, 周而复始, 直至其能耐受10 μmol/L浓度的OXA, 前后共6 mo, 定名为SGC7901/OXA细胞株, 并以1 μmol/L浓度的持续培养保持其耐药性. 实验前3 d更换为不含OXA的培养基.
1.2.2 耐药指数的检测: 常规MTT法检测. 收集对数期SGC7901细胞和SGC7901/OXA细胞, 调整细胞悬液浓度, 分于96孔板, 每孔150 μL, 4 000个/孔, 设置5个OXA组(细胞、培养基、OXA)、阴性对照孔(细胞、培养基)及空白调零孔(培养基), 每组设置5个复孔. 置37 ℃、50 mL/L CO2温箱培养24 h使细胞贴壁后, OXA组加入含药培养基, 其中OXA终浓度分别为0.5、1、5、10、20、50 μmol/L, 继续培养48 h. 小心吸去上清, 按MTT试剂盒操作, 加入50 μL A溶液后37 ℃孵育4 h, 再加入100 μL工作液终止反应, 常温下静置20 min待紫色颗粒溶解后, 酶标仪上以580 nm波长测吸光度值(A). 计算抑制率=1-A加药/A对照×100%; IC50计算器软件计算50%细胞生长抑制时的药物浓度(IC50); 耐药指数(resistance index, RI) = IC50SGC7901/OXA/IC50SGC7901.
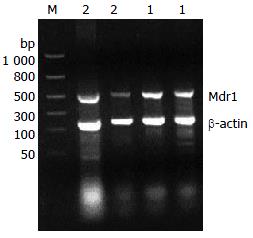
1.2.3 RT-PCR检测Mdr1 mRNA: 取对数生长的SGC7901及SGC7901/OXA细胞, 按TRIzol试剂(武汉谷歌生物)说明书操作抽提总RNA, 分装后-70 ℃储存备用, 保证A260/A280的比值1.8-2.0进行RT-PCR实验. Mdr1及内参β-actin引物(上海生物工程技术有限公司)见表1. 扩增条件为: 预变性94 ℃, 5 min; 变性94 ℃, 50 s; Mdr1、β-actin退火温度分别为57 ℃﹑54 ℃, 90 s; 延伸72 ℃, 共35个循环. 扩增产物在2%琼脂糖凝胶中电泳, 于凝胶电泳成像分析仪上进行吸光度扫描, 进行条带分析. 以目标条带比β-actin的相对A值表示结果.
| 引物名称 | 引物序列 | 引物长度(bp) |
| Mdr1 | P1 5'- AGCAGAGGATCGCCATTGGACG-3' | |
| P2 5'-TTGGGCTTGTGATCCACGGACAC-3' | 428 | |
| β-actin | P1 5'-GTTGCGTTACACCCTTTCTTG-3' | |
| P2 5'-GACTGCTGTCACCTTCACCGT-3' | 157 |
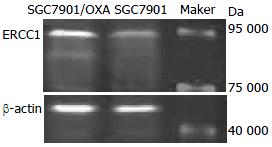
1.2.4 Western blot检测ERCC1蛋白表达: 收集对数生长的SGC7901及SGC7901/OXA细胞, 按总蛋白抽提试剂盒操作说明提取总蛋白, 考马斯亮蓝测蛋白浓度. 每泳道加入40 μg蛋白, 100 V电压电泳后275 mA转膜, 脱脂奶粉封闭后加入ERCC1一抗, 4 ℃孵育过夜, PBS清洗后加入荧光二抗, 奥德赛红外荧光成像仪进行扫描比较组间差异.
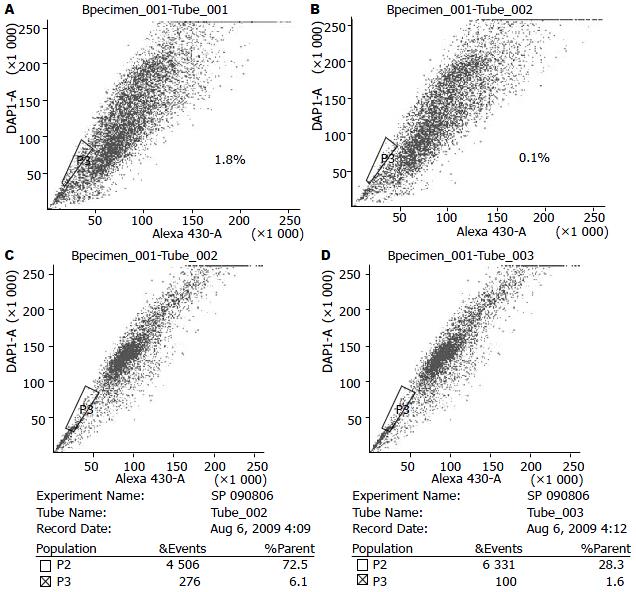
1.2.5 SP细胞的分选: 分别取经胰酶消化为单细胞悬液, 以1×106的密度重悬于37 ℃预热过的含20 mL/L FBS的DMEM培养液中. 分装于1.5 mL的Eppendorf管中, 每管1 mL. 加入终浓度为2.5 mg/L的Hoechst33342, SP细胞的阻断对照组则在加入Hoechst33342前加入终浓度为100 μmol/L的verapamil, 置于37 ℃水浴中15 min后再加入Hoechst33342. 使Hoechst33342在细胞悬液中彻底混匀, 在37 ℃水浴中染色90 min, 每间隔20 min细胞悬液需要摇匀防止细胞沉降. 90 min染色结束后细胞在4 ℃离心弃上清液重悬于400 μL冰浴过的含20 mL/L FBS的PBS中; 流式细胞仪检测前, 在细胞悬液中加入终浓度为2 mg/L的PI以除去死细胞, 上流式细胞仪检测. 每组结果重复3次.
统计学处理 所有数据均采用SPSS11.5统计软件进行t检验分析, 实验结果以mean±SD表示, 以P<0.05具有统计学意义.
细胞SGC7901/OXA细胞和SGC7901细胞48 h各浓度的抑制率较SGC7901明显降低, 差异有统计学意义(P<0.05), 两者IC50分别为38.23 μmol/L和7.12 μmol/L, RI为5.37(表2).
| 0.5 μmol/L | 1 μmol/L | 5 μmol/L | 10 μmol/L | 25 μmol/L | 50 μmol/L | IC50 | RI | |
| SGC7901/OXA | 0.093±0.018 | 0.113±0.068 | 0.275±0.107 | 0.328±0.143 | 0.437±0.162 | 0.531±0.262 | 38.23 | 5.37 |
| SGC7901 | 0.125±0.076 | 0.255±0.097 | 0.464±0.129 | 0.557±0.152 | 0.681±0.189 | 0.796±0.246 | 7.12 |
Mdr1与β-actin mRNA A比值分别为0.468±0.147和0.427±0.136(n = 5), 两者差异无明显统计学意义(P = 0.079, 图1).
ERCC1蛋白浓度在SGC7901/OXA细胞较SGC7901细胞中明显增加(图2).
SGC7901中SP细胞的比例达到了1.8%, 加入verapamil后减少为0.1%, 说明该群细胞外排Hoechst33342的作用能被verapamil明显抑制, 证实该群细胞即为SP细胞; 而SGC7901/OXA中SP细胞的比例达到了6.1%, 较SGC7901细胞明显升高(图3).
由于胃癌早期诊断率较低, 经确诊的胃癌患者绝大多数已属中晚期, 化疗作为中晚期胃癌患者的主要治疗手段, 由于耐药的原因, 5年生存率极低[8]. 探讨其耐药的成因, 积极寻找逆转耐药的药物是目前的研究热点.
奥沙利铂在胃癌治疗中有较多应用, 建立耐OXA胃癌细胞株对研究胃癌耐药机制具有重要作用. 本实验对建立的SGC7901/OXA细胞系与亲本细胞研究表明其对OXA明显耐药, 其IC50分别为38.23 μmol/L和7.12 μmol/L, RI达到了5.37. 目前现有铂类耐药的相关研究认为, DNA损伤修复过程的改变是铂类等化疗药物耐药的主要可能机制[9]. 化疗药物造成的DNA损伤主要通过NER途径完成[10]. ERCC1参与识别和切割DNA链损伤, 是ERCC家族的关键基因, 也是NER途径的关键基因之一[11]. ERCC1编码产物参与形成蛋白质复合体, 通过协同修复核苷酸的化学变化和结构改变, 确保基因组的完整性[12]. ERCC1过表达可使停滞在G2/M期的损伤DNA迅速修复, 尤其是ERCC1能使铂类诱导的DNA络合物清除增加, 导致耐药[13]. 在胃癌中, ERCC1高表达患者化疗有效率低, 生存期短[14]. 我们的研究结果表明SGC7901/OXA耐药细胞系较亲本细胞ERCC1的蛋白浓度明显升高, 提示ERCC1在胃癌细胞对OXA获得性耐药过程中发挥了重要作用. Mdr1基因编码P-gp, 由MDR为ATP依赖性转运蛋白, 能将多种药物如括蒽环霉素、植物生物碱、鬼臼霉素、紫杉类等化疗药物泵出细胞外, 从而减少细胞内化疗药物的蓄积产生耐药[15]. 有研究表明在耐药细胞株SGC7901/VCR中存在Mdr1的高表达[16], 而我们在SGC7901/OXA中并未发现Mdr1的高表达, 可能与诱导药物不同有关.
最新研究表明肿瘤是一种干细胞疾病. 肿瘤组织中存在极少量瘤细胞, 充当着干细胞的角色, 通过自我更新维持着肿瘤的持续生长[17]. 常规的治疗手段只能消灭处于增殖阶段的已分化的肿瘤细胞, 而肿瘤干细胞具有与成体干细胞相同的抗凋亡、耐药、免疫耐受等特点, 并不能被清除而成为肿瘤继续生长、复发及转移的根源[18]. 近年来越来越多的证据表明胃癌中存在一小部分细胞具有干细胞的特点[19,20]. 2009年, Takaishi等[21]利用人胃癌细胞表面分子标志物CD44从胃癌细胞株中分离出了的CD44+细胞极少数量便能在NOD/SCID小鼠体内成瘤. 但就其来源目前认为有两种可能, 一是来源于胃的成体干细胞[22], 二是来源于骨髓的间充质干细胞[23]. 目前, SP细胞分选作为肿瘤干细胞研究的重要手段, 在胃癌中得以应用并证实胃癌中确实存在小部分具有干细胞特性的SP细胞. Haraguchi等[24]从16个胃肠道肿瘤细胞株中分离得到15株SP细胞, 占整个细胞比例0.3%-2.2%, 我们的研究结果表明在SGC7901中SP细胞的比例约为1.8%, 与之相似. 该类细胞有很强的自我更新繁殖能力, 与致瘤性高度相关, 而且这些SP细胞较非SP细胞对5-氟尿嘧啶、阿霉素、吉西他滨有更高的耐药性. 在SGC7901/OXA细胞中SP细胞比例增加了6.1%, 提示胃癌在获得性耐药发生的过程中, 具有干细胞特性的比例较前明显升高, 可能是胃癌复发、转移的原因. 这一现象与Liang等[25]研究的发现一致, 这可能与肿瘤细胞基因不稳定有关.
本实验研究结果提示ERCC1蛋白浓度以及SP细胞比例的变化在SGC7901/OXA获得性耐药发生过程中扮演着重要角色, 而Mdr1基因表达在SGC7901/OXA细胞株中无明显变化. SP细胞比例变化的同时, 有关SP细胞对OXA耐药的具体机制有待进一步深入研究.
草酸铂(OXA)作为目前胃癌临床运用广泛的药物之一, 其获得性耐药往往是治疗失败的主要原因之一, 目前有关胃癌铂类获得性耐药的机制大都从ABC转运蛋白及苷酸切除修复(NER)途径着手.
刘冰熔, 教授, 黑龙江省哈尔滨医科大学附属第二临床医院消化内科; 黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
由于胃癌早期诊断率较低, 经确诊的胃癌患者绝大多数已属中晚期, 化疗作为中晚期胃癌患者的主要治疗手段, 由于耐药的原因, 5年生存率极低. 探讨其耐药的成因, 积极寻找逆转耐药的药物是目前的研究热点.
Takaishi等利用人胃癌细胞表面分子标志物CD44从胃癌细胞株中分离出了的CD44+细胞极少数量便能在NOD/SCID小鼠体内成瘤.
本文通过建立胃癌耐药细胞系SGC7901/OXA, 并从SP细胞比例及Mdr1、ERCC1基因表达方面来探讨其耐药机制, 立意新颖.
本研究结果表明ERCC1蛋白表达以及SP细胞比例的变化在SGC7901/OXA获得性耐药发生过程中扮演着重要角色, 为进一步探讨胃癌耐药的成因提供了有益的线索.
侧群(SP)细胞: 是一类更具有外排Hoechst33342作用而使细胞低染从而用流式细胞仪得以分离的亚群细胞, 因为其具有干细胞特性被用来研究肿瘤干细胞的特性.
本文学术性较好, 为进一步研究胃癌获得性耐药的发生机制提供了有价值的信息.
编辑: 李薇 电编:李薇
| 2. | 高 福莲, 马 开颜, 张 钦宪. P-gp、MRP、LRP、GSTπ和TOPOⅡ在胃癌表达的趋势. 胃肠病学和肝病学杂志. 2006;15:216-218. |
| 3. | Zhang D, Fan D. Multidrug resistance in gastric cancer: recent research advances and ongoing therapeutic challenges. Expert Rev Anticancer Ther. 2007;7:1369-1378. [PubMed] [DOI] |
| 4. | Saikawa Y, Fukuda K, Takahashi T, Nakamura R, Takeuchi H, Kitagawa Y. Gastric carcinogenesis and the cancer stem cell hypothesis. Gastric Cancer. 2010;13:11-24. [PubMed] [DOI] |
| 5. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-110. [PubMed] [DOI] |
| 6. | Feuring-Buske M, Hogge DE. Hoechst 33342 efflux identifies a subpopulation of cytogenetically normal CD34(+)CD38(-) progenitor cells from patients with acute myeloid leukemia. Blood. 2001;97:3882-3889. [PubMed] [DOI] |
| 7. | Fukuda K, Saikawa Y, Ohashi M, Kumagai K, Kitajima M, Okano H, Matsuzaki Y, Kitagawa Y. Tumor initiating potential of side population cells in human gastric cancer. Int J Oncol. 2009;34:1201-1207. [PubMed] |
| 9. | Martin LP, Hamilton TC, Schilder RJ. Platinum resistance: the role of DNA repair pathways. Clin Cancer Res. 2008;14:1291-1295. [PubMed] [DOI] |
| 10. | Dip R, Camenisch U, Naegeli H. Mechanisms of DNA damage recognition and strand discrimination in human nucleotide excision repair. DNA Repair (Amst). 2004;3:1409-1423. [PubMed] [DOI] |
| 11. | Park CJ, Choi BS. The protein shuffle. Sequential interactions among components of the human nucleotide excision repair pathway. FEBS J. 2006;273:1600-1608. [PubMed] [DOI] |
| 12. | Tripsianes K, Folkers GE, Zheng C, Das D, Grinstead JS, Kaptein R, Boelens R. Analysis of the XPA and ssDNA-binding surfaces on the central domain of human ERCC1 reveals evidence for subfunctionalization. Nucleic Acids Res. 2007;35:5789-5798. [PubMed] [DOI] |
| 13. | Altaha R, Liang X, Yu JJ, Reed E. Excision repair cross complementing-group 1: gene expression and platinum resistance. Int J Mol Med. 2004;14:959-970. [PubMed] |
| 14. | 刘 美荣, 王 潍博. 胃癌组织与癌旁组织中ERCC1与AKT1的表达及临床意义. 山东大学学报(医学版). 2010;48:86-89. |
| 15. | Li Y, Yuan H, Yang K, Xu W, Tang W, Li X. The structure and functions of P-glycoprotein. Curr Med Chem. 2010;17:786-800. [PubMed] [DOI] |
| 16. | 张 敏, 李 勇莉, 高 建凯, 王 国栋, 高 福莲. 靶向mdr1不同位点的siRNA对两种耐药细胞MDR的逆转效果. 世界华人消化杂志. 2009;17:3387-3393. [DOI] |
| 17. | Clevers H. The cancer stem cell: premises, promises and challenges. Nat Med. 2011;17:313-319. [PubMed] [DOI] |
| 19. | Ehata S, Johansson E, Katayama R, Koike S, Watanabe A, Hoshino Y, Katsuno Y, Komuro A, Koinuma D, Kano MR. Transforming growth factor-β decreases the cancer-initiating cell population within diffuse-type gastric carcinoma cells. Oncogene. 2011;30:1693-1705. [PubMed] [DOI] |
| 20. | Nishii T, Yashiro M, Shinto O, Sawada T, Ohira M, Hirakawa K. Cancer stem cell-like SP cells have a high adhesion ability to the peritoneum in gastric carcinoma. Cancer Sci. 2009;100:1397-1402. [PubMed] [DOI] |
| 21. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 22. | Tatematsu M, Tsukamoto T, Inada K. Stem cells and gastric cancer: role of gastric and intestinal mixed intestinal metaplasia. Cancer Sci. 2003;94:135-141. [PubMed] [DOI] |
| 23. | Houghton J, Stoicov C, Nomura S, Rogers AB, Carlson J, Li H, Cai X, Fox JG, Goldenring JR, Wang TC. Gastric cancer originating from bone marrow-derived cells. Science. 2004;306:1568-1571. [PubMed] [DOI] |
| 24. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 25. | Liang Y, Zhong Z, Huang Y, Deng W, Cao J, Tsao G, Liu Q, Pei D, Kang T, Zeng YX. Stem-like cancer cells are inducible by increasing genomic instability in cancer cells. J Biol Chem. 2010;285:4931-4940. [PubMed] [DOI] |