修回日期: 2011-04-14
接受日期: 2011-04-18
在线出版日期: 2011-04-18
目的: 构建并制备携带目的基因的rAAV-EGFP-Slug-siRNA病毒载体.
方法: 首先构建pDC316-EGFP-Slug-siRNA质粒, 以PCR鉴定正确的pDC316-EGFP-Slug-siRNA克隆为模板扩增EGFP-Slug-siRNA片段, EcoRⅠ和SalⅠ双酶切回收的PCR产物; 酶切pSNAV2.0-lacz-α载体质粒, 并与上述产物进行连接; 转化感受态大肠杆菌DH5α, 得到重组质粒pSNAV2.0-EGFP-Slug-siRNA, 酶切和测序对其进行鉴定. 建立载体细胞株BHK/Slug-siRNA, 大规模制备rAAV2-EGFP-Slug-siRAN并对其纯化、鉴定和滴度测定.
结果: 携带编码靶向Slug的小发夹状干扰RNA序列的腺相关病毒载体质粒pSNAV2.0-EGFP-Slug-siRNA, 经PCR、酶切和测序鉴定, 质粒构建正确. 将构建成功的载体质粒与重组Ⅰ型单纯疱疹病毒HSV1-rc/ΔUL2共转染包装细胞BHK-2, 成功复制和包装出重组腺相关病毒rAAV2-EGFP-Slug-siRNA, 经检测目的片段插入成功, 滴度为9.23×1010 puf.
结论: 成功制备出高滴度的携带目的基因的rAAV-EGFP-Slug-siRNA病毒载体.
引文著录: 严明总, 张克君, 王齐全, 欧树安. 靶向Slug基因的腺相关腺病毒载体的构建与鉴定. 世界华人消化杂志 2011; 19(11): 1179-1183
Revised: April 14, 2011
Accepted: April 18, 2011
Published online: April 18, 2011
AIM: To construct a recombinant adeno-associated virus-2 vector carrying a small interfering RNA (siRNA) targeting the slug gene (rAAV2-slug-siRNA).
METHODS: A double-stranded siRNA targeting the slug gene was designed, synthesized and cloned into the pDC316-EGFP vector. The resulting vector containing slug siRNA was confirmed by RT-PCR and direct sequencing. EGFP-slug-siRNA sequence was amplified, double digested with EcoR I and Sal I, and ligated to pSNAV2.0-lacz-α plasmid digested with the same enzyme pair. After the resulting recombinant plasmid was transformed into DH5α, bacterial colonies containing the recombinant plasmid was screened on LB agar plates. pSNAV2.0-EGFP-Slug-siRNA plasmid DNA was prepared, purified, identified, and transfected into BHK cells by means of Lipofectamine. BHK cells expressing slug-siRNA (BHK-slug-siRNA) were obtained and subsequently infected with recombinant herpes simplex virus l (HSV1-rc/ΔUL2) to package the rAAV2-slug-siRNA to obtain a functional and infectious virus (rAAV2-slug-siRNA).
RESULTS: A recombinant adeno-associated virus-2 vector carrying a slug siRNA was constructed successfully. The presence of the target sequence in the vector was confirmed by RT-PCR and enzyme digestion. By transfecting the pSNAV2.0-EGFP-Slug-siRNA plasmid into BHK cells, BHK-slug-siRNA was obtained and infected with HSV1-rc/ΔUL2 to package the rAAV2- slug-siRNA to obtain a functional and infectious virus. The titer of the recombinant virus was 9.23×1010 PFU.
CONCLUSION: A high-titer recombinant adeno-associated virus-2 vector carrying a slug siRNA has been constructed successfully.
- Citation: Yan MZ, Zhang KJ, Wang QQ, Ou SA. Construction and identification of a recombinant adeno-associated virus-2 vector carrying an siRNA targeting the slug gene. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1179-1183
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1179.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1179
以往研究发现[1], 脂质体转染携带siRNA-Slug的载体特异抑制Slug基因表达后, 胰腺癌BxPC-3细胞株的生长明显被抑制, 并且BxPC-3细胞对放射治疗的敏感性也明显提高, 因此, Slug是胰腺癌治疗的有效靶基因. rAAV对于肿瘤的基因治疗是一种理想的载体, 对人体无毒害作用, 免疫反应小, 能有效地转导非分裂细胞, 并且可定点整合至人的19号染色体上, 产生长期基因表达[2]. 因此, rAAV是一种用于基因治疗的安全而有效的病毒载体. 本实验中我们将构建并大量制备携带siRNA-Slug基因的腺相关腺病毒载体(rAAV-siRNA-Slug), 用于胰腺癌的基因治疗.
pDC316-EGFP载体质粒、pSNAV2.0-LacZ-α载体质粒、pSNAV2.0-EGFP-si-cdc2-U6质粒、HSV1-rc/ΔUL2(北京元阳基因公司); 金黄地鼠胚胎肾细胞BHK-21(ATCC); BamHⅠ、Hind Ⅲ、EcoRⅠ、SalⅠ、Pyrobest酶(TaKaRa公司). 其他试剂为国产纯.
1.2.1 质粒构建: (1)pDC316-EGFP-Slug-siRNA质粒构建及鉴定: 根据前期筛选的有效靶点, 设计合成以下序列: sense: 5'-gatccgcaaatgtacccaatgatattcaagagatatcattgggtacatttgctttttta-3'; antisense: 5'-agcttaaaaaagcaaatgtacccaatgatatctcttgaatatcattgggtacatttgcgg-3', 其中上游加入BamHⅠ位点,下游加入HindⅢ位点, 双链退火. 酶切pDC316-EGFP-U6质粒, 回收酶切片段; 连接、转化感受态大肠杆菌DH5α; PCR鉴定pDC316-EGFP-Slug-siRNA质粒; (2)pSNAV2.0-EGFP-Slug-siRNA构建: PCR扩增EGFP-Slug-siRNA片段, 扩增条件: 94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 共30个循环, 72 ℃ 5 min. 产物经10 g/L琼脂糖凝胶10 V/cm电泳, 回收目的DNA片段. EcoRⅠ和SalⅠ双酶切回收的PCR产物, 37 ℃水浴酶切3 h. 酶切pSNAV2.0-lacz-α载体质粒, 并与前面的产物进行连接, 转化细菌; (3)重组质粒pSNAV2.0-EGFP-Slug-siRNA鉴定: PCR鉴定, 反应体系: 1.0 µL pSNAV2.0-EGFP-Slug-siRNA, 2.0 µL 10×PCR Buffer, 0.4 µL RNAi-ID-F(50 µmol/L), 0.4 µL RNAi-ID-R(50 µmol/L), 1.6 µL dNTP(2.5 mmol/L), 0.3 µL Taq酶(5 U/µL), 14.3 µL ddH2O; 扩增条件: 94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 共30个循环; 72 ℃ 5 min. PCR产物经1%琼脂糖凝胶10 V/cm电泳, 紫外成像. 酶切鉴定, PCR鉴定正确的质粒进行SalⅠ+EcoRⅠ双酶切和SmaⅠ单酶切鉴定. 测序鉴定, 对PCR鉴定和酶切鉴定正确的pSNAV2.0-EGFP-Slug-siRNA质粒送北京诺赛基因测序, 采用测序引物EGFP-U6-cexu-r作单向测序, 所测得的序列为质粒的反义序列.
1.2.2 病毒包装: (1)载体细胞株BHK/Slug-siRNA的建立: 将2×105金黄地鼠肾细胞BHK-2接种至6孔板中, 含100 mL/L FBS的RPMI 1640培养液. 37 ℃, 50 mL/L CO2, 饱和湿度条件下培养24 h后待细胞长满至90%. 用无血清RPMI 1640培养液洗细胞2次. 同时用无血清Opti-MEM®I培养液分别稀释5 µg pSNAV2.0-EGFP-Slug-siRNA质粒及10 µL LipofectamineTM2000至250 µL, 室温孵化5 min后将两者轻轻混合, 室温下静置20 min. 将上述DNA-脂质体混合液滴加至细胞上, 轻轻混匀. 37 ℃, 50 mL/L CO2, 饱和湿度培养5 h. 弃转染液, 加入2 mL含150 mL/L FBS的RPMI 1640培养液继续培养24 h. 细胞按1:4传代, 加800 mg/L G418选择培养. 待抗性细胞克隆形成并生长至孔底面积的1/2左右时, 用胰酶消化, 继续用G418选择培养直至细胞长满. 传代后换用不含G418的培养液. 将此混合细胞株命名为BHK/slug-siRAN; (2)rAAV2-EGFP-Slug-siRNA的大规模制备: 将BHK/Slug-siRNA移至转瓶培养, 培养液为每个转瓶200 mL含150 mL/L FBS的RPMI 1640培养液. 细胞长满后(约为8×108个细胞)将培养液倾出, 加HSV1-rc/ΔUL2(MOI = 1.0), 低速转动吸附病毒2 h. 每个转瓶加200 mL无血清RPMI 1640培养液37 ℃低速转动培养. 24 h后, 将每个转瓶中的液体弃去100 mL, 继续培养24 h待细胞完全病变、容易脱落. 盖紧瓶盖剧烈振摇, 将瓶壁上的细胞全部洗脱至培养液中, 2 000 r/min离心10 min去细胞碎片, 所得病毒命名为rAAV2-EGFP-Slug-siRNA. 上清分装至500 mL的三角烧瓶中, 每瓶250 mL, 进行下一步纯化; (3)rAAV2-EGFP-Slug-siRNA的纯化: 将收集的上清加入25 mL的氯仿, 置于37 ℃摇床中剧烈振摇1 h. 加入终浓度为1 mol/L的固体氯化钠, 振摇溶解, 4 ℃, 12 000 r/min离心15 min. 弃氯仿和沉淀, 取上层水相, 加终浓度为1 mol/L NaCl, 100 g/L PEG8000, 振摇溶解, 冰浴1 h, 11 000 r/min离心15 min. 弃上清, 用5 mL PBS2+将离心管管底和管壁上的沉淀吹打洗脱下来分装至1.5 mL塑料离心管中(每管0.6 mL). 加入终浓度为1 mg/L的DNase和RNase, 室温消化30 min. 加等体积的氯仿, 4 ℃, 12 000 r/min离心5 min. 无菌操作下小心吸出上层水相, 即为浓缩和纯化的rAAV2-EGFP-Slug-siRNA病毒液; (4)采用SDS-PAGE电泳检测rAAV2-EGFP-Slug-siRNA纯度: 取纯化的病毒液与2×上样缓冲液等体积混合, 沸水浴5 min, 每个加样孔加样15 µL, 浓缩胶电泳的工作电压80 V, 分离胶电压120 V, 电泳2 h. 电泳完毕后将凝胶用ddH2O漂洗2次, 再用考马斯亮蓝染色固定液在常温下固定30 min. 置于5倍体积的1.25 µg/L考马斯亮蓝R-250染液中, 室温下在脱色摇床缓慢摇动染色4 h. 用考马斯亮蓝染色脱色液脱色, 期间液换3-4次, 直到显出低背景、清晰的条带. 照相, 采用凝胶扫描图像分析系统进行纯度测定; (5)rAAV2-EGFP-Slug-siRNA的目的基因的PCR鉴定: 取10 µL rAAV2-EGFP-Slug-siRNA病毒样品, 煮沸5 min, 冰浴. 扩增条件: 94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 共30个循环; 72 ℃ 7 min. PCR产物经10 g/L琼脂糖凝胶10 V/cm电泳, 紫外成像; (6)rAAV2-EGFP-Slug-siRNA滴度测定按照文献[3]进行.
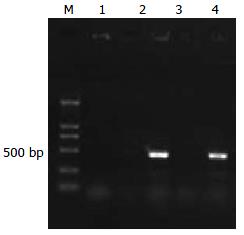
以siRNA鉴定引物扩增应能获得503 bp的条带, 2和4泳道结果与预期相符(图1).
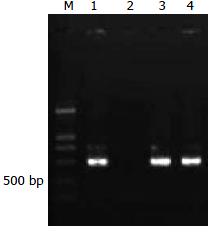
以RNAi鉴定引物扩增应能获得503 bp的条带, 1、3和4用泳道结果与预期相符(图2).
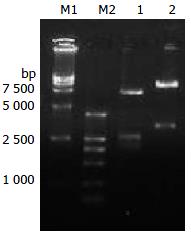
pSNAV2.0-EGFP-Slug-siRNA质粒经SmaⅠ酶切能获得4 810 bp+1 113 bp+1 009 bp+768 bp+692 bp的条带, 经SalⅠ+EcoRⅠ酶切获得7.1 kb和1.38 kb, 酶切鉴定与预期相符(图3).
将所测结果与设计的shRNA转录模板序列完全相同,与以往报道完全相同, 证实编码shRNA的序列已完全正确的插入载体中.
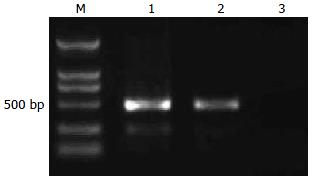
用RNAi-ID-F和RNAi-ID-R引物应能特异性扩增出503 bp左右的EGFP-Slug-siRAN-U6片段, 电泳证明该重组腺相关病毒携带目的基因EGFP-Slug-siRAN(图4).
经测定, rAAV2-EGFP-Slug-siRNA的滴度为9.23×1010 puf, 能够满足体内外动物实验的需要.
干扰性核糖核酸普遍存在于人体细胞内, 当外源性或内源性双链RNA(dsRNA)进入细胞后, 识别含有其互补序列的mRNA并与之结合后, 在酶的作用下降解mRNA, 从而干扰相应基因表达. 一些小干扰RNA(RNA interfere, RNAi)能够高效特异性地阻断相应基因的表达, 促进RNA降解, 可在细胞内发挥基因敲除的作用, 这一现象称为RNA干扰(short interfering RNA, siRNA), 他是在RNA水平调节基因表达的一种方式[4]. 随着近年来对RNA干扰的机制和功能研究, RNAi技术在肿瘤治疗方面显示出良好的前景.
我们曾将携带siRNA-Slug的载体特异干扰Slug基因表达后, 胰腺癌BxPC-3细胞株的生长明显被抑制, 并且BxPC-3细胞对放射治疗的敏感性也明显提高[2], 因此, Slug干扰是胰腺癌基因治疗有效方法.
基因治疗需要载体的协助, 基因载体系统在基因治疗中具有不可或缺的作用, 根据载体的组成和制备过程可将基因载体分为病毒载体和非病毒载体两大类. 病毒载体是将外源基因包装到天然病毒的外壳中, 利用病毒对宿主细胞的感染性将外源基因导入细胞中. 病毒载体因具有转导效率及表达效率高的特点而得到广泛应用. 目前常用的病毒载体有逆转录病毒载体、腺病毒载体、腺相关病毒载体等. 非病毒载体由于转导效率低, 其应用受到限制.
目前临床实验多用的是腺病毒和腺相关病毒. 腺病毒载体多用于肿瘤基因治疗. 其优点是易于培养和纯化基因组大, 因而可插入大片段外源基因可高效地转导不同类型的人组织细胞, 可转导非分裂细胞在细胞培养物中有高滴度的重组病毒产量进入细胞内并不整合到宿主细胞基因组, 仅瞬间表达, 因而安全性较高可原位感染组织, 如肺等. 缺点有: 表达外源基因时间短,免疫原性强, 可引发机体产生强烈的炎症反应和免疫反应, 几乎可以感染所有细胞, 而缺乏特异性.
较为优胜的是腺相关病毒, 腺相关病毒病毒基因组很小, 可感染分裂期及静止期细胞, 当辅助病毒不存在时, 能整合到宿主细胞基因组的特定区域, 无致病性, 免疫原性弱, 因此, 他无毒高效, 是目前理想的基因治疗载体.
本实验构建了携带编码靶向Slug的小发夹状干扰RNA序列的腺相关病毒载体质粒pSNAV2.0-EGFP-Slug-siRNA, 经PCR、酶切和测序鉴定, 质粒构建正确. pSNAV2.0-EGFP-Slug-siRNA质粒全长8 496 bp. 将构建成功的载体质粒与重组Ⅰ型单纯疱疹病毒HSV1-rc/ΔUL2共转染包装细胞BHK-2, 成功复制和包装出重组腺相关病毒rAAV2-EGFP-Slug-siRAN, 经检测目的片段插入成功, 滴度为9.23×1010 puf. 该病毒为我们下一步的实验提供了材料.
Slug是胰腺癌治疗的有效靶基因. rAAV对于肿瘤的基因治疗是一种理想的载体, 对人体无毒害作用, 免疫反应小, 能有效地转导非分裂细胞, 并且可定点整合至人的19号染色体上, 产生长期基因表达.
朱传武, 主任医师, 江苏省苏州市第五人民医院传染科
目前常用的病毒载体有逆转录病毒载体、腺病毒载体、腺相关病毒载体等. 非病毒载体由于转导效率低, 其应用受到限制.
以往研究发现, 脂质体转染携带siRNA-Slug的载体特异抑制Slug基因表达后, 胰腺癌BxPC-3细胞株的生长明显被抑制, 并且BxPC-3细胞对放射治疗的敏感性也明显提高.
本文设计合理, 对将来开发胰腺癌的基因治疗具有积极的意义.
编辑: 李军亮 电编:何基才
| 2. | Batchu RB, Shammas MA, Wang JY, Munshi NC. Dual level inhibition of E2F-1 activity by adeno-associated virus Rep78. J Biol Chem. 2001;276:24315-24322. [PubMed] [DOI] |
| 3. | 张 克君, 李 德春. p53正向凋亡调节因子(PUMA)重组腺病毒载体的构建及对体内外胰腺癌增殖的影响. 中华微生物学与免疫学杂志. 2009;29:12-15. |
| 4. | Agami R. RNAi and related mechanisms and their potential use for therapy. Curr Opin Chem Biol. 2002;6:829-834. [PubMed] [DOI] |
| 5. | Wadhwa R, Kaul SC, Miyagishi M, Taira K. Vectors for RNA interference. Curr Opin Mol Ther. 2004;6:367-372. [PubMed] |
| 6. | Tauşer RG, Stoica O. [Basic principles of the antisense strategy]. Rev Med Chir Soc Med Nat Iasi. 2003;107:483-486. [PubMed] |
| 7. | Sledz CA, Williams BR. RNA interference and double-stranded-RNA-activated pathways. Biochem Soc Trans. 2004;32:952-956. [PubMed] [DOI] |
| 8. | Amarzguioui M, Rossi JJ, Kim D. Approaches for chemically synthesized siRNA and vector-mediated RNAi. FEBS Lett. 2005;579:5974-5981. [PubMed] [DOI] |
| 9. | Vidal L, Blagden S, Attard G, de Bono J. Making sense of antisense. Eur J Cancer. 2005;41:2812-2818. [PubMed] [DOI] |
| 10. | Morris KV, Rossi JJ. Antiviral applications of RNAi. Handb Exp Pharmacol. 2006;105-116. [PubMed] |
| 11. | Shen Y. Advances in the development of siRNA-based therapeutics for cancer. IDrugs. 2008;11:572-578. [PubMed] |
| 12. | Rana TM. Illuminating the silence: understanding the structure and function of small RNAs. Nat Rev Mol Cell Biol. 2007;8:23-36. [PubMed] [DOI] |
| 13. | Fuchs U, Borkhardt A. The application of siRNA technology to cancer biology discovery. Adv Cancer Res. 2007;96:75-102. [PubMed] [DOI] |