修回日期: 2011-01-09
接受日期: 2011-01-21
在线出版日期: 2011-04-08
目的: 探讨微波消融术后肿瘤残余的原因及防治措施.
方法: 回顾性总结了中国医科大学附属第四医院2004-10/2010-06 465例(796个肿瘤结节)肝癌患者行微波消融治疗的临床资料, 分析了48例患者微波消融术后肿瘤残余的原因.
结果: 436例患者(754个肿瘤结节)获得有效复查资料, 其中48例(48/436, 11.01%)患者69个(69/754, 9.15%)肿瘤结节存在消融后肿瘤残余. 45例残余肿瘤患者的66个肿瘤结节再次接受微波消融治疗, 62个肿瘤获得完全消融, 完全消融率为93.94%. 1例患者的2个肿瘤结节再次接受无水乙醇消融治疗, 均获得完全消融. 2例患者接受肝癌切除治疗, 其中1例在术后1 mo仍有残余肿瘤. 统计学检验结果提示, 肿瘤直径较大、肿瘤位置特殊(肝门部、临近空腔脏器及近膈顶)、多发肿瘤、超声显像模糊者更容易发生肿瘤残余(均P<0.01), 结合肝动脉栓塞化疗(TACE)治疗可提高微波完全消融率(3.60% vs 12.39%, P<0.01). 进一步的多因素Logistic回归分析提示: 肿瘤大小、肿瘤部位、肿瘤数目, 结合TACE治疗是微波消融术后肿瘤残余的独立影响因素, 分别为肿瘤直径较大者(OR = 5.748, P = 0.016)、肿瘤位置特殊者(OR = 8.343, P<0.01)、多发性肿瘤(OR = 6.567, P = 0.001)、结合TACE治疗者(OR = 8.232, P<0.01).
结论: 肝癌微波消融术后局部肿瘤灶残留的相关因素包括肿瘤直径较大、肿瘤位置特殊、多发病灶、结合TACE治疗. 残留的局部肿瘤灶再次接受消融治疗仍是有效的治疗方法.
引文著录: 唐裕福, 张怡冰, 罗斌, 王学范, 林琳, 姜晓峰, 梁健. 肿瘤残余在肝癌微波消融治疗后出现的原因及防治. 世界华人消化杂志 2011; 19(10): 1075-1080
Revised: January 9, 2011
Accepted: January 21, 2011
Published online: April 8, 2011
AIM: To investigate the risk factors and preventive measures for partial response of hepatocellular carcinoma to percutaneous microwave ablation.
METHODS: The clinical data for 465 patients with hepatocellular carcinoma (796 tumor nodules) who underwent percutaneous microwave ablation from October 2004 to June 2010 were retrospectively analyzed. The risk factors and preventive measures for partial response to percutaneous microwave ablation were summarized.
RESULTS: Partial response occurred in 48 patients (69 tumor nodules), and the overall partial response rate was 9.15% (69/754). Of these 48 patients, 45 (64 tumor nodules) underwent percutaneous microwave ablation again and achieved complete ablation in 93.94% (62/64) of tumor nodules; 1 (2 tumor nodules) received percutaneous ethanol injection and achieved successful ablation; and 2 received palliative surgery. The incidence of partial response was positively correlated with large tumor diameter, tumor location (at the hepatic hilum or near the diaphragm or hepatic capsule), multiple tumors, and ill-defined margins on ultrasound(all P < 0.01), and complete ablation was negatively correlated with previous treatment by TACE (3.60% vs 12.39%, P < 0.01). Multivariate analysis showed that tumor size, number of nodules, tumor location, and previous treatment by TACE were independent risk factors for partial response of hepatocellular carcinoma to percutaneous microwave ablation.
CONCLUSION: Large tumor size, multiple tumors, subcapsular lesion, and previous treatment by TACE are often associated with partial response of hepatocellular carcinoma to percutaneous microwave ablation. Percutaneous microwave ablation is an effective and safe method for treatment of partial response of hepatocellular carcinoma.
- Citation: Tang YF, Zhang YB, Luo B, Wang XF, Lin L, Jiang XF, Liang J. Partial response of hepatocellular carcinoma to percutaneous microwave ablation: risk factors and preventive measures. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1075-1080
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1075.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1075
微波消融属于局部热消融治疗的一种, 目前被广泛应用于临床, 具有操作简单、安全、疗效确切等优点, 但也存在缺陷, 如治疗范围有限、消融不全致肿瘤残余及复发等[1], 尤其是肿瘤残余严重影响肝癌患者的后续治疗[2]. 本研究统计了中国医科大学附属第四医院2004-10/2010-06行微波消融治疗的465例原发性肝癌患者的临床资料, 分析了微波消融术后局部肿瘤残余的影响因素, 并对其防治进行了初步探讨.
回顾性分析了中国医科大学附属第四医院2004-10/2010-06 6 mo间, 住院的465例肝癌患者(796个肿瘤结节)接受微波消融术治疗, 其中男376例(80.9%), 女89例(19.1%). 年龄24-79(平均53.8±11.8)岁. 单个肿瘤直径8-72(平均33.8±13.1) mm. 单个肿瘤结节352例(75.7%), 多发结节113例(24.3%). 所有患者均通过超声引导下病灶穿刺活检病理证实为肝癌, 其中肝细胞癌448例, 胆管细胞癌17例.
1.2.1 入选标准: (1)不接受手术及放化疗, 仅同意微波消融治疗者; (2)外科手术很难切除的特殊病灶位置者; (3)年老体弱、难以耐受手术切除者; (4)手术切除或局部病灶消融治疗后复发者; (5)无肝外转移者, 另外患者无明显凝血功能障碍、无肝性脑病、无顽固性腹水、近期无上消化道大出血等病史.
1.2.2 微波消融术: 应用GX-1型微波肿瘤治疗仪(中国南京亿高医疗机械厂), 频率2 450 MHZ, 功率0-150 W(连续可调). ATL-3000型彩色超声仪(德国西门子公司)配合微波消融治疗. 麻醉采用静脉全身麻醉, 首先在超声引导下穿刺肿瘤病灶行病理活检, 然后行微波消融治疗. 微波输出功率60-80 W, 每个穿刺点消融时间6-18 min, 直径>4 cm的病灶行多点消融, 两穿刺针间距<3 cm, 力求微波消融后的超声显示汽化强回声范围覆盖并超过肿瘤病灶.
1.2.3 微波消融肿瘤残余的评估标准: 参照文献[3]从两方面评估微波消融后是否存在肿瘤残余: (1)术后1-2 mo复查增强CT或MRI, 显示病理性增强灶位于消融灶内或与消融灶相连; (2)肿瘤血清学指标(AFP、CEA、CA19-9), 术后1-2 mo复查比术前增高.
1.2.4 微波消融术后肿瘤残余的相关影响因素: 统计分析肝癌做病灶微波消融术患者的临床资料及术后电话随访结果. 根据临床资料、结合文献[4,5]筛选下列指标作为可能影响肝癌病灶微波消融不全的相关因素: 年龄、性别、肿瘤大小、肿瘤部位(肝实质、邻近空腔脏器及膈顶、肝门部)、肿瘤结节数目、术前AFP值、术前肝功能分级、门脉癌栓、术前肝动脉栓塞化疗(transhepatic arterial embolization, TACE)及术中超声定位清晰度等.
统计学处理 应用SPSS15.0统计软件, 单因素分析χ2检验, 对有统计学差异的指标做多因素Logistic回归分析, P<0.05为差异显著.
465例肝癌患者796个肿瘤病灶首次行微波消融术, 术后2 mo进行随访, 29例患者因各种原因失访, 失访率为6.23%; 获得有效复查资料的436例患者754个肿瘤中, 48例患者(11.01%, 48/436), 69个肿瘤(9.15%, 69/754)确认为微波消融术后肿瘤残余.
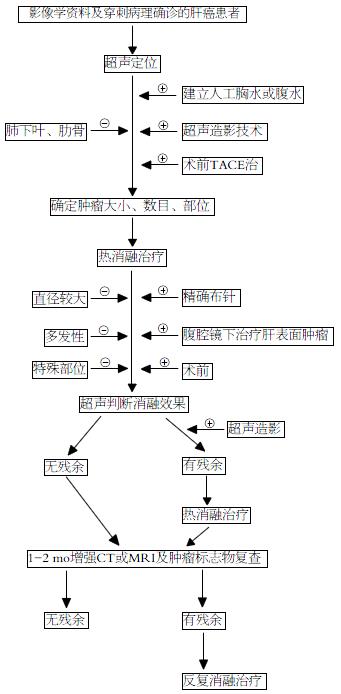
其中45例确认肿瘤残余的患者再次接受微波消融治疗, 术后1-2 mo重新随访复查结果, 45例患者的66个肿瘤灶中62个病灶被完全消融, 完全消融率为93.94%. 1例患者接受无水乙醇消融治疗, 术后1 mo复查肿瘤病灶被完全消融. 2例患者接受肝癌切除手术, 术后复查1例患者存在肿瘤复发, 另1例未见肿瘤复发. 通过对本次研究相关临床资料的总结及45例微波消融后肿瘤残余患者的处理,初步总结了肝癌热消融后肿瘤残余的防治途径(图1).
应用SPSS15.0软件, χ2检验结果提示, 肿瘤直径较大、肿瘤特殊位置(肝门部、邻近空腔脏器及膈顶)、多发肿瘤、不易超声定位的病灶容易发生肿瘤残余(均P<0.01), 术前行TACE治疗可提高微波完全消融(P<0.01). 多因素Logistic回归分析提示, 肿瘤大小、肿瘤部位、肿瘤数目, 结合TACE治疗是微波消融术后肿瘤残余的独立影响因素, 结果分别为肿瘤直径较大者(OR = 5.748, P = 0.016)、肿瘤特殊位置(OR = 8.343, P = 0.000)、多发性肿瘤病灶(OR = 6.567, P = 0.001)、结合TACE治疗者(OR = 8.232, P = 0.000, 表1, 2).
| 临床资料 | 消融的肿瘤数目(n) | 消融不全1的肿瘤数目(n) | 肿瘤残余率(%) | χ2值 | P值 |
| 性别 | |||||
| 男 | 637 | 56 | 8.79 | 0.640 | 0.424 |
| 女 | 117 | 13 | 11.11 | ||
| 年龄(岁) | |||||
| >60 | 211 | 22 | 10.43 | 0.573 | 0.449 |
| <60 | 543 | 47 | 8.66 | ||
| 肿瘤大小(cm) | |||||
| 3 | 493 | 39 | 7.91 | 42.006 | 0.000 |
| 3-5 | 217 | 14 | 6.45 | ||
| >5 | 44 | 16 | 36.36 | ||
| 肿瘤部位 | |||||
| 肝实质内 | 391 | 23 | 5.88 | 39.903 | 0.000 |
| 包膜下 | 159 | 13 | 8.18 | ||
| 近肝膈顶 | 72 | 21 | 29.17 | ||
| 肝门部 | 132 | 12 | 9.09 | ||
| 肿瘤结节数目 | |||||
| 单发 | 328 | 18 | 5.49 | 9.371 | 0.002 |
| 多发 | 426 | 51 | 11.97 | ||
| 肿瘤分化程度 | |||||
| 低分化 | 207 | 20 | 9.66 | 0.102 | 0.950 |
| 中分化 | 286 | 26 | 9.09 | ||
| 高分化 | 261 | 23 | 8.81 | ||
| 术前AFP值(μg/L) | |||||
| <200 | 274 | 21 | 7.66 | 1.145 | 0.285 |
| 200 | 480 | 48 | 10.00 | ||
| Child-Pugh肝功能分级 | |||||
| Child A | 495 | 42 | 8.48 | 0.770 | 0.380 |
| Child B | 259 | 27 | 10.42 | ||
| 门脉癌栓 | |||||
| 有 | 178 | 16 | 8.99 | 0.001 | 0.982 |
| 无 | 586 | 53 | 9.04 | ||
| 结合TACE | |||||
| 有 | 278 | 10 | 3.60 | 16.339 | 0.000 |
| 无 | 476 | 59 | 12.39 | ||
| 超声定位清晰度 | |||||
| 清晰 | 582 | 41 | 7.04 | 13.618 | 0.000 |
| 模糊 | 172 | 28 | 16.28 |
| 项目 | OR值 | P值 | 95%CI |
| 肿瘤大小 | 5.748 | 0.016 | 1.388-23.795 |
| 肿瘤部位 | 8.343 | 0.000 | 2.940-23.678 |
| 肿瘤数目 | 6.567 | 0.001 | 2.231-19.332 |
| 结合TACE | 8.232 | 0.000 | 2.549-26.580 |
随着微波消融治疗技术在临床肝癌的广泛应用, 有关其并发症的临床报道越来越受到人们的关注. 对肝癌病灶的微波消融微创治疗的主要并发症包括出血、肿瘤残余(消融不全)、胆汁漏、肝脓肿、血气胸、周围脏器损伤、经针道的肿瘤转移, 术中血红蛋白尿等[1,6,7]. 其中肿瘤残余是对肝癌局部热消融治疗后、近期肿瘤复发的主要原因, 对肝癌的后续治疗至关重要[2], 因此深入研究微波消融术后肝癌肿瘤残余的原因, 对提高肝癌患者的生存时间具有重要的临床意义.
参考文献[8-10], 本研究主要涉及以下因素进行探讨: (1)患者情况, 例如年龄、性别、肝功能分级等; (2)与治疗相关的因素, 例如热消融的功率和时间、热消融针道的选择、术前是否行TACE治疗等; (3)局部肿瘤病灶的相关因素, 例如肿瘤大小、生长位置及与邻近器官的关系、病灶的数目等. 统计分析结果提示: 肿瘤大小、肿瘤病灶的特殊位置、肿瘤数目以及术前TACE是微波消融后局部肿瘤残余的重要相关因素.
肿瘤大小是影响肝癌热消融治疗效果的主要因素之一[3-5,8-11], Komorizono等[8]研究证实肿瘤直径>2 cm是局部残余肿瘤复发的危险因素. 翟博等[3]研究发现, 随着肿瘤直径越大, 消融后肿瘤活性组织的残余率越高. 本研究亦证实了同样结论. 直径大的肿瘤消融治疗后容易残留的原因: (1)肿瘤直径过大, 消融时容易出现三维上的漏空, 导致病灶消融不完全[12]; (2)临床常选择多点消融, 但存在消融重叠和盲区; (3)直径越大其边界常不规则, 消融时其安全边缘常不易确定, 很难做到一次性消融完全[3]; (4)肿瘤直径越大, 其分化越差、侵袭性越强, 更易发生肿瘤微转移, 更容易在肿瘤较远的地方形成卫星灶[13]; (5)采用超声波下判断消融的范围, 由于大肿瘤多点消融产生的局部汽化增强改变, 影响了再次穿刺的精确把握.
肝内病灶数目也是影响局部消融治疗效果的因素之一[4]. 本次研究证实多发性肿瘤微波消融治疗后更容易发生肿瘤残余, 这可能与以下因素有关: (1)肝内多发性肿瘤提示已发生肝内转移, 即使肉眼可见的肿瘤全部被消融仍然存在肿瘤的微转移; (2)多发性肿瘤, 常因为相邻肿瘤间距较近, 肿瘤消融后的汽化改变掩盖了相邻病灶, 导致相邻肿瘤穿刺定位不准.
文献报道[3-4,8-11]及本研究均证实肿瘤部位是热消融后肿瘤残余的危险因素. 本次研究结果还显示, 肝门部、邻近空腔脏器及膈顶的肿瘤容易发生消融后肿瘤残余. (1)邻近空腔脏器及膈顶的肿瘤易发生消融后出血、感染、周围脏器损伤等并发症[1,14]; (2)由于病灶消融的安全边缘不易确定, 也容易发生针道转移[8]; (3)近膈顶部肿瘤可因肺叶、肋骨的覆盖使超声显影困难; (4)肝门部的肿瘤消融常有残余, 一方面临近大血管, 血液循环带走部分热量[15-17], 致使肿瘤消融温度不够. 另一方面肝门部管道结构密集, 微波针穿刺方向不易掌握, 出于安全考虑, 存在消融盲区导致消融后肿瘤残余[3].
有关热消融治疗联合TACE治疗的研究证实了治疗前TACE有利于增大局部热消融的范围[3,17]. 本研究结果证实先行TACE治疗的肿瘤残余率明显低于未结合TACE的患者. 可能性包括: (1)阻断肝动脉血流, 减少了"热流失效应", 提高热消融的效率; TACE治疗后碘油可引起周围性栓塞使肿瘤内血供减少, 进而提高热消融的效率[17]. 此外TACE治疗后肿瘤组织缺血和炎性水肿, 可以增大微波消融的范围[18]; (2)碘油沉积使肿瘤位置及边界显影更加清晰[19]; (3)TACE可使肿瘤体积减小, 使微波消融的效果更明显[19].
总之, 肿瘤相关因素是肝癌热消融治疗后肿瘤残余的最重要影响因素, 先行TACE治疗可以提高肿瘤的完全消融率. 我们认为通过如下途径对防治热消融后肿瘤残余有临床意义: (1)对于直径较大、多发性肿瘤及肝门部的肿瘤, 最好先做TACE治疗; (2)直径>3 cm的肿瘤, 建议采用多点消融方式治疗. Chen等[20]研究发现, 应用数学公式决定肿瘤消融点数及精确、合理的空间排布可以扩大消融范围, 降低肿瘤残余率; (3)对于位于肝脏表面的肿瘤, 有学者利用腹腔下局部消融取得较满意的效果[21,22], 其定位直观清楚、引导穿刺准确, 可以在腹腔下即时观察肿瘤消融的情况, 并可以避免损伤周围脏器; (4)消融后即刻应用超声造影技术, 能区分无灌注的凝固区域和有灌注的残癌区域[23], 有利于残癌的及时发现. 对残余肿瘤若能及时再次消融治疗, 可以提高完全消融率; (5)对于微波消融治疗的患者, 治疗后1-2 mo应常规复查CT或MRI及肿瘤血清学指标(AFP、CEA、CA19-9). 本研究组的肿瘤残余患者, 绝大多数再次接受微波消融治疗, 取得良好的临床效果.
此外, 临床操作时尚有许多环节影响局部热消融的治疗效果, 例如操作熟练程度及超声技术熟练程度[24]、消融及超声等仪器设备的改良[25,26]等. 有关微波消融治疗后肿瘤残余的其他影响因素, 有待进一步研究.
通过微波消融治疗肝癌在临床上已经被广泛应用, 具有操作简单、安全、疗效确切等优点, 但也存在缺陷, 受肿瘤位置影响, 存在消融不全致肿瘤残余, 影响肝癌患者的生存时间.
荚卫东, 教授, 安徽省立医院肝胆外科
翟博等研究发现, 随着肿瘤直径越大, 消融后肿瘤活性组织的残余率越高.
本研究通过总结45例微波消融治疗后肿瘤残余的肝癌患者的临床资料, 系统地探讨了微波消融治疗后肿瘤残余的相关影响因素及其防治措施.
本研究总结了肝癌微波消融治疗后肿瘤残余的相关影响因素, 分别为肿瘤大小、肿瘤部位、肿瘤数目及术前TACE; 术前TACE可以提高肿瘤完全消融率; 微波消融治疗后患者应早期复查CT或MRI及肿瘤血清学指标, 及时发现残余肿瘤; 对于残余肿瘤, 再次消融治疗仍是安全有效的治疗方法.
本文设计合理, 讨论较全面, 内容较新颖, 对临床有一定的指导意义.
编辑: 李薇 电编:李薇
| 1. | Shimada S, Hirota M, Beppu T, Matsuda T, Hayashi N, Tashima S, Takai E, Yamaguchi K, Inoue K, Ogawa M. Complications and management of microwave coagulation therapy for primary and metastatic liver tumors. Surg Today. 1998;28:1130-1137. [PubMed] [DOI] |
| 2. | Choi H, Loyer EM, DuBrow RA, Kaur H, David CL, Huang S, Curley S, Charnsangavej C. Radio-frequency ablation of liver tumors: assessment of therapeutic response and complications. Radiographics. 2001;21 Spec No:S41-S54. [PubMed] |
| 4. | Liang P, Dong B, Yu X, Yang Y, Yu D, Su L, Xiao Q, Sheng L. Prognostic factors for percutaneous microwave coagulation therapy of hepatic metastases. AJR Am J Roentgenol. 2003;181:1319-1325. [PubMed] |
| 5. | Kuvshinoff BW, Ota DM. Radiofrequency ablation of liver tumors: influence of technique and tumor size. Surgery. 2002;132:605-611; discussion 611-612. [PubMed] [DOI] |
| 7. | Huo TI, Huang YH, Wu JC. Percutaneous ablation therapy for hepatocellular carcinoma: current practice and future perspectives. J Chin Med Assoc. 2005;68:155-159. [PubMed] [DOI] |
| 8. | Komorizono Y, Oketani M, Sako K, Yamasaki N, Shibatou T, Maeda M, Kohara K, Shigenobu S, Ishibashi K, Arima T. Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session, single application of percutaneous radiofrequency ablation. Cancer. 2003;97:1253-1262. [PubMed] [DOI] |
| 9. | Hori T, Nagata K, Hasuike S, Onaga M, Motoda M, Moriuchi A, Iwakiri H, Uto H, Kato J, Ido A. Risk factors for the local recurrence of hepatocellular carcinoma after a single session of percutaneous radiofrequency ablation. J Gastroenterol. 2003;38:977-981. [PubMed] [DOI] |
| 10. | 夏 景林, 叶 生龙, 邹 静怀, 任 正刚, 干 育红, 王 艳红, 陈 漪, 葛 宁灵, 汤 钊猷, 杨 秉辉. 单次经皮射频消融治疗小肝癌的预后及复发危险因素分析. 癌症. 2004;23:977-980. |
| 11. | Yu HC, Cheng JS, Lai KH, Lin CP, Lo GH, Lin CK, Hsu PI, Chan HH, Lo CC, Tsai WL. Factors for early tumor recurrence of single small hepatocellular carcinoma after percutaneous radiofrequency ablation therapy. World J Gastroenterol. 2005;11:1439-1444. [PubMed] |
| 13. | Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008. J Hepatol. 2008;48 Suppl 1:S20-S37. [PubMed] [DOI] |
| 15. | Yu NC, Raman SS, Kim YJ, Lassman C, Chang X, Lu DS. Microwave liver ablation: influence of hepatic vein size on heat-sink effect in a porcine model. J Vasc Interv Radiol. 2008;19:1087-1092. [PubMed] [DOI] |
| 16. | Patterson EJ, Scudamore CH, Owen DA, Nagy AG, Buczkowski AK. Radiofrequency ablation of porcine liver in vivo: effects of blood flow and treatment time on lesion size. Ann Surg. 1998;227:559-565. [PubMed] [DOI] |
| 17. | Ishida T, Murakami T, Shibata T, Inoue Y, Takamura M, Niinobu T, Sato T, Nakamura H. Percutaneous microwave tumor coagulation for hepatocellular carcinomas with interruption of segmental hepatic blood flow. J Vasc Interv Radiol. 2002;13:185-191. [PubMed] [DOI] |
| 19. | Yang WZ, Jiang N, Huang N, Huang JY, Zheng QB, Shen Q. Combined therapy with transcatheter arterial chemoembolization and percutaneous microwave coagulation for small hepatocellular carcinoma. World J Gastroenterol. 2009;15:748-752. [PubMed] [DOI] |
| 20. | Chen MH, Yang W, Yan K, Zou MW, Solbiati L, Liu JB, Dai Y. Large liver tumors: protocol for radiofrequency ablation and its clinical application in 110 patients--mathematic model, overlapping mode, and electrode placement process. Radiology. 2004;232:260-271. [PubMed] [DOI] |
| 21. | Sakaguchi H, Seki S, Tsuji K, Teramoto K, Suzuki M, Kioka K, Isoda N, Ido K. Endoscopic thermal ablation therapies for hepatocellular carcinoma: a multi-center study. Hepatol Res. 2009;39:47-52. [PubMed] [DOI] |
| 22. | Kawamoto C, Ido K, Isoda N, Hozumi M, Nagamine N, Ono K, Sato Y, Kobayashi Y, Nagae G, Sugano K. Long-term outcomes for patients with solitary hepatocellular carcinoma treated by laparoscopic microwave coagulation. Cancer. 2005;103:985-993. [PubMed] [DOI] |
| 23. | Youk JH, Kim CS, Lee JM. Contrast-enhanced agent detection imaging: value in the characterization of focal hepatic lesions. J Ultrasound Med. 2003;22:897-910. [PubMed] |
| 24. | Poon RT, Ng KK, Lam CM, Ai V, Yuen J, Fan ST, Wong J. Learning curve for radiofrequency ablation of liver tumors: prospective analysis of initial 100 patients in a tertiary institution. Ann Surg. 2004;239:441-449. [PubMed] [DOI] |
| 25. | Yu Z, Liu W, Fan L, Shao J, Huang Y, Si X. The efficacy and safety of percutaneous microwave coagulation by a new microwave delivery system in large hepatocellular carcinomas: four case studies. Int J Hyperthermia. 2009;25:392-398. [PubMed] [DOI] |
| 26. | Hotta N, Fukuzawa Y, Ayada M, Sato K, Maeno T, Tagaya T, Okumura A, Ishikawa T, Ito Y, Kakumu S. A case of hepatocellular carcinoma (HCC) treated with radiofrequency ablation (RFA) using 4D real-time ultrasound system. Hepatogastroenterology. 2005;52:1224-1227. [PubMed] |