修回日期: 2011-03-14
接受日期: 2011-03-23
在线出版日期: 2011-04-08
目的: 研究丹参酮ⅡA诱导人胰腺癌细胞凋亡和凋亡相关基因表达的JNK信号转导通路, 揭示其抗胰腺癌的部分机制.
方法: MTT法观察丹参酮ⅡA对人胰腺癌PANC-1细胞的生长抑制作用; 8、16、32 mg/L丹参酮ⅡA分别作用人胰腺癌PANC-1细胞48 h后, 免疫荧光染色观察细胞凋亡情况; 流式细胞仪法(FCM)检测细胞凋亡; Western blot检测丹参酮ⅡA作用PANC-1细胞后SAPK/JNK信号通路的激活情况, 荧光定量PCR检测Survivin基因mRNA的表达水平; 并比较阻断JNK信号通路后, 丹参酮ⅡA对胰腺癌细胞凋亡Survivin基因mRNA的表达.
结果: MTT法测得丹参酮ⅡA对人胰腺癌PANC-1细胞的生长抑制率均有显著的抑制作用, 其作用与剂量和作用时间成正相关; 丹参酮ⅡA作用48 h后, 荧光显微镜下观察到经Hoechst染色的典型凋亡细胞. 8、16、32 mg/L浓度丹参酮ⅡA作用人胰腺癌细胞后的细胞凋亡率分别为8.83%±1.51%, 12.86%±2.70%和21.24%±2.58%, 与对照组(0.63%±0.18%)比较, 均有显著性差异(均P<0.01); 阻断JNK信号通路后, 凋亡率明显降低(P<0.01). 丹参酮ⅡA作用人胰腺癌细胞1 h后JNK信号通路被激活, 4 h达峰值. 16 mg/L丹参酮ⅡA作用人胰腺癌细胞48 h后, Survivin mRNA的表达明显下降, 分别为正常细胞的0.61, 0.39, 0.10倍; 阻断JNK信号通路后, 丹参酮ⅡA作用人胰腺癌细胞的Survivin mRNA的表达明显上升.
结论: 丹参酮ⅡA能诱导人胰腺癌PANC-1细胞株凋亡. 通过JNK信号转导通路下调Survivin mRNA的表达可能是其诱导胰腺癌细胞凋亡的重要机制.
引文著录: 王炎, 李琦, 范忠泽, 王忆勤, 邱艳艳, 靳宝辉, 陈星竹, 殷佩浩. 丹参酮ⅡA对人胰腺癌细胞凋亡的诱导作用及其对SAPK/JNK信号转导通路的影响. 世界华人消化杂志 2011; 19(10): 1028-1033
Revised: March 14, 2011
Accepted: March 23, 2011
Published online: April 8, 2011
AIM: To investigate whether tanshinone IIA (TSIIA) induces apoptosis of human pancreatic cancer cells via the SAPK/JNK signal pathway.
METHODS: After treatment with TSIIA, MTT assay was used to observe the cytostatic effect of TSIIA on human pancreatic cancer PANC-1 cells; cell apoptosis was assessed by immunofluorescence and flow cytometry (FCM); p-JNK expression was assayed by Western blot; and mRNA expression of survivin was detected by quantitative fluorescence PCR.
RESULTS: TSIIA inhibited PANC-1 cell growth in a concentration- and time-dependent manner. After PANC-1 cells were treated with 8, 16, or 32 mg/L of TSIIA for 48 h, typical morphologic changes of apoptosis were observed by fluorescence microscopy after Hoechst staining. The apoptosis rates of cells treated with 8, 16, and 32 mg/L of TSIIA for 48 h were (8.83 ± 1.51)%, (12.86 ± 2.70)% and (21.24 ± 2.58)%, respectively, showing a significant difference among the three groups (P < 0.01). After the SAPK/JNK signal pathway was blocked, cell apoptosis rate decreased significantly (P < 0.01). p-JNK expression began to increase at 1 h and reached the peak at 4 h after TSIIA treatment. The mRNA expression of the survivin gene decreased obviously after treatment with 16 mg/L TSIIA for 48 h but increased significantly when the SAPK/JNK signal transduction pathway was blocked.
CONCLUSION: TSIIA can induce human pancreatic cancer cell apoptosis. TSIIA exerts anti-pancreatic cancer effects possibly by down-regulating the expression of survivin mRNA via the SAPK/JNK signal transduction pathway.
- Citation: Wang Y, Li Q, Fan ZZ, Wang YQ, Qiu YY, Jin BH, Chen XZ, Yin PH. Tanshinone IIA induces apoptosis of pancreatic cancer cells via the SAPK/JNK signal pathway. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1028-1033
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1028.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1028
丹参酮ⅡA(tanshinone ⅡA, TSⅡA)为中药丹参主要有效成分之一, 最早用于治疗心脑血管疾病. 近年研究发现, TSⅡA对肝癌、胃癌等多种肿瘤细胞具有显著的杀伤作用, 引起了人们的广泛关注[1-3]. 国内外已有的研究[4-6]证实, TSⅡA能够诱导体外培养的细胞凋亡. 我们最近的实验研究也表明, TSⅡA能够显著地抑制小鼠胰腺癌瘤体生长, 延长生存期, 其抗胰腺癌的主要机制是诱导细胞凋亡[7,8]. 但其诱导细胞凋亡机制尚不明确. 本研究从细胞内信号转导角度对TSⅡA诱导人胰腺癌细胞株PANC-1细胞凋亡及凋亡相关基因进行研究, 探讨p38MAPK信号通路在TSⅡA诱导人胰腺癌细胞凋亡中的作用, 为揭示TSⅡA治疗胰腺癌的机制提供实验依据.
人胰腺癌细胞株PANC-1购于中科院上海细胞研究所; TSⅡA购自西安冠宇生物技术有限公司, 纯度≥98%(批号: 200512001). JNK特异性的抑制剂sp600125购于美国Serologllcais公司; 总RNA抽提试剂RNAiso Reagent、荧光定量PCR试剂日本TaKaRa公司; GAPDH、Survivin上下游引物和探针由上海闪晶分子生物科技有限公司设计并合成, 5'端标记上报告荧光基团FAM(6-carboxy-fluo-rescein-phosphoramidite), 3'端标记上淬灭荧光基团TAMRA(carboxy-tetramethyl-rhodamine). 引物序列如下: 上游引物: 5'-GGTTCATCCAGTCGCTTTGT-3', 下游引物: 5'-AATTCTGTTGCCACCTTTCG-3'; 内参GAPDH作为对照, 上游引物: 5'-CCACTCCTCCACCTTTGAC-3', 下游引物: 5'-ACCCTGTTGCTGTAGCCA-3'. 氯仿、异丙醇、无水乙醇均为分析纯.
1.2.1 MTT法测定TSⅡA对人胰腺癌细胞的生长抑制作用: 取对数生长期的人胰腺癌PANC-1细胞, 调整细胞浓度至2×107/L, 以每孔100 μL接种于96孔培养板中, 在50 mL/L CO2、饱和湿度、37 ℃孵箱中预培养24 h后加入100 μL不同浓度培养液配制的TSⅡA, 使最终每组含TSⅡA浓度分别为: 2、4、8、16、32、64 mg/L 6个剂量, 每个剂量分别设4个复孔, 并设正常细胞作对照组, 继续培养. 分别于24、48、72 h 3个时相进行MTT比色实验: 每次于实验结束前每孔加入浓度为5 g/L MTT液20 μL, 37 ℃避光培养继续培养4 h, 使MTT还原为formazan. 每孔加DMSO 150 μL, 震荡10 min, 混匀使formazan充分溶解, 10 min后置于酶标仪570 nm检测吸光度(A)值, 以空白组平均值调零, 按以下公式计算抑制率: 细胞生长抑制率 = (1-实验孔平均A值)/对照孔平均A值×100%, 以剂量和生长抑制率作直线相关分析.
1.2.2 Hoechst染色观察细胞凋亡形态: PANC-1细胞常规培养, 取对数生长期细胞制备细胞悬液, 以每孔1×105个细胞接种于6孔培养板中, 在37 ℃、50 mL/L CO2的培养箱中培养过夜. 加不同浓度TSⅡA (浓度为8、16、32 mg/L)作用48 h后, 按说明书固定、染色、封片. 荧光显微镜下激发波长350 nm, 发射波长460 nm观察.
1.2.3 流式细胞仪检测细胞凋亡: 人胰腺癌PANC-1细胞常规培养至对数生长期, 换无血清培养液培养12 h使细胞周期同步化, 设8、16、32 mg/L TSⅡA组, 20 μmol/L的JNK抑制剂sp600125组, 20 μmol/L的JNK抑制剂sp600125 TSⅡA组, 培养48 h后, 分别收集各组细胞置于10 mL离心管中. 各样本的细胞密度为1×109/L, 1 000 r/min离心5 min后弃去培养液. 用孵育缓冲液洗涤1次, 1 000 r/min离心5 min, 用100 μL标记溶液重悬细胞, 室温下避光孵育15 min, 1 000 r/min离心5 min沉淀细胞, 孵育缓冲液洗1次. 加入Annexin V-FITC /PI溶液5 μL, 4 ℃下孵育20 min. 最后补400 μL PBS, 用流式细胞仪(FACS Calibur, BD公司)检测细胞凋亡情况. 每个样品检测1万个细胞, 用Cell Quest软件分析细胞凋亡情况.
1.2.4 Western印迹法检测JNK的磷酸化: 将各组细胞用预冷的PBS液洗2次, 吸弃PBS液, 加入预冷的含抑制剂的蛋白质抽提试剂, 轻轻摇动5 min后, 用一预冷的橡胶和塑料细胞刮刮下培养瓶壁上细胞, 转移细胞悬液到离心管中, 冰浴15 min进行裂解. 裂解液于预冷的离心机中14 000 r/min离心15 min, 吸弃上清液; BCA法测定蛋白质浓度. 50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 膜在5% BSA溶液中室温培养1 h, 以封闭膜上的非特异结合. 封闭过的膜加入一抗4 ℃过夜. TBST洗膜3次, 每次5 min; 再加入HRP标记的二抗, 室温孵育1 h, TBST洗膜3次, 每次5 min; 同样方法标记鼠单克隆抗GAPDH作对照. 洗膜稍干后, 按1:1加入AB显影液(与二抗HRP结合), 在Bio-Rad的化学发光成像仪上显影, 然后分析灰度值, 再计算灰度系数比.
1.2.5 荧光定量PCR检测Survivin mRNA表达: 将TSⅡA稀释至终浓度为16 mg/L, 处理人胰腺癌细胞48 h后加胰酶消化离心收集细胞. 将各组细胞分别加入2 mL RNAiso, 按说明书提取总RNA, 1 μL总RNA在20 μL体系中按照标准程序进行反转录, 反应条件: 37 ℃ 15 min, 85 ℃ 5 s. Survivin和GAPDH基因荧光定量PCR反应体系均如下: Premix EX TaqTM 10 μL, Rox Reference Dye 0.4 μL, 上下游引物各0.4 μL, 荧光探针0.8 μL, dH2O 6 μL, cDNA 2 μL, 20 μL体系, 反应条件如下: (1)预变性: 95 ℃ 10 s; (2)变性: 95 ℃ 5 s; (3)退火, 延伸: 60 ℃ 31 s, 40个循环, 数据采用ABI 7300 SDS Software分析. 相对mRNA表达 = 2-ΔCt, ΔCt值 = 靶基因Ct值-GAPDH Ct值. 以GAPDH作为内参照, 同时以PANC-1细胞作为基准, 各组细胞mRNA的表达量表示成PANC-1细胞的N倍. N = 样品表达量/基准表达量 = 2-样本ΔCt/2-基准ΔCt, 每组均做3个样本, 取均数.
统计学处理 采用PEMS3.1医学统计软件包进行统计分析. 采用计量资料以mean±SD表示. 多样本比较采用单因素方差分析, Student's t, Rank sum test, SNK检验方法进行统计分析, 组间比较用t或t'检验. P<0.05具有统计学差异.
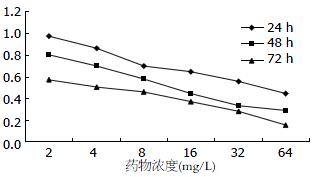
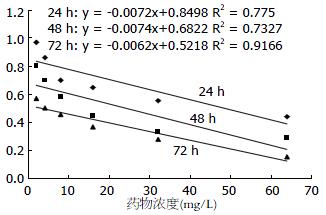
不同剂量的TSⅡA在对PANC-1细胞的生长均有一定的抑制作用. 在相同的作用时间随着TSⅡA作用剂量的增加对PANC-1细胞的生长抑制率明显增高(P<0.01, 图1), 量效关系明显, 以下公式表明TSⅡA剂量与抑制率成正相关. TSⅡA剂量和对胰腺癌细胞的生长抑制率之间的直线回归方程为: 24 h: y = -0.0072x+0.8498, R2 = 0.775; 48 h: y = -0.0074x+0.6822, R2 = 0.7327; 72 h: y = -0.0062x+0.5218, R2 = 0.9166. 72 h半数抑制浓度(IC50)为3.52 mg/L(图2).
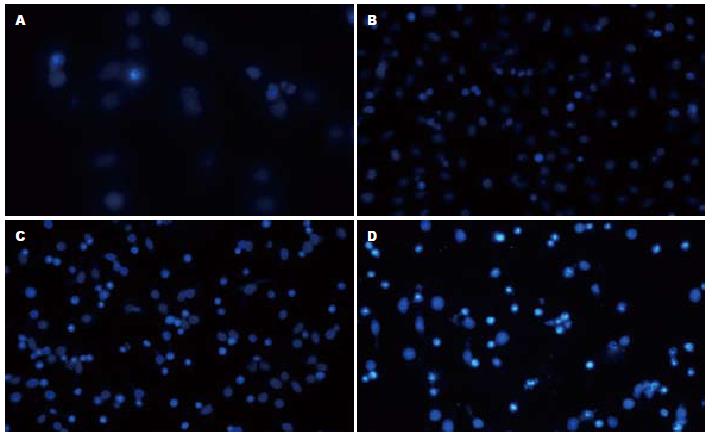
荧光显微镜下对照组PANC-1细胞(未加药物处理)核呈弥漫均匀的蓝色荧光染色, 未见凋亡荧光染色细胞. 8、16、32 mg/L剂量的TSⅡA作用于人胰腺癌PANC-1细胞后, 均可见凋亡细胞, 表现为胞核或胞质内可见浓染致密的颗粒荧光及块状荧光(DNA荧光碎片, 图3).
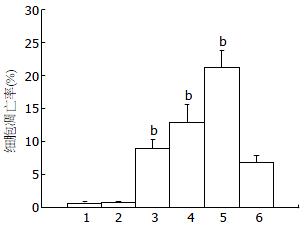
8、16、32 mg/L浓度的TSⅡA作用人胰腺癌细胞后的细胞凋亡率明显高于对照组的凋亡率(8.83%±1.51, 12.86±2.70%, 21.24±2.58% vs 0.63±0.18%), 并出现凋亡典型性特征峰. 加入抑制剂sp600125组的细胞凋亡率, TSⅡA组作用人胰腺癌细胞后凋亡率显著提高(0.78±0.09% vs 0.63±0.18%, P<0.01); 阻断SAPK/JNK信号转导通路后TSⅡA作用人胰腺癌细胞后凋亡率明显降低(P<0.01). 提示TSⅡA通过胰腺癌细胞内SAPK/JNK信号转导途径诱导细胞凋亡(图4).
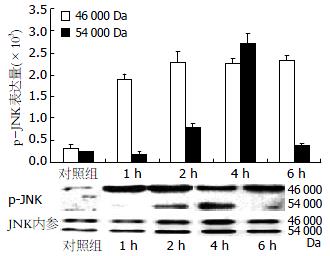
对照组PANC-1细胞p-JNK弱表达, TSⅡA作用PANC-1细胞1 h时JNK被迅速激活, 随着作用时间的延长p-JNK表达逐步增强, 4 h达峰值, 约为对照组的 2.5倍(图5).
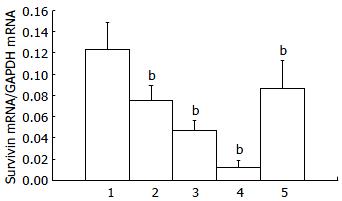
TSⅡA作用人胰腺癌细胞48 h后Survivin mRNA的表达明显下调(P<0.01), 分别为正常细胞的0.61, 0.39, 0.10倍; 阻断SAPK/JNK信号通路后, Survivin mRNA的表达明显上调(P<0.01, 图6).
胰腺癌属于中医中"癥瘕"、"积聚"等范畴. 近年来, 中医药治疗胰腺癌显现出一定的优势, 引起了人们关注, 现代研究发现[9-11], 中医药在胰腺癌治疗中具有在减轻症状、控制肿瘤发展、延长带瘤生存期等方面作用. 瘀血是肿瘤的常见中医症候, 活血化瘀是肿瘤的重要的中医治法之一. 中药丹参是活血化瘀的要药, 丹参酮是从中药丹参中提取的脂溶性有效成分, 按其不同的化学结构分为TanⅠA、TanⅡA、TanⅢB, 丹参酮Ⅳ等15种成分, 其中TSⅡA具有天然抗炎、抗氧化作用, 早年主要用于心脑血管病, 近年来研究发现对肝癌等多种肿瘤细胞具有抑制作用, 其抗肿瘤的作用的通过诱导细胞凋亡途径的来实现[12,13]. 课题组前期实验研究也表明, TSⅡA能够显著地抑制小鼠胰腺癌瘤体生长, 延长生存期, 其抗胰腺癌的主要机制是诱导细胞凋亡.
细胞凋亡是在基因调控下的细胞程序性死亡, 临床上除了大剂量化疗、放疗可能引起细胞坏死外, 一般抗癌药物、激素制剂、放疗、中药等的主要作用机制之一, 都是通过诱导各自敏感的细胞发生凋亡来达到治疗目的. 凋亡不仅直接影响着机体组织的正常发育、分化与死亡, 他在肿瘤治疗中的作用也已受到极大的重视[14-16].
c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)也被称为应激活化蛋白激酶(stress-activated protein kinase, SAPK), 是丝裂原活化蛋白酶(mitogen-activated protein kinase, MAPK)家族中的重要成员, 是细胞内重要的信号转导通路之一[17-19]. JNK位于细胞质, 相对分子质量为54 000 Da的丝氨酸/苏氨酸蛋白激酶. JNK包含双磷酸化的功能区Thr-Pro-Tyr, JNK与其下游c-Jun N端的活化区结合并使其第63, 73位丝氨酸残基磷酸化, JNK的活化是通过其氨基酸残基端的磷酸化, 在静止细胞中, JNK通过磷酸化反应而激活, 一旦被激活, 胞质中的JNK移位到细胞核, 通过对转录因子c-Jun, ATF-2, Elk-1等的磷酸化促进基因的表达及新蛋白质的合成, 而促进或引起细胞凋亡[20]. 目前, 多数研究认为JNK通路是化疗药物, 紫外线照射及Fas蛋白等诱导细胞凋亡所必需的通路, 并必须持续激活JNK才能诱导细胞凋亡[21-23].
我们在实验中发现, TSⅡA对人胰腺癌PANC-1细胞的生长抑制率均有显著的抑制作用, 其作用与剂量和作用时间成正相关; TSⅡA作用48 h后, 荧光显微镜下观察到经Hoechst染色的典型凋亡细胞. 8、16、32 mg/L浓度TSⅡA作用人胰腺癌细胞后的细胞凋亡率分别为8.83%±1.51%, 12.86%±2.70%和21.24%±2.58%, 与对照组(0.63%±0.18%)比较, 均有显著性差异(P<0.01); 阻断JNK信号通路后, 凋亡率明显降低(P<0.01). TSⅡA作用人胰腺癌细胞1 h后, JNK信号通路被激活, 4 h达峰值. 16 mg/L TSⅡA作用人胰腺癌细胞48 h后, Survivin mRNA的表达明显下降; 阻断JNK信号通路后, TSⅡA作用人胰腺癌细胞的Survivin mRNA的表达明显上升. 提示TSⅡA治疗胰腺癌的机制与诱导胰腺癌细胞凋亡有关, 通过JNK信号转导下调Survivin mRNA是TSⅡA诱导胰腺癌细胞凋亡的重要机制之一. 本实验显示TSⅡA具有较好的诱导胰腺癌细胞凋亡的作用, 在治疗胰腺癌方面具有较好的应用前景.
丹参酮ⅡA是中药丹参的有效成分之一, 近年研究发现, 丹参酮ⅡA对胰腺癌等多种肿瘤细胞具有显著的杀伤作用, 已成为肿瘤治疗的一个新靶点.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室; 张春虎, 副教授, 中南大学湘雅医院中西医结合研究所
随着分子生物学技术的发展, 信号转导及表达调控机制成为当今肿瘤研究中的热点. 如能从细胞内信号转导角度, 深入研究丹参酮ⅡA诱导胰腺癌细胞凋亡的机制, 将会为胰腺癌的治疗提供新的途径和实验方法.
国内外有关报道提示丹参酮ⅡA对多种肿瘤细胞具有显著的杀伤作用. 国内已有的研究证明丹参酮ⅡA能够诱导体外培养的细胞凋亡, 但对丹参酮诱导胰腺癌细胞凋亡的具体机制尚缺乏报道.
本研究从细胞内信号转导角度揭示丹参酮ⅡA的抗胰腺癌机制, 并发现丹参酮ⅡA通过SAPK/JNK信号通路下调Survivin基因诱导胰腺癌细胞凋亡, 是其抗肿瘤的重要机制.
本文研究了丹参酮ⅡA诱导人胰腺癌细胞凋亡的有效浓度和剂量关系, 探讨了治疗其作用的分子机制, 为丹参酮ⅡA治疗胰腺癌提供了理论依据.
本文学术性较好, 揭示了丹参酮ⅡA诱导人胰腺癌细胞凋亡的部分机制.
编辑: 李军亮 电编:何基才
| 1. | Zhou L, Chan WK, Xu N, Xiao K, Luo H, Luo KQ, Chang DC. Tanshinone IIA, an isolated compound from Salvia miltiorrhiza Bunge, induces apoptosis in HeLa cells through mitotic arrest. Life Sci. 2008;83:394-403. [PubMed] [DOI] |
| 2. | Li Q, Wang Y, Feng N, Fan Z, Sun J, Nan Y. Novel polymeric nanoparticles containing tanshinone IIA for the treatment of hepatoma. J Drug Target. 2008;16:725-732. [PubMed] [DOI] |
| 3. | 王 炎, 李 琦, 范 忠泽, 孙 珏, 王 忆勤, 王 忆勤, 高 虹. 丹参酮ⅡA介导p38MAPK信号转导诱导人肝癌细胞凋亡. 世界华人消化杂志. 2009;17:124-129. [DOI] |
| 4. | Kim HJ, Kim SH. Tanshinone IIA enhances BMP-2-stimulated commitment of C2C12 cells into osteoblasts via p38 activation. Amino Acids. 2010;39:1217-1226. [PubMed] [DOI] |
| 5. | Park IJ, Kim MJ, Park OJ, Park MG, Choe W, Kang I, Kim SS, Ha J. Cryptotanshinone sensitizes DU145 prostate cancer cells to Fas(APO1/CD95)-mediated apoptosis through Bcl-2 and MAPK regulation. Cancer Lett. 2010;298:88-98. [PubMed] [DOI] |
| 6. | Tian HL, Yu T, Xu NN, Feng C, Zhou LY, Luo HW, Chang DC, Le XF, Luo KQ. A novel compound modified from tanshinone inhibits tumor growth in vivo via activation of the intrinsic apoptotic pathway. Cancer Lett. 2010;297:18-30. [PubMed] [DOI] |
| 8. | 李 琦, 王 炎, 范 忠泽, 冯 年平, 高 虹, 南 艺蕾, 倪 雷, 鲍 文磊, 隋 华. 丹参酮ⅡA及其纳米粒诱导肝癌细胞凋亡及对p38 MAPK、TGFβ1信号蛋白表达的影响. 肿瘤. 2008;28:8-12. |
| 14. | Ribatti D, Vacca A. The role of microenvironment in tumor angiogenesis. Genes Nutr. 2008;3:29-34. [PubMed] [DOI] |
| 15. | Lee SK, Kim HN, Kang YR, Lee CW, Kim HM, Han DC, Shin J, Bae K, Kwon BM. Obovatol inhibits colorectal cancer growth by inhibiting tumor cell proliferation and inducing apoptosis. Bioorg Med Chem. 2008;16:8397-8402. [PubMed] [DOI] |
| 17. | Bogoyevitch MA, Ngoei KR, Zhao TT, Yeap YY, Ng DC. c-Jun N-terminal kinase (JNK) signaling: recent advances and challenges. Biochim Biophys Acta. 2010;1804:463-475. [PubMed] |
| 18. | Séverin S, Ghevaert C, Mazharian A. The mitogen-activated protein kinase signaling pathways: role in megakaryocyte differentiation. J Thromb Haemost. 2010;8:17-26. [PubMed] [DOI] |
| 19. | Geest CR, Coffer PJ. MAPK signaling pathways in the regulation of hematopoiesis. J Leukoc Biol. 2009;86:237-250. [PubMed] [DOI] |
| 20. | Yu MK, Lee YH, Yoon MR, Bhattarai G, Lee NH, Kim TG, Jhee EC, Yi HK. Attenuation of AH26-induced apoptosis by inhibition of SAPK/JNK pathway in MC-3T3 E1 cells. J Endod. 2010;36:1967-1971. [PubMed] [DOI] |
| 21. | Brnjic S, Olofsson MH, Havelka AM, Linder S. Chemical biology suggests a role for calcium signaling in mediating sustained JNK activation during apoptosis. Mol Biosyst. 2010;6:767-774. [PubMed] [DOI] |
| 22. | Bermudez O, Pagès G, Gimond C. The dual-specificity MAP kinase phosphatases: critical roles in development and cancer. Am J Physiol Cell Physiol. 2010;299:C189-C202. [PubMed] [DOI] |