修回日期: 2010-11-18
接受日期: 2010-11-23
在线出版日期: 2011-01-08
目的: 探讨胆盐输出泵BSEP基因V444A(BSEP V444A)与特发性婴儿肝炎肝内胆汁淤积的相关性.
方法: 以81例特发性婴儿肝炎肝内胆汁淤积患儿(病例组)和48例无肝内胆汁淤积婴儿(对照组)为研究对象, 应用聚合酶链-限制性片段长度多态性(PCR-RFLP)技术对V444A片段行扩增及酶切分析.
结果: BSEPV444A有3种基因型: AA纯合子、GA杂合子、GG纯合子, AA, AG和GG 3种基因型在病例组和对照组频率分别为4.9%, 50.6%, 44.4%和14.6%, 62.5%, 22.9%, 两组差异显著(P = 0.019). 等位基因频率的相对风险分析发现, 其中GG基因型在两组人群中的分布差异有显著性(P<0.05, OR = 2.691, 95%CI: 1.205-6.008); G等位基因携带者患特发性婴儿肝炎肝内胆汁淤积的风险是A等位基因的1.951倍(OR = 1.951, 95%CI: 1.56-3.291).
结论: 在广西地区小儿当中发现BSEP V444A单链核苷酸的多态性位点, BSEP V444A G等位基因可能是特发性婴儿肝炎肝内胆汁淤积的一个危险因素, G等位基因携带者可能增加特发性婴儿肝炎肝内胆汁淤积的相对危险度.
引文著录: 邓亚楠, 王琳琳, 唐清, 陈秀奇, 陈萍, 单庆文, 连淑君, 云翔. 胆盐输出泵基因V444A与特发性婴儿肝炎肝内胆汁淤积的关系. 世界华人消化杂志 2011; 19(1): 38-43
Revised: November 18, 2010
Accepted: November 23, 2010
Published online: January 8, 2011
AIM: To explore the association between the V444A polymorphism in the bile salt export pump (BSEP) gene and the risk of idiopathic neonatal hepatitis/cholestasis.
METHODS: Eighty-one infants with idiopathic hepatitis/cholestasis (case group) and 48 healthy infants without intrahepatic cholestasis (control group) were included in this study. The V444A polymorphism was genotyped by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP).
RESULTS: There are three V444A genotypes: AA homozygote, GA heterozygote, and GG homozygote. The frequencies of AA and AG and GG genotypes were 0.6%, 4.9% and 44.4% in the case group and 14.6%, 62.5% and 22.9% in the control group, respectively, with a significant difference between the two groups (P = 0.019). The distribution of GG genotype was significantly different between the two groups (P < 0.05, OR = 2.691, 95%CI: 1.205-6.008). The risk of suffering from idiopathic intrahepatic cholestasis in G allele carriers was 1.951 times higher than that in A allele carriers (OR = 1.951, 95%CI: 1.56-3.291).
CONCLUSION: The G allele of the BSEP V444A G polymorphism may be a risk factor for idiopathic intrahepatic cholestasis in infants.
- Citation: Deng YN, Wang LL, Tang Q, Chen XQ, Chen P, Shan QW, Lian SJ, Yun X. Association between BSEP V444A polymorphism and risk of idiopathic neonatal hepatitis/cholestasis. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 38-43
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/38.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.38
随着分子生物学的发展, 有关基因多态性与疾病关系的探讨越来越受到人们的关注, ABCB11又称胆盐输出泵(bile salt export pump, BSEP)基因, 1995年, 猪的BSEP基因首先被克隆, 因其编码的蛋白与p糖蛋白170(由ABCB1基因编码)结构相似, 当时被命名为Spgp(the sister of pglycoprotein). 后来发现Spgp是肝脏主要的胆盐运载体, 改称为BSEP[1,2]. 人类BSEP基因位于2q24.3, 含28个外显子[3]编码的1 321个氨基酸[4,5]. BSEP主要存在于肝脏中, 位于肝细胞的毛细胆管表面, 通过依赖ATP将肝细胞内的胆盐分泌到毛细胆管中, 是影响胆汁流量最重要的因素之一[6,7]. BSEP基因多态性是胆汁淤积疾病的易感因素[8], 目前研究表明BSEP基因与多种胆汁淤积性肝脏疾病有关, 如进行性家族性肝内胆汁淤积2型(progressive familial intrahepatic cholestasis, PFIC2)[9-13], 良性复发性肝内胆汁淤积2型(benign recurrent intrahepatic cholestasis, BRIC2)[14,15], 妊娠期肝内胆汁淤积(intrahepatic cholestasis of pregnancy, ICP)[16,17], 药物诱导的肝内胆汁淤积[7,18], 肝癌[19-21]或其他部位癌症[22]及原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)[23]. 有报道称胆汁淤积疾病肝移植预后不良与BSEP基因缺失有一定关系[24-27], 但婴儿胆汁淤积是否存在BSEP基因的突变, 目前国内外报道尚少. 本研究采用PCR技术对BSEP基因1个常见变异位点进行分析, 结合DNA直接序列测序与限制性核酸内切技术, 评价BSEPV444A基因在婴儿胆汁淤积发病机制中的遗传作用.
征得患儿家长同意及医院伦理委员会批准, 收集 2008-10/2010-02广西医科大学第一附属医院儿科住院的特发性婴儿肝炎肝内胆汁淤积的患儿81例, 其中男66例, 女15例, 男女比值为4∶1, 病例组纳入标准: 婴儿期(包括新生儿期)起病; 黄疸属肝细胞性, 血清总胆红素(serum total bilirubin, TB)升高, 以直接胆红素(direct bilirubin, DB)增高为主, 可伴间接胆红素(indirect bilirubin, IB)升高; 肝大或肝脾肿大, 质地改变; 肝功能损害以血清谷丙转氨酶(alanine aminotransferase, ALT)升高为主; 除外了肝炎病毒感染, 巨细胞病毒感染, 梅毒感染, 弓形虫感染, 人体免疫缺损病毒(human immunodeficiency virus, HIV)感染等. 对照组为随机选取无胆汁淤积的婴儿48例.
1.2.1 PCR-RFLP分析: 所有研究对象分别抽取外周血2 mL, 用酚氯仿法提取外周血DNA, 引物F: 5'-GTTGGGAGAACAGTGAGTATTG-3', R: 5'-AGCTCTGTCTCACAGTTTTGTT-3'(350 bp), PCR反应体系, Premix Tap(TaKaRa)25 μL, DNA模板2.5 μL, 引物1 1 μmol/L, 引物2 1 μmol/L, ddH2O补充体积至50 μL, PCR具体扩增条件95 ℃ 5 min, 95 ℃ 35 s, 59.3 ℃ 50 s, 72 ℃ 50 s, 30循环(最后一个循环延伸5 min). PCR产物经2%琼脂糖凝胶电泳鉴定. 取扩增产物5 μL, HaeⅢ限制性内切酶(Fermentas)5 U, 10×Buffer R缓冲液1 μL, 用无菌去离子水补足总体积至10 μL, 混匀, 37 ℃水浴4 h. 经2%琼脂糖凝胶电泳(120 mV)30 min, 在凝胶成像系统下观察结果.
1.2.2 DNA直接测序分析: PCR产物经上海生工生物工程有限公司纯化后直接测序. 所得序列结果与GenBank基因库上所提供的正常序列对比, 明确突变位点.
统计学处理 所有的数据用SSPS13.0处理, 以Hardy-Weinberg平衡法检验各组基因频率的群体代表性; 正态性分布的资料用mean±SD表示, 计量资料的统计推断采用t检验或单因素方差分析, 计数资料的统计学推断采用χ2检验或Fisher's确切概率法.
所有病例都有不同程度肝肿大, 临床肝功指标在病例组与对照组相比均有明显统计学差异, 而两组的年龄差异没有统计学意义.
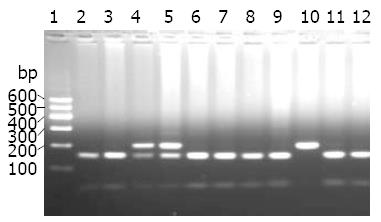
PCR扩增产物片段大小为205 bp, BSEP基因1 331位点A被G置换后, 产生限制性内切酶HaeⅢ的酶切位点. 根据酶切片段的情况, 基因型有3种: AA型(只出现205 bp 1条带) , AG型(出现205、159、46 bp 3条带), GG型(出现159、46 bp 2条带)(图1).
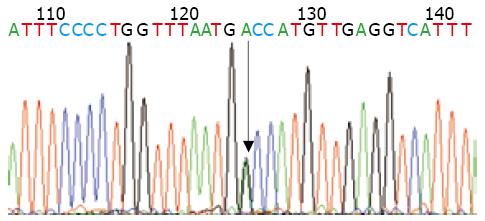
对BSEP外显子13的一单核苷酸多态性(single-nucleotide polymorphisms, SNP)位点进行基因测序显示, 在BSEP的外显子13第444编码位点上检测出单个碱基A>G的纯合突变和杂合突变均导致了单个氨基酸的替代, 在第444编码位点由原来编码的缬氨酸变成丙氨酸(V444A)(图2).
BSEP基因13号外显子上一SNP位点经电泳及测序结果显示3种基因型, 分别为GG、GA、 AA 3种基因型. BSEPV444A各基因型在两组中分布符合遗传平衡, 表明抽样具有人群代表性. 而两组基因型的差异性检验, 经Fisher确切概率法检验, 差异具有有统计学意义(P = 0.004); 其中GG基因型在两组人群中的分布差异有显著性(P<0.05, OR = 2.691, 95%CI: 1.205-6.008); G等位基因频率在两组人群中的分布差异有显著性(P<0.05, OR = 1.951, 95%CI: 1.56-3.291); 等位基因频率的相对风险分析发现, G等位基因携带者患特发性婴儿肝炎肝内胆汁淤积的风险是A等位基因的1.951倍(OR = 1.951)(表1).
| 病例组(n = 81) | 对照组(n = 48) | P值 | OR | 95%CI | |
| 基因型 | |||||
| GG | 36(44.4) | 11(22.9) | 0.014 | 2.691 | 1.205-6.008 |
| GA | 41(50.6) | 30(62.5) | |||
| AA | 4(4.9) | 7(14.6) | |||
| 等位基因 | |||||
| G | 113(69.8) | 52(54.2) | 0.012 | 1.951 | 1.56-3.291 |
| A | 49(30.2) | 44(45.8) |
在病例组中, 对不同基因型的临床生化指标进行亚组分析, TB, DB, ALT, AST, γ-GT生化指标的进行方差分析, 差异均无统计学意义(表2).
| 血清生化指标 | A/A 基因型 | A/G基因型 | G/G基因型 |
| TB(μmol/L) | 158.42±13.39 | 156.52±45.71 | 213.95±31.9 |
| DB(μmol/L) | 79.62±59.00 | 83.75±26.12 | 94.75±26.58 |
| ALT(U/L) | 110.25±26.98 | 107.21±27.88 | 77.25±23.54 |
| AST(U/L) | 234.25±28.28 | 232.24±25.06 | 164.25±15.02 |
| γ-GT(U/L) | 125.75±18.76 | 309.73±32.80 | 124.50±11.97 |
在Lang进行的一项健康人BSEP基因的多中心研究中, 发现BSEP V444A可导致蛋白质替换而无致病性, 在不同国家、不同种族人群中有较高的基因频率, 在美国高加索人中占59.5%、在日本人中占80.4%、在非裔美国人中占65.6%[28]. Pauli等[23]通过对21例ICP患者和40例健康女性的研究发现, BSEP V444A在健康女性和ICP患者中所占比例分别为51.3%和83.3%[29]. Kim等[30]在日本正常人群研究也发现了V444A有较高的基因频率, 本研究结果, BSEP V444A在病例组和对照组出现比例分别为95%和85.5%, 结果与国外的一些研究结果不尽相同, 推测可能原因为: (1)样本的不均一性, 如种族、性别等; (2)研究对象设计不完全相同和样本量偏小. 由上可知V444A在正常人群当中普遍存在, 推测该基因位点不稳定容易发生突变, 在健康人群也有较高突变率.
本实验结果显示, BSEP基因外显子13上游第1 331核苷酸由A突变为G, 产生限制性内切酶HaeⅢ的酶切位点, 内切酶HaeⅢ能识别的即为G等位基因, 不能识别的为A等位基因, 因此, BSEPV444A有3种基因型: GG纯合子、GA杂合子、AA纯合子. BSEP V444A GG基因型在正常的婴儿和胆汁淤积患儿中总体所占比例存在差异, 差异具有统计学意义. 其中GG基因型在两组人群中的分布差异有显著性(P<0.05, OR = 2.691); 等位基因频率的相对风险分析发现, G等位基因携带者患特发性婴儿肝炎肝内胆汁淤积的风险是A等位基因的1.951倍(OR = 1.951), 推测G等位基因可能是特发性婴儿肝炎肝内胆汁淤积的一个危险因素, Dixon等[31]研究证实了ICP患者和健康对照组研究存在GG, GA和AA 3种基因型, 研究认为携带G等位基因是ICP 1个重要的危险因素(OR = 1.70, 95%CI: 1.4-2.1, P<0.0001). Meier等[32]研究也证实了携带G等位基因是ICP 1个重要的危险因素(OR = 3.0, 95%CI: 1.7-6.4), 胆汁酸水平在V444A多态性者中较高.
BSEP V444A发病机制方面, V444A使444位点的缬氨酸变成丙氨酸, 从而引起胆BSEP功能的改变, 但Meier等的研究认为胆酸盐的运输特性在含丙氨酸和含缬氨酸之间并没有不同, 氨基酸444位点为丙氨酸肝细胞内BSEP的表达量的低于缬氨酸的, 以此推测氨基酸444位点为丙氨酸是进行性胆汁淤积一个敏感因素, 可能会在特定情况下, 如使用某些药物抑制BSEP功能[33]. Keitel等[34]研究认为BSEP V444A与MDR3多态性位点联合作用可导致严重严重ICP, V444A可能是ICP发病的诱发因素, 从功能方面推测V444A多态性可能使阻碍BSEP分泌作用增强或是降低细胞内可用BSEP. Kubitz等[35]研究通过对1例诊断为BRIC-2的17岁男性患者进行BSEP基因分析, 发现了两种BSEP突变位点(E186G和V444A), 认为这种多位点联合突变导致BSEP蛋白表达不稳定或表达缺失, 是导致胆盐排泄减少引起高胆红素血症潜在影响因素. BSEPV444A可能影响BSEP的基因转录, 进而影响BSEP的功能, 从而导致不同人群对特发性婴儿肝炎肝内胆汁淤积易感性, 但不能排除BSEP V444A联合BSEP其他位点或其他基因如多药耐药蛋白3基因致病的可能性.
临床生化检查方面, 本研究对病例组中, 不同基因型的临床生化指标进行亚组分析, 基因型GG的TB, DB平均值高于基因型GA和AA, 但差异不具有统计学意义, 尚不能认为GG基因型引起胆红素水平高于GG和GA基因型, 分析原因可能是样本例数少, 3种基因组间例数差异较大, 使组间生化指标比较差异没有统计学意义, 在以后的研究中我们还应进一步探讨BSEP V444A G等位基因与临床生化指标及预后的关系, 使研究和临床更加有效的结合.
总之, 本研究从一个角度说明, BSEP V444A G等位基因可能是特发性婴儿肝炎肝内胆汁淤积的一个危险因素, G等位基因携带者可能增加特发性婴儿肝炎肝内胆汁淤积的相对危险度. 但BSEP的其他位点变异是否是特发性婴儿肝炎肝内胆汁淤积的危险因素, 以及BSEPV444A是否联合BSEP其他位点或其他基因如MDR3(多药耐药蛋白3基因)共同致病, 尚需进一步的实验证实.
胆盐输出泵(BSEP)主要存在于肝脏中, 位于肝细胞的毛细胆管表面, 通过依赖ATP将肝细胞内的胆盐分泌到毛细胆管中, 是影响胆汁流量最重要的因素之一. BSEP基因多态性是胆汁淤积疾病的易感因素, 目前研究表明BSEP基因与多种胆汁淤积性肝脏疾病有关.
施诚仁, 教授, 上海交通大学医学院附属新华医院小儿外科
Kubitz等研究通过对1例诊断为BRIC-2的17岁男性患者进行BSEP基因分析, 发现了两种BSEP突变位点(E186G和V444A), 认为这种多位点联合突变导致BSEP蛋白表达不稳定或表达缺失, 是导致胆盐排泄减少, 引起高胆红素血症潜在影响因素.
特发性婴儿肝炎肝内胆汁淤积是儿科常见病, 其病因和发病机制尚不明确, 国内有关婴儿胆汁淤积是否存在BSEP基因的突变报道较少, 本研究采用PCR-SSCP技术探讨BSEP基因V444A在婴儿胆汁淤积发病机制中的遗传作用.
BSEP V444A G等位基因可能是特发性婴儿肝炎肝内胆汁淤积的一个危险因素, G等位基因携带者可能增加特发性婴儿肝炎肝内胆汁淤积的相对危险度.
本文可读性较好, 为婴儿黄疸的研究奠定基础, 具有一定的临床意义.
编辑: 李薇 电编:李薇
| 1. | Bouchard G, Nelson HM, Lammert F, Rowe LB, Carey MC, Paigen B. High-resolution maps of the murine Chromosome 2 region containing the cholesterol gallstone locus, Lith1. Mamm Genome. 1999;10:1070-1074. [PubMed] [DOI] |
| 2. | Lammert F, Carey MC, Paigen B. Chromosomal organization of candidate genes involved in cholesterol gallstone formation: a murine gallstone map. Gastroenterology. 2001;120:221-238. [PubMed] [DOI] |
| 3. | Strautnieks SS, Byrne JA, Pawlikowska L, Cebecauerová D, Rayner A, Dutton L, Meier Y, Antoniou A, Stieger B, Arnell H. Severe bile salt export pump deficiency: 82 different ABCB11 mutations in 109 families. Gastroenterology. 2008;134:1203-1214. [PubMed] [DOI] |
| 4. | Byrne JA, Strautnieks SS, Mieli-Vergani G, Higgins CF, Linton KJ, Thompson RJ. The human bile salt export pump: characterization of substrate specificity and identification of inhibitors. Gastroenterology. 2002;123:1649-1658. [PubMed] [DOI] |
| 5. | Noé J, Stieger B, Meier PJ. Functional expression of the canalicular bile salt export pump of human liver. Gastroenterology. 2002;123:1659-1666. [PubMed] [DOI] |
| 6. | Stieger B, Meier Y, Meier PJ. The bile salt export pump. Pflugers Arch. 2007;453:611-620. [PubMed] [DOI] |
| 7. | Langmann T, Mauerer R, Zahn A, Moehle C, Probst M, Stremmel W, Schmitz G. Real-time reverse transcription-PCR expression profiling of the complete human ATP-binding cassette transporter superfamily in various tissues. Clin Chem. 2003;49:230-238. [PubMed] [DOI] |
| 8. | Stieger B. Role of the bile salt export pump, BSEP, in acquired forms of cholestasis. Drug Metab Rev. 2010;42:437-445. [PubMed] [DOI] |
| 9. | Treepongkaruna S, Gaensan A, Pienvichit P, Luksan O, Knisely AS, Sornmayura P, Jirsa M. Novel ABCB11 mutations in a Thai infant with progressive familial intrahepatic cholestasis. World J Gastroenterol. 2009;15:4339-4342. [PubMed] [DOI] |
| 10. | Davit-Spraul A, Fabre M, Branchereau S, Baussan C, Gonzales E, Stieger B, Bernard O, Jacquemin E. ATP8B1 and ABCB11 analysis in 62 children with normal gamma-glutamyl transferase progressive familial intrahepatic cholestasis (PFIC): phenotypic differences between PFIC1 and PFIC2 and natural history. Hepatology. 2010;51:1645-1655. [PubMed] [DOI] |
| 11. | Chen HL, Liu YJ, Su YN, Wang NY, Wu SH, Ni YH, Hsu HY, Wu TC, Chang MH. Diagnosis of BSEP/ABCB11 mutations in Asian patients with cholestasis using denaturing high performance liquid chromatography. J Pediatr. 2008;153:825-832. [PubMed] [DOI] |
| 12. | Chen ST, Chen HL, Su YN, Liu YJ, Ni YH, Hsu HY, Chu CS, Wang NY, Chang MH. Prenatal diagnosis of progressive familial intrahepatic cholestasis type 2. J Gastroenterol Hepatol. 2008;23:1390-1393. [PubMed] [DOI] |
| 13. | Pauli-Magnus C, Stieger B, Meier Y, Kullak-Ublick GA, Meier PJ. Enterohepatic transport of bile salts and genetics of cholestasis. J Hepatol. 2005;43:342-357. [PubMed] [DOI] |
| 14. | van Mil SW, van der Woerd WL, van der Brugge G, Sturm E, Jansen PL, Bull LN, van den Berg IE, Berger R, Houwen RH, Klomp LW. Benign recurrent intrahepatic cholestasis type 2 is caused by mutations in ABCB11. Gastroenterology. 2004;127:379-384. [PubMed] [DOI] |
| 15. | Kagawa T, Watanabe N, Mochizuki K, Numari A, Ikeno Y, Itoh J, Tanaka H, Arias IM, Mine T. Phenotypic differences in PFIC2 and BRIC2 correlate with protein stability of mutant Bsep and impaired taurocholate secretion in MDCK II cells. Am J Physiol Gastrointest Liver Physiol. 2008;294:G58-G67. [PubMed] [DOI] |
| 16. | Eloranta ML, Häkli T, Hiltunen M, Helisalmi S, Punnonen K, Heinonen S. Association of single nucleotide polymorphisms of the bile salt export pump gene with intrahepatic cholestasis of pregnancy. Scand J Gastroenterol. 2003;38:648-652. [PubMed] [DOI] |
| 17. | Lam P, Soroka CJ, Boyer JL. The bile salt export pump: clinical and experimental aspects of genetic and acquired cholestatic liver disease. Semin Liver Dis. 2010;30:125-133. [PubMed] [DOI] |
| 18. | Lang C, Meier Y, Stieger B, Beuers U, Lang T, Kerb R, Kullak-Ublick GA, Meier PJ, Pauli-Magnus C. Mutations and polymorphisms in the bile salt export pump and the multidrug resistance protein 3 associated with drug-induced liver injury. Pharmacogenet Genomics. 2007;17:47-60. [PubMed] [DOI] |
| 19. | Knisely AS, Strautnieks SS, Meier Y, Stieger B, Byrne JA, Portmann BC, Bull LN, Pawlikowska L, Bilezikçi B, Ozçay F. Hepatocellular carcinoma in ten children under five years of age with bile salt export pump deficiency. Hepatology. 2006;44:478-486. [PubMed] [DOI] |
| 20. | Scheimann AO, Strautnieks SS, Knisely AS, Byrne JA, Thompson RJ, Finegold MJ. Mutations in bile salt export pump (ABCB11) in two children with progressive familial intrahepatic cholestasis and cholangiocarcinoma. J Pediatr. 2007;150:556-559. [PubMed] [DOI] |
| 22. | Bass LM, Patil D, Rao MS, Green RM, Whitington PF. Pancreatic adenocarcinoma in type 2 progressive familial intrahepatic cholestasis. BMC Gastroenterol. 2010;10:30. [PubMed] [DOI] |
| 23. | Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, Beuers U, Meier PJ. BSEP and MDR3 haplotype structure in healthy Caucasians, primary biliary cirrhosis and primary sclerosing cholangitis. Hepatology. 2004;39:779-791. [PubMed] [DOI] |
| 24. | Maggiore G, Gonzales E, Sciveres M, Redon MJ, Grosse B, Stieger B, Davit-Spraul A, Fabre M, Jacquemin E. Relapsing features of bile salt export pump deficiency after liver transplantation in two patients with progressive familial intrahepatic cholestasis type 2. J Hepatol. 2010;53:981-986. [PubMed] [DOI] |
| 25. | Siebold L, Dick AA, Thompson R, Maggiore G, Jacquemin E, Jaffe R, Strautnieks S, Grammatikopoulos T, Horslen S, Whitington PF. Recurrent low gamma-glutamyl transpeptidase cholestasis following liver transplantation for bile salt export pump (BSEP) disease (posttransplant recurrent BSEP disease). Liver Transpl. 2010;16:856-863. [PubMed] [DOI] |
| 26. | Jara P, Hierro L, Martínez-Fernández P, Alvarez-Doforno R, Yánez F, Diaz MC, Camarena C, De la Vega A, Frauca E, Muñoz-Bartolo G. Recurrence of bile salt export pump deficiency after liver transplantation. N Engl J Med. 2009;361:1359-1367. [PubMed] [DOI] |
| 27. | Keitel V, Burdelski M, Vojnisek Z, Schmitt L, Häussinger D, Kubitz R. De novo bile salt transporter antibodies as a possible cause of recurrent graft failure after liver transplantation: a novel mechanism of cholestasis. Hepatology. 2009;50:510-517. [PubMed] [DOI] |
| 28. | Lang T, Haberl M, Jung D, Drescher A, Schlagenhaufer R, Keil A, Mornhinweg E, Stieger B, Kullak-Ublick GA, Kerb R. Genetic variability, haplotype structures, and ethnic diversity of hepatic transporters MDR3 (ABCB4) and bile salt export pump (ABCB11). Drug Metab Dispos. 2006;34:1582-1599. [PubMed] [DOI] |
| 29. | Pauli-Magnus C, Lang T, Meier Y, Zodan-Marin T, Jung D, Breymann C, Zimmermann R, Kenngott S, Beuers U, Reichel C. Sequence analysis of bile salt export pump (ABCB11) and multidrug resistance p-glycoprotein 3 (ABCB4, MDR3) in patients with intrahepatic cholestasis of pregnancy. Pharmacogenetics. 2004;14:91-102. [PubMed] [DOI] |
| 30. | Kim SR, Saito Y, Itoda M, Maekawa K, Kawamoto M, Kamatani N, Ozawa S, Sawada J. Genetic variations of the ABC transporter gene ABCB11 encoding the human bile salt export pump (BSEP) in a Japanese population. Drug Metab Pharmacokinet. 2009;24:277-281. [PubMed] [DOI] |
| 31. | Dixon PH, van Mil SW, Chambers J, Strautnieks S, Thompson RJ, Lammert F, Kubitz R, Keitel V, Glantz A, Mattsson LA. Contribution of variant alleles of ABCB11 to susceptibility to intrahepatic cholestasis of pregnancy. Gut. 2009;58:537-544. [PubMed] |
| 32. | Meier Y, Zodan T, Lang C, Zimmermann R, Kullak-Ublick GA, Meier PJ, Stieger B, Pauli-Magnus C. Increased susceptibility for intrahepatic cholestasis of pregnancy and contraceptive-induced cholestasis in carriers of the 1331T>C polymorphism in the bile salt export pump. World J Gastroenterol. 2008;14:38-45. [PubMed] [DOI] |
| 33. | Meier Y, Pauli-Magnus C, Zanger UM, Klein K, Schaeffeler E, Nussler AK, Nussler N, Eichelbaum M, Meier PJ, Stieger B. Interindividual variability of canalicular ATP-binding-cassette (ABC)-transporter expression in human liver. Hepatology. 2006;44:62-74. [PubMed] [DOI] |
| 34. | Keitel V, Vogt C, Häussinger D, Kubitz R. Combined mutations of canalicular transporter proteins cause severe intrahepatic cholestasis of pregnancy. Gastroenterology. 2006;131:624-629. [PubMed] [DOI] |
| 35. | Kubitz R, Keitel V, Scheuring S, Köhrer K, Häussinger D. Benign recurrent intrahepatic cholestasis associated with mutations of the bile salt export pump. J Clin Gastroenterol. 2006;40:171-175. [PubMed] [DOI] |