修回日期: 2010-11-20
接受日期: 2010-11-23
在线出版日期: 2011-01-08
目的: 研究鳖甲煎改良方对大鼠肝纤维化(HF)的防治作用及对TGF-β1和Sman3/7蛋白表达的影响, 探讨其机制.
方法: SD♂大鼠90只, 随机取10只作为正常对照组(A组), 其余大鼠用皮下注射40% CCl4橄榄油油剂3 mL/kg诱导大鼠肝纤维化模型8 wk, 于第2周时随机处死5只大鼠证实HF形成后, 将剩下的大鼠随机分为肝纤维化模型组(B组)、鳖甲煎改良方高剂量组[C组, 28.4 g/(kg•d)]、中剂量组[D组, 14.2 g/(kg•d)]、低剂量组[E组, 7.1 g/(kg•d)]、复方鳖甲软肝片组[F组, 0.6 g/(kg•d)], 每组15只. C、D、E、F组给予10 mL/(kg•d)相应药液灌胃治疗, A、B组同时给予等剂量的生理盐水灌胃处理. 8 wk后采血测定血清丙氨酸氨基转移酶(ALT)、草氨酸氨基转移酶(AST)、白蛋白和球蛋白含量; 取肝组织作HE染色观察肝纤维化程度变化; Western blot方法检测TGF-β1、Smad3和Smad7蛋白的表达.
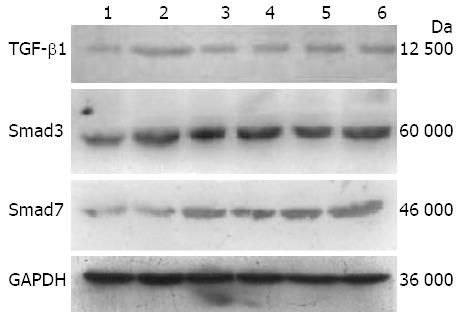
结果: 8 wk后, 与B组比较, C、D、E组和F组肝小叶结构破坏明显减轻, 肝纤维化程度分级较B组明显好转; ALT和AST含量显著降低(P<0.01), 白蛋白含量显著增加(37.85 g/L±3.08 g/L, 38.25 g/L±1.90 g/L, 38.13 g/L±1.50 g/L, 38.09 g/L±3.27 g/L vs 27.05 g/L±4.81 g/L, 均P<0.01); TGF-β1、Smad3蛋白表达显著减少(TGF-β1: 0.127±0.014, 0.122±0.051, 0.126±0.027, 0.119±0.020 vs 0.332±0.074, 均P<0.01; Smad3: 0.415±0.057, 0.427±0.074, 0.425±0.080, 0.432±0.075 vs 0.527±0.054, 均P<0.01), Smad7蛋白的表达明显增加(0.308±0.077, 0.326±0.086, 0.315±0.071, 0.348±0.065 vs 0.185±0.059, 均P<0.01), 且C、D、E组和F组间疗效比较无明显差异.
结论: 鳖甲煎改良方能够显著减轻CCl4导致的大鼠肝纤维化程度, 其作用机制可能与鳖甲煎改良方调控TGF-β1和Sman3/7信号转导蛋白表达有关.
引文著录: 艾志波, 张荣华, 闫国和. 鳖甲煎改良方对大鼠肝纤维化的防治作用. 世界华人消化杂志 2011; 19(1): 13-18
Revised: November 20, 2010
Accepted: November 23, 2010
Published online: January 8, 2011
AIM: To investigate the effects of treatment with a modified recipe of Turtle Shell Decoction (MRTSD) on the expression of TGF-β1 and Smad 3/7 in experimental hepatic fibrosis in rats, and to explore its anti-fibrotic mechanism.
METHODS: Ninety Sprague-Dawley adult rats were used in this study, 10 of which were randomly selected as normal controls (A), and the rest were used to induce hepatic fibrosis by multiple subcutaneous injections of 40% carbon tetrachloride (CCl4, 3 mL/kg) for 8 wk. At week 2, five rats were executed to confirm the formation of liver fibrosis, and the rest of rats were randomly and equally divided into pathological model group (B), high-dose [28.4 g/(kg•d)] MRTSD group (C), medium-dose [14.2 g/(kg•d)] MRTSD group (D), low-dose [7.1 g/(kg•d)] MRTSD group, and Fufang Biejia Ruangan Tablet-treated group [F, 0.6 g/(kg•d)]. Drugs were intragastrically administrated at a volume of 10 mL/(kg•d) in groups C-E, whereas the rats of groups A and B were given the same volume of physiological saline. At week 8, serum levels of ALT, AST, albumin, and globulin were measured. The formation of hepatic fibrosis was confirmed by HE staining. The protein expression of TGF-β1 and Smad 3/7 in liver tissue was detected by Western blot.
RESULTS: In groups C-F at week 8, the structure of liver lobules was almost restored to normal; HF score was obviously reduced; the contents of ALT and AST were significantly decreased (P < 0.01); the content of albumin was significantly increased (37.85 g/L ± 3.08 g/L, 38.25 g/L ± 1.90 g/L, 38.13 g/L ± 1.50 g/L, 38.09 g/L ± 3.27 g/L vs 27.05 g/L ± 4.81 g/L, all P < 0.01); the protein expression of TGF-β1 and Smad 3 was remarkably down-regulated (TGF-β1: 0.127 ± 0.014, 0.122 ± 0.051, 0.126 ± 0.027, 0.119 ± 0.020 vs 0.332 ± 0.074, all P < 0.01; Smad 3: 0.415 ± 0.057, 0.427 ± 0.074, 0.425 ± 0.080, 0.432 ± 0.075 vs 0.527 ± 0.054, all P < 0.01); and the expression of Smad 7 was significantly up-regulated (0.308 ± 0.077, 0.326 ± 0.086, 0.315 ± 0.071, 0.348 ± 0.065 vs 0.185 ± 0.059, all P < 0.01) when compared with group B. There were no significant differences in the above parameters between MRTSD- and Fufang Biejia Ruangan Tablet-treated groups.
CONCLUSION: MRTSD can reverse CCl4-induced liver fibrosis in rats possibly by regulating the protein expression of TGF-β1 and Smad 3/7.
- Citation: Ai ZB, Zhang RH, Yan GH. A modified recipe of Turtle Shell Decoction reduces experimental hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2011; 19(1): 13-18
- URL: https://www.wjgnet.com/1009-3079/full/v19/i1/13.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i1.13
肝纤维化(hepatic fibrosis, HF)是多种慢性肝病向肝硬化发展的共同病理过程, 是慢性肝病发展到肝硬化的必经病理阶段, 防治HF是攻克肝硬化的突破口, 从中医药中寻求有效的治疗方法具有重要意义. 转化生长因子β(transforming growth factor beta, TGF-β)是一类调节细胞生长和分化的多肽, 具有活化肝星状细胞(hepatic stellate cells, HSC)[1], 促进肝脏胶原基因表达, 促进细胞外基质(extracellular matrix, ECM)合成等作用, 是最重要的促HF因子之一[2,3]. 为探讨鳖甲煎改良方防治HF作用, 我们采用CCl4中毒诱导的大鼠HF模型, 研究鳖甲煎改良方对大鼠HF的防治作用及对TGF-β1和Smad3/7蛋白表达情况, 探讨其机制.
健康♂SD大鼠90只, SPF级, 体质量190-210 g, 由中国人民解放军第三军医大学大坪医院实验动物中心提供. 鳖甲煎改良方由土鳖虫10 g、鳖甲15 g、柴胡10 g、黄芩12 g、半夏15 g、茵陈15 g、桂枝10 g、桃仁10 g、茯苓15 g、黄芪15 g、白芍15 g等组成, 用传统方法蒸馏水浸泡1 h、煎煮(先煎鳖甲、土鳖虫)、过滤、浓缩、制成煎剂, 每毫升含生药2.84 g、1.42 g和0.71 g, 由西南医院药剂科煎制提供, 复方鳖甲软肝片为内蒙古福瑞中蒙药科技股份有限公司产品, 批号: 20090107, 用蒸馏水配制成水溶剂, 使每毫升含生药0.06 g; CCl4, 分析纯, 成都市科龙化工试剂厂, 批号: 20090115; 橄榄油, 化学纯, 四川天源油橄榄有限公司.
1.2.1 造模: CCl4与橄榄油以4∶6(V/V)配制成40%油剂, 首剂5 mL/kg体质量大鼠背部皮下注射, 以后按3 mL/kg体质量重复注射, 每隔2 d重复注射1次, 共8 wk.
1.2.2 分组及给药: 随机取10只作为正常对照组(A组), 相同部位皮下注射等量橄榄油溶液, 其余大鼠复制HF模型, 与第2周时随机处死5只取肝组织作HE染色观察HF程度, 证实HF中度形成, 余下造模大鼠75只随机分5组, 各15只, 分别为HF模型组(B组)、鳖甲煎改良方高(C组)、中(D组)、低(E组)剂量组, 灌胃剂量为28.4 g/(kg•d)、14.2 g/(kg•d)、7.1 g/(kg•d), 分别为临床成人用量的12倍、6倍和3倍, 各组剂量选择参考文献[4]的方法, 复方鳖甲软肝片组(F组), 灌胃剂量0.6 g/(kg•d), 相当于临床用量0.1 g/(kg•d)的6倍. 治疗6 wk, 各组灌胃体积皆为10 mL/(kg•d), A、B组同时给予等量生理盐水灌胃处理.
1.2.3 标本采集: 8 wk后, 大鼠禁食12 h, 称量体质量, 3%戊巴比妥钠腹腔注射1 mL/kg麻醉, 经股动脉放血, 分离血清, -20 ℃保存, 取肝右叶同一部位组织, 一部分用100 mL/L甲醛溶液固定作常规组织病理学观察, 另一部分用锡箔纸包裹储存于液氮罐中, 用Western blot检测.
1.2.4 指标检测: 应用EX7全自动生化测定仪检测血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、草氨酸氨基转移酶(aspartate aminotransferase, AST)、白蛋白(albumin)、球蛋白(globulin)含量.
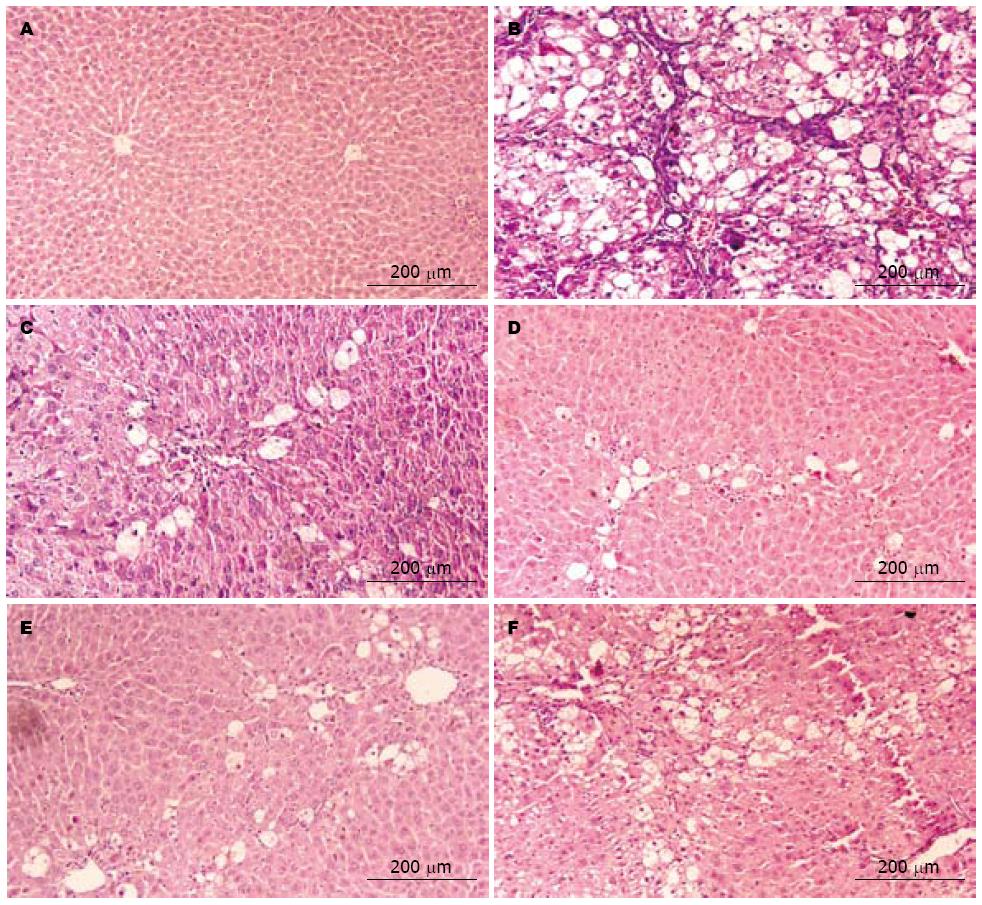
1.2.5 组织纤维化检测: 取肝右叶同一部位组织用100 mL/L甲醛溶液固定, 常规(HE)染色制片, 镜检观察肝细胞变性、胶原纤维增生程度和组织形态学变化. 用定量及半定量法记分评价: 0分, 肝细胞无病变, 肝脏正常或无明显胶原纤维增生; 1分, 变性的肝细胞占全部肝细胞比例<25%, 胶原纤维增生, 中央静脉和汇管区有少量纤维延伸, 但无间隔形成; 2分, 变性的肝细胞占全部肝细胞比例25%-50%, 胶原纤维明显增生, 中央静脉和汇管区结缔组织变厚, 由此四周伸出纤维索, 形成不完全间隔; 3分, 变性的肝细胞占全部肝细胞比例50%-75%, 胶原纤维大量增生, 有个别完全间隔或较厚的不完全间隔形成假小叶; 4分, 变性的肝细胞占全部肝细胞比例>75%, 完全间隔较厚, 假小叶大量形成.
1.2.6 Western blot检测TGF-β1、Smad3、Smad7蛋白表达: 取液氮罐中保存肝组织各组50 mg分别用Western及IP细胞裂解液(货号: P0013, 碧云天)按照说明书步骤提取各组总蛋白, 用BCA蛋白浓度测定盒(货号: P0010S, 碧云天)在酶标仪中测定各组浓度后, 计算加入5×SDS-PAGE上样缓冲液(货号: P0015, 碧云天)及蒸馏水比例, 使各组蛋白浓度调整一致, 均为5 kg/L, 95 ℃变性5 min后4 ℃保存, 等量上样进行SDS-PAGE, 电泳完毕, 将凝胶中的蛋白转移至PVDF膜上, PVDF膜以含5%脱脂奶粉的PBST溶液室温封闭2 h, 分别加入抗TGF-β1抗体1∶100(Santa Cruz, sc-146)、抗Smad3抗体1∶200(Santa Cruz, sc-101154)和抗Smad7抗体1∶400(Abcam, ab90086), 4 ℃孵育过夜, 二抗(1∶1 000, 碧云天)37 ℃孵育1 h, 将化学发光试剂盒(P0018, 碧云天)中A和B试剂等比例混匀加至膜上反应数分钟, 显影, 定影, 拍照. 条带图像用美国BioRad公司Quantity One 4.0图像分析软件分析吸光度值.
统计学处理 采用SPSS13.0统计软件, 数据以mean±SD表示, 进行组间方差分析, 以P<0.05为有统计学差异.
B、C、D、E和F组ALT和AST含量显著高于A组(P<0.01), 且B组最高, 显著高于其他各组(P<0.01), 白蛋白含量则明显低于A组(P<0.01), B组更低于其他各组(P<0.01); C、D、E组间比较无统计学意义, 但与F比较有显著差异(P<0.01); 各组球蛋白含量比较均无显著性差异(表1).
| 分组 | n | ALT(IU/L) | AST(IU/L) | 球蛋白(g/L) | 白蛋白(g/L) |
| A组 | 10 | 36.72±7.63 | 36.53±6.79 | 33.85±1.85 | 42.68±4.42 |
| B组 | 15 | 611.21±37.27b | 462.14±28.05b | 33.90±4.75 | 27.05±4.81b |
| C组 | 15 | 186.62±23.82bdf | 156.57±24.98bdf | 33.05±3.75 | 37.85±3.08bdf |
| D组 | 15 | 174.73±39.52bdf | 136.93±14.08bdf | 30.45±3.22 | 38.25±1.90bdf |
| E组 | 15 | 153.82±18.44bdf | 167.80±18.62bdf | 34.21±5.92 | 38.13±1.50bdf |
| F组 | 15 | 130.82±18.10bd | 180.30±132.65bd | 31.30±4.61 | 38.09±3.27bd |
光镜观察: A组肝小叶结构完整清晰, 呈条索状向四周放射排列, 无脂肪变性及坏死, 汇管区无明显纤维组织增生及炎性细胞浸润, 肝细胞正常, 核圆形, 核仁清晰可见, 中央静脉及汇管区结缔组织未见增生. B组大部分正常肝小叶结构破坏或消失, 肝组织大片脂肪变性、坏死, 呈空网状, 仅残存少量肝细胞, 汇管区和肝小叶坏死区可见大量纤维组织增生, 形成较宽阔, 厚薄不均且连接的纤维间隔, 出现明显的HF. 与B组相比, C、D、E、F组肝小叶破坏明显减轻, 部分肝细胞脂肪变性, 炎性细胞浸润较少, 胶原纤维组织轻度增生, 仅见细薄的纤维束, 未见明显假小叶形成, 其中C、D、E、F组HF评分明显较低(图1, 表2).
| 分组 | HF程度评分 | ||||
| 0 | 1 | 2 | 3 | 4 | |
| A组 | 10 | 0 | 0 | 0 | 0 |
| B组 | 0 | 0 | 0 | 10 | 5 |
| C组 | 0 | 8 | 6 | 1 | 0 |
| D组 | 0 | 7 | 7 | 1 | 0 |
| E组 | 0 | 8 | 5 | 2 | 0 |
| F组 | 0 | 6 | 7 | 2 | 0 |
HF是慢性肝病共有的病理改变, 其本质是肝组织中ECM的合成与降解的动态平衡[5,6], HF及肝硬化时, 纤维结缔组织的形成是各种不同致病因子导致ECM合成增多与降解的相对减少[7-9]. TGF-β1是一类调节细胞生长和分化的多肽, 是目前公认的最重要的致HF的细胞因子之一[9], 其具体机制为活化HSC, 使其转化为肌成纤维细胞(myofibroblast, MFB), 通过自分泌及旁分泌, 使HSC增殖, 由于TGF-β自分泌作用, MFB进一步受到刺激, 合成和分泌大量ECM, 并抑制其降解[10,11]. 肝脏MFB是HSC的激活形式, 活化HSC是肝脏胶原产生和纤维化形成的中心环节[12,13].
TGF-β1生物效应的发挥必须通过特定的信号转导过程[14]. TGF-β1胞外激活后, 与其细胞膜上特异性受体Ⅰ和受体Ⅱ(TβRⅠ, TβRⅡ)结合, 继而主要由Smads蛋白介导胞内信号传导[15]. Smads是 TGF-β受体复合物下游信号调节蛋白, Smads蛋白目前已鉴定出8种同源序列, 即Smad1-8, 存在于胞质、胞核内, 由高度保守的N端的MH1区、C端的MH2区及中间富含脯氨酸的连接区组成, 主要参与调控细胞的增殖、转化、合成、分泌和凋亡[16,17]. 根据Smads蛋白结构和功能特点, 主要分为3类[18]: 调节性Smads, 主要有Smad1, 2, 3, 5, 8, 其中Smad2, 3主要介导TGF-β和生物素的信号; 公用性Smad在哺乳动物发现的有Smad4, 与调节性Smads形成多聚体转位入核后调节靶基因转录; 抑制性Smads, 主要有Smad6, 7, 抑制其他二类Smads的活性, 可与调节性Smads竞争性结合受体, 阻止调节性Smads磷酸化而阻断TGF-β的信号. TGF-β1首先与细胞表面的TβRⅡ结合形成复合物, 配体构型发生改变, 从而可被TβRⅠ识别并结合, 活化的TβRⅠ可使调节性Smads C末端SSXS结构中3个丝氨酸残基被磷酸化. 磷酸化的Smad2或Smad3可与Smad4结合, 形成异二聚体或Smad2、Smad3、Smad4异三聚体, 由胞质移至胞核, 参与调节基因表达[18,19]. 有关文献报道HSC的激活主要与Smad3有关[20-22], 针对Smad3的靶向治疗也取得显著疗效[23,24]. 这一超家族成员中, Smad6、7具有与其他信息分子不同的负性调节作用, Smad6在HF的负反馈调节作用的研究相对较少, 而Smad7在抑制HSC细胞活化, 调节TGF-β1信号转导及减轻肝损伤方面起重要作用[25]. 目前研究表明, 调控TGF-β1信号途径是治疗HF的有效方法[26].
HF归属于中医学的癥瘕、积聚、胁痛等病证范畴, 病机为"虚实夹杂", 活血化瘀、软坚散结与补益虚损是临床治疗的重要方法. 鳖甲煎改良方是我们长期临床实践中在鳖甲煎丸[27]基础上总结的有效方, 能显著改善患者肝功能、肝纤谱, 提高患者生活质量, 其组成为鳖甲, 土鳖虫, 柴胡, 黄芩, 半夏, 黄芪, 茵陈, 桂枝, 白芍, 桃仁, 茯苓等, 脉络瘀血日久, 非一般活血药物所能及, 鳖甲、土鳖虫两位虫类药为君药, 活血逐瘀, 破积消癥, 有祛除肝脏瘀血, 通理血脉涩滞之功; 配以桃仁、白芍活血养血, 达祛瘀而不伤正之效; 加黄芪、茯苓健脾益气, 鼓舞正气; 柴胡、黄芩、半夏、茵陈入肝经, 软坚散结, 清热祛痰除湿; 辅以桂枝通络. 全方具有活血化瘀、软坚散结兼益气健脾之效, 不仅对症治疗而且也体现了中医的"见肝之病, 知肝传脾"的未病先防、既病防变的治未病思想. 复方鳖甲软肝片是经国家药品监督管理局批准生产的目前国内专一用于预防、阻断和治疗HF及早期肝硬化的国家级新药, 具有明显的抗纤维化作用[28,29]. 本实验证实, 通过C、D、E组治疗HF大鼠后, 肝功能及HF结构得到明显改善, TGF-β1、Smad3表达显著降低, 而Smad7表达明显升高, 与复方鳖甲软肝片治疗效果比较虽无明显差异, 但是在药物成分上复方鳖甲软肝片紫河车、冬虫夏草等稀少且价位高, 真品少等特点, 鳖甲煎改良方就很好地弥补了这方面的劣势, 具有很高的临床应用价值, 其抗大鼠HF可能机制为调控TGF-β/Smad信号转导通路. 我们知道, HF的形成是多种细胞因子, 多种信号通络共同作用的结果, 彼此间存在着广泛的联系, 中药复方的治疗优势在于多途径、多靶点的整合作用, 扶正祛邪, 彼此兼顾, 以达ECM合成与降解的动态平衡, 然而TGF-β1具有广泛的生物学效应[30], 鳖甲煎改良方治疗后可使其表达显著降低, 是否影响其他生物学变化及鳖甲煎改良方是否对其他致HF的信号通路也有抑制作用, 都有待于进一步研究. 总之, 本实验结果表明: 鳖甲煎改良方具有抗大鼠HF作用, 其机制可能与鳖甲煎改良方调控TGF-β/Smad这一信号通路有关.
非常感谢何跃、赵长春、梁宇佳、周青及赵映兰等在本实验中给予的大力帮助和支持.
中医药治疗肝纤维化源远流长, 疗效显著. 目前关于肝纤维化发生、发展及逆转的现代生物机制的研究取得了较大进展. 用现代生物技术阐释中医药的治疗机制是中医药现代化的有效途径.
李康, 副教授, 广东药学院药科学院药物分析教研室
TGF-β1/Smads信号传导途径是肝纤维化形成最重要的调控机制之一, 其传导过程已基本明确, 中药复方的治疗优势在于多靶点、多途径的整合作用, 扶正祛邪, 兼顾彼此, 从中医药中寻求对该信号通路有干预作用的药物是当前重要的研究热点.
有关文献报道HSC的激活主要与Smad3有关, 针对Smad3的靶向治疗也取得显著疗效.
从胞内信号转导层面, 运用分子生物学技术, 研究鳖甲煎改良方对肝纤维化大鼠肝组织和细胞内信号转导的影响, 探讨其抗肝纤维化作用机制, 充分发挥了中医药和现代技术的各自优势.
鳖甲煎改良方能够显著减轻CCl4导致的大鼠肝纤维化程度, 其作用机制可能与鳖甲煎改良方调控TGF-β1和Sman3/7信号转导蛋白表达有关.
本文科学性较好, 为防治肝纤维化的机制研究奠定基础.
编辑: 李薇 电编:何基才
| 1. | Lim MC, Maubach G, Zhuo L. TGF-beta1 down-regulates connexin 43 expression and gap junction intercellular communication in rat hepatic stellate cells. Eur J Cell Biol. 2009;88:719-730. [PubMed] [DOI] |
| 2. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 3. | Yasuda H, Imai E, Shiota A, Fujise N, Morinaga T, Higashio K. Antifibrogenic effect of a deletion variant of hepatocyte growth factor on liver fibrosis in rats. Hepatology. 1996;24:636-642. [PubMed] [DOI] |
| 4. | 徐 叔云, 卞 如濂, 陈 修. 实验药理方法学. 第3版. 北京: 人民卫生出版社 2001; 202-204. |
| 5. | Pinzani M, Rombouts K. Liver fibrosis: from the bench to clinical targets. Dig Liver Dis. 2004;36:231-242. [PubMed] [DOI] |
| 6. | Jarcuska P, Janicko M, Veselíny E, Jarcuska P, Skladaný L. Circulating markers of liver fibrosis progression. Clin Chim Acta. 2010;411:1009-1017. [PubMed] [DOI] |
| 7. | Henderson NC, Iredale JP. Liver fibrosis: cellular mechanisms of progression and resolution. Clin Sci (Lond). 2007;112:265-280. [PubMed] [DOI] |
| 8. | Rombouts K, Marra F. Molecular mechanisms of hepatic fibrosis in non-alcoholic steatohepatitis. Dig Dis. 2010;28:229-235. [PubMed] [DOI] |
| 9. | Cui W, Jin HB, Li ZW. Mechanism of the transforming growth factor-beta induction of fibronectin expression in hepatic stem-like cells. Braz J Med Biol Res. 2010;43:36-42. [PubMed] |
| 10. | Gaça MD, Zhou X, Issa R, Kiriella K, Iredale JP, Benyon RC. Basement membrane-like matrix inhibits proliferation and collagen synthesis by activated rat hepatic stellate cells: evidence for matrix-dependent deactivation of stellate cells. Matrix Biol. 2003;22:229-239. [PubMed] [DOI] |
| 11. | Wells RG. Cellular sources of extracellular matrix in hepatic fibrosis. Clin Liver Dis. 2008;12:759-768, viii. [PubMed] [DOI] |
| 12. | Mann DA, Marra F. Fibrogenic signalling in hepatic stellate cells. J Hepatol. 2010;52:949-950. [PubMed] [DOI] |
| 13. | Atzori L, Poli G, Perra A. Hepatic stellate cell: a star cell in the liver. Int J Biochem Cell Biol. 2009;41:1639-1642. [PubMed] [DOI] |
| 14. | Cheng JH, She H, Han YP, Wang J, Xiong S, Asahina K, Tsukamoto H. Wnt antagonism inhibits hepatic stellate cell activation and liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2008;294:G39-G49. [PubMed] [DOI] |
| 15. | Schiller M, Javelaud D, Mauviel A. TGF-beta-induced SMAD signaling and gene regulation: consequences for extracellular matrix remodeling and wound healing. J Dermatol Sci. 2004;35:83-92. [PubMed] [DOI] |
| 16. | Miyazono K, ten Dijke P, Heldin CH. TGF-beta signaling by Smad proteins. Adv Immunol. 2000;75:115-157. [PubMed] [DOI] |
| 17. | Seuntjens E, Umans L, Zwijsen A, Sampaolesi M, Verfaillie CM, Huylebroeck D. Transforming Growth Factor type beta and Smad family signaling in stem cell function. Cytokine Growth Factor Rev. 2009;20:449-458. [PubMed] [DOI] |
| 18. | Xu L. Regulation of Smad activities. Biochim Biophys Acta. 2006;1759:503-513. [PubMed] |
| 19. | Javelaud D, Mauviel A. Mammalian transforming growth factor-betas: Smad signaling and physio-pathological roles. Int J Biochem Cell Biol. 2004;36:1161-1165. [PubMed] [DOI] |
| 20. | Yokote K, Kobayashi K, Saito Y. The role of Smad3-dependent TGF-beta signal in vascular response to injury. Trends Cardiovasc Med. 2006;16:240-245. [PubMed] [DOI] |
| 21. | Roberts AB, Tian F, Byfield SD, Stuelten C, Ooshima A, Saika S, Flanders KC. Smad3 is key to TGF-beta-mediated epithelial-to-mesenchymal transition, fibrosis, tumor suppression and metastasis. Cytokine Growth Factor Rev. 2006;17:19-27. [PubMed] [DOI] |
| 22. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] [DOI] |
| 23. | Latella G, Vetuschi A, Sferra R, Catitti V, D'Angelo A, Zanninelli G, Flanders KC, Gaudio E. Targeted disruption of Smad3 confers resistance to the development of dimethylnitrosamine-induced hepatic fibrosis in mice. Liver Int. 2009;29:997-1009. [PubMed] [DOI] |
| 24. | Moro T, Shimoyama Y, Kushida M, Hong YY, Nakao S, Higashiyama R, Sugioka Y, Inoue H, Okazaki I, Inagaki Y. Glycyrrhizin and its metabolite inhibit Smad3-mediated type I collagen gene transcription and suppress experimental murine liver fibrosis. Life Sci. 2008;83:531-539. [PubMed] [DOI] |
| 25. | Yan X, Liu Z, Chen Y. Regulation of TGF-beta signaling by Smad7. Acta Biochim Biophys Sin (Shanghai). 2009;41:263-272. [PubMed] [DOI] |
| 26. | Matsuzaki K. Modulation of TGF-beta signaling during progression of chronic liver diseases. Front Biosci. 2009;14:2923-2934. [PubMed] [DOI] |
| 28. | 蔺 武, 刘 心娟, 魏 南, 高 炳霞, 姜 国俊, 常 岩芹. 复方鳖甲软肝片抗肝纤维化疗效的系统评价. 胃肠病学和肝病学杂志. 2007;16:69-72. |
| 30. | Meyer C, Meindl-Beinker NM, Dooley S. TGF-beta signaling in alcohol induced hepatic injury. Front Biosci. 2010;15:740-749. [PubMed] [DOI] |