修回日期: 2010-03-07
接受日期: 2010-03-15
在线出版日期: 2010-03-28
目的: 探讨胃癌RUNX3、RASSF1A基因启动子甲基化在胃癌进展转移中的作用及意义.
方法: RT-PCR和MSP检测62例胃癌标本及56例正常胃黏膜组织RUNX3、RASSF1A基因mRNA表达及甲基化状况, 免疫组织化学检测VEGF在RUNX3、RASSF1A甲基化与非甲基化胃癌组织及20例正常组织中的表达, 并分析RUNX3、RASSF1A甲基化与VEGF表达的关系.
结果: 胃癌组织RUNX3与RASSF1A表达较正常组织均明显降低(0.629±0.461 vs 0.893±0.543, 0.653±0.476 vs 0.858±0.581, 均P<0.05), 且RUNX3与RASSF1A甲基化率均高于正常组织(69.4% vs 26.8%, 66.1% vs 23.2%, 均P<0.01). 胃癌组织中RUNX3、RASSF1A甲基化组mRNA表达量较非甲基化组明显降低(0.545±0.299 vs 0.736±0.291, 0.562±0.208 vs0.674±0.185, 均P<0.05). RASSF1A甲基化与肿瘤TNM分期及浸润深度相关, RUNX3甲基化与肿瘤淋巴结转移、血管侵犯及TNM分期相关(P<0.05). RUNX3甲基化组胃癌组织VEGF蛋白表达高于非甲基化组(86.0% vs 57.9%), RUNX3甲基化与VEGF表达相关(P<0.05).
结论: RUNX3、RASSF1A启动子高甲基化可能是导致其表达降低的原因, 并与胃癌进展演变相关. RUNX3甲基化可能参与胃癌血管、淋巴管转移.
引文著录: 林海, 曹俊, 张斌, 吴育美, 邹晓平. RUNX3、RASSF1A启动子高甲基化与胃癌进展转移的关系. 世界华人消化杂志 2010; 18(9): 889-896
Revised: March 7, 2010
Accepted: March 15, 2010
Published online: March 28, 2010
AIM: To investigate the clinical significance of runt-related transcription factor 3 (RUNX3) and Ras association domain family 1A (RASSF1A) promoter methylation in human gastric cancer.
METHODS: The mRNA expression and methylation of RUNX3, and RASSF1A in 62 gastric cancer specimens and 56 adjacent normal tissue specimens were detected by reverse transcription-polymerase chain reaction (RT-PCR) and methylation-specific PCR (MSP), respectively. The expression of VEGF protein was measured by immunohistochemistry in methylation-positive and -negative cancer tissue specimens and 20 normal gastric tissue specimens.
RESULTS: The mRNA expression levels of RUNX3 and RASSF1A in gastric cancer were lower than those in normal gastric tissue (0.629 ± 0.461 vs 0.893 ± 0.543 and 0.653 ± 0.476 vs 0.858 ± 0.581, respectively; both P < 0.05). The positive rates of RUNX3 and RASSF1A methylation were significantly higher in gastric cancer tissue specimens than in normal control ones (69.4% vs 26.8% and 66.1% vs 23.2%, respectively; both P < 0.01). The expression levels of RUNX3 and RASSF1A mRNAs were lower in methylation-positive cancer tissue specimens than in methylation-negative ones (P < 0.05). Neither RUNX3 nor RASSF1A promoter methylation were correlated with sex, age, tumor size, tumor differentiation degree, and Lauren classification. However, RASSF1A methylation was related with TNM stage and depth of infiltration, and RUNX3 methylation was associated with lymph node metastasis, vascular invasion and TNM stage. The positive rate of VEGF protein expression in RUNX3 methylation-positive gastric cancer specimens was significantly higher than that in RUNX3 methylation-negative ones (86.0% vs 57.9%, P < 0.05).
CONCLUSION: Aberrant RUNX3 and RASSF1A promoter methylation may lead to down-regulation of the two genes in GC and is therefore involved in the progression of the disease. RUNX3 promoter methylation may participate in the vascular/lymphatic metastasis of GC.
- Citation: Lin H, Cao J, Zhang B, Wu YM, Zou XP. Correlations of RUNX3 and RASSF1A promoter hypermethylation with the progression and metastasis of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 889-896
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/889.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.889
胃癌发病率居所有恶性肿瘤的第2位, 是否发生转移对患者治疗方式的选择及预后影响较大, 而目前尚缺乏可以实现早期检测胃癌侵犯转移的指标[1-3]. VEGF的表达与肿瘤血管、淋巴管转移密切相关, 多数肿瘤中均存在VEGF高表达, 虽然已有报道抑癌基因表达失活与VEGF表达相关, 但是其具体调节机制仍不完全清楚[4-6]. 既往我们已经研究发现RUNX3在胃癌癌前病变及早期胃癌中均存在高甲基化现象, 对胃癌的发生起重要作用, 但有关RUNX3甲基化是否参与胃癌进展转移尚不完全清楚[7]. RASSF1A是目前发现的在不同类型肿瘤中最常发生甲基化的基因, 关于其启动子甲基化与国内胃癌关系的报道较少. 我们通过检测进展期胃癌组织RUNX3、RASSF1A基因甲基化和mRNA表达, 以及VEGF蛋白表达, 以期进一步深入探讨抑癌基因高甲基化与胃癌发生、发展的关系.
62例胃癌组织(6例为皮革胃)及相应的56例正常胃黏膜组织取自鼓楼医院普外科2008-04/2009-06行手术切除的胃癌患者, 其中男44例, 女18例, 年龄34-83岁(平均年龄61.5岁±10.1岁). 肿瘤组织取自肿块中心未发生坏死的组织, 正常组织取自距肿块5 cm以外区域, 病理检测未见癌细胞浸润, 所有患者术前均未行放、化疗. 所有癌组织标本术后均经病理学专家确诊为胃癌. 根据1997年国际抗癌联盟TNM分期标准将62例胃癌分为Ⅰ/Ⅱ期17例, Ⅲ/Ⅳ期45例. 肿瘤浸润深度: T1/T2期22例, T3/T4期40例(T1: 肿瘤浸润至黏膜或黏膜下层; T2: 肿瘤浸润至肌层或浆膜层; T3: 肿瘤已穿透浆膜层, 但未侵及邻近组织; T4: 肿瘤侵及邻近组织或器官). 按Lauren分型分为肠型30例, 弥漫型25例, 混合型7例. 按术后病理分为高/中分化24例, 低分化38例. 标本离体后立即存入-80 ℃冰箱备用. 组织获取均征得患者及家属知情同意, 并经鼓楼医院伦理委员会同意. 引物委托上海英骏生物技术有限公司合成.
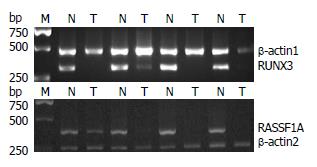
1.2.1 RNA提取及逆转录聚合酶链式反应(RT-PCR): 取100 mg组织匀浆后, 参照TRIzol(Invitrogen, USA)说明书提取癌及正常组织RNA, 琼脂糖凝胶电泳检测RNA完整性, 用紫外分光光度计检测RNA浓度及纯度. 取2 μg RNA, 参照逆转录试剂盒(Invitrogen, USA)操作说明书逆转录合成cDNA. 取2 μL cDNA扩增RUNX3基因(311 bp), 同时扩增β-actin1(434 bp)作为内参. 其中RUNX3引物序列为: F: 5'-ATCCCCTGACAAAAAGTGACG-3'; R: 5'-GCAAAGCAGTTTCCACCCA-3', β-actin1引物序列: F: 5'-CGGGAAATCGTGCGTGAC-3'; R: 5'-TGGAAAGGTGGACAGCGAGG-3'. 反应体系包括: 10×PCR Buffer 2.0 μL, dNTP 1.6 μL, MgCl2 2.0 μL, 上下游引物各0.4 μL(10 pmol/L), cDNA2.0 μL, Taq酶0.1 μL, 双蒸水补齐至20 μL. RASSF1A(331 bp)引物序列: F: 5'-CTTTTACCTGCCCAAGGATGC-3'; R: 5'-CACCTCCCCAGAGTCATTTTCC-3'. β-actin2(263 bp)引物序列:F: 5'-GAGACCTTCAACACCCCAGC-3', R: 5'-ATGTCACGCACGATTTCCC-3'. 反应体系包括: 10×PCR Buffer 2.5 μL, dNTP 2.0 μL, MgCl2 1.5 μL, 上下游引物各0.5 μL(10 pmol/L), cDNA 2.0 μL, Taq酶(TaKaRa, 日本)0.125 μL, 去离子水补齐至25 μL. 反应条件为: 95 ℃, 5 min, 95 ℃, 30 s, 退火温度(RUNX3 58 ℃, RASSF1A 60 ℃)45 s, 72 ℃, 1 min, 共38个循环, 最后72 ℃延伸10 min. 取5 μL PCR扩增产物在2%琼脂糖凝胶同一胶孔上行同步电泳, 凝胶成像仪拍照, 分别计算RUNX3、RASSF1A与内参的平均吸光度(A)值, 以两者吸光度比值作为目的基因相对表达量.
1.2.2 DNA提取及修饰: 取50-80 mg组织, 使用蛋白酶K消化、酚/氯仿变性、乙醇沉淀法提取组织DNA, 紫外分光光度计测定DNA浓度及纯度. 取1 μg DNA按试剂盒EZ DNA Methylation GoldTM(Zymo research, USA)说明书步骤行亚硫酸氢钠修饰, 修饰后DNA存于-80℃备用.
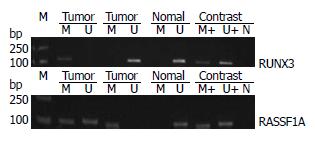
1.2.3 甲基化特异性聚合酶链式反应(MSP): 按照Herman等[8]提出的MSP方法, 分别设计甲基化与非甲基化引物行MSP扩增检测癌与正常组织RUNX3、RASSF1A基因是否发生甲基化. 具体引物序列、退火温度及扩增片段大小见表1. MSP反应体系为25 μL: 包括去离子水16.875 μL, 10×PCR Buffer(含15 mmol/L MgCl2)2.5 μL, dNTP 2.5 μL, 上下游引物各0.5 μL(10 pmol/L), 修饰DNA 2.0 μL, Taqhotstart酶(TaKaRa, 日本)0.125 μL. 反应条件: 95 ℃, 5 min, 95 ℃, 45 s, 退火温度复性45 s, 72 ℃, 1 min, 共40个循环, 最后72 ℃延伸10 min. 同时分别选取经甲基化酶M.SssⅠ(New England BioLabs® Inc.)处理和未处理的正常人外周血淋巴细胞DNA作为甲基化、非甲基化阳性对照, 去离子水代替DNA作空白对照. 取5 μL MSP产物在3%琼脂糖凝胶上电泳, 用GDS-8000(UVP, 美国)凝胶成像仪拍照分析.
| 基因 | 引物序列 | 产物大小(bp) | 退火温度(℃) | 参考文献 |
| RUNX3MF | ATAATAGCGGTCGTTAGGGCGTCG | 115 | 60 | [9] |
| RUNX3MR | GCTTCTACTTTCCCGCTTCTCGCG | |||
| RUNX3UF | ATAATAGTGGTTGTTAGGGTGTTG | 115 | 55 | [9] |
| RUNX3UR | ACTTCTACTTTCCCACTTCTCACA | |||
| RASSF1AM F | GTGTTAACGCGTTGCGTATC | 93 | 58 | [10] |
| RASSF1AM R | AACCCCGCGAACTAAAAACGA | |||
| RASSF1AU F | TTTGGTTGGAGTGTGTTAATGTG | 105 | 58 | [10] |
| RASSF1AU R | CAAACCCCACAAACTAAAAACAA |
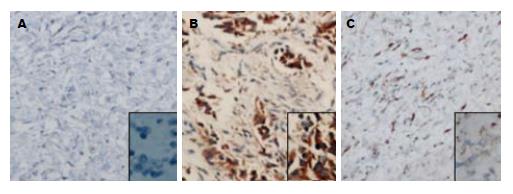
1.2.4 免疫组织化学检测VEGF表达: 将组织标本用100 g/L甲醛固定, 石蜡包埋, 制备4 μm厚连续切片. 采用EnVision二步法行免疫组织化学染色. 具体操作步骤如下: 将石蜡切片常规脱蜡至水, 采用高压锅加热法行抗原修复, 10%山羊血清封闭, 滴加兔抗人VEGF单克隆抗体(北京中杉金桥生物技术有限公司)并于4 ℃过夜, PBS漂洗3次, 滴加二抗(北京中杉公司试剂盒)并在室温下孵育30 min, DAB显色, 苏木精复染后将切片脱水、透明并封片. 以已知的VEGF染色阳性切片做阳性对照, PBS代替一抗做阴性对照. 高倍镜下随机取4个视野, 以细胞质出现棕黄色或棕褐色颗粒为VEGF阳性, 根据阳性细胞百分比及染色强度分别计分判定VEGF染色结果: 阳性细胞百分比计数如下: ≤10%(0分), 11%-25%(1分), 26%-50%(2分), 51%-75%(3分), ≥76%(4分). 染色强度评分如下: 无染色(0分), 淡染色(1分), 棕黄色(2分), 棕褐色(3分). 以两项积分乘积<3分为阴性, 积分≥3分判定为阳性(3-6分弱阳性; ≥6分强阳性)[11,12].
统计学处理 采用SPSS16.0软件进行统计分析. χ2检验、t-检验分别用于比较癌与正常组织中RUNX3、RASSF1A两基因甲基化率及表达差异. χ2检验或Fisher确切概率法对性别、年龄、TNM分期等临床病理参数进行单因素分析. RUNX3和RASSF1A两基因甲基化与其mRNA表达及VEGF蛋白表达之间的关系用t-检验和χ2检验, P<0.05为有统计学意义.
RUNX3在胃癌与正常胃黏膜组织中的相对表达量分别为0.629±0.461和0.893±0.543, 癌组织RUNX3表达量低于正常组织, 差异具有统计学意义(t = 2.189, P = 0.033). RASSF1A在癌与正常组织中的相对表达量分别为0.653±0.476, 0.858±0.581, 两组差异具有统计学意义(t = 2.017, P = 0.046). RUNX3甲基化组胃癌组织其RUNX3 mRNA表达低于非甲基化组(0.545±0.299 vs 0.736±0.291, t = 2.310, P = 0.025). RASSF1A甲基化组的胃癌RASSF1A mRNA表达量低于非甲基化组(0.562±0.208 vs 0.674±0.185, t = 2.572, P = 0.012, 图1).
胃癌组织RUNX3甲基化率为69.4%(43/62), 高于正常组织26.8 %(15/56), 癌组织甲基化率是正常胃黏膜组织的2.60倍, 差异具有统计学意义(P<0.01). RASSF1A在癌组织和正常组织中的甲基化率分别为66.1%(41/62)和23.2%(13/56), 癌组织甲基化率是正常组织的2.80倍, 具有统计学差异(P<0.01, 图2).
癌组织中RUNX3与RASSF1A两基因同时发生甲基化的有29例(46.8%), 正常组织有6例(10.7%), 两组差异显著(P<0.01). 癌组织中RUNX3、RASSF1A至少1个基因存在甲基化的有54例(87.1%), 正常组织为17例(30.4%), 两者差异显著(P<0.01). 癌组织中RUNX3与RASSF1A两基因甲基化不存在相关性(表2).
| RUNX3 | n | RASSF1A | χ2值 | P值 | |
| M | U | ||||
| M | 39 | 29 | 10 | 0.587 | 0.564 |
| U | 23 | 15 | 8 | ||
| 合计 | 62 | 44 | 18 | ||
两基因甲基化与患者性别、年龄、肿瘤大小、分化程度、Lauren分型之间无相关性(P>0.05), 但RUNX3甲基化与肿瘤淋巴结转移、血管侵犯、TNM分期相关, 而RASSF1A甲基化与TNM分期和浸润深度具有相关性(P<0.05, 表3).
| 临床病理参数 | n | RUNX3 | χ2值 | P值 | RASSF1A | χ2值 | P值 | ||
| M | U | M | U | ||||||
| 性别 | |||||||||
| 男 | 44 | 31 | 13 | 0.086 | 0.770 | 29 | 15 | 0.003 | 1.000 |
| 女 | 18 | 12 | 6 | 12 | 6 | ||||
| 年龄(岁) | |||||||||
| ≥60 | 38 | 27 | 11 | 0.781 | 0.133 | 24 | 14 | 0.387 | 0.591 |
| <60 | 24 | 16 | 8 | 17 | 7 | ||||
| 肿瘤大小(cm) | |||||||||
| ≥5 | 33 | 25 | 8 | 1.361 | 0.280 | 23 | 10 | 0.401 | 0.596 |
| <5 | 29 | 18 | 11 | 18 | 11 | ||||
| 分化程度 | |||||||||
| 高/中 | 24 | 19 | 5 | 1.774 | 0.260 | 15 | 9 | 0.230 | 0.784 |
| 低 | 38 | 24 | 14 | 26 | 12 | ||||
| 淋巴结转移 | |||||||||
| 有 | 43 | 34 | 9 | 6.231 | 0.018a | 30 | 13 | 0.829 | 0.395 |
| 无 | 19 | 9 | 10 | 11 | 8 | ||||
| 血管侵犯 | |||||||||
| 有 | 42 | 33 | 9 | 5.204 | 0.038a | 29 | 13 | 0.495 | 0.570 |
| 无 | 20 | 10 | 10 | 12 | 8 | ||||
| TNM分期 | |||||||||
| Ⅰ/Ⅱ | 17 | 8 | 9 | 5.478 | 0.030a | 7 | 10 | 6.511 | 0.016a |
| Ⅲ/Ⅳ | 45 | 35 | 10 | 34 | 11 | ||||
| Lauren 分型 | |||||||||
| 肠型 | 30 | 21 | 9 | 1.630 | 0.443 | 17 | 13 | 2.260 | 0.323 |
| 弥漫型 | 25 | 20 | 5 | 15 | 10 | ||||
| 混合型 | 7 | 4 | 3 | 2 | 5 | ||||
| 浸润深度 | |||||||||
| T1/T2 | 22 | 12 | 10 | 3.519 | 0.085 | 10 | 12 | 6.507 | 0.023a |
| T3/T4 | 40 | 31 | 9 | 31 | 9 | ||||
胃癌细胞胞质可见VEGF阳性染色, 阳性率为79.0%(49/62), 正常胃黏膜细胞阳性率为15.0%(3/20), 癌组织VEGF蛋白表达明显高于正常胃黏膜组织(P = 0.000, χ2 = 26.724). 将胃癌组织按RUNX3甲基化与否分组发现, RUNX3甲基化组中VEGF表达阳性的有37例(86.0%), 非甲基化组中VEGF表达阳性的有11例(57.9%), 两组差异显著, RUNX3甲基化与VEGF表达相关(P = 0.022, χ2 = 5.974, 表4). VEGF在RASSF1A甲基化与非甲基化胃癌组织中表达率分别为81.0%(35/43)和73.7%(14/19), 无统计学差异(P = 0.513, χ2 = 0.473, 图3).
RUNX3基因编码TGF-β信号通路下游转录调节因子, 其表达失活, 可以使胃黏膜细胞凋亡受抑, 并向恶性细胞转化[13]. RASSF1A是位于染色体3p21.3位点的抑癌基因, 通过阻断CyclinD1累积及控制细胞G1/S期进展而抑制肿瘤细胞生长[14,15]. RUNX3、RASSF1A基因在肺癌、胃癌、乳腺癌等多种实体瘤中均存在甲基化导致的表达失活[16-18]. 本实验发现胃癌组织RUNX3与RASSF1A基因均存在低表达改变, 并伴有高甲基化现象. 为了更好地阐明RUNX3、RASSF1A基因甲基化与表达之间的关系, 我们进一步对发生与未发生甲基化的胃癌组织中RUNX3、RASSF1A mRNA表达做统计分析, 发现两基因存在甲基化的癌组织其mRNA表达均较未发生甲基化的胃癌组织明显降低, 差异具有统计学意义. 表明RUNX3、RASSF1A基因甲基化与其表达相关, 抑癌基因高甲基化可能是导致其表达降低的原因. 本实验中个别组织不存在RUNX3及RASSF1A甲基化却出现基因表达缺失或降低, 对于这种现象, 我们考虑除了甲基化外可能还有杂合性缺失、点突变等机制共同调节基因的表达.
与前期研究[7]的RUNX3在异型增生、早期胃癌中甲基化率分别为48.1%、50%相比, 本研究发现RUNX3在进展期胃癌中甲基化率达到69.4%, 这与Oshimo等[19]报道的71%甲基化率基本一致, 稍高于Kim等[20]等报道的64%的甲基化率. 随着胃癌的发展RUNX3甲基化率逐步升高, 这提示RUNX3甲基化可能贯穿于胃癌进展演变的全过程, 与胃癌的发生发展均有关系.RASS1A在胃癌组织中的甲基化率为66.1%, 正常胃黏膜组织为23.2%. 胃癌组织RASS1A甲基化率稍高于李学彦等[21]报道的甲基化率. 而同Ye等[22]的研究结果相比, RASS1A在胃癌组织中的甲基化率基本一致, 而正常胃黏膜组织RASS1A甲基化率高于其报道的14.8%检出率. 关于正常组织RASS1A甲基化率的差异, 我们考虑可能是由于病例年龄组成不同所致(61.5±10.1/57.6±13.7). 由于我们所检测标本的患者其年龄相对较高, 而且已有研究表明随着年龄增长, 正常胃黏膜出现RASSF1A等抑癌基因高甲基化的几率将会增加[20,23]. 当通过对RUNX3和RASSF1A甲基化进行联合分析时我们发现, RUNX3与RASSF1A甲基化不存在相关性, 这说明两基因甲基化可能是通过不同路径影响胃癌的发生发展. 由于联合检测两个基因甲基化的敏感性和特异性均高于单基因甲基化检测, 而且目前已有报道通过检测血清中肿瘤细胞游离DNA甲基化作为肿瘤的分子标记[24,25]. 这提示或许在今后的临床研究中可以应用这种创伤较小的检查方法, 联合检测多个相关基因甲基化或建立肿瘤相关基因的甲基化模式图谱, 从而为肿瘤的诊断、分型、分期及个体化诊疗等提供帮助.
此外, 通过与患者临床病理指标比较我们发现, 两基因甲基化率在分期较晚及浸润较深的胃癌中较高, 表明随着肿瘤的进展演变, 甲基化现象变得更为普遍. RUNX3甲基化率在发生血管及淋巴管转移的胃癌组织中明显升高, 这提示RUNX3甲基化可能参与胃癌的进展及血管、淋巴管转移. 由于VEGF是最主要的血管淋巴管生成调节因子, 其不仅参与肿瘤新生血管的形成, 而且可以通过与淋巴管内皮细胞Flt-4受体相结合而诱导瘤体内淋巴管的增生、扩张, 与肿瘤的血管淋巴管转移有密切的联系[26,27]. VEGF高表达的肿瘤患者对治疗的反应及预后较差[28,29]. 虽然既往有报道甲基化等原因造成的抑癌基因表达失活及癌基因激活可能与肿瘤组织VEGF高表达相关,但是有关抑癌基因甲基化与VEGF表达之间的关系仍不完全清楚[5-6,30]. 为了进一步阐明RUNX3甲基化与胃癌转移之间的关系, 我们用免疫组织化学检测了43例RUNX3发生甲基化与19例未发生甲基化的胃癌组织, 分析发现RUNX3发生甲基化的胃癌组织其VEGF表达阳性率(86.0%)明显高于RUNX3非甲基化胃癌组织(57.9%), RUNX3甲基化与VEGF表达相关. 伏洁等[31]利用胃癌组织芯片验证了RUNX3失表达可以通过促进VEGF表达增加胃癌血管的生成和转移. 而Peng等[12]通过动物实验及对120例胃癌组织中RUNX3与VEGF表达的研究也发现, RUNX3低表达与VEGF高表达密切相关, 通过激活RUNX3基因表达可以有效抑制胃癌血管及淋巴管的形成. 这说明RUNX3甲基化或许是通过调节VEGF高表达从而促进胃癌的血管及淋巴管转移. 由于RUNX3基因表达失活与胃癌转移密切相关, 而甲基化所导致的基因表达异常属于可逆性遗传改变, 应用5-Aza-cdR等去甲基化药物可以逆转甲基化而使得抑癌基因恢复表达[32,33]. 这提示或许可以通过应用5-Aza-cdR等去甲基化药物逆转RUNX3基因甲基化以降低胃癌组织中VEGF的表达, 从而使得胃癌血管淋巴管生成减少, 降低肿瘤转移的可能性, 改善胃癌患者预后. 但是由于并非所有抑癌基因甲基化均参与胃癌的进展转移, 而目前的去甲基化药物尚不能做到针对特异性基因实现去甲基化, 故如何进一步研究RUNX3特异性去甲基化药物对于肿瘤的去甲基化治疗具有重要意义.
总之, 启动子高甲基化是导致抑癌基因表达失活或降低的重要机制, 其不仅与胃癌发生相关, 而且参与胃癌的进展转移. 在今后的临床研究中检测胃癌组织RUNX3、RASSF1A甲基化或许有助于评估胃癌的浸润及转移状况从而优化患者的临床治疗方案. 并且通过检测患者的不同基因甲基化状况, 可以为患者的诊断及临床预后评估提供参考, 同时如能针对特异基因去甲基化, 或许可以将有助于降低肿瘤的浸润转移并改善预后[34,35]. 但有关甲基化与胃癌之间的具体分子机制及相关因素尚需进一步深入研究.
感谢鼓楼医院病理科周祀乔, 冯安宁在胃癌组织标本收集过程中所提供的帮助.
胃癌是我国病死率最高的消化系肿瘤之一, 其中甲基化导致的抑癌基因表达失活是胃癌发生的重要原因. RUNX3基因位于染色体1p36.1位点, 是TGF-β信号通路的重要调节因子, 具有调节胃黏膜上皮细胞增殖与凋亡平衡的作用, 其表达缺失与胃癌的发生、发展相关. RASSF1A是近年发现的抑癌基因, 位于染色体3p21.3处. 其启动子区甲基化与胃肠道肿瘤发生、发展有密切的联系.
于颖彦, 教授, 上海交通大学医学院附属瑞金医院器官移植中心病理室; 崔莲花, 副教授, 青岛大学医学院公共卫生系.
淋巴结及血道转移是胃癌的主要转移途径. 近年来已有研究发现RUNX3、RASSF1A基因甲基化对胃癌的发生起重要作用, VEGF与胃癌的微转移相关. 但是有关抑癌基因甲基化在胃癌进展转移中的具体作用机制研究尚不完全清楚.
本课题组在前期研究发现RUNX3在胃黏膜异型增生及早期胃癌中甲基化率分别为48.1%、50%, 而RASSF1A基因无甲基化现象. Oshimo等报道进展胃癌RUNX3甲基化率达71%. Byun等研究发现RASSF1A甲基化与肿瘤分期分级、分期有关.
本研究采用MSP及免疫组织化学技术检测胃癌及正常胃黏膜组织中RUNX3、RASSF1A甲基化及VEGF蛋白表达状况, 并分析两基因甲基化与临床病理参数的关系.
通过检测RUNX3、RASSF1A基因甲基化可以有助于准确评价胃癌的分期分级, 及判断肿瘤有无微转移. 应用去甲基化药物逆转RUNX3基因甲基化或许可以通过降低胃癌组织VEGF表达, 减少胃癌血管淋巴管生成.
DNA甲基化: 是指在DNA甲基化转移酶(DNMTS的作用下, 将一个甲基添加到DNA分子碱基上, 其中最常添加于胞嘧啶, 从而形成5-甲基胞嘧啶. DNA甲基化主要发生于CpG岛, 其作用是导致基因失活, 一般DNA甲基化程度越高, 这段DNA被转录成RNA的可能性相对越小.
本实验设计合理, 技术和方法可靠, 结论明确, 对于探索胃癌浸润转移确切机制具有参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Oue N, Aung PP, Mitani Y, Kuniyasu H, Nakayama H, Yasui W. Genes involved in invasion and metastasis of gastric cancer identified by array-based hybridization and serial analysis of gene expression. Oncology. 2005;69 Suppl 1:17-22. [PubMed] [DOI] |
| 2. | Terry MB, Gaudet MM, Gammon MD. The epidemiology of gastric cancer. Semin Radiat Oncol. 2002;12:111-127. [PubMed] [DOI] |
| 3. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 4. | Xie K, Wei D, Shi Q, Huang S. Constitutive and inducible expression and regulation of vascular endothelial growth factor. Cytokine Growth Factor Rev. 2004;15:297-324. [PubMed] [DOI] |
| 5. | Kim JY, Hwang JH, Zhou W, Shin J, Noh SM, Song IS, Kim JY, Lee SH, Kim J. The expression of VEGF receptor genes is concurrently influenced by epigenetic gene silencing of the genes and VEGF activation. Epigenetics. 2009;4:313-321. [PubMed] |
| 6. | Matsumura S, Oue N, Mitani Y, Kitadai Y, Yasui W. DNA demethylation of vascular endothelial growth factor-C is associated with gene expression and its possible involvement of lymphangiogenesis in gastric cancer. Int J Cancer. 2007;120:1689-1695. [PubMed] [DOI] |
| 7. | Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ. Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions. Hum Pathol. 2009;40:1534-1542. [PubMed] [DOI] |
| 8. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 9. | Homma N, Tamura G, Honda T, Matsumoto Y, Nishizuka S, Kawata S, Motoyama T. Spreading of methylation within RUNX3 CpG island in gastric cancer. Cancer Sci. 2006;97:51-56. [PubMed] [DOI] |
| 10. | Lo KW, Kwong J, Hui AB, Chan SY, To KF, Chan AS, Chow LS, Teo PM, Johnson PJ, Huang DP. High frequency of promoter hypermethylation of RASSF1A in nasopharyngeal carcinoma. Cancer Res. 2001;61:3877-3881. [PubMed] |
| 11. | Wang L, Wei D, Huang S, Peng Z, Le X, Wu TT, Yao J, Ajani J, Xie K. Transcription factor Sp1 expression is a significant predictor of survival in human gastric cancer. Clin Cancer Res. 2003;9:6371-6380. [PubMed] |
| 12. | Peng Z, Wei D, Wang L, Tang H, Zhang J, Le X, Jia Z, Li Q, Xie K. RUNX3 inhibits the expression of vascular endothelial growth factor and reduces the angiogenesis, growth, and metastasis of human gastric cancer. Clin Cancer Res. 2006;12:6386-6394. [PubMed] [DOI] |
| 13. | Li QL, Ito K, Sakakura C, Fukamachi H, Inoue K, Chi XZ, Lee KY, Nomura S, Lee CW, Han SB. Causal relationship between the loss of RUNX3 expression and gastric cancer. Cell. 2002;109:113-124. [PubMed] [DOI] |
| 14. | Shivakumar L, Minna J, Sakamaki T, Pestell R, White MA. The RASSF1A tumor suppressor blocks cell cycle progression and inhibits cyclin D1 accumulation. Mol Cell Biol. 2002;22:4309-4318. [PubMed] [DOI] |
| 15. | Deng ZH, Wen JF, Li JH, Xiao DS, Zhou JH. Activator protein-1 involved in growth inhibition by RASSF1A gene in the human gastric carcinoma cell line SGC7901. World J Gastroenterol. 2008;14:1437-1443. [PubMed] [DOI] |
| 16. | Niklinska W, Naumnik W, Sulewska A, Kozłowski M, Pankiewicz W, Milewski R. Prognostic significance of DAPK and RASSF1A promoter hypermethylation in non-small cell lung cancer (NSCLC). Folia Histochem Cytobiol. 2009;47:275-280. [PubMed] [DOI] |
| 17. | Guo W, Dong Z, Chen Z, Yang Z, Wen D, Kuang G, Guo Y, Shan B. Aberrant CpG island hypermethylation of RASSF1A in gastric cardia adenocarcinoma. Cancer Invest. 2009;27:459-465. [PubMed] [DOI] |
| 18. | Li Y, Wei Q, Cao F, Cao X. Expression and promoter methylation of the RASSF1A gene in sporadic breast cancers in Chinese women. Oncol Rep. 2008;19:1149-1153. [PubMed] |
| 19. | Oshimo Y, Oue N, Mitani Y, Nakayama H, Kitadai Y, Yoshida K, Ito Y, Chayama K, Yasui W. Frequent loss of RUNX3 expression by promoter hypermethylation in gastric carcinoma. Pathobiology. 2004;71:137-143. [PubMed] [DOI] |
| 20. | Kim TY, Lee HJ, Hwang KS, Lee M, Kim JW, Bang YJ, Kang GH. Methylation of RUNX3 in various types of human cancers and premalignant stages of gastric carcinoma. Lab Invest. 2004;84:479-484. [PubMed] [DOI] |
| 22. | Ye M, Xia B, Guo Q, Zhou F, Zhang X. Association of diminished expression of RASSF1A with promoter methylation in primary gastric cancer from patients of central China. BMC Cancer. 2007;7:120. [PubMed] [DOI] |
| 23. | Waki T, Tamura G, Sato M, Motoyama T. Age-related methylation of tumor suppressor and tumor-related genes: an analysis of autopsy samples. Oncogene. 2003;22:4128-4133. [PubMed] [DOI] |
| 24. | Yanagawa N, Tamura G, Oizumi H, Kanauchi N, Endoh M, Sadahiro M, Motoyama T. Promoter hypermethylation of RASSF1A and RUNX3 genes as an independent prognostic prediction marker in surgically resected non-small cell lung cancers. Lung Cancer. 2007;58:131-138. [PubMed] [DOI] |
| 25. | Wang YC, Yu ZH, Liu C, Xu LZ, Yu W, Lu J, Zhu RM, Li GL, Xia XY, Wei XW. Detection of RASSF1A promoter hypermethylation in serum from gastric and colorectal adenocarcinoma patients. World J Gastroenterol. 2008;14:3074-3080. [PubMed] [DOI] |
| 26. | Da MX, Wu Z, Tian HW. Tumor lymphangiogenesis and lymphangiogenic growth factors. Arch Med Res. 2008;39:365-372. [PubMed] [DOI] |
| 27. | Shida A, Fujioka S, Kobayashi K, Ishibashi Y, Nimura H, Mitsumori N, Yanaga K. Expression of vascular endothelial growth factor (VEGF)-C and -D in gastric carcinoma. Int J Clin Oncol. 2006;11:38-43. [PubMed] [DOI] |
| 28. | Ustuner Z, Saip P, Yasasever V, Vural B, Yazar A, Bal C, Ozturk B, Ozbek U, Topuz E. Prognostic and predictive value of vascular endothelial growth factor and its soluble receptors, VEGFR-1 and VEGFR-2 levels in the sera of small cell lung cancer patients. Med Oncol. 2008;25:394-399. [PubMed] [DOI] |
| 29. | Li SG, Ye ZY, Zhao ZS, Tao HQ, Wang YY, Niu CY. Correlation of integrin beta3 mRNA and vascular endothelial growth factor protein expression profiles with the clinicopathological features and prognosis of gastric carcinoma. World J Gastroenterol. 2008;14:421-427. [PubMed] [DOI] |
| 30. | Shi Q, Le X, Abbruzzese JL, Peng Z, Qian CN, Tang H, Xiong Q, Wang B, Li XC, Xie K. Constitutive Sp1 activity is essential for differential constitutive expression of vascular endothelial growth factor in human pancreatic adenocarcinoma. Cancer Res. 2001;61:4143-4154. [PubMed] |
| 32. | Deng T, Zhang Y. 5-Aza-2'-deoxycytidine reactivates expression of RUNX3 by deletion of DNA methyltransferases leading to caspase independent apoptosis in colorectal cancer Lovo cells. Biomed Pharmacother. 2009;63:492-500. [PubMed] [DOI] |
| 34. | Tamura G. Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer. World J Gastroenterol. 2006;12:192-198. [PubMed] |
| 35. | Prabhu JS, Korlimarla A, Banerjee A, Wani S, K P, Sahoo R. Gene-specific methylation: potential markers for colorectal cancer. Int J Biol Markers. 2009;24:57-62. [PubMed] |