修回日期: 2010-03-08
接受日期: 2010-03-15
在线出版日期: 2010-03-28
目的: 探讨减轻大鼠胰腺移植后缺血再灌注损伤的保护作用机制.
方法: IPC后动态检测大鼠胰腺组织热休克蛋白表达. 建立大鼠胰腺移植缺血再灌注模型, 选择表达热休克蛋白高峰时段供体大鼠胰腺移植作为实验组, 未预处理供体大鼠胰腺移植作为对照组. 移植后6 h, 采集静脉血及移植胰腺. 热休克蛋白70(HSP70)分别用Western blot法及免疫组织化学法检测. 免疫组织化学法测定肿瘤坏死因子-α(TNF-α)表达. 流式细胞仪检测胰腺细胞凋亡率. 碘淀粉比色法检测血淀粉酶水平.
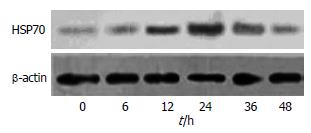
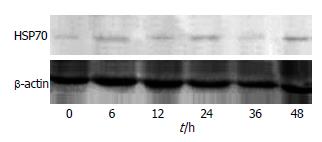
结果: IPC后供体大鼠胰腺中HSP70的表达在24 h达到高峰, 与其他各时段比较具有显著差异(0.92±0.25 vs 0.24±0.04, 0.34±0.06, 0.58±0.07, 0.62±0.11, 0.25±0.09, 均P<0.05), IPC后6 h, 12 h, 24 h, 36 h大鼠胰腺中HSP70的表达与未预处理组相应时段比较差异也显著(0.34±0.06 vs 0.28±0.07, 0.58±0.07 vs 0.25±0.04, 0.92±0.25 vs 0.27±0.05, 0.62±0.11 vs 0.25±0.06, 均P<0.05), 48 h恢复到原来水平. 而未预处理组各时段间比较差异无统计学意义(P>0.05). HSP70主要表达于胰腺腺泡细胞及血管壁. 对照组胰腺组织中TNF-α、细胞凋亡率、中性粒细胞、血淀粉酶的水平明显升高, 与假手术组相比差异显著(均P<0.01). 实验组降低了胰腺组织中TNF-α、细胞凋亡率、白细胞数、血淀粉酶的水平, 与对照组比较差异具有统计学意义(11 929±1220 vs 46 111±3127, 26.7%±4.5% vs 37.4%±4.7%, 3 308±531 vs 6 668±1 506, 1 057 IU/L±148 IU/L vs 1 408 IU/L±195 IU/L, 均P<0.05).
结论: IPC减轻了大鼠胰腺移植后缺血再灌注损伤, IPC保护作用与HSP70的诱导生成有关.
引文著录: 裴广辉, 梁健, 宋文利, 王智平, 莫春柏. 异丙肾上腺素预处理对大鼠胰腺移植后缺血再灌注损伤的抑制作用. 世界华人消化杂志 2010; 18(9): 871-876
Revised: March 8, 2010
Accepted: March 15, 2010
Published online: March 28, 2010
AIM: To determine the protective effects of isoproterenol preconditioning (IPC) against ischemia/reperfusion injury in rats after pancreas transplantation and to explore mechanisms involved.
METHODS: The expression of heat shock protein 70 (HSP70) in the pancreas of rats undergoing IPC was detected at different time points after IPC. A rat model of posttransplant pancreatic ischemia/reperfusion injury was established. The donor rats that showed high expression of HSP70 in the pancreas were used as experiment group, while donor rats that did not undergo IPC were used as control group. The blood and pancreatic samples were taken 6 h after pancreas transplantation. The expression of HSP70 in the pancreas was detected by Western blot and immunohistochemistry. The expression of TNF-α in the pancreas was detected by immunohistochemistry. Serum amylase was determined by iodine colorimetry. The apoptosis rate of pancreatic cells was determined by flow cytometry.
RESULTS: The expression level of HSP70 in the pancreas of donor rats reached the peak at 24 h after IPC, which was significantly higher than those at other time points (0.92 ± 0.25 vs 0.24 ± 0.04, 0.34 ± 0.06, 0.58 ± 0.07, 0.62 ± 0.11 and 0.25 ± 0.09, respectively; all P < 0.05). The expression levels of HSP70 in the experimental group at 6, 12, 24 and 36 h after IPC were significantly higher than those in the control group at corresponding time points (0.34 ± 0.06 vs 0.28 ± 0.07, 0.58 ± 0.07vs 0.25 ± 0.04, 0.92 ± 0.25 vs 0.27 ± 0.05 and 0.62 ± 0.11 vs 0.25 ± 0.06, respectively; all P < 0.05) but returned to normal level at 48 h. No significant differences were noted in the expression levels of HSP70 among each time point in the control group. HSP70 was mainly expressed in pancreatic acinar cells and the vessel wall. The expression level of TNF-α, apoptosis rate, neutrophil count and serum amylase significantly increased in the control group when compared with those in sham-operated group (all P < 0.01). However, the levels of these parameters significantly decreased in the experiment group when compared with those in the control group (11 929 ± 1 220 vs 46 111 ± 3 127, 26.7% ± 4.5% vs 37.4% ± 4.7%, 3 308 ± 531 vs6 668 ± 1 506 and 1 057 IU/L± 148 IU/L vs 1 408 IU/L± 195 IU/L, respectively; all P < 0.05).
CONCLUSION: Isoproterenol preconditioning reduces ischemia/reperfusion injury in rats after pancreas transplantation perhaps by inducing the production of HSP70.
- Citation: Pei GH, Liang J, Song WL, Wang ZP, Mo CB. Preconditioning of pancreatic graft with isoproterenol reduces posttransplant ischemia/reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 871-876
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/871.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.871
胰腺移植缺血再灌注(ischemia/reperfusion, I/R)损伤是胰腺移植失败的主要原因之一[1-3]. 胰腺持续性缺血可导致组织损伤和细胞死亡, 早期再灌注尽管对组织非常重要, 但再灌注后循环白细胞附壁、聚积, 渗出血管、侵及脏器, 导致组织细胞坏死, 另外补体激活以及活性氧的产生致使缺血的脏器损伤更为严重, 即再灌注损伤[4,5]. 在此过程中多种炎性细胞因子参与, 导致组织细胞凋亡及坏死[6,7]. 通过预处理的方法启动机体内源性保护机制, 提高器官对缺血再灌注损伤的耐受性是减轻缺血再灌注损伤理想的方法. 国外报道通过异丙肾上腺素预处理可以减轻由蛙皮素引起的胰腺炎损伤[8]. 本实验采用大鼠胰腺移植模型, 通过腹腔注射异丙肾上腺素预处理, 探讨减轻大鼠胰腺缺血再灌注损伤的保护作用机制. 为临床通过异丙肾上腺素预处理减轻缺血再灌注损伤提供实验依据.
清洁级Wistar大鼠, ♂, 体质量200-250 g, 由中国医科大学动物部提供. 一抗兔抗大鼠热休克蛋白70(heat shock protein 70, HSP70)抗体、二抗碱磷酶标记山羊抗兔IgG(北京中山生物技术有限公司). HSP70及TNF-α免疫组织化学染色试剂盒(武汉博士德生物工程有限公司). β-actin(Santa Cruz biotechnology公司). 碘化丙啶(Sigma公司). 硝酸纤维素膜(Bio-Rad公司)、异丙肾上腺素(上海禾丰药业有限公司).
1.2.1 诱导热休克蛋白大鼠分组: (1)异丙肾上腺素预处理(IPC)组: IPC组腹腔注射异丙肾上腺素0.05 mg/kg. (2)未预处理(C)组: C组腹腔注射与IPC组相应等量0.9%氯化钠注射液. 按照预处理后0、6、12、24、36、48 h分6小组. 分别于预处理后各时段将IPC组(n = 36)及C组(n = 36)大鼠处死取胰腺组织, 各时段大鼠胰腺组织置-70 ℃冰箱保存, 待Western blot法及免疫组织化学检测胰腺组织HSP70.
1.2.2 Western blot法检测胰腺组织HSP70的表达: 将胰腺组织用匀浆机与缓冲液制成匀浆, 离心收集上清液, 蛋白定量后, SDS-聚丙烯酰胺凝胶电泳, 转印至硝酸纤维素膜上. 各与一抗兔抗大鼠HSP70抗体及一抗兔抗大鼠β-actin抗体孵育过夜, TBS液洗去未结合的抗体, 二抗碱磷酶标记山羊抗兔IgG孵育2 h. TBS洗去未结合的二抗. 膜浸入AKP显色液染色20 min, 将膜转至蒸馏水中, 终止显色反应. 运用凝胶图像分析系统(GDS8000型, 美国UVP公司)测定电泳条带积分吸光度值(IA). 以β-actin作为内对照, 将目的条带IA与β-actin IA的比值作为目的蛋白相对表达量.
1.2.3 大鼠胰腺移植模型建立及分组: 术前大鼠全身肝素化, 开腹将大鼠横结肠系膜、十二指肠悬韧带剪断, 分别结扎切断胆总管、肝固有动脉、胃左及胃短动静脉、胃幽门、肾左右动脉, 在腹腔干动脉上结扎腹主动脉, 在肠系膜上动脉下切断腹主动脉, 插管UW液灌洗, 高度60 cm, 灌洗5-8 mL, 直到胰腺变白为止, 游离切断腹主动脉、门静脉, 取出胰腺及脾, 放在4 ℃ UW液中, 腹主动脉远端封闭, 将腹主动脉近端及门静脉断端分别与另外一只大鼠腹主动脉、下腔静脉端侧吻合, 用7-0丝线将供体十二指肠断端与受体空肠作端侧吻合, 逐层关腹, 制成大鼠胰腺移植模型. 将表达热休克蛋白高峰时段大鼠及未预处理组大鼠分别作为供体鼠制作此模型, 分别作为实验组及对照组. 实验组10只预处理后的大鼠作为供体与10只未处理大鼠受体分别行胰腺移植, 对照组10只未预处理大鼠作为供体与10只未处理大鼠受体分别行胰腺移植. 10只大鼠仅行麻醉后开腹, 不制成模型, 作为假手术组. 通血再灌注6 h后视为胰腺移植成功, 分别处死实验组及对照组大鼠, 取其胰腺及血样检测.
1.2.4 免疫组织化学法检测预处理后胰腺组织HSP70及移植后胰腺组织TNF-α的表达: 胰腺标本固定于中性甲醛液24 h, 经脱水、浸蜡及包埋, 切片. 按照HSP70及TNF-α免疫组织化学染色试剂盒说明书操作进行. 应用显微图像分析系统(Metamorph/Dpio/Bx41, UIC/Olympus, US/JP)测免疫组织化学TNF-α IA进行量化比较.
1.2.5 流式细胞仪检测移植后胰腺细胞凋亡率: 收集各组胰腺组织, 放在400目筛网上, 筛网覆盖于小烧杯上, 剪碎胰腺组织, 用PBS液冲洗组织碎块, 将浑浊液体移入流式细胞仪专用管中, 在离心机上1 000 r/min, 离心5 min, 弃上清, 留试管底液体加含RnaseA酶的碘化丙啶0.8 mL染色液混匀, 4 ℃避光30 min. 然后上流式细胞仪检测.
1.2.6 碘淀粉比色法行血清淀粉酶测定: 1个淀粉酶单位为100 mL血清中的淀粉酶在37 ℃条件下, 15 min水解5 mg淀粉. 血清正常值为80-180淀粉酶单位.
1.2.7 胰腺组织白细胞计数: 在200倍HE染色片随机选4个视野, 显微图像分析系统(Metamorph/Dpio/Bx41, UIC/Olympus, US/JP)计数白细胞, 取平均值为此片白细胞数.
统计学处理 数据用mean±SD表示, 采用SPSS10.0软件, 诱导热休克蛋白组内各时段之间比较采用单因素方差分析. 两组之间比较采用t检验. P<0.05为有统计学意义.
异丙肾上腺素预处理组大鼠胰腺组织中HSP70的表达在异丙肾上腺素预处理6 h后增加, 在24 h达到高峰(0.92±0.25), 48 h恢复到原来水平, 预处理24 h的IDV与其他各时段IDV比较有显著性差异(P<0.05, 表1, 图1). IPC后6, 12, 24, 36 h大鼠胰腺中HSP70的表达与未预处理组相应时段比较差异也显著(P<0.05, 表1). 而未预处理组各时段间比较差异无统计学意义(P>0.05, 表1, 图2).
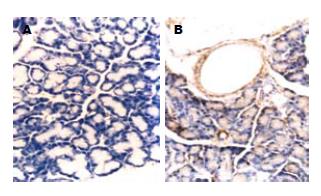
HSP70免疫组织化学染色显示, IPC后HSP70主要表达于胰腺腺泡细胞及血管壁, 而未预处理组免疫组织化学HSP70的表达为弱阳性(图3).
胰腺移植后再灌注6 h 100%成功, TNF-α在胰腺腺泡细胞中表达, 对照组TNF-α、细胞凋亡率, 白细胞浸润数, 血淀粉酶的水平显著增高, 与假手术组比较有显著性差异(P<0.01). 而实验组明显降低了胰腺细胞TNF-α、凋亡率、白细胞浸润数, 血淀粉酶水平, 与对照组比较差异有统计学意义(P<0.05, 表2).
热休克蛋白是一组高度保守的蛋白质, 当器官暴露于各种应激条件下, 细胞表达热休克蛋白增强[9]. 不仅通过修复受损伤的蛋白质, 使细胞在应激阶段存活, 而且还帮助合成、降解、折叠、跨膜转运蛋白质[10]. 其中主要是HSP70家族, HSP70家族是多基因家族, 广泛分布在细胞的亚细胞结构中, 其N端结构域高度保守, 具有ATP酶活性, 可结合ATP, 其C端类似MHC结合肽结构区域, 同源性及功能差异较大, 具有结合多肽或特殊蛋白并调节其构象的功能[11]. 本实验结果证实, 异丙肾上腺素预处理后HSP70的表达强度有时间依从性, 在异丙肾上腺素预处理后24 h胰腺组织的HSP70表达至高峰, 随后HSP70缓慢恢复到原来水平. Frossard等[8]报道通过大鼠热处理产生热休克蛋白可以减轻大鼠急性胰腺炎的发生程度. 我们通过腹腔注射异丙肾上腺素应激诱导大鼠HSP70的产生, 因此将预处理后24 h表达HSP70高峰的大鼠作为供体进行胰腺移植, 观察异丙肾上腺素预处理对大鼠胰腺移植后缺血再灌注损伤的保护作用.
组织器官缺血再灌注时大量激活的白细胞及细胞因子进入缺血组织. 其中由再灌注黏附于血管壁的白细胞产生的毒性物质, 破坏胰腺血管内皮细胞[12-15]. TNF-α引起细胞因子级联反应, 加重炎症反应[16-18]. 急性胰腺炎通常被认为是胰腺腺泡细胞合成及分泌的消化酶引起的自身消化疾病. 同样胰腺移植物缺血再灌注损伤时, 胰腺腺泡细胞内胰蛋白酶原及NF-κB被激活, 引起腺泡细胞损伤和胰腺炎, 导致血淀粉酶升高[19,20]. 与其他研究结果一样[21], 我们在研究中也证实, HSP70主要表达于胰腺腺泡细胞及血管壁. 这样可以抑制胰腺胰蛋白酶原激活, 从而抑制胰蛋白酶的自身消化, 可以降低胰腺炎时血淀粉酶水平, 而HSP70在血管壁抑制白细胞在血管壁的黏附聚集, 抑制白细胞渗出血管壁, 减轻了胰腺缺血再灌注损伤[22]. NF-κB与HSP70结合将阻止NF-κB的核易位, 并抑制TNF-α的转录[23], 从而HSP70抑制缺血再灌注损伤时表达TNF-α, 减轻了TNF-α对胰腺组织的损害. 本实验组降低了TNF-α的表达及血淀粉酶水平, 减少了白细胞浸润, 提示热休克蛋白在大鼠胰腺移植缺血/再灌注损伤过程中起到增强细胞对损害的耐受, 维持细胞的正常功能代谢, 提高了细胞的生存能力.
脏器缺血性再灌注损伤可以引起细胞凋亡[24-26]. 目前研究已明确, 细胞表面的Fas/Apo-1受体和他们的配体相结合是诱导凋亡的重要原因, 热休克蛋白的表达可能提供一种能够包裹自身和外来抗原新的免疫物质, 通过抑制c-Jun激酶的活性来抑制凋亡受体, 从而使细胞避免凋亡[27,28]. Matsumoto等[29]研究发现大鼠短暂高温预处理后, 体内积聚热休克蛋白, 并减少细胞凋亡, 而热休克蛋白合成的抑制物能阻碍这种现象. 我们在实验中证实, 实验组的移植胰腺细胞凋亡率明显低于对照组, 间接提示经异丙肾上腺素预处理, 胰腺高表达的热休克蛋白降低了胰腺细胞的凋亡率, 从而减轻了大鼠胰腺移植缺血再灌注损伤.
总之, 经过异丙肾上腺素预处理后减轻了大鼠胰腺缺血性再灌注损伤, 表明异丙肾上腺素预处理减轻大鼠胰腺缺血性再灌注损伤的机制可能与上调胰腺组织HSP70的表达有关, 且异丙肾上腺素应用剂量小, 使用方便, 具有临床应用价值.
胰腺移植缺血再灌注损伤是胰腺移植失败的主要原因之一. 胰腺持续性缺血可导致组织损伤和细胞死亡, 早期再灌注尽管对组织非常重要, 但再灌注后循环白细胞附壁、聚积, 渗出血管、侵及脏器, 导致组织细胞坏死, 另外补体激活以及活性氧的产生致使缺血的脏器损伤更为严重. 在此过程中多种炎性细胞因子参与, 导致组织细胞凋亡及坏死. 通过预处理的方法启动机体内源性保护机制, 提高胰腺对缺血再灌注损伤的耐受性是减轻胰腺缺血再灌注损伤理想的方法.
巩鹏, 教授, 大连医科大学附属第一医院普外二科.
热休克蛋白是一组高度保守的蛋白质, 当器官暴露于各种应激条件下, 细胞表达热休克蛋白增强. 不仅通过修复受损伤的蛋白质, 使细胞在应激阶段存活, 而且还帮助合成、降解、折叠、跨膜转运蛋白质, 具有抗细胞凋亡, 抑制炎性细胞因子的表达, 起到增强细胞对损害的耐受, 维持细胞的正常功能代谢, 提高细胞的生存能力, 在器官移植领域日益受到关注.
Frossard等报道通过大鼠热处理产生热休克蛋白可以减轻大鼠急性胰腺炎的发生程度.
本研究首次提出应用异丙肾上腺素诱导热休克蛋白减轻胰腺移植缺血性再灌注损伤. 为临床通过异丙肾上腺素预处理减轻缺血再灌注损伤提供实验依据.
异丙肾上腺素化学结构、药代动力学、药效学及药理作用机制明确, 不良反应很小. 应用异丙肾上腺素诱导热休克蛋白, 使用方便, 剂量小, 具有临床应用价值.
本文书写思路清晰, 规范, 意义明确, 具有重要的临床意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Mohan P, Safi K, Little DM, Donohoe J, Conlon P, Walshe JJ, O'Kelly P, Thompson CJ, Hickey DP. Improved patient survival in recipients of simultaneous pancreas-kidney transplant compared with kidney transplant alone in patients with type 1 diabetes mellitus and end-stage renal disease. Br J Surg. 2003;90:1137-1141. [PubMed] [DOI] |
| 2. | Hopt UT, Drognitz O. Pancreas organ transplantation. Short and long-term results in terms of diabetes control. Langenbecks Arch Surg. 2000;385:379-389. [PubMed] [DOI] |
| 3. | Orsenigo E, Fiorina P, Cristallo M, Socci C, La Rocca E, Maffi P, Invernizzi L, Zuber V, Secchi A, Di Carlo V. Long-termsurvival after kidney and kidney-pancreas transplantation in diabetic patients. Transplant Proc. 2004;36:1072-1075. [PubMed] [DOI] |
| 4. | Obermaier R, Drognitz O, Benz S, Hopt UT, Pisarski P. Pancreatic ischemia/reperfusion injury: impact of different preservation temperatures. Pancreas. 2008;37:328-332. [PubMed] [DOI] |
| 5. | Oehmann C, Benz S, Drognitz O, Pisarski P, Hopt UT, Obermaier R. Remote preconditioning reduces microcirculatory disorders in pancreatic ischemia/reperfusion injury. Pancreas. 2007;35:e45-e50. [PubMed] [DOI] |
| 6. | Obermaier R, Benz S, Von Dobschuetz E, Drognitz O, Schareck W, Jonas L, Messmer K, Hopt UT. Characterization of microcirculatory disturbance in a novel model of pancreatic ischemia-reperfusion using intravital fluorescence-microscopy. Pancreas. 2002;25:142-148. [PubMed] [DOI] |
| 7. | Woeste G, Wullstein C, Meyer S, Usadel KH, Hopt UT, Bechstein WO, von Dobschuetz E. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 2008;86:961-967. [PubMed] [DOI] |
| 8. | Frossard JL, Bhagat L, Lee HS, Hietaranta AJ, Singh VP, Song AM, Steer ML, Saluja AK. Both thermal and non-thermal stress protect against caerulein induced pancreatitis and prevent trypsinogen activation in the pancreas. Gut. 2002;50:78-83. [PubMed] [DOI] |
| 9. | Saluja A, Dudeja V. Heat shock proteins in pancreatic diseases. J Gastroenterol Hepatol. 2008;23 Suppl 1:S42-S45. [PubMed] [DOI] |
| 10. | Weitzmann A, Baldes C, Dudek J, Zimmermann R. The heat shock protein 70 molecular chaperone network in the pancreatic endoplasmic reticulum - a quantitative approach. FEBS J. 2007;274:5175-5187. [PubMed] [DOI] |
| 11. | Mayer MP, Bukau B. Hsp70 chaperones: cellular functions and molecular mechanism. Cell Mol Life Sci. 2005;62:670-684. [PubMed] [DOI] |
| 12. | Zheng Z, Kim JY, Ma H, Lee JE, Yenari MA. Anti-inflammatory effects of the 70 kDa heat shock protein in experimental stroke. J Cereb Blood Flow Metab. 2008;28:53-63. [PubMed] [DOI] |
| 13. | Weiss YG, Bromberg Z, Raj N, Raphael J, Goloubinoff P, Ben-Neriah Y, Deutschman CS. Enhanced heat shock protein70 expression alters proteasomal degradation of IkappaB kinase in experimental acute respiratory distress syndrome. Crit Care Med. 2007;35:2128-2138. [PubMed] [DOI] |
| 14. | Uchida Y, Freitas MC, Zhao D, Busuttil RW, Kupiec-Weglinski JW. The inhibition of neutrophil elastase ameliorates mouse liver damage due to ischemia and reperfusion. Liver Transpl. 2009;15:939-947. [PubMed] [DOI] |
| 15. | Warzecha Z, Dembinski A, Ceranowicz P, Konturek SJ, Dembinski M, Pawlik WW, Tomaszewska R, Stachura J, Kusnierz-Cabala B, Naskalski JW. Ischemic preconditioning inhibits development of edematous cerulein-induced pancreatitis: involvement of cyclooxygenases and heat shock protein 70. World J Gastroenterol. 2005;11:5958-5965. [PubMed] |
| 16. | von Dobschuetz E, Meyer S, Thorn D, Marme D, Hopt UT, Thomusch O. Targeting vascular endothelial growth factor pathway offers new possibilities to counteract microvascular disturbances during ischemia/reperfusion of the pancreas. Transplantation. 2006;82:543-549. [PubMed] [DOI] |
| 17. | von Dobschuetz E, Pahernik S, Hoffmann T, Kiefmann R, Heckel K, Messmer K, Mueller-Hoecker J, Dellian M. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 2004;67:55-63. [PubMed] [DOI] |
| 18. | Tukiainen E, Kylänpää ML, Puolakkainen P, Kemppainen E, Halonen K, Orpana A, Methuen T, Salaspuro M, Haapiainen R, Repo H. Polymorphisms of the TNF, CD14, and HSPA1B genes in patients with acute alcohol-induced pancreatitis. Pancreas. 2008;37:56-61. [PubMed] [DOI] |
| 19. | von Dobschuetz E, Schmidt R, Scholtes M, Thomusch O, Schwer CI, Geiger KK, Hopt UT, Pannen BH. Protective role of heme oxygenase-1 in pancreatic microcirculatory dysfunction after ischemia/reperfusion in rats. Pancreas. 2008;36:377-384. [PubMed] [DOI] |
| 20. | Jaworek J, Nawrot-Porabka K, Leja-Szpak A, Bonior J, Szklarczyk J, Kot M, Konturek SJ, Pawlik WW. Melatonin as modulator of pancreatic enzyme secretion and pancreatoprotector. J Physiol Pharmacol. 2007;58 Suppl 6:65-80. [PubMed] |
| 21. | Tashiro M, Schäfer C, Yao H, Ernst SA, Williams JA. Arginine induced acute pancreatitis alters the actin cytoskeleton and increases heat shock protein expression in rat pancreatic acinar cells. Gut. 2001;49:241-250. [PubMed] [DOI] |
| 22. | Dembiński A, Warzecha Z, Ceranowicz P, Dembiński M, Cieszkowski J, Pawlik WW, Tomaszewska R, Konturek SJ, Konturek PC. Effect of ischemic preconditioning on pancreatic regeneration and pancreatic expression of vascular endothelial growth factor and platelet-derived growth factor-A in ischemia/reperfusion-induced pancreatitis. J Physiol Pharmacol. 2006;57:39-58. [PubMed] |
| 23. | Bhagat L, Singh VP, Dawra RK, Saluja AK. Sodium arsenite induces heat shock protein 70 expression and protects against secretagogue-induced trypsinogen and NF-kappaB activation. J Cell Physiol. 2008;215:37-46. [PubMed] [DOI] |
| 24. | Jang HJ, Kwak JH, Cho EY, We YM, Lee YH, Kim SC, Han DJ. Glutamine induces heat-shock protein-70 and glutathione expression and attenuates ischemic damage in rat islets. Transplant Proc. 2008;40:2581-2584. [PubMed] [DOI] |
| 25. | Garrido C, Brunet M, Didelot C, Zermati Y, Schmitt E, Kroemer G. Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties. Cell Cycle. 2006;5:2592-2601. [PubMed] [DOI] |
| 26. | Muñoz-Casares FC, Padillo FJ, Briceño J, Collado JA, Muñoz-Castañeda JR, Ortega R, Cruz A, Túnez I, Montilla P, Pera C. Melatonin reduces apoptosis and necrosis induced by ischemia/reperfusion injury of the pancreas. J Pineal Res. 2006;40:195-203. [PubMed] [DOI] |
| 27. | Mokhtari D, Kerblom B, Mehmeti I, Wang X, Funa NS, Olerud J, Lenzen S, Welsh N, Welsh M. Increased Hsp70 expression attenuates cytokine-induced cell death in islets of Langerhans from Shb knockout mice. Biochem Biophys Res Commun. 2009;387:553-557. [PubMed] [DOI] |
| 28. | Yenari MA, Liu J, Zheng Z, Vexler ZS, Lee JE, Giffard RG. Antiapoptotic and anti-inflammatory mechanisms of heat-shock protein protection. Ann N Y Acad Sci. 2005;1053:74-83. [PubMed] [DOI] |
| 29. | Matsumoto K, Honda K, Kobayashi N. Protective effect of heat preconditioning of rat liver graft resulting in improved transplant survival. Transplantation. 2001;71:862-868. [PubMed] [DOI] |