修回日期: 2010-02-04
接受日期: 2010-02-09
在线出版日期: 2010-03-18
目的: 观察饥饿大鼠肠道胆碱能神经元和肠传输功能的变化, 探讨氨基胍对肠动力功能保护的神经机制.
方法: 90只♂SD大鼠随机分为正常对照组(C组, n = 10)、全饥饿组(S组, n = 40)和氨基胍(aminoguanidine AG)组(A组, n= 40), S、A组随机分为饥饿3、5、7、9 d亚组(n = 10). A组给予AG 150 mg/(kg•d)腹腔注射. 采用葡聚糖蓝染色法测定各组肠道色素推进比率, AchE组织化学染色法测定各组回肠肌间神经丛胆碱能神经元分布密度.
结果: S、A组各时间点肠道色素推进率较对照组明显降低(P<0.05或0.01), 并随饥饿时间延长呈进行性下降, 均于9 d达最低点, A组在饥饿后3、5、7 d较S组高且有显著性差异(52.2%±4.7%, 49.8%±5.6%, 43.3%±6.4% vs 47.5%±4.2%, 42.3%±5.4%, 36.6%±5.2%, 均P<0.05), 饥饿后9 d A组较S组无显著差异. S、A组各时间点胆碱能神经元分布密度较对照组明显降低(P<0.01), 并随饥饿时间延长呈进行性下降, 均于9 d达最低点, A组在饥饿后5、7 d较S组高且有显著性差异(均P<0.05), 饥饿后3、9 d A组较S组无显著差异.
结论: 饥饿后早期给予氨基胍能够一定程度减轻肠胆碱能神经元损伤, 改善肠传输功能, 发挥肠神经保护作用.
引文著录: 陆之辉, 张小平, 程爱国. 氨基胍对饥饿大鼠肠道胆碱能神经元及肠动力功能的保护. 世界华人消化杂志 2010; 18(8): 825-829
Revised: February 4, 2010
Accepted: February 9, 2010
Published online: March 18, 2010
AIM: To investigate the changes in enteric cholinergic neurons and intestinal transit in starved rats and to explore the protective mechanism of aminoguanidine (AG) on enteric nervous system and gastrointestinal motility.
METHODS: Ninety male Sprague-Dawley rats were randomly divided into three groups: normal control group (n = 10), starvation group (n = 40) and AG group (n = 40). The starvation group and AG group were further divided into four subgroups for testing on 3, 5, 7 and 9 days after starvation. The AG group was intraperitoneally injected with AG 150 mg/(kg•d) from the first day of starvation. Rats were killed on days 3, 5, 7 and 9 after starvation to take intestinal samples. The rate of intestinal transit was assessed with dextran blue-2000. The distribution density of cholinergic neurons in the ileal myenteric plexus were evaluated by acetylcholinesterase (AChE) histochemistry.
RESULTS: The rates of intestinal transit were significantly lower at all time points after starvation in the starvation group and AG group than in the control group (all P < 0.05 or 0.01). The rates of intestinal transit in the starvation group and AG group decreased with time, reaching the lowest point on day 9. However, the rates of intestinal transit were significantly higher on days 3, 5 and 7 in the AG group than in the starvation group (52.2% ± 4.7% vs 47.5% ± 4.2%, 49.8% ± 5.6% vs 42.3% ± 5.4%, and 43.3% ± 6.4% vs 36.6% ± 5.2%, all P < 0.05) though there was no obvious difference on day 9. The density of cholinergic neurons was significantly lower in the starvation group and AG group than in the control group at all time points (allP < 0.01). The density of cholinergic neurons in the starvation group and AG group decreased with time, reaching the lowest point on day 9. The density of cholinergic neurons was significantly higher on days 5 and 7 in the AG group than in the starvation group (both P < 0.05) though there was no obvious difference on days 3 and 9.
CONCLUSION: Early intraperitoneal supplement of aminoguanidine is helpful in promoting enteric nervous system function and intestinal transit in starved rats.
- Citation: Lu ZH, Zhang XP, Cheng AG. Protective effects of aminoguanidine on enteric cholinergic neurons and gastrointestinal motility in starved rats. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 825-829
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/825.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.825
在重大事故及自然灾害中被埋困人员饥饿状态下机体发生应激反应, 其中, 肠神经及肠动力功能在饥饿应激中的病理变化是需要关注的重要环节. 肠神经系统(enteric nervous system, ENS)由肠肌间神经丛和黏膜下神经丛组成[1], 在各种调节胃肠蠕动功能的机制中起主要作用, 其中主要的兴奋性神经元是乙酰胆碱能神经元[2], 在肠道淤血、缺血再灌注等应激条件下, 肠壁内的乙酰胆碱酯酶(acetylcholinesterase, AchE)阳性神经元数量减少, 提示应激条件会造成ENS神经元功能异常[3], 氨基胍(aminoguanidine, AG)作为一种选择性诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)抑制剂, 能有效地抑制应激状态下肠道产生的过多NO, 发挥肠道保护作用[4], 但对于完全饥饿状态下ENS神经元及肠动力功能的保护作用还鲜见报道. 本研究采用AchE组织化学染色技术, 观察氨基胍(AG)对饥饿大鼠肠神经及肠动力功能的影响, 探讨早期添加AG对肠神经的保护机制.
健康♂SD大鼠90只(北京维通利华实验动物技术有限公司提供清洁级), 质量250 g±20 g, 随机分为正常对照组(C组, n = 10)、全饥饿组(S组, n = 40) 和氨基胍+全饥饿组(A组, n = 40).
1.2.1 造模: 单笼适应性喂养1 wk后进行实验, 实验期无饲料供应, 自由摄水, 自然光照, 室温控制在18 ℃-25 ℃. 饥饿组和氨基胍组随机分为3、5、7、9 d 4个亚组, 氨基胍组于饥饿当天开始干预, 氨基胍按150 mg/(kg•d)配制成2 mL溶液定时腹腔注射; 饥饿组定时腹腔注射生理盐水2 mL/d, 排除腹腔注射操作本身干扰因素, 两组实验期间自由饮水, 直至被处死.
1.2.2 小肠传输速率测定: 各亚组大鼠禁水12 h, 于相应时间点采用20 g/L葡聚糖蓝-2000溶液0.4 mL灌胃后30 min, 10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉, 开胸经左心室顺序灌注37 ℃ 9 g/L氯化钠溶液、4 ℃含10 g/L氯化钙的40 g/L甲醛液固定组织. 剖腹取出胃肠道, 截取幽门至回盲部整段小肠, 盲肠侧在上、幽门侧在下, 以5 g重物垂直牵引悬挂, 测量并记录幽门至葡聚糖蓝-2000色素推进最前端(推进长度)、幽门至盲肠(总长度)的长度, 二者之比为小肠传输速率.
1.2.3 组织标本制备: 小肠传输速率测定完毕, 迅速截取距回盲部3 cm一段回肠(5 cm), 用0.01 mol/L PBS冲洗后用10 g/L多聚甲醛+1%氯化钙溶液稍充盈, 将肠管两端结扎紧, 立即置入4 ℃上述溶液中过夜, 次日如下述行全层铺片, 0.01 mol/L PBS冲洗, 沿肠系膜处剪开肠管, 再将组织剪成0.5 cm×0.5 cm的组织块, 在解剖显微镜下用钟表镊剥除黏膜层和黏膜下层, 再用镊尖轻轻挑去附于肌间神经丛的环行肌, 即得外纵肌层标本(肠肌间神经丛附于其上).
1.2.4 酶组织化学染色: 每只大鼠各取5片外纵肌层标本分别进行乙酰胆碱酯酶(AchE)组织化学染色. AchE染色法[3]: 按Karnovsky-Roots直接法进行AchE神经元染色, 将剥离的上段纵肌层标本用0.01 mol/L PBS冲洗3次, 置入含碘化乙酰硫代胆碱(美国Sigma公司)5 mg、0.1 mol/L醋酸缓冲液(pH5.5)6.5 mL、0.1 mol/L枸橼酸钠0.5 mL、30 mmol/L硫酸铜l mL及蒸馏水l mL的孵育液中37 ℃孵育60 min. PBS冲洗、贴片、铺平, 牵拉率小于1:1.1, 晾干、逐级酒精脱水, 二甲苯透明, 中性树胶封片. 另设对照实验: 孵育液中不加碘化乙酰硫代胆碱.
1.2.5 结果观察: Olympus光学显微镜下观察, 比较各组大鼠肠肌间神经丛AchE阳性神经染色强弱, 每只标本随机计数5个200倍视野, 单盲下测定被检测的外纵肌层标本AchE阳性神经元细胞数量, 用于比较各组AchE阳性神经元密度.
统计学处理 计量资料数据以mean±SD表示, 多组间比较采用完全随机设计方差分析, 进一步采用均数间两两比较的LSD法, SPSS13.0统计分析软件对实验数据进行统计学分析.
小肠传输速率在饥饿后3 d开始进行性降低, 并于饥饿后9 d达最低点, S、A组各时间点比对照组明显降低, 其中3 d时A组差异显著(P<0.05), 其余各组差异非常显著(P<0.01). A组在饥饿后3、5、7 d较S组高且有显著性差异(P<0.05), 饥饿后9 d A组较S组无显著差异(表1).
| 分组 | 时间(d) | 总长度(cm) | 推进长度(cm) | 推进比率(%) |
| 对照组 | 0 | 122.3±10.5 | 71.4±8.9 | 59.2±7.1 |
| 饥饿组 | 3 | 126.4±10.1 | 59.9±6.2b | 47.5±4.2b |
| 5 | 121.4±10.7 | 51.4±6.4b | 42.3±5.4b | |
| 7 | 128.4±11.7 | 46.5±8.8b | 36.6±5.2b | |
| 9 | 122.9±10.3 | 34.8±6.9b | 28.1±4.9b | |
| AG组 | 3 | 122.0±10.5 | 63.6±7.1a | 52.2±4.7ac |
| 5 | 124.1±10.2 | 60.3±7.1b | 49.8±5.6bc | |
| 7 | 119.8±11.4 | 51.3±8.6b | 43.3±6.4bc | |
| 9 | 126.8±12.9 | 41.0±8.8b | 32.2±5.6b |
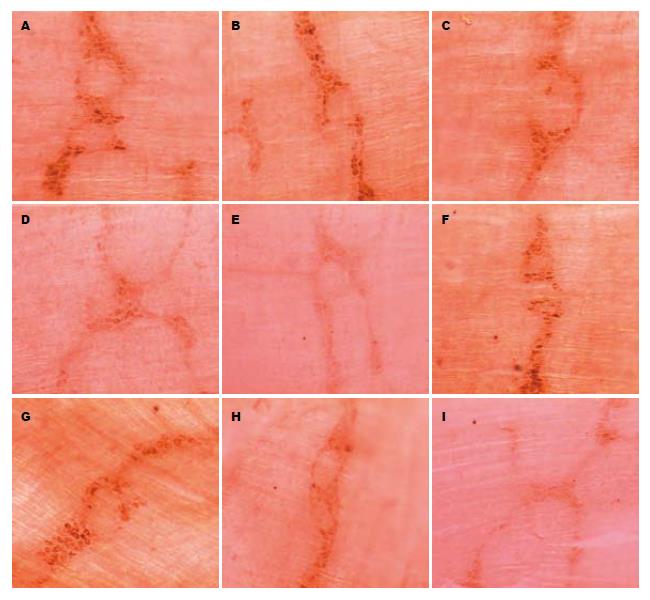
光镜下, 对照组AchE阳性神经元染色呈棕黄色, 胞体大小不等, 形态多样, 细胞核不着色, 胞体内可见大量棕黄色或棕黑色强阳性染色颗粒; 随饥饿时间延长, 饥饿各组强阳性神经元及其胞体内强阳性染色颗粒着色逐渐变浅, 数目呈减少趋势, AchE组织化学染色对照实验结果呈阴性, 具体结果及数值如下述: 回肠肌间神经丛胆碱能神经元分布密度在饥饿后3天开始进行性降低, 并于饥饿后9 d达最低点, S、A组各时间点比对照组明显降低(P<0.01), A组在饥饿后5、7 d较S组高且有显著性差异(P<0.05), 饥饿后3、9 d A组较S组无显著差异(表2, 图1).
在胃肠道诸多功能中, 正常的肠蠕动功能意义不仅在于参与食物的消化、吸收和排泄, 同时也是胃肠道非免疫防御的重要机制, 可防止肠内有害物质包括内毒素的积聚和限制细菌生长, 是肠腔内环境的"清道夫"[5]. 胃肠蠕动反映了胃肠道平滑肌、黏膜上皮和血管的整合的功能[6], 其神经调节主要依赖3个系统即中枢神经、自主神经和ENS, 其中ENS起主要作用, ENS是独立的具有与脑和脊髓类似的整合和处理信息功能机制的神经系统, 可以不依赖中枢而具有高度的自主性, 因此称作胃肠道的"微型脑"[1,7,8]. ENS主要兴奋性神经递质是乙酰胆碱(acetylcholine, Ach), AchE是Ach的水解酶, AchE活性增强代表Ach释放增加, 胆碱能神经兴奋性增高. ENS与胃肠蠕动密切相关, 研究显示, 糖尿病、间断禁食应激大鼠肠胆碱能神经元分布密度异常, 同时出现肠蠕动功能损伤[9,10].
肠道为应激的中心器官, 在应激反应中, 机体为保证心、脑重要器官血液供应, 通过复杂的神经-内分泌系统介导, 调节全身血流重新分配, 产生选择性内脏血管痉挛, 肠道缺血、缺氧[11], 肠黏膜屏障受损, 肠道细菌、内毒素群移位, 引起炎性反应及多种细胞因子表达, 过氧化物酶水平升高, 抗氧化防御系统的清除能力下降, 产生大量的氧自由基[12]等肠道损伤机制. 完全饥饿是一种严重应激状态, 可通过上述机制损害肠道功能, 本实验结果显示, 肠动力方面, 全饥饿组大鼠肠道传输比率明显低于对照组, 并随着饥饿时间延长进行性降低, 提示肠传输功能障碍; ENS方面, 回肠肌间神经丛胆碱能神经元分布密度明显低于对照组, 并随着饥饿时间延长进行性降低, 提示ENS兴奋功能降低. 以上结果证实饥饿应激损害ENS及胃肠运动功能, 并随饥饿时间延长, 这种损害进行性加重, ENS及胃肠运动功能损害在时间和程度上基本一致.
AG是一种具有亲核作用的肼化物, 基本的化学结构为HN-NH-C-NH, 带有一个能与缺乏电子的羰基起反应的无毒亲核肼基团, 能使过量的氧化酶失活[13,14], AG与L-精氨酸(NO合成底物)和L-精氨酸类似物(N-单甲基-L-精氨酸, NOS竞争性抑制剂)的化学结构相似, 为iNOS的选择性抑制剂, 这些化学结构特点使AG具有独特的生化作用. 研究显示, AG对应激诱导的肠黏膜损伤、肠道炎性反应、肠道微循环障碍具有保护作用[15,16], 我们建立饥饿应激模型, 研究AG对ENS及胃肠运动的影响, 结果显示, AG组大鼠肠道传输比率在饥饿后3、5、7 d明显高于全饥饿组, 回肠肌间神经丛胆碱能神经元分布密度在饥饿后5、7 d明显高于全饥饿组, 提示AG能一定程度减轻饥饿应激对胆碱能神经元及肠道传输功能的损伤作用, 发挥ENS及胃肠运动保护作用.
AG可能通过以下途径保护ENS及胃肠运动功能: AG能够使应激状态下肠道nNOS的mRNA转录水平升高[17], 促进nNOS合成, 进而保持正常神经源性NO的稳定合成, 发挥其对肠道平滑肌[18]、黏膜屏障、血管紧张度及血管渗透性的生理调节作用, 保证ENS及胃肠运动功能正常运行; 作为iNOS的选择性抑制剂, AG能抑制应激时被炎症刺激、内毒素及细胞因子激活的iNOS合成, 进而减轻诱导型NO大量合成引起的抑制线粒体呼吸链、脂质过氧化或DNA断裂等细胞毒性作用及参与炎症细胞趋化、炎症反应逐步放大等有害反应[15], 减少应激对ENS及胃肠运动功能的伤害; AG还能降低毛细血管内白细胞的黏滞、抑制血管内皮生长因子[14,19]. 但AG的这种保护作用是有限的, 饥饿终末期, AG组较全饥饿组肠道传输比率, 胆碱能神经元分布密度无显著差异, 可能是由于神经递质合成原料耗竭, 损伤因素进行性积累加重, 胆碱能神经元结构已严重破坏, AG失去有效保护作用.
总之, 饥饿后早期给予氨基胍可明显改善肠道胆碱能神经元结构和功能, 改善肠传输功能; 但其不能完全阻止饥饿后肠神经及肠传输功能受损.
在重大事故及自然灾害中被埋困人员饥饿状态下机体发生应激反应, 肠道为应激的中心器官, 但肠神经对肠动力功能的影响及变化规律尚不十分清楚. 本文研究饥饿大鼠肠神经及肠动力功能的变化过程, 探索氨基胍的肠神经保护机制, 以期为深入研究被困人员肠道保护提供依据.
陈敬贤, 教授, 安徽医科大学微生物教研室; 张志坚, 教授, 福州总医院消化内科
肠神经及其分泌递质种类多, 调节机制复杂, 应激状态下对其干预必将产生复杂的变化, 选取适当的应激条件和强度、干预时间、干预药物种类、剂量和给药方式, 需要精心研究、设计.
研究证实, 适当应用肠神经调节药物更有利于应激状态下肠神经及肠传输功能的保护, 有利于肠道黏膜屏障功能的保护, 延缓肠道内毒素积聚和细菌移位.
本文为进一步研究灾害中被困人员肠神经及肠动力功能保护提供依据.
本研究内容具有很强的实用性, 提供了较多有意义的信息且具有一定的创新性.
编辑: 李军亮 电编:何基才
| 1. | Gariepy CE. Developmental disorders of the enteric nervous system: genetic and molecular bases. J Pediatr Gastroenterol Nutr. 2004;39:5-11. [PubMed] [DOI] |
| 2. | Schemann M. Control of gastrointestinal motility by the "gut brain"--the enteric nervous system. J Pediatr Gastroenterol Nutr. 2005;41 Suppl 1:S4-S6. [PubMed] [DOI] |
| 6. | Costa M, Brookes SJ, Hennig GW. Anatomy and physiology of the enteric nervous system. Gut. 2000;47 Suppl 4:iv15-iv19; discussion iv26. [PubMed] |
| 7. | Gershon MD. Nerves, reflexes, and the enteric nervous system: pathogenesis of the irritable bowel syndrome. J Clin Gastroenterol. 2005;39:S184-S193. [PubMed] |
| 11. | Ishimaru K, Mitsuoka H, Unno N, Inuzuka K, Nakamura S, Schmid-Schönbein GW. Pancreatic proteases and inflammatory mediators in peritoneal fluid during splanchnic arterial occlusion and reperfusion. Shock. 2004;22:467-471. [PubMed] [DOI] |
| 12. | Tost H, Gógl A, Lendvai A, Bartha J. Effect of extracellular volume expansion and surgical stress on splanchnic blood flow and cardiac output in anesthetized rats: role of nitric oxide. J Cardiovasc Pharmacol. 2003;41:452-459. [PubMed] [DOI] |
| 19. | Griffiths MJ, Messent M, MacAllister RJ, Evans TW. Aminoguanidine selectively inhibits inducible nitric oxide synthase. Br J Pharmacol. 1993;110:963-968. [PubMed] |