修回日期: 2010-01-28
接受日期: 2010-02-01
在线出版日期: 2010-03-18
目的: 探讨HGF对SMMC-7721失巢凋亡的影响以及PI3K在该过程中的作用.
方法: 悬浮培养SMMC-7721, 建立失巢凋亡模型, 应用TUNEL染色观察凋亡率. 分别悬浮培养SMMC-7721、HGF处理后SMMC-7721及LY294002预处理后的HGF处理细胞, 用台盼蓝染色观察细胞失巢凋亡后存活率, 用MTT检测细胞的增殖能力的变化, 流式细胞仪检测失巢凋亡细胞的早、晚期凋亡率, Hoechst染色观察不同处理细胞的凋亡情况. 应用免疫印迹技术检测失巢凋亡后Akt、p-Akt、FAK、p-FAK的表达.
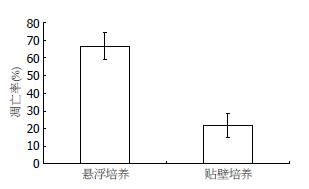
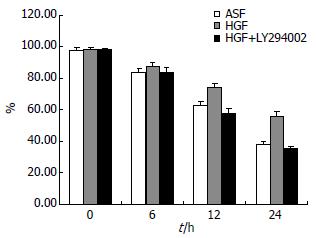
结果: TUNEL染色显示, 悬浮培养的SMMC-7721失巢凋亡率远大于贴壁培养的SMMC-7721(21.72%±6.85% vs 66.67%±7.66%,P<0.05); 台盼蓝染色显示, HGF处理后的SMMC-7721存活率明显高于悬浮培养细胞(P<0.05), 而HGF不能提高经LY294002预处理后细胞的存活率; MTT实验显示HGF处理细胞A值明显大于悬浮培养细胞(P<0.05), LY294002预处理细胞与悬浮培养细胞相似. 流式细胞仪和Hoechst 33258染色均显示HGF处理后细胞的失巢凋亡明显低于悬浮培养细胞(P<0.05), 而经LY294002处理后细胞的失巢凋亡率明显升高. 蛋白印迹结果显示HGF处理后细胞Akt、FAK、p-Akt、p-FAK的表达均升高, 而经LY294002预处理后, 其表达与悬浮培养SMMC-7721一致.
结论: 在肝细胞癌SMMC-7721失巢凋亡过程中, HGF通过活化Akt和FAK来增强细胞的抗失巢凋亡能力, 该作用受PI3K的调节.
引文著录: 谷艳娇, 奥瑞芳, 苏荣健. 肝细胞生长因子对肝癌细胞系SMMC-7721失巢凋亡的影响. 世界华人消化杂志 2010; 18(8): 819-824
Revised: January 28, 2010
Accepted: February 1, 2010
Published online: March 18, 2010
AIM: To investigate the effects of hepatocellular growth factor (HGF) on the anoikis of SMMC-7721 cells and the role of phosphoinositide 3 kinase (PI3K) in this process.
METHODS: SMMC-7721 cells were suspended to induce anoikis. The anoikis rate of suspended cells was detected by terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) assay. SMMC-7721 cells cultured in suspension were divided into three groups: control cells, cells treated with HGF, and those pretreated with LY294002 and then treated with HGF. After HGF treatment, cell survival and proliferation were evaluated by trypan blue staining and methyl thiazolyl tetrazolium (MTT) assay, respectively; anoikis was detected by flow cytometry; and the expression of Akt, phosphorylated Akt (p-Akt), focal adhesion kinase (FAK), and phosphorylated FAK (p-FAK) was detected by Western blot.
RESULTS: The anoikis rate of suspended SMMC-7721 is higher than that of adherent cells (21.72% ± 6.85% vs 66.67% ± 7.66%, P < 0.05). The survival rat of suspended SMMC-7721 treated with HGF is significantly higher than that of control cells (P< 0.05). However, HGF treatment could not significantly improve the survival of suspended SMMC-7721 pre-treated with LY294002 (P < 0.05). MTT assay showed that HGF treatment could improve the proliferation of suspended SMMC-7721 but showed little impact on the proliferation of suspended SMMC-7721 pre-treated with LY294002 (both P < 0.05). FCM and Hoechst 33258 staining results indicated that HGF could reduce the anoikis of SMMC-7721 while LY294002 could inhibit such effect (both P < 0.05). Western blot analysis showed that HGF treatment could up-regulate the expression of Akt, FAK, p-Akt and p-FAK in suspended SMMC-7721 cells but not in suspended SMMC-7721 cells pre-treated with LY294002.
CONCLUSION: HGF can reduce the anoikis of SMMC-7721 cells by activating Akt and FAK in a PI3K-dependent manner.
- Citation: Gu YJ, Ao RF, Su RJ. Hepatocellular growth factor reduces anoikis in human hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 819-824
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/819.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.819
肝细胞癌是一种常见的恶性肿瘤, 其发病率呈逐年上升的趋势, 居全球第5位, 死亡率居第3位, 仅次于肺癌和胃癌[1]. 肝细胞生长因子(hepatocellular growth factor, HGF)是间质细胞(如成纤维细胞、巨噬细胞等)分泌的一种多效应生长因子, 对细胞增殖等多种生物学行为具有调节作用[2]. 失巢凋亡是一种细胞的程序死亡, 由于是细胞外基质和其他细胞脱离接触而诱发的, 他的存在对于维护组织内环境稳定和结构完整具有重要意义[3]. 当肿瘤细胞离开原发部位, 获得逃逸失巢凋亡的能力, 便能长时间存活, 这是恶性肿瘤获得侵袭和转移能力的先决条件. 我们之前的研究已经证明HGF可以促进肝细胞癌的侵袭和转移, 并且明确HGF对肝细胞癌侵袭和转移作用与PI3K有关[4,5].
为了进一步论证在失巢凋亡状态下HGF对肝细胞癌SMMC-7721的作用及影响, 本实验应用poly-HEMA对肝细胞癌SMMC-7721细胞悬浮培养, 观察细胞的存活状况, 并初步探讨其机制.
肝细胞癌细胞系SMMC-7721为中国医科大学发育生物学教研室惠赠; HGF、LY294002购于Sigma公司; Akt和磷酸化Akt(Ser-473)抗体购于Cell Signal公司; FAK和磷酸化FAK(Tyr-397)抗体购于Invitrogen公司; poly-HEMA(P3932-10G)购于Sigma公司; 原位凋亡试剂盒, 购于日本TaKaRa生物.
1.2.1 细胞培养: 人肝细胞癌细胞系SMMC-7721培养于含100 mL/L胎牛血清、100 g/L青霉素、100 g/L链霉素的DMEM培养液中, 当细胞生长至培养瓶底面的70%-80%进行传代.
1.2.2 失巢凋亡的诱导: 为避免细胞贴壁, 按照Folkman等的方法[10], 取poly-HEMA用950 mL/L的乙醇, 配置成浓度为120 g/L的储存液, 混合过夜. 800 g离心, 去除未溶物, 1:10用950 mL/L乙醇稀释, 制成工作液. 加入平皿, 室温干燥过夜, 用之前, 用PBS漂洗2次. 然后, 将细胞以1×106/mL接种于培养皿中, 培养于含血清10 mL/L的DMEM培养基中, 37 ℃, 50 mL/L CO2, 培养.
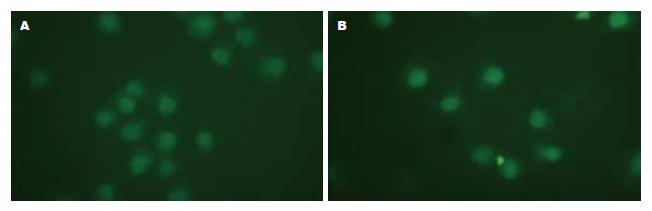
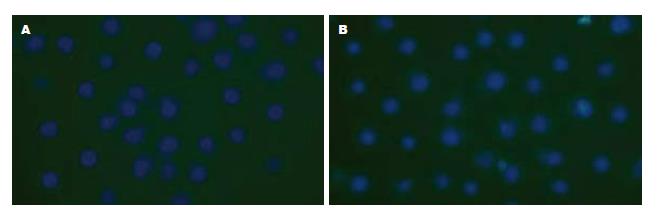
1.2.3 TUNEL染色: 取贴壁培养与悬浮培养24 h的SMMC-7721做TUNEL染色, 比较二者凋亡的差别: 将贴壁培养和悬浮培养的细胞悬浮于PBS中, 滴加于硅烷处理的载玻片上, 均匀涂片, 风干, 40 g/L多聚甲醛室温固定30 min. PBS漂洗2次, 加入透化缓冲液100 µL冰上孵育5 min. PBS漂洗2次, 加入预冷的TdT反应液(FITC标记)50 µL孵育在湿盒中, 37 ℃反应60 min, PBS冲洗, Hoechst33258复染细胞核, 封片. 计数每200个细胞中, TUNEL染色阳性的细胞数, 计算百分率. 计数至少3次独立实验的结果, 记为细胞凋亡率, 统计分析.
1.2.4 HGF处理: 将SMMC-7721细胞血清饥饿3 h, 消化收集, 用无血清DMEM悬浮, 细胞计数后, 以1×105/mL细胞密度悬浮, 加入HGF浓度为50 μg/L[4], 处理12 h. 对照组细胞加入等体积无血清培养液.
1.2.5 LY294002处理: 细胞培养方法同上, 血清饥饿3 h, 加入LY294002(终浓度10 μmol/L)预处理1 h, PBS漂洗3次, 加入HGF(终浓度50 μg/L)处理12 h.
1.2.6 台盼蓝染色: 分别取HGF, HGF+LY294002处理组细胞和对照SMMC-7721细胞取无血清培养液处理, 悬浮培养0、6、12、24 h, 1:1(V/V)与2 g/L的台盼蓝溶液混合, 用血细胞计数板计数每100倍视野活细胞数, 连续计数3个. 统计分析, 计算存活率.
1.2.7 细胞增殖实验(MTT): 将HGF, LY294002处理组细胞和对照组细胞分别以5×104/mL悬浮, 每孔100 μL接种于96孔板, 每组3孔, 72 h后取出孔板, 用PBS漂洗3次, 每孔加入无血清DMEM 200 μL, 每孔20 μL MTT(pH7.2-7.4)5 g/mL, 37 ℃, 50 mL/L CO2, 培养4 h, 小心吸弃上清, 每孔加入DMSO 100 μL, 振荡, 溶解, 于酶标仪以595 nm 波长扫描, 测定吸光度(A)值. 平行3次, 取平均值.
1.2.8 流式细胞仪检测: 用流式细胞仪检测贴壁培养SMMC-7721、悬浮培养24 h后的SMMC-7721、HGF处理以及HGF+PI3K处理细胞的失巢凋亡率. 将细胞收集, 用PBS漂洗2次, 悬浮于85 µL的缓冲液中, 加入10 µL FITC标记的AV和5 µL PI, 立即流式细胞仪检测.
1.2.9 Hoechst33258染色: 贴壁培养SMMC- 7721、悬浮培养24 h后的SMMC-7721、HGF处理以及HGF+PI3K处理细胞, 全部以1×106/mL涂片. 40 g/L多聚甲醛固定, PBS漂洗, 加入Hoechst33258染色10 min, PBS漂洗, 甘油封片. 倒置荧光显微镜观察拍照.
1.2.10 免疫印迹: 细胞处理方法同上, 24 h后, 离心收集悬浮培养的细胞, PBS漂洗3次, RIPA缓冲液冰上裂解30 min, BCA法测定蛋白含量. SDS聚丙烯酰胺凝胶电泳, 转膜, 1 g/L BSA封闭, 一抗(Akt, p-Akt, FAK, p-FAK)室温孵育3 h, 二抗室温孵育1 h, BCIP/NBT显色.
统计学处理 文中所有数据均用mean±SD表示. SPSS13.0统计分析, 应用t检验比较分析.
贴壁培养细胞的细胞凋亡率很低, 而悬浮培养24 h后, 细胞的凋亡率明显增加(图1, 2); 贴壁培养细胞TUNEL染色阳性率较悬浮细胞显著降低(21.72%±6.85% vs 66.67%±7.66%, P<0.05, 图3).
SMMC-7721分别于无血清培养基(ASF)悬浮培养, HGF和HGF+LY294002处理后, 经过不同时间的悬浮培养处理后, ASF台盼蓝染色结果可见, 3组细胞随着时间的延长, 存活率均逐渐降低, 而经HGF处理后的SMMC-7721活性明显大于ASF和HGF+LY294002处理组(图4).
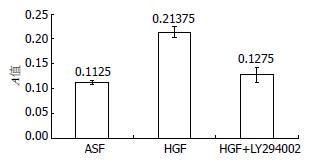
选择24 h作为细胞悬浮培养后增殖能力检测的时间. HGF处理后的SMMC-7721细胞的增殖能力明显高于无血清培养液对照组(约2倍), 而经HGF+LY294002预处理后的SMMC-7721细胞增殖能力与对照组无明显差别(图5).
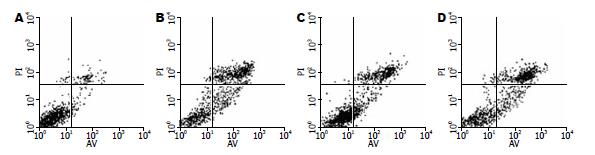
由图6可见, 单染AV的细胞表示早期凋亡; AV和PI双染的细胞表示晚期凋亡; 贴壁的SMMC-7721早期凋亡率为5.14%, 悬浮培养24 h后的凋亡率为20.56%, 加HGF处理后为13.19%, HGF+LY294002处理细胞的凋亡率为23.12%. 总凋亡率分别为: 13.36%, 60.82%, 41.24%, 68.75%, 见表1. 贴壁细胞与悬浮培养细胞、HGF处理细胞与悬浮培养细胞、HGF+LY294002组细胞与HGF处理细胞相比在早期凋亡率方面差异具有统计学差异(P<0.05); 由图7可见, 悬浮培养24 h后, 细胞的凋亡率明显高于贴壁细胞, 经HGF处理后细胞的凋亡率明显降低, 而经LY294002抑制后, 凋亡率又重新升高.
| 分组 | 早期凋亡率 | 晚期凋亡率 | 总凋亡率 |
| 贴壁SMMC-7721组 | 5.14 | 8.22 | 13.36 |
| 悬浮SMMC-7721组 | 20.56 | 40.26 | 60.82 |
| HGF组 | 13.19 | 28.05 | 41.24 |
| HGF+LY294002组 | 23.12 | 45.63 | 68.75 |
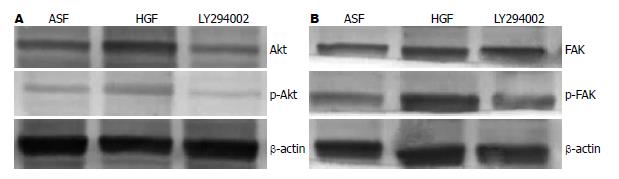
由图8A可见, HGF处理组细胞的Akt和p-Akt表达约为ASF组的3倍, LY294002组约为HGF组细胞的1/3. HGF(50 μg/L)可以促进Akt的高表达和Akt位点的磷酸化. 由图8B可见, HGF处理组细胞的FAK表达约为ASF组的4倍, LY294002组约为HGF组细胞的1/3, 而p-FAK表达约为ASF组的6倍, LY294002组约为HGF组细胞的1/5, 所以HGF可以促进FAK表达增高和磷酸化. (ASF为无血清培养液处理的悬浮培养细胞; HGF为HGF处理SMMC-7721; LY294002为LY294002预处理后加入HGF处理的SMMC-7721).
正常细胞依赖于细胞外的基质成分黏附生存, 当脱离这些基质后, 黏附状态被破坏, 即可发生细胞的失巢凋亡, 这对于维持体正常的组织内环境是非常重要的. 肿瘤细胞获得了抗失巢凋亡能力, 即产生了侵袭和转移能力[11-15]. 据文献报道, 很多恶性肿瘤在失去与细胞外基质的黏附以后FAK和Akt仍然可以有较高水平的磷酸化[3,6], 这说明Akt和FAK与肿瘤细胞的抗失巢凋亡能力的获得有关[7,8]. 我们之前的研究证实, HGF能够促进肝细胞癌SMMC-7721的上皮间叶转化作用, 增强其侵袭和转移能力[4], 增加其黏着斑激酶的表达[5]. 然而, HGF对于肝细胞癌细胞失巢凋亡的研究尚未见报道.
本实验应用poly-HEMA[9,10]包被六孔板, 悬浮培养细胞, 由TUNEL染色发现悬浮培养细胞的凋亡率明显高于贴壁细胞, 说明该方法能够成功制造失巢凋亡模型; 台盼蓝染色结果表明, 0 h时, 细胞的生存率相同, 从6-24 h, 应用HGF处理后SMMC-7721细胞的生存能力逐渐强于ASF组, 而当加入PI3K抑制剂LY294002以后, 细胞的生存能力明显受到抑制, 与对照组细胞相似. 差别以24 h的结果最为明显, 可见HGF+LY294002, 即PI3K抑制剂能够明显抑制HGF引起的细胞活性增强; MTT实验结果说明, HGF处理后的细胞抗失巢凋亡能力明显强于对照组细胞, 约为对照组细胞的2倍, 而经PI3K抑制物LY294002预处理后, SMMC-7721细胞的增殖能力明显下降, 与对照组细胞相似; 流式细胞仪结果发现, 悬浮培养细胞的早期凋亡率, 即AV单染细胞, 约为贴壁培养细胞4倍, 而经HGF处理后再悬浮培养, 其凋亡率明显降低, 约为正常贴壁细胞的2.5倍, 而经LY294002预处理后, HGF的抑制失巢凋亡作用消失, 与悬浮培养细胞相近, 这说明HGF对细胞失巢凋亡的抑制作用于PI3K信号通路有关; Hoechst33258染色也显示了HGF处理后肝细胞癌的抗凋亡作用增强, 经PI3K抑制剂抑制后, 该作用明显消失. 由此可见, HGF可以增强肝细胞癌细胞SMMC-7721的抗失巢凋亡能力, 并且是通过调节PI3K信号通路的来调节细胞的抗失巢凋亡能力.
Western blot结果显示, HGF处理后的细胞Akt和p-Akt的表达均高于对照组细胞, 应用PI3K抑制物LY294002处理后, Akt的表达与磷酸化水平显著降低约为HGF处理组细胞的1/3. 这些说明在肝细胞癌SMMC-7721失巢凋亡细胞中PI3K参与调节Akt的活化过程, 抑制Akt的表达及活化. 本研究结果也显示了, PI3K抑制剂能够明显抑制该作用. FAK的表达在HGF处理后也增加, 但其磷酸化更为明显, 他们都在LY294002预处理后下降, 但以磷酸化FAK更为明显. 这说明HGF处理后的肝细胞癌SMMC-7721的抗失巢凋亡能力增强, 而这种增强作用受PI3K调节. 总之, HGF通过活化PI3K激活Akt和FAK, 从而抑制肝细胞癌细胞的失巢凋亡.
总之, HGF对于肝细胞癌SMMC-7721的抗失巢凋亡具有重要的增强作用. 而该作用是通过PI3K信号通路调节的, 抑制PI3K便可以抑制HGF引起的SMMC-7721抗失巢凋亡能力的增强. 这可能为肝细胞癌的治疗提供一个新思路.
肝细胞癌是一种恶性肿瘤, 其病死率仅次于第一位的肺癌. 肝细胞生长因子(HGF)是间充质细胞分泌的多效应因子, 对细胞增殖等多种生物学行为具有调节作用. 失巢凋亡是细胞由于脱离其黏附的基质而产生的, 其对于维护内环境的稳定有重要作用, 而肿瘤细胞具有抗失巢凋亡的能力.
张锦生, 教授, 复旦大学上海医学院病理学系
HGF能够促进很多肿瘤细胞的侵袭和转移, 而对于其可以促进细胞的抗失巢调往能力研究才刚刚开始. 并且, 抗失巢的分子机制研究目前报道较少. 故而, HGF促进肝细胞癌抗失巢凋亡机制的研究成为国内外学者的研究热点. 通过促进肿瘤细胞的失巢凋亡成为亟待解决的问题之一.
目前的研究认为, HGF对于肿瘤细胞抗失巢凋亡的机制是通过多信号通路实现的, PI3K信号通路在此过程中发挥了重要的作用. HGF与c-Met结合, 激活下游很多激酶, 引起肿瘤细胞的抗失巢凋亡.
本文以肝细胞癌细胞系SMMC- 7721为研究对象, 用HGF和PI3K抑制剂LY294002处理, 观察其对于在失巢凋亡时, HGF和LY294002对于肝癌细胞的抗失巢凋亡能力的不同影响, 简要论述SMMC-7721的抗失巢凋亡能力的机制.
本文探讨肝细胞癌SMMC-7721失巢凋亡时, HGF与LY294002对其影响及作用机制. 通过对SMMC-7721的抗失巢凋亡机制的论述, 阐明肿瘤细胞抗失巢凋亡能力的获得与HGF有关. 为肝细胞癌的研究及治疗提出一个新的思路.
本研究选题较好, 新颖性强, 但需进一步研究探讨.
编辑: 李瑞敏 电编:何基才
| 1. | Yau T, Chan P, Epstein R, Poon RT. Evolution of systemic therapy of advanced hepatocellular carcinoma. World J Gastroenterol. 2008;14:6437-6441. [PubMed] [DOI] |
| 2. | You WK, McDonald DM. The hepatocyte growth factor/c-Met signaling pathway as a therapeutic target to inhibit angiogenesis. BMB Rep. 2008;41:833-839. [PubMed] |
| 3. | Frisch SM, Vuori K, Ruoslahti E, Chan-Hui PY. Control of adhesion-dependent cell survival by focal adhesion kinase. J Cell Biol. 1996;134:793-799. [PubMed] [DOI] |
| 5. | 苏 荣健, 李 贞, 李 宏丹, 宋 慧娟, 程 留芳. 肝细胞生长因子对肝细胞癌细胞系SMMC-7721黏着斑激酶的影响. 世界华人消化杂志. 2009;17:2070-2073. [DOI] |
| 6. | Dufour G, Demers MJ, Gagné D, Dydensborg AB, Teller IC, Bouchard V, Degongre I, Beaulieu JF, Cheng JQ, Fujita N. Human intestinal epithelial cell survival and anoikis. Differentiation state-distinct regulation and roles of protein kinase B/Akt isoforms. J Biol Chem. 2004;279:44113-44122. [PubMed] [DOI] |
| 7. | Liu G, Meng X, Jin Y, Bai J, Zhao Y, Cui X, Chen F, Fu S. Inhibitory role of focal adhesion kinase on anoikis in the lung cancer cell A549. Cell Biol Int. 2008;32:663-670. [PubMed] [DOI] |
| 8. | Vachon PH, Harnois C, Grenier A, Dufour G, Bouchard V, Han J, Landry J, Beaulieu JF, Vézina A, Dydensborg AB. Differentiation state-selective roles of p38 isoforms in human intestinal epithelial cell anoikis. Gastroenterology. 2002;123:1980-1991. [PubMed] [DOI] |
| 9. | Richardson NE, Davies DJ, Meakin BJ, Norton DA. The interaction of preservatives with polyhydroxyethylmethacrylate (polyHEMA). J Pharm Pharmacol. 1978;30:469-475. [PubMed] |
| 10. | Folkman J, Moscona A. Role of cell shape in growth control. Nature. 1978;273:345-349. [PubMed] [DOI] |
| 11. | Li H, Ray G, Yoo BH, Erdogan M, Rosen KV. Down-regulation of death-associated protein kinase-2 is required for beta-catenin-induced anoikis resistance of malignant epithelial cells. J Biol Chem. 2009;284:2012-2022. [PubMed] [DOI] |
| 12. | De Herdt MJ, Baatenburg de Jong RJ. HGF and c-MET as potential orchestrators of invasive growth in head and neck squamous cell carcinoma. Front Biosci. 2008;13:2516-2526. [PubMed] [DOI] |
| 13. | Zeng Q, McCauley LK, Wang CY. Hepatocyte growth factor inhibits anoikis by induction of activator protein 1-dependent cyclooxygenase-2. Implication in head and neck squamous cell carcinoma progression. J Biol Chem. 2002;277:50137-50142. [PubMed] [DOI] |
| 14. | Shelly C, Herrera R. Activation of SGK1 by HGF, Rac1 and integrin-mediated cell adhesion in MDCK cells: PI-3K-dependent and -independent pathways. J Cell Sci. 2002;115:1985-1993. [PubMed] |
| 15. | Cheng H, Liu P, Wang ZC, Zou L, Santiago S, Garbitt V, Gjoerup OV, Iglehart JD, Miron A, Richardson AL. SIK1 couples LKB1 to p53-dependent anoikis and suppresses metastasis. Sci Signal. 2009;2:ra35. [PubMed] [DOI] |