修回日期: 2010-02-19
接受日期: 2010-02-23
在线出版日期: 2010-03-08
目的: 研究脾切除及部分脾动脉栓塞术(PSE)对肝癌伴脾亢患者免疫功能的影响.
方法: 前瞻性研究肝癌合并脾亢的患者69例, 全部经过影像学及实验室检查证实为肝癌合并脾亢, 随机分为两组, 其中PSE组37例, 脾切除组32例. PSE组实施肝癌介入治疗同时行PSE(双介入)治疗, 脾切除组实施肝癌介入治疗同时行外科切脾. 观察两组术前术后的外周血象、免疫系统指标及临床症状体征的变化.
结果: 在PSE组, 术后测WBC、PLT, 与术前比较均有显著性差异(P<0.05); 术后测RBC与术前相比无显著差异(P>0.05). 在脾切除组, 术后测WBC、PLT, 与术前比较均有显著性差异(P<0.05); 术后测RBC与术前相比无显著差异(P>0.05). 术前测PSE组与脾切除组的CD4+、CD4+/CD8+, 两组间无显著差异, 术后7 d、术后28 d测CD4+, 两组间有显著差异(t = 16.063, 9.409,P<0.05). 术后7 d、术后28 d测CD4+/CD8+, 两组间有显著差异(t = 2.060, 2.228, P<0.05). 在PSE组, 术后测CD4+、CD4+/CD8+分别与术前比较, 均有显著性差异(P<0.05). 在脾切除组, 术后测CD4+、CD4+/CD8+分别与术前比较, 均无显著性差异(P>0.05). 两组病例术后并发症(发热、腹痛、腹水、胸腔积液)发生率的比较均无显著性差异(P>0.05).
结论: PSE与传统脾切除术相比, 有操作简单、并发症少、术后细胞免疫功能改善等优点, 取得了更好的临床治疗效果.
引文著录: 马立辉, 周健, 史丽民, 胡大为, 王助新, 崔亮. 脾动脉栓塞术对肝癌伴脾亢患者免疫功能的影响. 世界华人消化杂志 2010; 18(7): 669-675
Revised: February 19, 2010
Accepted: February 23, 2010
Published online: March 8, 2010
AIM: To investigate the impact of splenectomy and partial splenic embolization (PSE) on immune function in patients with hepatocellular carcinoma and hypersplenism.
METHODS: A prospective study was performed. Sixty-nine patient clinically diagnosed as liver cancer with hypersplenism were randomly divided into two groups: PSE group (n = 37) and splenectomy group (n = 32). The PSE group underwent PSE and transcatheter arterial chemoembolization (TACE), while the splenectomy group underwent splenectomy and TACE. Before and after treatment, blood routine examination was performed, and immunologic parameters were determined in both groups. The complications associated with treatment were also observed.
RESULTS: In the PSE group, significant differences were noted in WBC and PLT (both P < 0.05) but not in RBC (P > 0.05) between before and after treatment. Similar results were also obtained in the splenectomy group. No significant differences were found in preoperative CD4+ lymphocyte percentage and CD4+/CD8+ ratio between the PSE group and the splenectomy group. However, significant differences were noted in CD4+ lymphocyte percentage and CD4+/CD8+ ratio 7 and 28 days after treatment (CD4+: t = 16.063 and 9.409, both P < 0.05; CD4+/CD8+: t = 2.060 and 2.228, both P < 0.05). Significant differences were noted between preoperative and postoperative CD4+ lymphocyte percentage and CD4+/CD8+ ratio in the PSE group (all P < 0.05) but not in the splenectomy group (all P > 0.05). There is no significant difference in the incidence of complications (such as fever, abdominal pain, ascites, and pleural effusion) between the two groups (P > 0.05).
CONCLUSION: PSE has several advantages over splenectomy in the treatment of hepatocellular carcinoma with hypersplenism, including simpleness, fewer complications, and being able to improve cellular immune function.
- Citation: Ma LH, Zhou J, Shi LM, Hu DW, Wang ZX, Cui L. Impact of splenectomy partial splenic embolization on immune function in patients with hepatocellular carcinoma and hypersplenism. Shijie Huaren Xiaohua Zazhi 2010; 18(7): 669-675
- URL: https://www.wjgnet.com/1009-3079/full/v18/i7/669.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i7.669
肝细胞癌(hepatocellular carcinoma, HCC)是全球第5位常见的肿瘤, 占所有癌症的5.6%[1,2]. 在我国, 肝癌每年的新发病例占全世界肝癌病例数的43.7%[3], 其中50%-90%的肝癌患者合并肝硬化或脾功能亢进[4]. 由于多数肝癌患者临床就医时已是晚期, 且能够外科手术治疗的低于20%[5], 所以大多数选择经导管动脉栓塞化疗(transcatheter arterial chemoembolization, TACE)[6,7]. 肝癌患者多数合并有肝硬化、脾脏功能亢进, 有些学者认为巨脾脾亢患者抗氧化维生素含量和抗氧化酶活性降低、促进肝硬化发展并具有负性抗肿瘤作用[8]. 目前外科治疗脾亢主要是脾切除术, 而肝癌根治术同时行脾切除术, 手术的创伤大、风险高, 全脾切除术后患者免疫系统功能与保脾者相比明显下降, 因此近年来已陆续报道了应用部分性脾栓塞术(partial splenic embolization, PSE)治疗脾功能亢进, 是在保持脾脏部分功能的基础上治疗脾亢. 在进行肝癌介入治疗的同时进行PSE, 具有创伤小、风险小的优点, 本文通过检测PSE术前术后患者血常规、免疫学指标, 探讨PSE对患者免疫功能的影响.
选取2006-03/2009-02河北省承德医学院附属医院就诊, 并被临床确诊为肝癌合并脾功能亢进的患者69例, 其中37例行PSE同时行肝癌介入治疗术(双介入治疗术), 32例实施外科切脾同时行肝癌介入治疗术. 69例患者均为原发性肝癌伴脾功能亢进患者, 其中男30例, 女39例, 年龄33-74(平均51)岁; 手术治疗两组的患者性别、年龄无显著性差异(P<0.05). 全部病例的诊断标准符合中国抗癌协会肝癌专业委员会2001-09在广州召开的第八届全国肝癌学术会议上正式通过的"原发性肝癌的临床诊断与分期标准"及脾功能亢进国内的诊断标准(1991).
1.2.1 手术: (1)PSE: 采用Seldinger穿刺技术, 在数字减影X光机导引下, 穿刺右股动脉送入5F RH导管或5F cobra导管, 经髂总动脉、腹主动脉、腹腔动脉干, 行造影检查, 了解肝癌情况及脾脏大小情况. 先行肝动脉灌注化疗及栓塞治疗, 然后将导管超选择插入脾下极动脉, 经导管缓慢注入明胶海绵颗粒混悬剂, 行脾下极动脉栓塞. 根据栓塞过程中脾动脉血流情况掌握栓塞面积: 血流速度稍有减慢栓塞程度约40%, 轻度减慢约60%, 明显减慢或成蠕动样前进栓塞程度大于80%. (2)全脾切除术: 于左肋缘下切口进腹, 结扎脾动脉主干, 离断脾胃、脾肾和脾膈韧带, 搬出脾脏予以切除. 腹腔镜下切脾按文献方法进行[9].
1.2.2 血常规检测: 术前1 d, 术后1 d、术后7 d、术后28 d化验患者红细胞计数(RBC)、白细胞计数(WBC)、血小板计数(PLT). 检测患者免疫功能指标: 术前1 d, 术后7 d、术后28 d检测CD4+细胞比例、CD8+细胞比例及CD4+/CD8+比值测定.
1.2.3 观察术后并发症: 观察患者术后腹痛(程度、持续时间、是否有顽固性腹痛的发生及其持续时间)、胃肠道反应(恶心、呕吐情况及发生时间)、发热(程度、持续时间)、腹水、胸水、门静脉血栓、爆发性感染、脾脓肿的发生情况.
统计学处理 各项指标检测所得数值用Excel建立数据库, 采用SPSS13.0软件进行统计分析, 计量资料采用mean±SD表示, 各组间比较采用t检验, 计数资料采用χ2检验. 检验水准P = 0.05.
2.1.1 WBC: PSE组与脾切除术组WBC比较, 术前、术后均无显著性差异(均P>0.05). 在PSE组, WBC术前与术后7、28 d比较, 均有显著性差异(t = 15.103, 11.872, 均P<0.05). 在脾切除组, WBC术前与术后7、28 d比较, 也有显著性差异(t = 9.498, 10.478, 均P<0.05, 表1).
2.1.2 RBC: PSE组与脾切除术组RBC比较, 术前、术后均无显著性差异(均P>0.05). 在PSE组, RBC术前与术后7、28 d比较, 无显著性差异(t = 0.687, 0.743, 均P>0.05). 在脾切除组, RBC术前与术后7、28 d比较, 无显著性差异(t = 1.470, 0.606, 均P>0.05, 表1).
2.1.3 PLT变化: PSE组与脾切除术组PLT比较, 术前、术后均无显著性差异(均P>0.05). 在PSE组, PLT术前与术后7、28 d比较, 有显著性差异(t = 33.268, 35.505, 均P<0.05). 在脾切除组, PLT术前与术后7、28 d比较, 有显著性差异(t = 25.776, 20.668, 均P<0.05, 表1).
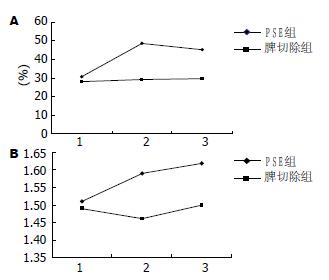
2.2.1 CD4+细胞比例: PSE组与脾切除术组CD4+细胞比例术前比较, 无显著差异(P>0.05); PSE组与脾切除术组CD4+细胞比例术后7、28 d比较, 均有显著差异(均P<0.05, 表2, 图1). 在PSE组, CD4+细胞比例术后7、28 d与术前比较, 均有显著性差异(t = 13.947, 8.314, 均P<0.05). 在脾切除术组, CD4+细胞比例术后7、28 d与术前比较, 均无显著性差异(t = 0.946, 1.009, 均P>0.05, 表2, 图1).
2.2.2 CD4+/CD8+比值: PSE组与脾切除术组术前CD4+/CD8+比值的比较, 无显著性差异(P>0.05); PSE组与脾切除术组术后7、28 d CD4+/CD8+比值的比较, 均有显著性差异(均P<0.05, 表2, 图1). 在PSE组, 术后7、28 d CD4+/CD8+比值与术前比较, 有显著性差异(t = 2.259, 2.950, 均P<0.05). 在脾切除术组, 术后7、28 d CD4+/CD8+比值与术前比较, 无显著性差异(t = 1.416, 0.130, 均P>0.05, 表2, 图1).
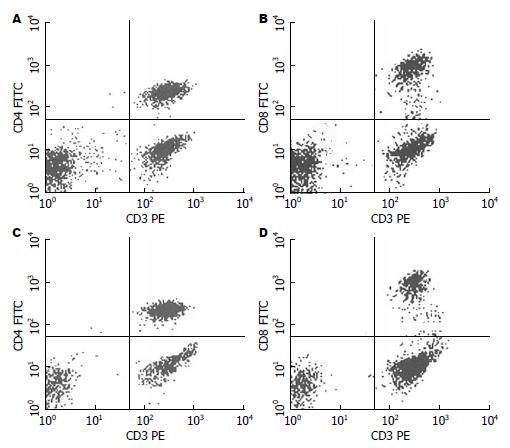
术前CD4+、CD8+的比率和CD4+/CD8+比值分别为31.72%、25.43%、1.25:1; 术后28 d CD4+、CD8+比率和CD4+/CD8+比值分别为56.13%、21.24%、2.64:1(图2).
两组患者术后并发症(发热、腹痛、腹水胸腔积液)的发生率比较均无显著性差异(P>0.05), 在PSE组, 术后均恢复, 37例均无死亡, 无后遗症. 脾切除组, 术后均恢复, 32例均无死亡, 无后遗症(表3).
| 分组 | PSE n(%) | 脾切除组 n(%) | χ2值 | P值 |
| 发热(>38.5 ℃) | 32(86.48) | 26(81.25) | 0.351 | 0.553 |
| 腹痛 | 30(81.08) | 25(78.13) | 0.093 | 0.761 |
| 腹水 | 7(18.92) | 6(18.75) | 0.000 | 0.986 |
| 胸腔积液 | 1(2.70) | 4(12.50) | 1.210 | 0.271 |
在PSE组, 栓塞面积大, 并发症出现多. 本组脾栓塞面积60%的病例25例, 脾栓塞面积40%的病例12例. 12例栓塞面积40%的病例术后8例出现发热, 25例栓塞面积60%的病例术24例出现发热, 两组比较有显著性差异(P<0.05). 12例栓塞面积40%的病例术后7例出现腹痛, 25例栓塞面积60%的病例术23例出现发热, 两组比较有显著性差异(P<0.05). 12例栓塞面积40%的病例术后2例出现腹水, 25例栓塞面积60%的病例术5例出现发热, 两组比较无显著性差异(P>0.05).
我国原发性肝癌患者多数是在乙型肝炎、肝硬化的基础上发展的, 绝大部分合并脾功能亢进[12]. 脾脏是免疫活性细胞受抗原刺激后分化增殖、发生免疫应答的重要外周淋巴器官之一[10], 在机体免疫反应中起着重要作用. 正常脾脏切除后, 可导致机体免疫功能下降, 出现急性爆发性感染. 脾动脉节段性分布特征为PSE提供了解剖学基础, 脾动脉自腹腔动脉干发出后, 逐级分出脾叶动脉、脾段动脉、亚段动脉, 供应相应区域的脾脏组织, 各叶、段、亚段间血管吻合极少. 上述特征为PSE提供了解剖学依据, 即当栓塞某叶支或段支后, 相应区域的脾脏组织会发生缺血梗死. 因此, 行PSE准确的选择靶动脉是极其必要的. 脾动脉近端栓塞后, 脾实质通过侧支循环可不产生梗死, 而外周脾动脉, 经脾段动脉分支之间吻合动脉较少, 且栓塞剂均分布在外周脾组织, 至梗死机化, 包绕在残留脾组织外周, 能有效地限制了脾脏进一步增大. 因此把脾段外周小动脉支作为栓塞靶动脉是PSE治疗脾亢的前提.
人体免疫系统是复杂的调节网络, 各免疫细胞间具有相互促进, 相互制约的作用, 并以此维持生理平衡[16]. 正常机体中各种T细胞亚群相互作用, 维持着机体的正常免疫功能, 当不同淋巴细胞亚群的数量和功能发生异常时, 机体免疫功能将发生紊乱. CD4+和CD8+分别代表TH/诱导亚群和HS/抑制亚群, CD4+/CD8+比值减少是免疫缺陷的重要指征[11].
本研究通过对肝癌合并脾功能亢进的患者进行肝癌介入治疗, 同时分别进行PSE和脾切除. 初步研究结果表明, 部分性脾栓塞术较脾切除治疗脾功能亢进更安全有效, 并且能改善患者的免疫功能.
PSE和脾切除术对外周血象有相同的影响. PSE组与脾切除术组术后白细胞、血小板较术前均明显增高, 有显著差异. 脾脏具有清除血细胞的功能. 脾功能亢进时, 大量的血液淤滞在肿大的脾脏内, 在功能活跃的巨噬细胞系统的作用下, 血细胞被大量破坏, 以及因脾脏过度分泌血小板抗体(PA-IgG)更加重了血小板的破坏[15]导致外周血细胞, 尤其是白细胞、血小板减少. 脾切除后, 脾脏破坏外周血细胞的功能消失, 外周血细胞的数量明显上升, 和术前比较有显著差异. 而部分性脾栓塞术通过栓塞部分脾动脉分支, 将脾脏外周的红髓部分栓塞, 使网状内皮细胞数目减少, 该部分脾实质缺血性坏死、机化、萎缩, 最终被结缔组织增生代替. 这种不可逆的病理改变削弱了脾脏吞噬和破坏血细胞的能力, 减少血细胞在脾脏的滞留和破坏, 从而改善脾功能亢进患者的外周血象. PSE组与脾切除组, 术后7 d、28 d外周血细胞数量比较无显著差异. 综合以上PSE治疗脾功能亢进对外周血细胞的影响方面达到了和脾切除的相同疗效. 红细胞数量术前术后无明显变化. 这一结果与Xu等[13]的研究结果一致, 但Pålsson等[14]报道: 根据长期随访结果, 脾栓塞患者术后在经过一段较长时间后, 其红细胞升高具有显著差异.
PSE与脾切除术相比, 有改善患者术后免疫功能的作用. 本课题表明: PSE组经过PSE治疗后, CD4+ T细胞亚群于术后7 d、28 d较术前有不同程度的改善, 经统计分析有显著差异(P<0.05). CD4+/CD8+比值较术前明显改善, 经统计分析有显著差异(P<0.05). CD4+和CD8+分别代表TH/诱导亚群和TS抑制亚群. 肝癌合并脾功能亢进患者, CD4+降低, CD4+/CD8+降低, 从而导致机体免疫监视、防御和调节功能低下[17,18]. 脾为免疫调节的重要器官, 也是强烈影响细胞免疫的动力器官[19]. 主要起到免疫功能的是脾脏的白髓部分, 白髓位于脾脏中央部. PSE后脾脏外围或部分被栓塞, 外周较大范围的组织增生, 限制了脾脏的充血肿大[20], 但其内部组织未受影响. 本课题PSE组, 肝癌合并脾功能亢进患者在行肝癌介入治疗的基础上行PSE后, CD4+、CD8+明显改善, CD4+/CD8+比值较术前明显增高, 均有统计学意义(P<0.05). 说明肝癌合并脾功能亢进患者的脾脏并非无功能, 而是其功能由正性免疫效应转向负性免疫效应, 可产生正常脾脏不会产生的某种毒素或因子, 对抗体产生了不良结果, 这是一种双向调节作用. 脾功能亢进行部分脾栓塞后可以减弱这种免疫抑制作用, 使患者的免疫功能得到改善. Tomikawa等[21]在实验鼠中研究发现肝部分切除脾栓塞后DNA合成多于未栓塞组, 并且肝细胞生长因子的激活也早于未栓塞组, 证明了病脾可产生某种毒素或因子对机体免疫功能有不良影响. 而脾切除组, 肝癌合并脾功能亢进者行脾切除术后, CD4+、CD4+/CD8+比值均有所下降但差异无统计学意义(P>0.05). 以上结果提示脾脏被切除后, 其产生淋巴细胞合成抗体的功能被剥夺, 机体T淋巴细胞系统出现紊乱, 淋巴细胞转换率明显下降, 但本次样本均取自成年人, 因为成年人免疫系统完善, 淋巴结发育成熟, 脾切除后机体免疫功能尚有其他淋巴器官代偿[22]. PSE组较脾切除组术后第7 d、28 d的CD4+、CD4+/CD8+比值均有明显改善, 差异显著, 有统计学意义(P>0.05), 说明PSE较脾切除能够保留脾脏的正常免疫功能并能改善脾功能亢进时增强的负性免疫效应.
PSE栓塞面积与术后并发症是有联系的. 从理论上讲, 栓塞面积与疗效成正比, 即面积越大, 疗效越明显, 多数学者认为[23-26]残留20%的脾组织就可以维持脾脏的免疫功能及过滤作用, 但栓塞后综合征重, 易出现脾脓肿、败血症和肝功能衰竭等严重并发症. 也有学者认为栓塞面积小于30%则难以达到改善外周血象的理想疗效或中远期复发脾亢的风险增高[27]. 另有作者提出分期栓塞即分2-3次进行脾脏栓塞, 每次栓塞范围在30%左右, 此法比较安全[28], 故本研究PSE组栓塞脾脏面积选定于40%-60%, 其中三系外周血细胞均出现下降栓塞60%, 其余栓塞40%. PSE组术后出现32例需处理的发热(发热主要和栓塞后组织缺血梗死、炎性渗出、液化吸收、急性水肿刺激包膜有关), 其中栓塞40%的患者中8例出现发热, 栓塞60%的患者中24例发热, 经检验两组比较有显著性差异, 说明患者术后发热情况和栓塞面积有正相关, 栓塞面积越大出现发热的几率越大. 共有30例出现腹痛, 栓塞40%的12例患者中7例出现腹痛, 绝大多数疼痛于Ⅱ度以下(疼痛明显, 睡眠受干扰), 栓塞60%的25例患者中23例出现腹痛, 4例出现Ⅲ度疼痛(疼痛剧烈, 伴自主神经功能紊乱, 睡眠严重受干扰)栓塞40%的25例中2例出现顽固性腹痛. 两组比较腹痛有显著性差异, 说明腹痛和栓塞面积大小成正相关性. 脾切除组的术后并发症主要是发热、右上腹痛. 其发热原因主要是由于术后吸收热. 6例出现腹水, 是由于脾切除术及肝介入术后肝功能异常、术后禁饮食低蛋白血症所致. PSE组和脾切除组术后并发症发生比率经统计学分析虽无显著差异, 但从手术方式上来看, 行PSE治疗是和肝癌介入治疗同时进行的, 无需另行手术切口, 而脾切除则需要在全麻下于左肋缘下切开进行, 切口约10 cm, 这增加了麻醉风险, 手术风险, 且创伤大.
总之, PSE与传统脾切除术相比, 有操作简单、并发症少、术后细胞免疫功能改善等优点, 取得了更好的临床治疗效果.
肝癌伴脾功能亢进临床较为常见. 近年来有人应用部分脾动脉栓塞术(PSE)治疗肝癌伴脾功能亢进, 经初步临床观察, 他可能是一个未来的治疗方向, 其对患者免疫功能的影响是目前临床关注的重要课题.
黄志勇, 教授, 华中科技大学同济医院普外科.
Tomikawa等在实验鼠中研究发现肝部分切除脾栓塞后DNA合成多于未栓塞组, 并且肝细胞生长因子的激活也早于未栓塞组, 证明了病脾可产生某种毒素或因子对机体免疫功能有不良影响.
本文通过检测PSE术前术后患者血常规、免疫学指标, 探讨PSE对患者免疫功能的影响.
PSE与传统脾切除术相比, 有操作简单、并发症少、术后细胞免疫功能改善等优点, 取得了更好的临床治疗效果.
本研究分析了部分脾动脉栓塞术治疗肝癌伴脾亢患者术前术后的外周血象及临床症状体征的变化情况, 并且检测免疫系统指标CD4+、CD4+/CD8+的变化, 具有一定的新颖性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lau WY. Primary liver tumors. Semin Surg Oncol. 2000;19:135-144. [PubMed] [DOI] |
| 2. | Bosch FX, Ribes J, Díaz M, Cléries R. Primary liver cancer: worldwide incidence and trends. Gastroenterology. 2004;127:S5-S16. [PubMed] [DOI] |
| 3. | Lai EC, Lau WY. The continuing challenge of hepatic cancer in Asia. Surgeon. 2005;3:210-215. [PubMed] [DOI] |
| 4. | Kumpe DA, Rumack CM, Pretorius DH, Stoecker TJ, Stellin GP. Partial splenic embolization in children with hypersplenism. Radiology. 1985;155:357-362. [PubMed] |
| 5. | Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol. 2004;130:417-422. [PubMed] [DOI] |
| 6. | Lladó L, Virgili J, Figueras J, Valls C, Dominguez J, Rafecas A, Torras J, Fabregat J, Guardiola J, Jaurrieta E. A prognostic index of the survival of patients with unresectable hepatocellular carcinoma after transcatheter arterial chemoembolization. Cancer. 2000;88:50-57. [PubMed] [DOI] |
| 7. | Zangos S, Gille T, Eichler K, Engelmann K, Woitaschek D, Balzer JO, Mack MG, Thalhammer A, Vogl TJ. [Transarterial chemoembolization in hepatocellular carcinomas: technique, indications, results]. Radiologe. 2001;41:906-914. [PubMed] [DOI] |
| 10. | 梁 扩寰. 肝脏病学. 第1版. 北京: 人民卫生出版社 1995; 306-308. |
| 12. | 霍 枫, 蒲 淼水, 詹 世林, 汪 邵平, 陈 建雄. 原发性肝癌合并脾功能亢进的外科治疗. 中国普外基础与临床杂志. 2006;13:173-174. |
| 13. | Xu RY, Liu B, Lin N. Therapeutic effects of endoscopic variceal ligation combined with partial splenic embolization for portal hypertension. World J Gastroenterol. 2004;10:1072-1074. [PubMed] |
| 14. | Pålsson B, Hallén M, Forsberg AM, Alwmark A. Partial splenic embolization: long-term outcome. Langenbecks Arch Surg. 2003;387:421-6. [PubMed] |
| 15. | Noguchi H, Hirai K, Aoki Y, Sakata K, Tanikawa K. Changes in platelet kinetics after a partial splenic arterial embolization in cirrhotic patients with hypersplenism. Hepatology. 1995;22:1682-1688. [PubMed] [DOI] |
| 16. | 康 格菲. 临床生物化学. 第1版. 北京: 人民出版社 1989; 45. |
| 17. | 左 朝晖, 张 柏和, 姜 小清, 谭 春祁, 莫 胜川, 欧阳 永忠, 周 德善. 肝癌伴脾功能亢进症行肝脾联合切除术后肝功能和免疫功能的变化. 中国普通外科杂志. 2008;17:6-9. |
| 18. | 冯 凯, 马 宽生. 继发性脾功能亢进症的治疗现状及展望. 国外医学·外科学分册. 2005;32:183-187. |
| 21. | Tomikawa M, Hashizume M, Highashi H, Ohta M, Sugimachi K. The role of the spleen, platelets, and plasma hepatocyte growth factor activity on hepatic regeneration in rats. J Am Coll Surg. 1996;182:12-16. [PubMed] |
| 23. | Numata S, Akagi K, Sakino I, Ogata H, Kawadoko T, Suzuki N, Nomiyama K, Tsuji H, Fujishima M. [Partial splenic embolization for the treatment of liver cirrhosis with hypersplenism: assessment of clinical response and liver function]. Nippon Shokakibyo Gakkai Zasshi. 1997;94:526-531. [PubMed] |
| 24. | Iida T, Sakino I, Akagi K. [Prognosis of residual spleen after partial splenic embolization for the treatment of hypersplenism in cirrhosis]. Nippon Igaku Hoshasen Gakkai Zasshi. 1998;58:152-156. [PubMed] |
| 25. | Moro E, Pais M, Benvegnù M, Ferrari M, Bittolo Bon G. [Decrease of insulin resistance after splenectomy in a diabetic patient with liver cirrhosis and portal hypertension. Physiopathologic evaluation]. Minerva Gastroenterol Dietol. 1994;40:213-218. [PubMed] |
| 26. | Sangro B, Bilbao I, Herrero I, Corella C, Longo J, Beloqui O, Ruiz J, Zozaya JM, Quiroga J, Prieto J. Partial splenic embolization for the treatment of hypersplenism in cirrhosis. Hepatology. 1993;18:309-314. [PubMed] [DOI] |
| 27. | 宁 文锋, 张 明亮. 不同脾动脉栓塞面积治疗肝硬化合并脾功能亢进临床分析. 南华大学学报(医学版). 2004;32:170-172. |