修回日期: 2009-12-31
接受日期: 2010-01-04
在线出版日期: 2010-02-18
目的: 探讨超声检查肝细胞癌(hepatocellular carcinoma, HCC)门静脉对肝移植患者预后的诊断价值.
方法: 收集2000-01/2006-10四川大学华西医院进行肝移植的HCC患者148例, 结合患者超声、病理以及临床资料, 对患者肝移植后生存情况进行回顾性分析.
结果: 全组随访时间2.8-69.5(平均16.4) mo. 随访期间, 肿瘤复发率为43.2%. 超声检查无门静脉受累者102例(68.9%), 门静脉肝内分支受累者32例(21.6%), 门静脉主干受累者14例(9.5%). 单因素COX模型分析结果显示: 门静脉受累是对累积生存率和无瘤生存率有统计学意义的协变量(RR = 2.673, P = 0.000). 多因素COX逐步回归分析结果显示: 门静脉受累是对累积生存率(RR = 2.426, P = 0.000)和无瘤生存率(RR = 2.258, P = 0.000)有影响的独立因素.
结论: 门静脉受累是独立性的预后影响因素, 超声检测HCC患者门静脉是否受累有助于患者适应证的选择.
引文著录: 马步云, 李晋, 卢强, 严律南, 罗燕, 彭玉兰. 超声评估门静脉与HCC患者肝移植预后的关系. 世界华人消化杂志 2010; 18(5): 512-516
Revised: December 31, 2009
Accepted: January 4, 2010
Published online: February 18, 2010
AIM: To evaluate the prognostic value of portal vein involvement in patients undergoing liver transplantation for hepatocellular carcinoma (HCC).
METHODS: One hundred and forty-eight HCC patients who underwent liver transplantation at West China Hospital of Sichuan University from January 2000 to October 2006 were included in the study. The pathological, clinical and ultrasound imaging data for these patients were analyzed retrospectively.
RESULTS: The median follow-up was 16.4 months (range: 2.8-69.5 months). During the follow-up, the overall tumor recurrence rate was 43.2%. Ultrasound examination revealed intrahepatic portal vein involvement in 32 patients, main portal vein involvement in 14 patients, and no portal vein involvement in 102 patients. Univariate COX model analysis showed that portal vein involvement was an independent predictor of actuarial survival [relative risk (RR) = 2.673, P = 0.000] and recurrence-free survival (RR = 2.951, P = 0.000). Multivariate COX proportional hazards model analysis also showed portal vein involvement was an independent predictor of actuarial survival (RR = 2.426, P = 0.000) and recurrence-free survival (RR = 2.258, P = 0.000).
CONCLUSION: Portal vein involvement is an independent prognostic factor for survival in patients undergoing liver transplantation for HCC. Ultrasound assessment of portal vein involvement can help identify indications for liver transplantation in patients with HCC.
- Citation: Ma BY, Li J, Lu Q, Yan LN, Luo Y, Peng YL. Prognostic value of portal vein involvement in patients undergoing liver transplantation for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 512-516
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/512.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.512
原发性肝癌(primary hepatic cancer, PHC)是最常见的恶性肿瘤之一, 位居全球恶性肿瘤发病率的第3位, 全世界每年大约有新发病例62.6万, 有59.8万人死于该疾病, 居肿瘤死亡原因的第3位, 我国约占其中的55%[1]. 肝细胞癌(hepatocellular carcinoma, HCC)占PHC的80%-90%, HCC已成为我国恶性肿瘤的第2大病因, 每年死亡患者列全球第1位[2]. 从肿瘤的治疗原则上讲, 肝移植是根治HCC的最佳方法, 术后早期效果良好, 但肿瘤复发和转移导致的远期低存活率却严重制约了肝癌肝移植的开展. 多项研究表明[3,4], 影响肝癌肝移植预后的因素包括肿瘤大小、数量、血管侵犯、肿瘤组织学分化程度和淋巴结转移等. 超声检查是肝脏疾病的常规方法, 在肝癌的术前诊断、术中监控和术后随访中发挥着重要的作用. 肝癌累及门静脉后, 在超声图像上可以形成门静脉栓塞的表现, 超声可以评估门静脉有无受累、受累部位及程度. 本文分析了148例HCC肝移植患者的超声及相关资料, 以探讨超声评估HCC患者的门静脉与肝移植预后的关系.
2000-01/2006-10我院进行肝移植的HCC患者148例, 男133例, 女15例, 年龄17-68(平均46)岁. 术前Child-Pugh评分: A级76例, B级57例, C级15例. MELD评分: <14分107例, ≥14分41例. 肿瘤TNM分期: Ⅰ期27例, Ⅱ期40例, Ⅲa期66例, Ⅲb期10例, Ⅲc期5例.
影像学检查包括超声、CT、MRI和核素骨扫描, 以排除肝外远处转移. 超声仪器包括GE 500、HP Sonos 4500、HDI 3500、HDI 5000和Acuson Sequoia 512等, 探头频率2-6 MHz. 应用超声仪器显示病肝及肿瘤的超声征象, 并对门静脉进行观察, 首先采用二维超声观察门静脉的管径、管壁以及管腔内回声, 然后进行彩色血流显像并测量频谱.
除了门静脉有无受累外, 本研究并对其他可能影响预后的因素进行了分析, 包括肿瘤的大小、数目、组织学分级和局部淋巴结有无受累等. 肝移植术式包括原位肝移植133例, 活体肝移植15例. 术前治疗情况: 肝动脉栓塞化疗(transcatheter arterial chemoembolization, TACE)30例, 经皮射频消融治疗(percutaneous radiofrequency ablation, PRFA)4例, 全身化疗9例, TACE+PRFA或PRFA+全身化疗4例, 未治疗101例.
切除的病肝当即进行病理大体标本检测, 方法为平行于肝脏水平面将肝脏切开, 切面间隔约1 cm, 仔细寻找癌灶, 详细记录肿瘤数目、大小、分布、门静脉和肝静脉的主干或分支有无癌栓, 肝门有无肿大的淋巴结. 再将病肝固定于350-400 mL/L甲醛液中, 由专业病理学者将标本石蜡包埋, 切片后采用Olympus显微镜观察, 记录肿瘤有无包膜及包膜受累情况, 肿瘤分化程度, 镜下有无微血管癌栓等, 免疫组织化学染色下观察HbsAg, HbcAg和HCVAg的染色情况. 肿瘤组织学分级按Edmondson标准分为Ⅰ-Ⅳ级, Ⅰ级为高度分化, Ⅱ级和Ⅲ级为中度分化, Ⅳ级为低度分化. 送检的淋巴结常规进行组织学病检, 判断有无转移.
肝移植术后常规进行抗感染、抗排斥和化疗. 患者出院后定期随访, 随访内容包括实验室和影像学检查. 记录肿瘤复发的时间和部位, 死亡日期和原因.
统计学处理 采用SPSS13.0软件. 累积生存率和无瘤生存率的计算及相应生存曲线的绘制均采用Kaplan-Meier方法, 组间差异采用Log-Rank检验法. 对每个可能影响肝癌肝移植预后的因素先采用单因素Cox比例风险模型进行分析, 由此筛选出有统计学意义的因素, 以P<0.05为纳入标准, 再利用多因素Cox比例风险模型进行分析, 从而确定独立预后因素.
全组随访2.8-69.5 mo, 平均16.4 mo. 存活81例, 包括无瘤生存69例和带瘤生存12例: 存活12 mo以内32例, 12-24 mo 32例, 24-36 mo 6例, 36 mo以上11例. 全组死亡62例, 包括肿瘤复发死亡52例和非肿瘤复发死亡10例, 从复发到死亡平均4.4 mo(1-15 mo). 全组失访5例. 全组肿瘤复发64例(复发率43.2%): 6 mo以内复发者25例, 6-12 mo复发者18例, 12-24 mo复发者18例, 24-36 mo复发者3例. 平均复发时间10.0 mo(8.4-11.7 mo).
全组患者平均生存时间33.6 mo(95%CI: 27.5-39.6), 平均无瘤生存时间32.8 mo(95%CI: 26.4-39.1)(表1).
| 生存情况 | 6 mo | 12 mo | 24 mo | 36 mo | 60 mo |
| 累积生存 | 90.0 | 73.3 | 45.6 | 35.4 | 32.1 |
| 无瘤生存 | 82.1 | 67.0 | 44.3 | 34.5 | 34.5 |
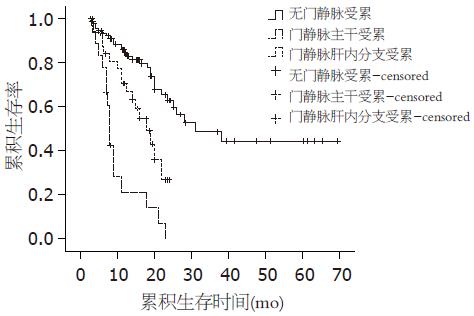
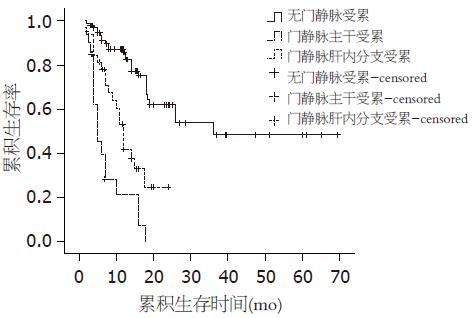
超声检查无门静脉受累者102例(68.9%), 门静脉肝内分支受累者32例(21.6%), 门静脉主干受累者14例(9.5%). 累积生存率和无瘤生存率的单因素相关分析结果(Log-rank检验)见表2.
| 生存情况 | 无门静脉受累者 | 门静脉肝内分支受累者 | 门静脉主干受累者 | ||||||
| 1年 | 2年 | 3年 | 1年 | 2年 | 3年 | 1年 | 2年 | 3年 | |
| 累积生存 | 84.5 | 62.9 | 48.7 | 70.6 | 26.9 | 0.0 | 21.2 | 0.0 | 0.0 |
| 无瘤生存 | 85.7 | 62.0 | 48.4 | 41.8 | 0.0 | 0.0 | 21.3 | 0.0 | 0.0 |
单因素COX模型分析结果显示: 门静脉受累是对累积生存率有统计学意义的协变量(RR = 2.673, 95%CI: 1.929-3.705, P = 0.000). 多因素COX逐步回归分析结果(Forward方式)显示: 门静脉受累是对累积生存率有影响的独立影响因素(RR = 2.426, 95%CI: 1.727-3.407, P = 0.000)(图1). 单因素COX模型分析结果显示: 门静脉受累是对无瘤生存率有统计学意义的协变量(RR = 2.951, 95%CI: 2.160-4.032, P = 0.000). 多因素COX逐步回归分析结果(Forward方式)显示: 门静脉受累是对无瘤生存率有影响的独立影响因素(RR = 2.258, 95%CI: 1.625-3.137, P = 0.000, 图2).
手术切除肿瘤是临床上常用的肝癌治疗方法. 由于早期肝癌患者缺乏典型的临床症状和体征, 导致多数患者在病变晚期才就诊, 丧失了手术治疗的最佳时期, 只有约10%的患者能够进行手术治疗, 术后5年生存率低于50%[5-7]. 近年来, 随着手术技术、麻醉技术和抗排斥药物等方面的进展, 肝移植在国内外发展迅速. 从外科治疗原则上讲, 肝移植治疗HCC是以全肝切除为基础的手术, 符合根治要求, 在切除肿瘤的同时, 能够消除传统肝癌手术难以解决了肝硬化和门静脉高压问题[8].
通过对HCC患者肝移植的术后随访发现, 许多中晚期患者, 尽管在术后早期有一个较好的恢复期, 但有近70%的患者在术后2年内复发, 5年生存率低于30%-40%, 其生存期较良性肝病肝移植患者短[9]. 由于供肝严重短缺、肿瘤复发和转移等因素的影响, 限制了肝移植治疗肝癌的广泛开展. 为了合理地利用供肝, 治愈或使其疗效与非肿瘤移植相当, 已经成为肝癌肝移植的目标. Mazzaferro等[10]提出了基于肿瘤TNM分期基础之上的受体Milan标准, 认为经过严格选择的HCC受体可以取得令人满意的远期效果, 4年的累积和无瘤生存率分别为85%和92%. 此后, 世界上许多肝移植中心都依照此标准或在此标准上进行改良, 并取得了良好的远期疗效. 有选择的HCC患者肝移植术后5年生存率可达70%, 复发率降至10%-15%[11,12]. 本研究中, 患者pTNM为Ⅲ期比例为54.8%, 1和2年累积生存率达到了73.3%和45.6%, 而复发率为43.2%, 这也反映了我国肝移植技术成熟的同时, 应该更加关注HCC患者适应证的制定.
Milan标准虽然可以取得令人满意的远期效果, 但是过高剔除率也使部分可能通过肝移植而获得治愈机会的HCC患者被拒之门外, 扩大选择标准又可能会增加肿瘤复发, 降低远期疗效[13]. 目前, "有选择的HCC"已经被公认为肝移植的适应证, 但是并没有在"如何选择"上达成共识. 术后肿瘤复发转移是影响肝癌肝移植预后的最主要原因. 多项研究证实, 血管受累, 尤其是门静脉受累是其中的主要影响因素之一[4,14,15]. Shetty等[16]通过对109例HCC肝移植的分析认为, 肉眼大血管受累是对累积和无瘤生存率都有显著性影响的预后因素, 而显微血管受累对预后无显著影响. HCC伴有门静脉受累时, 肿瘤可能已不局限于肝脏, 血循环中可能已存在肿瘤细胞. 虽然并非所有播散在血循环中的肿瘤细胞会种植进而发展成远处转移, 但是术后免疫抑制治疗可能会在此基础上增加肿瘤转移的可能性. 目前, 西方和亚洲绝大多数移植中心主张将门静脉主干或肝内分支癌栓的HCC患者排除在受体选择标准之外[17]. 本研究结果显示, 门静脉受累是影响累积和无瘤生存率的独立危险因素, 全组46例门静脉受累者中有35例于随访期内复发, 复发率高达76.1%. 门静脉受累明显影响着患者的累积生存率和无瘤生存率, 尤其是主干受累者. 无门静脉受累者2年的累积生存率和无瘤生存率分别为62.9%和62.0%, 而门静脉肝内分支受累者2年的累积生存率和无瘤生存率分别为26.9%和0, 门静脉主干受累者2年的累积生存率和无瘤生存率分别为0和0. 极低的远期预后大大降低了肝移植手术的价值, 不符合长期无病存活的根本目标, 也造成了有限供肝资源的浪费.
因此, 早期发现肿瘤并对其进行准确的评估, 尤其是影响预后的门静脉是否受累, 是获得良好预后的重要前提之一. 常规超声可以为临床提供HCC病肝及肿瘤的相关资料, 但是肝硬化背景、腹腔胀气等干扰因素的存在, 使得小肿瘤的发现和诊断较为困难. 再者, 弥漫型肝癌常常在超声图像上不形成明显的肿块, 超声显示门静脉肝内分支栓塞也有一定困难, 导致漏诊的发生. 对于门静脉栓塞, 常规超声也难以鉴别血栓和癌栓. 近年来, 随着超声造影在肝脏疾病中的广泛开展, 可以实时显示微血管的血流灌注, 弥补了常规超声难以显示的肿瘤滋养血管的不足, 可以更早的发现肿瘤, 对其边界的确定也更为准确[18,19]. 门静脉血栓本身没有血液供应, 而癌栓是有动脉供血, 这是超声造影鉴别二者的重要病理学基础. 超声造影动脉期, 由于癌栓内有动脉血供, 可见造影剂呈点状或条状的增强, 门静脉管腔内无增强; 静脉期由于有动、静脉瘘的形成, 癌栓内的造影剂快速消退, 形成充盈缺损[20].
在常规超声检查的基础上, 合理的应用超声造影, 可以早期发现和诊断HCC, 并对有无门静脉受累作出较为准确的评估, 有助于对选择合适的HCC患者进行肝移植手术, 对患者的预后将起到重要的作用.
肝细胞癌(HCC)是我国常见的恶性肿瘤, 肝移植是根治HCC的最佳方法. 超声是常规的检查方法, 通过术前超声对门静脉有无受累进行评估, 作为制定肝移植适应证的参考之一, 对于HCC治疗有重要的临床意义.
钱林学, 教授, 首都医科大学附属北京友谊医院内科.
肝移植是治疗HCC的研究热点之一, 影像学检查与移植预后的关系, 超声的相关报道较少. 常规超声的研究尚有不断深入的必要, 超声新技术, 例如超声造影的价值, 也需要在临床应用中进一步研究.
本研究提示, 对于HCC肝移植适应证的制定, 术前超声评估可以作为一种简单、无创和有效的参考手段.
本研究对肝癌门脉瘤栓患者移植生存情况进行了回顾性分析, 紧密结合临床, 具有很好参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Steinmüller T, Jonas S, Neuhaus P. Review article: liver transplantation for hepatocellular carcinoma. Aliment Pharmacol Ther. 2003;17 Suppl 2:138-144. [PubMed] [DOI] |
| 3. | Schwartz M. Liver transplantation for hepatocellular carcinoma. Gastroenterology. 2004;127:S268-S276. [PubMed] [DOI] |
| 4. | Zavaglia C, De Carlis L, Alberti AB, Minola E, Belli LS, Slim AO, Airoldi A, Giacomoni A, Rondinara G, Tinelli C. Predictors of long-term survival after liver transplantation for hepatocellular carcinoma. Am J Gastroenterol. 2005;100:2708-2716. [PubMed] [DOI] |
| 5. | Tang ZY, Ye SL, Liu YK, Qin LX, Sun HC, Ye QH, Wang L, Zhou J, Qiu SJ, Li Y. A decade's studies on metastasis of hepatocellular carcinoma. J Cancer Res Clin Oncol. 2004;130:187-196. [PubMed] [DOI] |
| 6. | Hemming AW, Greig PD, Langer B. Current surgical management of primary hepatocellular carcinoma. Adv Surg. 1999;32:169-192. [PubMed] [DOI] |
| 7. | Fong Y, Sun RL, Jarnagin W, Blumgart LH. An analysis of 412 cases of hepatocellular carcinoma at a Western center. Ann Surg. 1999;229:790-799; discussion 799-800. [PubMed] [DOI] |
| 8. | Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet. 2003;362:1907-1917. [PubMed] [DOI] |
| 9. | Llovet JM, Fuster J, Bruix J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology. 1999;30:1434-1440. [PubMed] [DOI] |
| 10. | Mazzaferro V, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F, Montalto F, Ammatuna M, Morabito A, Gennari L. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med. 1996;334:693-699. [PubMed] [DOI] |
| 11. | Yao FY, Ferrell L, Bass NM, Watson JJ, Bacchetti P, Venook A, Ascher NL, Roberts JP. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology. 2001;33:1394-1403. [PubMed] [DOI] |
| 12. | O'Grady JG, Polson RJ, Rolles K, Calne RY, Williams R. Liver transplantation for malignant disease. Results in 93 consecutive patients. Ann Surg. 1988;207:373-379. [PubMed] |
| 13. | Fung J, Marsh W. The quandary over liver transplantation for hepatocellular carcinoma: the greater sin? Liver Transpl. 2002;8:775-777. [PubMed] [DOI] |
| 14. | Jonas S, Bechstein WO, Steinmüller T, Herrmann M, Radke C, Berg T, Settmacher U, Neuhaus P. Vascular invasion and histopathologic grading determine outcome after liver transplantation for hepatocellular carcinoma in cirrhosis. Hepatology. 2001;33:1080-1086. [PubMed] [DOI] |
| 15. | Todo S, Furukawa H. Living donor liver transplantation for adult patients with hepatocellular carcinoma: experience in Japan. Ann Surg. 2004;240:451-459; discussion 459-461. [PubMed] [DOI] |
| 16. | Shetty K, Timmins K, Brensinger C, Furth EE, Rattan S, Sun W, Rosen M, Soulen M, Shaked A, Reddy KR. Liver transplantation for hepatocellular carcinoma validation of present selection criteria in predicting outcome. Liver Transpl. 2004;10:911-918. [PubMed] [DOI] |
| 17. | Kienle P, Weitz J, Klaes R, Koch M, Benner A, Lehnert T, Herfarth C, von Knebel Doeberitz M. Detection of isolated disseminated tumor cells in bone marrow and blood samples of patients with hepatocellular carcinoma. Arch Surg. 2000;135:213-218. [PubMed] [DOI] |
| 18. | Rettenbacher T. Focal liver lesions: role of contrast-enhanced ultrasound. Eur J Radiol. 2007;64:173-182. [PubMed] [DOI] |
| 19. | Konopke R, Bunk A, Kersting S. The role of contrast-enhanced ultrasound for focal liver lesion detection: an overview. Ultrasound Med Biol. 2007;33:1515-1526. [PubMed] [DOI] |