修回日期: 2010-11-03
接受日期: 2010-11-10
在线出版日期: 2010-12-18
目的: 探讨双歧杆菌与乳酸杆菌在大鼠肠道的动力学及肥胖对其的影响.
方法: 将80只清洁级♂SD大鼠随机分为肥胖组和普饲组. 普饲组40只, 喂饲普通饲料, 肥胖组40只, 喂饲高脂饲料, 第8周肥胖组大鼠肥胖模型成模. 利用5-(6-)羧基荧光素二乙酸琥珀酰亚胺酯(CFDA-SE)分子探针标记双歧杆菌、乳酸杆菌, 以每只4 mL×109 CFU/mL灌喂肥胖及普饲组SD大鼠, 分别于灌喂后0、2、4、8、12、24、48、72、96 h取大便, 灌喂后2、4、8、12、24 h取十二指肠、空肠、回肠、结肠等肠段, 在荧光镜下观察标记菌数量.
结果: 双歧杆菌肥胖组2、4、24 h细菌排出量较普饲组低(19.60±3.85, 130.00±24.49, 16.80±8.32 vs 346.00±45.61, 196.00±36.47, 382.00±40.87, 均P<0.05), 乳酸杆菌肥胖组2、8、24 h细菌排出量较普饲组低(14.80±3.70, 247.40±28.44, 7.40±3.85 vs 80.00±14.14, 326.00±27.93, 492.00±17.89, 均P<0.05); 双歧杆菌在普饲组2、4、8、24 h细菌排出量与乳酸杆菌不同(346.00±45.61, 196.00±36.47, 82.20±13.16, 382.00±40.87 vs 80.00±14.14, 36.00±7.71, 326.00±27.93, 492.00±17.89, P<0.05); 肥胖组双歧杆菌在十二指肠肠内和肠壁在2、12 h, 空肠在2、8 h, 回肠在2、4、8、12 h, 结肠在2、4、12、24 h细菌的分布与对照组不同(均P<0.05); 乳酸杆菌空肠在2 h, 回肠在8、12、24 h, 结肠在2、12、24 h与对照组不同(均P<0.05). 双岐杆菌: 2 h在普饲大鼠肠道主要集中在回肠末端及结肠, 8 h结肠内细菌明显减少, 24 h结肠内细菌大量增多; 而2 h在肥胖大鼠肠道主要集中在小肠远端, 后随肠道运动不断推移进入结肠, 8 h后细菌主要集中在结肠, 24 h结肠仅存少许细菌. 乳酸杆菌: 2 h在普饲大鼠肠道主要集中在小肠远端, 24 h结肠内细菌大量增多; 2 h在肥胖大鼠肠道主要集中在回肠, 24 h结肠仅少许细菌存留.
结论: 双歧杆菌、乳酸杆菌肠道动力不同, 肥胖对双歧杆菌、乳酸杆菌肠道动力有一定的影响.
引文著录: 史力群, 卢放根, 崔熠, 谢宁, 姚婷新. 双歧杆菌及乳酸杆菌在肥胖大鼠肠道中的动力学. 世界华人消化杂志 2010; 18(35): 3732-3739
Revised: November 3, 2010
Accepted: November 10, 2010
Published online: December 18, 2010
AIM: To investigate the dynamics of Bifidobacterium and Lactobacillus bacteria in the intestine of obese rats.
METHODS: Eighty SD ♂ rats were randomly divided into normal control group and obese group. The rats (n = 40) in control group were fed with normal forage, and the rats (n = 40) in obese group were fed with high fat forage. The obese rats model was constructed on week eight. Both Bifidobacterium and Lactobacillus bacteria were labeled with carboxyfluorescein diacetate succinimidyl ester (CFDA-SE) and fed to obese rats or normal control rats at 4 mL×109 CFU/mL. Rat faecal samples were collected at 0, 2, 4, 8, 12, 24, 48, 72, and 96 h after orogastric administration. Rats were sacrificed at 2, 4, 8, 12, and 24 h to take samples from the duodenum, jejunum, ileum, and colon. The number of fluorescence-positive bacteria was counted under a fluorescence microscope.
RESULTS: The numbers of Bifidobacteria (19.60 ± 3.85 vs 346.00 ± 45.61, 130.00 ± 24.49 vs 196.00 ± 36.47, 16.8 ± 8.32vs 382.00 ± 40.87, all P < 0.05) and Lactobacillus bacteria (14.80 ± 3.70 vs 80.00 ± 14.14; 247.40 ± 28.44 vs 326.00 ± 27.93; 7.40 ± 3.85 vs 492.00 ± 17.89, all P < 0.05) in faeces at 2, 4, and 24 h were significantly less in obese rats than in control ones. The numbers of Bifidobacteria bacteria in normal controls at 2, 4, 8, and 24 h were significantly different from those of Lactobacillus bacteria (all P < 0.05). In obese rats, significant differences were noted in the numbers ofBifidobacterium bacteria in the duodenum at 2 and 12 h (all P < 0.05), jejunum at 2 and 8 h (all P < 0.05), ileum at 2, 4, 8, and 12 h (all P < 0.05), and colon at 2, 4, 12, and 24 h (all P < 0.05), and in the numbers of Lactobacillus bacteria in the jejunum at 2 h (P < 0.05), ileum at 8, 12, and 24 h (all P < 0.05), and colon at 2, 12, and 24 h (all P < 0.05). Bifidobacteriumwere concentrated in terminal ileum and colon of control group in 2 h, they were obvious decrease in colon in 8 h, but rolled up in 24 h; while in the obese group, they were centralized in far-end small intestine in 2 h, increased in colon in 8 h, only little in 24 h. Lactobacillus were focused in far-end small intestine in 2 h, distinctly rised in colon in 24 h; while in the obese group, they were concentrated in ileum in 2 h, only little in colon in 24 h.
CONCLUSION: The dynamics of Bifidobacterium and Lactobacillus bacteria is different in the intestine of rats. Obesity can influence the dynamics of Bifidobacterium and Lactobacillus bacteria in the intestine of rats.
- Citation: Shi LQ, Lu FG, Cui Y, Xie N, Yao TX. Dynamics of Bifidobacterium and Lactobacillus bacteria in the intestine of obese rats. Shijie Huaren Xiaohua Zazhi 2010; 18(35): 3732-3739
- URL: https://www.wjgnet.com/1009-3079/full/v18/i35/3732.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i35.3732
随着益生菌开发、研究的深入, 益生菌的应用日益广泛. 其调节肠道微生态平衡[1,2]、抑制病原菌作用[3,4]在治疗急慢性腹泻、肝硬化菌群失调及物质代谢等方面的优势日益凸显. 益生菌能有效地在肠道定植或长时间存留是发挥上述生理功能的前提[5,6], 而益生菌的肠道动力学是其最根本的生物学特性, 亦是其作用的核心环节之一. 明确益生菌肠道动力学, 将为益生菌的生物学作用提供新的依据和方向, 对其应用产生积极而深远的影响.
肥胖及相关的代谢性疾病近年来已经成为威胁全球的公共健康问题[7-9]. 应用益生菌治疗肥胖早已成为研究的一大热点. 大量的实验研究表明, 益生菌能有效改善脂类代谢, 降低血脂和胆固醇[10,11]. 亦有不少研究表明, 益生菌改善脂类代谢, 降低血脂及胆固醇的作用尚有待进一步研究. Hashimoto等[12]发现含有干酪乳酸杆菌的食物可升高血液的高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)含量, Keim等[13]和Rossouw等[14]的研究却表明, 食用乳杆菌后人体内和猪体内的HDL-C不升反而有所降低. 此外, Fukushima等[15]报道对鼠予以乳酸杆菌和链球菌干预高脂动物模型对HDL-C作用不明显. 益生菌在肥胖研究中的矛盾差异, 是益生菌菌株的生物学特性, 还是与益生菌在肠道的分布及有效停留时间相关? 益生菌是否只在结肠密集, 特别是益生菌在肥胖肠道的分布及定植情况, 目前研究尚不清楚.
为此, 本实验择取了两株广泛应用的益生菌, 青春型双歧杆菌和发酵乳酸杆菌, 用5-(6-)羧基荧光素二乙酸琥珀酰亚胺酯(carboxyl fluorescein diacetate succinimidyl ester, CFDA-SE)分子探针标记[16,17], 研究其在肥胖大鼠肠道动力学情况. 以期明确益生菌在肠道分布、定植有无规律, 其分布与定植是益生菌固有的特性还是与肥胖等环境因素相关.
清洁级♂SD大鼠80只, 周龄3-4 wk, 质量60-70 g, 购于湖南农业大学东创实验动物科技公司, 24 ℃恒温恒湿, 12 h光照和12 h暗室清洁级动物饲养环境, 大鼠饮水经煮沸消毒, 饲料经60 ℃照射消毒. 肥胖饮食及基础饲料配方根据文献[18]自行配置, 由湖南东创实验动物有限公司制造. 青春型双歧杆菌丽珠肠乐, 国药准字S10960040号(96)卫药准字(珠)S-01号; 发酵乳酸杆菌M7-5[19], 康哲有限公司分离保存; CFDA- SE, 编号c1031, 购于长沙相宇生物有限公司.
1.2.1 分组及干预: SD大鼠适应性喂养1 wk后随机分为甲、乙组, 每组40只, 分组如下: 甲组(普饲组): 40只, 喂饲普通饲料, 乙组(肥胖组): 40只, 喂饲高脂饲料. 第8周末, 将甲组SD大鼠随机分为A、B两组, 乙组SD大鼠随机分为D、E两组, 每组20只. A组: 20只, 喂饲普通饲料, 第8周末灌喂标记的丽珠肠乐生态制剂1次. B组: 20只, 喂饲普通饲料, 第8周末灌喂标记的乳杆菌M7-5 1次. D组: 20只, 喂饲高脂饲料, 第8周末灌喂标记的丽珠肠乐生态制剂1次. E组: 20只, 喂饲高脂饲料, 第8周末灌喂标记的乳杆菌M7-5 1次.
1.2.2 动物喂养与造模: 所有大鼠专业人员清洁房内单笼饲养, 12 h光照, 12 h黑暗. 分组后, 甲组喂饲普通饲料, 乙组喂以高脂饲料. 每天下午喂食, 食量每鼠每天20 g, 自由饮水. 观察8 wk, 第8周乙组大鼠肥胖模型成模(248.77±13.03 vs 282.24±14.89, P<0.05).
1.2.3 细菌的培养及荧光标记: 发酵乳杆菌M7-5菌株于37 ℃ CO2培养箱培养箱复苏30 min后, 按3%接种于MAS液体培养基中, 37 ℃ CO2培养箱培养24 h, 3 000 g, 4 ℃条件下10 min离心收集菌体, 沉淀用灭菌的PBS缓冲液洗2次, 比浊法调整菌悬液终浓度至 1013 CFU/L备用. 双歧杆菌丽珠肠乐, 粉剂, 直接溶于灭菌PBS中, 3 000 g, 4 ℃条件下10 min离心收集菌体, 沉淀用灭菌的PBS缓冲液洗2次, 比浊法调整菌悬液终浓度至1013 CFU/L备用. CFDA-SE是一种酯化荧光素衍生物制备的分子探针, 能与细胞中脂肪氨基键合, 从而可以使荧光的消失率降低, 在细胞体内均匀分布, 且非常稳定, 不染色其他细胞, 不影响细胞活性. 目前已广泛应用于细胞分裂和细菌定植[20]. 按照试剂盒使用说明书取出试剂1管, 室温融化, 加入90 μL DMSO溶解, 取10 μL稀释至100 μL备用. 将制备好的荧光探针与菌体细胞等体积混合, 避光37 ℃温浴20 min; 离心终止荧光标记, 并用PBS缓冲液洗涤菌体两次以除去未与菌体结合的荧光染料, 菌体沉淀重悬于PBS缓冲液中, 调整菌悬液终浓度为1012 CFU/L. 经流式细胞仪检测, 显示99%细菌成功标记.
1.2.4 细菌灌喂: 第8周末的最后1 d, 4组大鼠禁食12 h, 灌喂给药1次, A、D组灌喂标记的双歧杆菌丽珠肠乐生态制剂菌悬液, 每只大鼠1012 CFU/L×4 mL, B、E组灌喂标记的乳酸杆菌M7-5悬液, 每只大鼠1012 CFU/L×4 mL.
1.2.5 大便排出情况: 灌喂后各组大鼠均喂饲普通饲料, 自由饮水. 从4组大鼠中各随机取出5只, 作为观察细菌大便情况. 0 h起, 于0, 2, 4, 8, 12, 24, 48, 72, 96 h, 甩尾各组大鼠, 主动取新鲜大便, 无菌称质量, 取0.1 g溶于1 mL灭菌PBS液中, 研磨制成悬浮液, 覆0.75%甲醛液, 避光保存. 取5 μL悬液于标准计数板上, 荧光镜下计数, 每次检3个视野, 重复3次, 取其平均值.
1.2.6 细菌肠道分布与定值: 4组各剩余的15只大鼠, 作为观察细菌在肠道分布与定值情况. 灌喂后各组大鼠喂饲普通饲料, 自由饮水, 2 h起, 于2, 4, 8, 12, 24 h, 每组大鼠脱颈处死3只, 无菌取出肠道, 按解剖位取十二指肠, 空场, 回肠, 结肠, 剪开肠壁, 用无菌棉签轻轻刮取内容物, 无菌称质量, 取0.1 g溶于1 mL灭菌PBS液中, 研磨制成悬浮液, 覆0.75%甲醛液, 避光保存. 无菌镊子剥取肠壁, 0.1 g溶于1 mL灭菌PBS液中, 研磨制成悬浮液, 覆0.75%甲醛液, 避光保存. 取5 μL悬液于标准计数板上, 荧光镜下计数, 每次检3个视野, 重复3次, 取其平均值.
统计学处理 用SPSS15.0统计软件包进行统计学分析, 数据测定值采用mean±SD表示. 各组间的差异比较采用方差分析, 两两比较采用最小显著差法, 参数相关分析采用Pearson相关检验, 取P<0.05为差异有统计学意义.
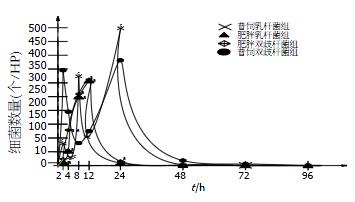
2.1.1 双歧杆菌在普饲与肥胖大鼠中细菌排出情况: 双歧杆菌在普饲与肥胖大鼠大便排出结果显示, 双歧杆菌在普饲大鼠中排出迅速, 存在两个细菌排出高峰, 分别为2和24 h, 两个高峰细菌排出量相当, 两者相比无统计学差异. 肥胖组细菌排出较慢, 呈逐渐上升趋势, 存在一个细菌排出高峰, 为12 h. 两组细菌在排出量及高峰时间均有统计学差异(表1, 图1).
| 时间 | 双歧杆菌 | 乳酸杆菌 | ||
| 普饲组 | 肥胖组 | 普饲组 | 肥胖组 | |
| 0 h | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 2 h | 346.00±45.61a | 19.60±3.85c | 80.00±14.14a | 14.80±3.70c |
| 4 h | 196.00±36.47a | 130.00±24.49ac | 36.00±7.71a | 58.20±8.01ac |
| 8 h | 83.20±13.16a | 259.60±39.00ac | 326.00±27.93a | 247.40±28.44ac |
| 12 h | 125.20±23.90a | 312.00±27.25ac | 104.00±11.40a | 314.00±21.91ac |
| 24 h | 382.00±40.87a | 16.80±8.32c | 492.00±17.89a | 7.40±3.85c |
| 48 h | 19.00±7.07 | 2.00±1.00 | 3.60±2.07 | 0.20±0.45 |
| 72 h | 6.00±3.32 | 0.40±0.55 | 1.60±1.14 | 0.20±0.45 |
| 96 h | 0.40±0.55a | 0.00±0.00 | 0.20±0.45 | 0.00±0.00 |
2.1.2 乳酸杆菌在普饲与肥胖大鼠中大便排出情况: 乳酸杆菌在普饲与肥胖大鼠中大便排出结果显示, 乳酸杆菌在普饲大鼠中排出较快, 存在1个小高峰1个大高峰, 分别为8、24 h. 第2高峰细菌排出量明显较第1高峰多, 两者有统计学意义. 肥胖组细菌排出较慢, 呈逐步上升趋势, 存在1个排出高峰, 为12 h. 两组细菌在排出量与高峰时间均不同, 有统计学差异(表1, 图1).
2.1.3 双歧杆菌与乳酸杆菌在普饲大鼠大便排出情况: 双歧杆菌与乳酸杆菌在普饲大鼠中大便排出结果显示, 双歧杆菌较乳杆菌排出更为迅速, 虽同样存在2个细菌排出高峰, 双歧杆菌波峰较乳酸杆菌前, 细菌排出峰呈"M"型, 乳酸杆菌则为1大1小两个高峰. 两者在细菌排出高峰的时段及同时段排出量均不同, 有统计学意义(表2, 图1).
| 部位 | 普饲组 | 肥胖组 | ||||||||
| 2 h | 4 h | 8 h | 12 h | 24 h | 2 h | 4 h | 8 h | 12 h | 24 h | |
| 十二指肠内 | 0.00±0.00 | 0.20±0.45 | 0.00±0.00 | 0.60±0.55 | 0.00±0.00 | 8.80±2.39cf | 3.20±1.30c | 0.00±0.00 | 13.60±1.95cf | 0.20±0.45 |
| 十二指肠壁 | 0.00±0.00 | 0.00±0.00 | 0.60±0.55 | 9.20±2.59c | 0.80±0.84 | 4.80±1.10cf | 2.40±0.89c | 0.60±0.55 | 4.20±1.10cf | 0.00±0.00 |
| 空肠内 | 0.80±0.84 | 8.80±1.64c | 0.20±0.45 | 20.40±1.52c | 0.20±0.45 | 100.00±11.86acf | 13.80±7.26c | 0.00±0.00 | 19.60±4.10c | 0.40±0.55 |
| 空肠壁 | 0.40±0.55 | 0.60±0.55 | 0.20±0.45 | 1.00±0.82 | 0.20±0.45 | 100.00±13.52acf | 4.80±1.64 | 1.60±1.52 | 24.00±9.46c | 0.60±0.55 |
| 回肠内 | 67.60±4.51ac | 7.80±4.02 | 14.80±3.83 | 25.67±19.24ac | 0.60±0.55 | 400.00±26.85acf | 332.00±43.82acf | 8.40±4.39 | 88.00±10.95acf | 1.80±1.48 |
| 回肠壁 | 13.60±2.88c | 11.60±2.30c | 7.20±1.92a | 3.80±1.30 | 0.40±0.55 | 62.80±10.13acf | 154.00±5.48acf | 52.00±6.67ac | 27.80±6.65cf | 1.20±1.10c |
| 结肠内 | 370.00±24.49ac | 264.00±16.73ac | 82.00±9.38ac | 122.00±24.90ac | 400.00±17.89ac | 25.80±2.49af | 140.00±14.14acf | 238.00±89.55ac | 396.00±8.94acf | 26.00±6.48af |
| 结肠壁 | 113.00±18.08ac | 250.00±18.71ac | 220.00±27.39ac | 150.00±14.14ac | 76.00±6.75ac | 7.60±1.95f | 94.00±16.73acf | 206.00±26.08ac | 100.00±9.82acf | 20.60±0.89af |
2.1.4 双歧杆菌与乳酸杆菌在肥胖大鼠大便排出情况: 双歧杆菌与乳酸杆菌在肥胖大鼠中的大便排出结果显示, 双歧杆菌、乳酸杆菌排出较慢, 均呈逐渐上升趋势, 仅一个细菌排出高峰, 为12 h, 且两者高峰无明显差异, 但双歧杆菌在4 h排出较乳酸杆菌多, 两者比较有统计学差异(表1, 图1).
2.2.1 双歧杆菌在普饲大鼠体内的分布情况: 双歧杆菌在普饲大鼠肠道分布结果显示, 双歧杆菌2 h主要集中在回肠末端及结肠, 以内容物为主, 4 h高度集中在结肠, 结肠内与肠壁分布大致相同. 随着细菌大量排出, 8 h结肠内细菌明显减少, 较前比较有统计学意义, 肠壁仍大量细菌, 较前无明显变化. 12 h时空肠、回肠内细菌较前增多, 24 h小肠极少细菌残留, 结肠内细菌大量增多, 结肠壁细菌较前明显减少, 较前均有统计学意义(表2).
2.2.2 双歧杆菌在肥胖大鼠肠道中的分布情况: 双歧杆菌在肥胖大鼠肠道的分布结果显示, 双歧杆菌2 h主要集中在小肠远端, 后随肠道运动不断推移进入结肠, 8 h后细菌主要集中在结肠, 小肠极少细菌. 12 h小肠段出现少许细菌, 结肠内细菌较前增多, 而肠壁细菌明显减少, 较前比较均有统计学差异; 24 h小肠段极少细菌残留, 结肠仅存少许细菌(表2).
2.2.3 乳酸杆菌在普饲大鼠肠道分布情况: 乳酸杆菌在普饲大鼠肠道的分布结果显示, 乳酸杆菌2 h主要集中在小肠远端, 随肠道运动细菌不断推进, 8 h主要集中在结肠, 以肠内容物为主, 后细菌大量排出肠道内细菌大量减少, 肠壁细菌无明显变化. 24 h结肠内细菌大量增多, 但肠壁细菌减少明显, 两者较前均有统计学意义(表3).
| 部位 | 普饲组 | 肥胖组 | ||||||||
| 2 h | 4 h | 8 h | 12 h | 24 h | 2 h | 4 h | 8 h | 12 h | 24 h | |
| 十二指肠内 | 0.00±0.00 | 22.20±2.79c | 0.00±0.00 | 0.60±0.89 | 0.00±0.00 | 23.60±4.16c | 12.20±4.38c | 0.40±0.55 | 0.00±0.00 | 0.00±0.00 |
| 十二指肠壁 | 0.00±0.00 | 60.20±2.17ac | 0.00±0.00 | 0.20±0.45 | 0.00±0.00 | 0.80±0.84 | 59.00±2.65ac | 0.00±0.00 | 0.40±0.55 | 0.00±0.00 |
| 空肠内 | 27.60±4.34ac | 48.20±2.49ac | 1.20±0.84 | 4.20±7.73 | 0.00±0.00 | 54.20±3.77acf | 11.20±2.39 | 26.00±3.81ac | 1.00±1.41 | 0.00±0.00 |
| 空肠壁 | 21.80±2.49ac | 9.00±1.58c | 8.40±2.70c | 0.00±0.00 | 0.60±0.55 | 10.20±0.84cf | 5.60±0.89 | 11.40±1.95ac | 0.40±0.55 | 0.00±0.00 |
| 回肠内 | 362.00±16.43ac | 304.00±16.73ac | 112.00±10.95ac | 7.00±3.79 | 42.60±7.50ac | 400.00±14.14ac | 308.00±10.95ac | 89.20±10.16acf | 0.20±0.45f | 0.40±0.55f |
| 回肠壁 | 200.00±16.74ac | 94.00±8.94ac | 57.20±3.70ac | 58.00±4.42ac | 7.00±1.58 | 200.00±12.36ac | 152.00±4.47ac | 17.00±4.24af | 10.20±2.77f | 0.60±0.55f |
| 结肠内 | 96.00±8.94ac | 82.80±8.32ac | 328.00±22.80ac | 132.00±16.43ac | 504.00±16.73ac | 54.00±4.24ac | 108.00±10.95ac | 296.00±8.94ac | 348.00±16.43acf | 21.20±1.30af |
| 结肠壁 | 74.00±37.15ac | 54.40±5.18c | 212.00±10.95ac | 208.00±10.95ac | 26.40±3.85a | 12.00±2.83 | 57.40±4.88acf | 208.00±10.95ac | 21.00±2.00af | 3.20±2.39af |
2.2.4 乳酸杆菌在肥胖大鼠肠道分布情况: 乳酸杆菌在肥胖大鼠肠道的分布结果显示, 乳酸杆菌2 h主要集中在回肠, 4 h细菌仍大部分集中在回肠, 结肠细菌较前增多, 以肠内容物为主, 较前有统计学差异. 随着肠道运动, 12 h肠道细菌高度集中在结肠, 以内容物为主, 肠壁细菌较前大量减少, 24 h结肠仅少许细菌存留, 肠壁极少细菌可见, 较前比较均有统计学差异(表3).
为明确益生菌在肠道的分布、定植及排出情况, 以及肥胖等环境因素是否对益生菌的肠道动力产生影响, 本实验研究了双歧、乳酸杆菌在大鼠大便排出及其在大鼠肠道分布、定植特点.
双歧、乳酸杆菌在大鼠大便排出实验表明: 在普饲条件下, 双歧、乳酸杆菌排出虽均呈双峰状, 然双歧杆菌较乳酸杆菌排出更快, 排出高峰较前, 且双歧杆菌排出两高峰呈"M"型, 两者排出情况明显不同; 而在肥胖组中, 两组细菌仅1个排出高峰, 细菌排出较慢, 排出量少. 目前国内外关于细菌排出的研究较少, 本实验细菌排出其时间间隔较大, 样本量较少, 肥胖与普饲组细菌排出高峰及排出曲线是否完全如此, 尚有待大样本, 密时段实验进一步验证. 就本实验所取时间段结果说明, 细菌排出有一定的特性, 不同的益生菌其排出规律不同; 肥胖可影响细菌的代谢, 使其排出延迟, 高峰推后, 细菌排出量减少, 其影响机制目前尚不清楚, 将于下一步实验继续探讨.
双歧、乳酸杆菌在大鼠肠道分布、定植实验表明, 双歧、乳酸杆菌在肠道的分布、定植情况各不相同, 双歧杆菌主要密集在结肠, 乳酸杆菌则能长时间停留在回肠及结肠. 双歧杆菌和乳酸杆菌是人体肠道最重要的生理性细菌, 被看做微生态学研究的核心, 对宿主发挥调节微生态平衡、抗病、改善人体代谢等多种生理作用, 两者的作用虽有相似点却不竟然相同. Bernet等[21], 郑跃杰等[22]的研究表明, 双歧杆菌在肠壁的黏附素是种糖蛋白, 各种糖类对双歧杆菌的黏附均有抑制作用, 因而双歧杆菌主要在结肠密集. 任邦哲[23]、王正根等[19]乳酸杆菌降胆固醇作用主要在回肠及近端结肠, 均与本研究结果相似. 可见益生菌的分布与定植是其固有的生物学特性, 不同的益生菌在肠道分布、定植情况不同, 其在肠道的分布、定植可能与其生理功能密切相关.
观察发现, 双歧、乳酸杆菌在肥胖组肠道分布、定植情况与普饲组明显不同. 肥胖组中, 双歧、乳酸杆菌在小肠内长时间停留, 同时段结肠壁细菌量较普饲组明显减少. 说明肥胖等环境因素对益生菌的分布、定植有一定的影响, 且肥胖对双歧杆菌的影响较乳酸杆菌明显. 其产生的机制可能为多方面的. 一方面, 肥胖个体的肠内细菌过度生长可能性较高. 肠道菌群可以产生和代谢乙醇[24,25]. 一方面, 肥胖改变了肠的运动性, 比如肥胖患者易患肠易激综合征和假性结肠梗阻[26,27]. 另一方面, 肥胖会改变肠道菌群结构和组成[28,29], 肥胖肠道黏膜不利于益生菌的黏附与定值. Vizoso Pinto等[30]对益生菌的分布、定植与其环境有关的研究结果与本实验结论相似.
以上说明, 不同的益生菌在肠道分布、定值及排出不同, 益生菌在肠道的分布、定植是其固有特性, 与其生理功能密切相关; 同菌株在不同的肠道环境分布、定植及排出不同, 肥胖对细菌肠道动力有明显的影响. 这提示, 使用益生菌改善肠道黏膜屏障[31]、调节物质代谢和治疗各种急慢性腹泻时[32], 选择恰当的益生菌株, 作用更精准, 效果更明显, 并有可能避免益生菌的滥用及可能引发细菌不良反应的发生; 同剂量给药, 肥胖人群可能每天2次才能维持肠道细菌较高浓度水平, 而普通人群可能每天1次即可维持高浓度水平.
还可以看出, 细菌的排出情况与其在肠道的分布、定植密切相关. 双歧、乳酸杆菌在普饲大鼠中, 主要集中在结肠, 细菌排出快; 肥胖组细菌则较长时间停留在小肠, 随肠道运动逐渐进入结肠, 细菌排出亦慢, 呈逐渐上升趋势. 观察发现, 结肠内细菌浓度与细菌排出量关系密切, 肠壁细菌浓度则与细菌排出持续时间及峰型更为相关. 结肠内细菌浓度越高, 细菌排出量越大, 肠壁细菌黏附越多其排出持续时间越长. 这是因为, 普饲组肠道运动性过快, 外来益生菌尚未能"抢占"空间, 有效黏附肠壁, 而肠道内细菌"超级大家族"[33]已达到饱和状态, 细菌便随肠内容迅速排出体外. 若环境允许, 时间足够, 益生菌则与肠道细胞发生作用, 黏附于肠壁[34]. 肥胖组肠道因运动性慢, 细菌过度生长, 肥胖所致肠道菌群及组成的变化, 不利于益生菌的黏附、复制与繁殖, 因而同时段肠壁细菌黏附较普通组少, 在体内增殖的量也少, 排出持续时间也就短. 这也解释了前面大鼠细菌排出, 普饲组排出快, 呈双峰状, 而肥胖组排出慢, 仅一个细菌排出高峰的结果. 也提示, 在使用益生菌改善脂类代谢、治疗其他疾病时, 长时间持续给药, 肠道才能保持较高的细菌浓度, 才可能有效地定植于肠道, 从而发挥其生理功能. 观察还发现, 同剂量活菌单次灌喂, 双歧杆菌较乳酸杆菌在肠道更易达高浓度水平, 提示在使用益生菌时, 双歧杆菌更应注意单次给药的剂量, 以防过高浓度易引发不良反应的发生.
研究发现, 双歧杆菌在大鼠体内12 h小肠上端意外出现少许细菌, 其原因目前不清, 可能为大鼠肠道细菌分布个体差异, 或细菌在食管、胃内黏附、定植, 后随食物消化, 肠道运动排入, 然乳酸杆菌却未有相同情况发生, 其具体机制, 尚有待进一步研究. 这也在另一方面再次证实, 不同的细菌其肠道分布、定植情况不同.
总之, 益生菌在肠道的动力学是其固有的特性, 不同的益生菌其肠道动力学不同, 双歧杆菌只在结肠密集, 乳酸杆菌则能长时间在结肠及回肠存留, 益生菌的分布、定植与其生理功能密切相关; 肥胖等环境因素对益生菌的分布、定植及排出有一定的影响, 其对不同的益生菌影响的大小不同, 对双歧杆菌的影响较乳酸杆菌明显; 普通人群较肥胖人群肠道环境可能更有利于益生菌的黏附与定植, 益生菌在普通人群更能有效发挥其生物学功能.
随着益生菌开发研究的深入, 益生菌在医学各个领域广泛应用. 益生菌能有效在肠道定植或长时间存留是发挥其生理功能的前提, 而益生菌的肠道动力学亦是其最根本的生物学特性, 明确益生菌肠道动力学, 将为益生菌的生物学作用提供新的依据和方向.
吴军, 研究员, 军事医学科学院生物工程研究所
肥胖及相关的代谢性疾病近年来已经成为威胁全球的公共健康问题. 应用益生菌治疗肥胖早已成为研究的一大热点.
Hashimoto等发现含有干酪乳酸杆菌的食物可升高血液的高密度脂蛋白胆固醇(HDL-C)含量, Keim等和Rossouw等的研究却表明, 食用乳杆菌后人体内和猪体内的HDL-C不升反而有所降低.
本实验显示,不同益生菌肠道动力不同, 益生菌的分布、定植与其生理功能密切相关, 治疗不同的疾病应选择最恰当的益生菌, 应用益生菌治疗疾病时, 同剂量给药, 肥胖人群可能每天2次才能维持肠道细菌较高浓度水平, 而普通人群可能每天1次即可维持高浓度水平. 双歧杆菌更易达肠道高浓度水平, 应注意单次给药浓度.
本文科学性较好, 为益生菌的研究工作奠定了实验基础.
编辑: 李薇 电编:何基才
| 1. | O'Toole PW, Cooney JC. Probiotic bacteria influence the composition and function of the intestinal microbiota. Interdiscip Perspect Infect Dis. 2008;2008:175285. [PubMed] |
| 2. | Alander M, De Smet I, Nollet L, Verstraete W, von Wright A, Mattila-Sandholm T. The effect of probiotic strains on the microbiota of the Simulator of the Human Intestinal Microbial Ecosystem (SHIME). Int J Food Microbiol. 1999;46:71-79. [PubMed] [DOI] |
| 3. | Britton RA, Versalovic J. Probiotics and gastrointestinal infections. Interdiscip Perspect Infect Dis. 2008;2008:290769. [PubMed] |
| 4. | Ooi LG, Liong MT. Cholesterol-lowering effects of probiotics and prebiotics: a review of in vivo and in vitro findings. Int J Mol Sci. 2010;11:2499-2522. [PubMed] [DOI] |
| 5. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718-15723. [PubMed] [DOI] |
| 6. | Towle HC. Glucose and cAMP: adversaries in the regulation of hepatic gene expression. Proc Natl Acad Sci U S A. 2001;98:13476-13478. [PubMed] [DOI] |
| 7. | Fagot-Campagna A, Saaddine JB, Flegal KM, Beckles GL. Diabetes, impaired fasting glucose, and elevated HbA1c in U.S. adolescents: the Third National Health and Nutrition Examination Survey. Diabetes Care. 2001;24:834-837. [PubMed] [DOI] |
| 8. | Pan WH, Flegal KM, Chang HY, Yeh WT, Yeh CJ, Lee WC. Body mass index and obesity-related metabolic disorders in Taiwanese and US whites and blacks: implications for definitions of overweight and obesity for Asians. Am J Clin Nutr. 2004;79:31-39. [PubMed] |
| 9. | Flegal KM, Williamson DF, Pamuk ER, Rosenberg HM. Estimating deaths attributable to obesity in the United States. Am J Public Health. 2004;94:1486-1489. [PubMed] [DOI] |
| 10. | Akalin AS, Gönç S, Düzel S. Influence of yogurt and acidophilus yogurt on serum cholesterol levels in mice. J Dairy Sci. 1997;80:2721-2725. [PubMed] [DOI] |
| 11. | Xiao JZ, Kondo S, Takahashi N, Miyaji K, Oshida K, Hiramatsu A, Iwatsuki K, Kokubo S, Hosono A. Effects of milk products fermented by Bifidobacterium longum on blood lipids in rats and healthy adult male volunteers. J Dairy Sci. 2003;86:2452-2461. [PubMed] [DOI] |
| 12. | Hashimoto H, Yamazaid K, He F, Kawase M, Hosoda M, Hosono A. Hypocholesterolemic effects of Lactobacillus casei subsp. casei TMC 0409 strain observed in rats fed cholesterol contained diets. Anim Sci. 1999;72:90-97. |
| 13. | Keim NL, Marlett JA, Amundsopn CH. The cholesterolemic effect of skim milk in young men consuming controlled diets. Nutr Res. 1981;1:422-429. [DOI] |
| 14. | Rossouw JE, Burger EM, Van der Vyver P, Ferreira JJ. The effect of skim milk, yoghurt, and full cream milk on human serum lipids. Am J Clin Nutr. 1981;34:351-356. [PubMed] |
| 15. | Fukushima M, Nakano M. Effects of a mixture of organisms, Lactobacillus acidophilus or Streptococcus faecalis on cholesterol metabolism in rats fed on a fat- and cholesterol-enriched diet. Br J Nutr. 1996;76:857-867. [PubMed] [DOI] |
| 17. | Lee YK, Ho PS, Low CS, Arvilommi H, Salminen S. Permanent colonization by Lactobacillus casei is hindered by the low rate of cell division in mouse gut. Appl Environ Microbiol. 2004;70:670-674. [PubMed] [DOI] |
| 18. | 徐 叔云, 卞 如濂, 陈 修. 药理实验方法学. 第3版. 北京: 人卫出版社 2003; 189-190. |
| 20. | Hoefel D, Grooby WL, Monis PT, Andrews S, Saint CP. A comparative study of carboxyfluorescein diacetate and carboxyfluorescein diacetate succinimidyl ester as indicators of bacterial activity. J Microbiol Methods. 2003;52:379-388. [PubMed] [DOI] |
| 21. | Bernet MF, Brassart D, Neeser JR, Servin AL. Adhesion of human bifidobacterial strains to cultured human intestinal epithelial cells and inhibition of enteropathogen-cell interactions. Appl Environ Microbiol. 1993;59:4121-4128. [PubMed] |
| 22. | 郑 跃杰, 潘 令嘉, 王 立生, 周 殿元, 郭 立安, 闫 哲. 双歧杆菌粘附素的提纯. 中华微生物学和免疫学杂志. 1999;19:196. |
| 23. | 任 邦哲. 生物化学与临床医学. 长沙: 湖南科学技术出版社 1992; 202-206. |
| 24. | Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980;55:434-438. [PubMed] |
| 25. | Nosova T, Jokelainen K, Kaihovaara P, Jousimies-Somer H, Siitonen A, Heine R, Salaspuro M. Aldehyde dehydrogenase activity and acetate production by aerobic bacteria representing the normal flora of human large intestine. Alcohol Alcohol. 1996;31:555-564. [PubMed] |
| 26. | Crowell MD, Cheskin LJ, Musial F. Prevalence of gastrointestinal symptoms in obese and normal weight binge eaters. Am J Gastroenterol. 1994;89:387-391. [PubMed] |
| 27. | O'Malley KJ, Flechner SM, Kapoor A, Rhodes RA, Modlin CS, Goldfarb DA, Novick AC. Acute colonic pseudo-obstruction (Ogilvie's syndrome) after renal transplantation. Am J Surg. 1999;177:492-496. [PubMed] [DOI] |
| 28. | Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Obesity alters gut microbial ecology. Proc Natl Acad Sci U S A. 2005;102:11070-11075. [PubMed] [DOI] |
| 29. | Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity. Nature. 2006;444:1022-1023. [PubMed] [DOI] |
| 30. | Vizoso Pinto MG, Schuster T, Briviba K, Watzl B, Holzapfel WH, Franz CM. Adhesive and chemokine stimulatory properties of potentially probiotic Lactobacillus strains. J Food Prot. 2007;70:125-134. [PubMed] |