修回日期: 2010-10-15
接受日期: 2010-10-18
在线出版日期: 2010-12-08
目的: 比较零下非结冰(-0.8 ℃)UW液、Celsior液和HTK液保存生物人工肝用L-02细胞的效果.
方法: 将制备好的L-02细胞悬液分成以下3组: UW液保存组(UW液组); Celsior液保存组(CS液组); HTK液保存组(HTK液组). 各组细胞于-0.8 ℃低温保存72 h后, 分别使用流式细胞术测定细胞存活率及死亡率, 谷丙转氨酶(ALT)及乳酸脱氢酶(LDH)释放, 尿素合成功能及白蛋白分泌功能.
结果: UW液较Celsior液和HTK液显著提高了零下非结冰保存72 h的L-02细胞的存活率(71.10%±4.09% vs 65.22%±4.45%, 50.48% ±5.13%, 均P<0.05); 降低了细胞死亡率(29.90%±4.09% vs 34.78%±4.45%, 49.52%±5.13%, 均P<0.05); 抑制了ALT(6.18 U/L±1.36U/L vs 8.15 U/L±1.14 U/L, 9.75 U/L±2.45U/L, 均P<0.05)和LDH(93.82 U/L±5.68U/L vs 115.67 U/L±8.77 U/L, 164.92 U/L±15.95 U/L, 均P<0.05)释放; 更好地维持了L-02细胞尿素合成功能(1.08 mmol/L±0.22 mmol/L vs0.92 mmol/L±0.17 mmol/L, 0.68 mmol/L±0.08 mmol/L, 均P<0.05)和白蛋白分泌功能(9.33 mg/L±1.36 mg/L vs 7.54 mg/L ±1.22 mmol/L, 7.18 mg/L±0.93 mg/L, 均P<0.05).
结论: 同Celsior液和HTK液相比, 使用UW液零下非结冰(-0.8 ℃)保存肝细胞可以明显提高复温后细胞存活率, 降低低温损伤引起的ALT、LDH释放, 有效保护肝细胞尿素合成功能和白蛋白分泌功能.
引文著录: 李运田, 李庆勇, 张清华, 沙杭, 杜大勇, 马建新, 柳杨, 王芳, 黄海, 高毅. UW液、Celsior液和HTK液零下非结冰保存生物人工肝用L-02细胞的效果比较. 世界华人消化杂志 2010; 18(34): 3679-3684
Revised: October 15, 2010
Accepted: October 18, 2010
Published online: December 8, 2010
AIM: To compare the biological features of L-02 hepatocytes undergoing subzero nonfreezing storage in University of Wisconsin (UW) solution, Celsior solution, and histidine-tryptophan-ketoglutarate (HTK) solution for use in bioartificial liver system.
METHODS: L-02 hepatocytes were divided into three groups: UW group, CS group, and HTK group. After 72 h of hypothermic storage, cell viability and death, alanine aminotransferase (ALT) and lactate dehydrogenase (LDH) release, and the ability of hepatocytes to synthesize urea and secrete albumin were measured.
RESULTS: After 72 h of hypothermic storage, cells of the UW group had higher cell viability rate (71.10% ± 4.09% vs 65.22% ± 4.45%, 50.48% ± 5.13%, both P < 0.05), lower cell death rate (29.90% ± 4.09% vs 34.78% ± 4.45%, 49.52% ± 5.13%, both P < 0.05), less release of ALT (6.18 U/L ± 1.36 U/L vs 8.15 U/L ± 1.14 U/L, 9.75 U/L ± 2.45 U/L, both P < 0.05) and LDH (93.82 U/L ± 5.68U/L vs 115.67 U/L ± 8.77 U/L, 164.92 U/L ± 15.95 U/L, both P < 0.05), and better ability to synthesize urea (1.08 mmol/L ± 0.22 mmol/L vs 0.92 mmol/L ± 0.17 mmol/L, 0.68 mmol/L ± 0.08 mmol/L, both P < 0.05) and secrete albumin (9.33 mg/L ± 1.36 mg/L vs 7.54 mg/L ± 1.22 mg/L, 7.18 mg/L ± 0.93 mg/L, both P < 0.05) than those of the CS and HTK groups.
CONCLUSION: L-02 hepatocytes undergoing subzero nonfreezing storage in UW solution could provide higher cell viability rate, lower ALT and LDH release, and better ability to synthesize urea and secrete albumin than those stored in CS or HTK solution.
- Citation: Li YT, Li QY, Zhang QH, Sha H, Du DY, Ma JX, Liu Y, Wang F, Huang H, Gao Y. Comparison of biological features of L-02 hepatocytes undergoing subzero nonfreezing storage in UW solution, Celsior solution or HTK solution for use in bioartificial liver system. Shijie Huaren Xiaohua Zazhi 2010; 18(34): 3679-3684
- URL: https://www.wjgnet.com/1009-3079/full/v18/i34/3679.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i34.3679
大量功能好且能够快速应用临床的肝细胞是生物人工肝支持系统(bioartificial liver support system, BALSS)的核心, 因此探索出一种可靠的肝细胞低温保存方法, 建立一个"血库样"(ready to use)肝细胞库是BALSS推广的基础[1]. 温度是影响保存效果的关键因素, 温度越低, 细胞代谢活性越低, 一般而言保存时间就越长[2]. 零下非结冰温度(subzero nonfreezing temperature, SZNFT)是指0 ℃到溶液冰点之间的温度范围, 一方面可以避免"冰晶形成"、"渗透性休克"等冻存损伤, 另一方面可使代谢降至最低, 保存效果优于常规4 ℃及0 ℃[3,4]. UW液(university of wisconsin solution)、CS液(celsior solution)和HTK液(histidine-tryptophan-ketoglutarate solution)是目前较常用的供肝保存液, 但供肝的保存混杂有缺血再灌注损伤的影响, 不能完全反应对肝细胞的保存效果[5]. L-02细胞是国内构建的一种永生化肝细胞株, 具备增殖迅速、传代稳定和氨基清除等功能, 已有学者用其进行BALSS的基础研究[6]. 因此, 本文分别采用UW液、Celsior液和HTK液零下非结冰保存生物人工肝用L-02细胞72 h, 以比较UW液、Celsior液和HTK液的保存效果.
L-02永生化肝细胞株(中国医学科学院); DMEM/F-12培养基、优级胎牛血清(FBS)、青霉素/链霉素溶液(×100)、0.25%胰酶及PBS缓冲液(Invitrogen, 美国); UW液(Bristol-Myers Squibb); 50 mL培养瓶、6孔培养板(Costar Corning); 氯化铵(Sigma); 人白蛋白ELISA试剂盒(R&D, 美国), Mode1450型酶标仪(Bio-Rad, 美国); CK2型倒置显微镜(Olympus, 日本); Live/Dead试剂盒(Invitrogen, 美国); DXC800型全自动生化仪及FACScan型流式细胞仪(Beckman coulter, 美国); MIR-151型微电脑程控低温培养箱[(-10 ℃至60 ℃±0.1 ℃]及MCO-175型二氧化碳培养箱(SANYO, 日本); 海尔智能温度记录仪[(-100 ℃至120 ℃)±0.1 ℃]. 超净工作台(北京昌平长城空气净化工程公司).
1.2.1 分组: L-02细胞悬液分3组: UW液保存组(UW液组); Celsior液保存组(CS液组); HTK液保存组(HTK液组).
1.2.2 细胞培养: 取L-02细胞约1×106个, 接种到50 mL培养瓶, 所用培养基为DMEM/F-12加10% FBS; 将培养瓶置于37 ℃、50 mL/L CO2、100%湿度的培养箱内培养; 每24 h换液1次, 倒置显微镜观察直至内壁长满.
1.2.3 低温保存及复温: 倾去培养瓶内的培养基, PBS液洗涤3次后分别置换为5 mL UW液、Celsior液和HTK液, 于-0.8 ℃保存72 h后, 将保存液液置换为培养基5 mL, 培养30 min.
1.2.4 复温后指标测定: 取一瓶细胞, 吸除培养基, 2.5 g/L胰酶消化, 制备成浓度约1×109/L细胞悬液. (1)取细胞悬液1 mL, 加到1 mL含4 mmol/L氯化铵培养液的6孔培养板中, 培养箱内培养24 h后, 取上清, 1 000 r/min, 离心20 min, 测定尿素的浓度、乳酸脱氢酶(alanine aminotransferase, LDH)与谷丙转氨酶(alanine aminotransferase, ALT)浓度, 人白蛋白含量(按人白蛋白ELISA试剂盒说明. (2)剩余的细胞悬液于1 000 r/min, 离心2 min, 沉淀细胞按Live/Dead试剂盒说明, 于流式细胞仪测定细胞存活率、死亡率.
统计学处理 所有计量资料以mean±SD表示. 采用SPSS13.0软件分析, 不同组样本均数比较采用One-way ANOVA, 多重比较采用LSD检验(方差不齐时采用Dunnett's T3检验), P<0.05有统计学差异.
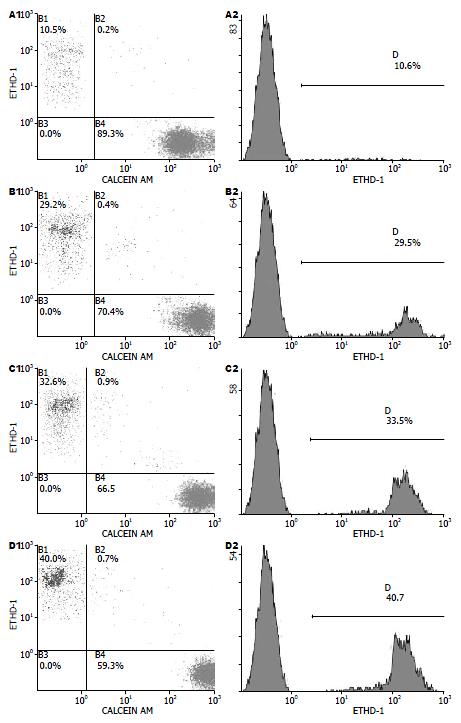
新鲜细胞的存活率是89.33%±2.64%, 死亡率是10.67%±2.64%. 低温保存72 h后, 细胞存活率较新鲜细胞降低, UW液组细胞存活率显著高于CS液组和HTK液组(P<0.001); 细胞死亡率较新鲜细胞增加, UW液组细胞死亡率显著低于CS液组和HTK液组(P<0.001, 表1, 图1).
新鲜细胞释放的ALT是3.93 U/L±1.04 U/L, LDH是44.00 U/L±5.72 U/L. 低温保存72 h后, 细胞ALT释放及LDH释放较新鲜细胞增加, 但UW液组ALT及LDH释放均显著低于CS液组和HTK液组(P<0.001, 表2).
新鲜细胞尿素合成是2.60 mmol/L±0.56 mmol/L, 白蛋白分泌是12.21 mg/L±1.68 mg/L. 低温保存72 h后, 细胞尿素合成功能下降, 但UW液组尿素合成功能优于HTK液组(P<0.001), 同CS液组无差别(P = 0.358); 细胞白蛋白分泌功能下降, 但UW液组白蛋白分泌优于CS液组与HTK液组(P<0.05), CS液组与HTK液组无差别(P = 0.618, 表3).
目前肝细胞低温保存分为-196 ℃深低温冻存(cryopreservation)和4 ℃常规低温保存(hypothermic preservation)两大类. 深低温具有保存时间长、适用性强等优点, 但"细胞内冰晶形成"及"渗透性休克"是深低温冻存无法逾越的障碍[1], 4 ℃常规低温保存具有易取易用、操作简单等优点, 但4 ℃保存48 h后细胞存活率明显下降. 为获得较高的细胞存活率及延长低温保存时间, 研究者开始把肝细胞低温保存转向SZNFT[7]. 不同溶液的SZNFT不同, 蒸馏水的为0 ℃, UW液、CS液及HTK液的为0 ℃-1 ℃[3,4]. UW液和Celsior液和HTK液是目前应用最广泛的器官保存液, 其中UW液是肝移植中广泛使用的保存液, 是器官保存液的"金标准"[8], 但UW液费用昂贵. 而CS液和HTK液最初为心脏保存设计, 价格相对便宜, 目前也广泛应用腹部脏器的保存. 本研究分别采用UW液、CS液和HTK液零下非结冰保存(-0.8 ℃)生物人工肝用L-02细胞72 h, 使用流式细胞仪分析发现UW液组细胞存活率显著高于CS液组和HTK液组, 细胞死亡率则相反; 同时发现UW液组的反应细胞损伤程度的ALT和LDH释放显著低于CS液组和HTK液组; UW液组的肝细胞尿素合成功能和白蛋白分泌功能优于Celsior液组和HTK液组, 具体可能的原因分析如下.
从离子角度分析UW液是一种低钠高钾含少量镁离子和不含钙氯离子的细胞内液型保存液, 渗透压是320 mosm/L; CS液是一种高钠低钾含少量镁离子和少量钙氯离子的细胞外液性保存液, 渗透压是310 mosm/L; 而HTK液是一种低钠稍高含少量镁离子和少量钙氯离子的等渗性保存液, 渗透压是320 mosm/L. K+是细胞内主要的主要阳离子, 对细胞的酸碱平衡状态和细胞代谢有很大的影响, 细胞主要依靠膜上的Na+-K+-ATP酶来维持细胞内Na+-K+的平衡, 低温保存过程中往往伴有细胞内K+的丢失, 因此适当提高低温保存液K+浓度, 可能对复苏后细胞功能的改善有重要的作用[9]. Na+是细胞外的主要阳离子, 但保存液中Na+过高一方面可以起Na+内流增加导致细胞水肿, 同时细胞内高Na+可以引起Na+/Ca2+交换增加, 细胞内Ca2+增加, 引起低温保存时细胞凋亡. 而适量添加Mg2+则可以抑制细胞内Ca2+超载, 减轻细胞凋亡的发生[9], 细胞外高钙则同样促进细胞凋亡的发生. 综上UW液的离子成分可能更适宜肝细胞的低温保存.
从渗透压成分分析UW液中添加了羟乙基淀粉、密三糖和乳糖醛酸等非渗透性保护剂, 而CS液和HTK液以甘露醇为非渗透性保护剂, 另外CS液含有乳糖醛酸. 羟乙基淀粉、低分子右旋糖酐和甘露醇等是比较常用的非渗透性保护剂, 具体保护机制目前仍然不明确, 可能是与冻存过程中减少细胞内冰晶形成及复苏时减轻由于渗透压改变引起的细胞肿胀有关. 另外大量的研究显示低温保存液中添加膜稳定剂糖类物质可提高复温后肝细胞存活率: (1)Miyamoto等[10]发现在冻存介质中添加葡萄糖(单糖)、海藻糖(双糖)、麦芽糖(三糖)或者长链糖均可明显提高复温后肝细胞的存活率, 减轻肝细胞冻存损伤; (2)海藻糖是一种双糖, Katenz等[11]在10% DMSO基础上添加不同浓度的海藻糖-156 ℃冻存原代人肝细胞7 d, 结果显示: 同单用10% DMSO相比, 添加海藻糖可以明显提高复苏后肝细胞存活率(62.9%±13% vs 46.9%±11%, P<0.01), 更好的维持白蛋白分泌、尿素合成能力及Ⅰ相、Ⅱ相细胞代谢能力, 降低LDH、AST释放, 海藻糖的最合适浓度是0.2 mmol/L; (3)Sasnoor等[12]在10% DMSO基础上分别添加海藻糖和抗氧化剂过氧化氢酶于-80 ℃或者-196 ℃冻存人胎肝细胞发现: 海藻糖和过氧化氢酶均明显提高了冻存复苏后肝细胞的存活率及生物转化功能, 而且两者于-196 ℃可产生协同作用, -80 ℃未观察到协同效应. 总之, UW液中联合应用羟乙基淀粉、密三糖和乳糖醛酸等非渗透性保护剂同CS液和HTK液相比可能更适合肝细胞的低温保存.
从缓冲系统分析分析UW液以磷酸盐为缓冲系统来防止细胞酸中毒, UW液的pH值为7.4; 而CS液和HTK液则加入了强有力的酸碱缓冲系统-组氨酸缓冲系统, 其中CS液的组氨酸含量较低同时含有OH-以防止细胞细胞内酸中毒, CS液和HTK液的pH值分别为7.3、7.2; 尽管组氨酸有强大的缓冲能力, 可以有效地减轻H+的聚集, 解除糖酵解的抑制, 使ATP和乳酸有较大的生成率, 但Bahde等[13]发现使用HTK液低温保存鼠肝, 复温后因大量氧自由基产生, 可引起大量大量肝细胞凋亡. 而组氨酸则增加肝细胞凋亡的发生, 通过减少组氨酸含量, 使用N-乙酰组氨酸替代优化HTK液可明显减轻肝细胞的凋亡指数. 因此CS液和HTK液的强大酸碱缓冲系统-组氨酸缓冲系统可能并不是很适宜肝细胞的低温保存, 而且pH值提示溶液偏酸性.
从抗氧化剂和能量底物分析, UW液含谷胱甘肽及别嘌呤醇等抗氧化剂, 以ADP为能量底物; CS液含谷胱甘肽, 以谷氨酸为能量底物; HTK液无抗氧化剂, 以α-酮戊二酸、色氨酸为能量底物. 大量研究发现, 在低温保存液添加生物抗氧化剂[14](如还原性谷胱甘肽[15], 氮乙酰半胱氨酸[9], 过氧化氢酶[12]等),可以提高冻存肝细胞存活率, 减轻低温保存复温后大量氧自由基生成引起的细胞凋亡. UW液、CS液及HTK液的能量底物更有特点: UW液以直接的能量底物ADP得形成提供细胞所需的ATP; CS液以谷氨酸为能量底物; HTK液以三羧酸循环中的中间产物α-酮戊二酸, 同时色氨酸为尼克酰胺核苷酸辅酶的前体, 两者可以促进肝细胞低温保存时通过三羧酸循环合成ATP. 3种保存液的能量底物有无差别尚待进一步的研究. 总之, UW液、CS液含有抗氧化的还原性谷胱甘肽可能系对肝细胞的低温保存效果优于HTK液的原因.
总之, 同CS液和HTK液相比, 使用UW液零下非结冰(-0.8 ℃)保存肝细胞可以明显的提高复温后细胞存活率, 降低低温损伤引起的ALT、LDH释放, 有效的保护肝细胞尿素合成功能和白蛋白分泌功能. 采用零下非结冰保存肝细胞, 建立一个"血库样"(ready to use)肝细胞库, 可以有效地促进BLASS的发展.
目前肝功能衰竭病死率高达80%, 而生物人工肝的发展为肝衰竭的治疗提供了新的途径, 通过人工肝支持, 一方面可使可逆肝衰竭患者正常肝细胞再生恢复肝功能, 另一方面可为不可逆肝衰竭患者最终的肝移植赢得宝贵的供肝时间.
郑素军, 副主任医师, 首都医科大学附属北京佑安医院人工肝中心
Miyamoto等发现在冻存介质中添加葡萄糖(单糖)、海藻糖(双糖)、麦芽糖(三糖)或者长链糖均可明显提高复温后肝细胞的存活率, 减轻肝细胞冻存损伤.
本文首次比较了UW液、CS液及HTK液采用零下非结冰温度(-0.8 ℃)保存生物人工肝用L-02细胞的效果.
Celsior液和HTK液相比, 使用UW液零下非结冰(-0.8 ℃)保存肝细胞可以明显地提高复温后细胞存活率, 降低低温损伤引起的ALT、LDH释放, 有效的保护肝细胞尿素合成功能和白蛋白分泌功能.
本文选题较好, 有一定的临床应用参考价值.
编辑: 李薇 电编:何基才
| 1. | Fiegel HC, Kaufmann PM, Bruns H, Kluth D, Horch RE, Vacanti JP, Kneser U. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory. J Cell Mol Med. 2008;12:56-66. [PubMed] [DOI] |
| 2. | Llarrull MS, Pizarro MD, Scandizzi AL, Bottai H, Guibert EE, Rodriguez JV. Cold preservation of isolated hepatocytes in UW solution: experimental studies on the respiratory activity at 0 degrees C. Cryo Letters. 2007;28:313-328. [PubMed] |
| 3. | Guibert EE, Almada LL, Mamprin ME, Bellarosa C, Pizarro MD, Tiribelli C, Rodriguez JV. Subzero nonfreezing storage of rat hepatocytes using UW solution and 1,4-butanediol. II- functional testing on rewarming and gene expression of urea cycle enzymes. Ann Hepatol. 2009;8:129-133. [PubMed] |
| 4. | 李 庆勇, 张 清华, 蒋 知新, 沙 杭, 林 虎, 李 安全, 龙 炫辉, 高 毅. 生物人工肝用C3A细胞在零下非结冰时的保存. 世界华人消化杂志. 2010;18:428-436. [DOI] |
| 5. | Ambros JT, Herrero-Fresneda I, Borau OG, Boira JM. Ischemic preconditioning in solid organ transplantation: from experimental to clinics. Transpl Int. 2007;20:219-229. [PubMed] [DOI] |
| 7. | Rodríguez JV, Almada LL, Mamprin ME, Guibert EE, Furno G. Subzero nonfreezing storage of rat hepatocytes using modified University of Wisconsin solution (mUW) and 1,4-butanediol. I- effects on cellular metabolites during cold storage. Ann Hepatol. 2009;8:57-62. [PubMed] |
| 8. | Cavallari A, Cillo U, Nardo B, Filipponi F, Gringeri E, Montalti R, Vistoli F, D'amico F, Faenza A, Mosca F. A multicenter pilot prospective study comparing Celsior and University of Wisconsin preserving solutions for use in liver transplantation. Liver Transpl. 2003;9:814-821. [PubMed] [DOI] |
| 9. | Martin H, Abadie C, Heyd B, Mantion G, Richert L, Berthelot A. N-acetylcysteine partially reverses oxidative stress and apoptosis exacerbated by Mg-deficiency culturing conditions in primary cultures of rat and human hepatocytes. J Am Coll Nutr. 2006;25:363-369. [PubMed] |
| 10. | Miyamoto Y, Suzuki S, Nomura K, Enosawa S. Improvement of hepatocyte viability after cryopreservation by supplementation of long-chain oligosaccharide in the freezing medium in rats and humans. Cell Transplant. 2006;15:911-919. [PubMed] [DOI] |
| 11. | Katenz E, Vondran FW, Schwartlander R, Pless G, Gong X, Cheng X, Neuhaus P, Sauer IM. Cryopreservation of primary human hepatocytes: the benefit of trehalose as an additional cryoprotective agent. Liver Transpl. 2007;13:38-45. [PubMed] [DOI] |
| 12. | Sasnoor LM, Kale VP, Limaye LS. Supplementation of conventional freezing medium with a combination of catalase and trehalose results in better protection of surface molecules and functionality of hematopoietic cells. J Hematother Stem Cell Res. 2003;12:553-564. [PubMed] [DOI] |
| 13. | Bahde R, Palmes D, Gemsa O, Minin E, Stratmann U, de Groot H, Rauen U, Spiegel HU. Attenuated cold storage injury of rat livers using a modified HTK solution. J Surg Res. 2008;146:49-56. [PubMed] [DOI] |
| 14. | Guha M, Kumar S, Choubey V, Maity P, Bandyopadhyay U. Apoptosis in liver during malaria: role of oxidative stress and implication of mitochondrial pathway. FASEB J. 2006;20:1224-1226. [PubMed] [DOI] |
| 15. | Stevenson DJ, Morgan C, McLellan LI, Helen Grant M. Reduced glutathione levels and expression of the enzymes of glutathione synthesis in cryopreserved hepatocyte monolayer cultures. Toxicol In Vitro. 2007;21:527-532. [PubMed] [DOI] |