修回日期: 2010-11-10
接受日期: 2010-11-17
在线出版日期: 2010-12-08
目的: 探讨Barrett's食管(BE)、食管腺癌(EADC)和食管鳞癌(ESCC)中趋化因子受体4(CXCR4)和趋化因子受体7(CCR7)表达的临床意义.
方法: 应用免疫组织化学SP法对56例正常食管黏膜、80例BE(含22例BE伴多灶性非典型增生)、25例EADC和48例ESCC中的CXCR4和CCR7的表达进行检测, 运用免疫组织化学图像分析加以定量, 然后进行统计学分析.
结果: CXCR4和CCR7在BE、EADC和ESCC中的表达均显著高于正常食管黏膜组织(CXCR4: 78.75%, 68.00%, 83.33% vs 39.29%; CCR7: 60.00%, 60.00%, 58.33% vs 30.36%; 均P<0.01); CXCR4和CCR7的表达在BE、EADC和ESCC这3类食管病理类型中的表达无差异; CXCR4的表达在BE和ESCC中均显著高于CCR7(P<0.05, P<0.01). 并且CXCR4和CCR7的表达差异与临床病理特征有一定关系; CXCR4和CCR7在BE、EADC和ESCC的表达与性别、年龄、病变发生位置均无关; CXCR4和CCR7的表达在BE无非典型增生和BE伴多灶性非典型增生这两类组织样本中无差异; CXCR4和CCR7在中-低分化EADC中的表达较高分化, 以及有淋巴结转移较无淋巴结转移均显著升高(P<0.05); CXCR4和CCR7在ESCC中的表达水平在肿瘤TNM分期的Ⅲ-Ⅳ级较Ⅰ-Ⅱ级以及有淋巴结转移较无淋巴结转移均显著升高(P<0.05), 中-低分化较高分化则极显著升高(P<0.01). BE无非典型增生、BE伴多灶性非典型增生和EADC组织中CXCR4的表达与CCR7的表达呈明显的正相关(r = 0.456, r = 0.652, r = 0.490), 而在ESCC中CXCR4的表达与CCR7的表达无相关性(r = 0.076).
结论: 联合检测CXCR4和CCR7有助于更准确诊断BE、EADC和ESCC; CXCR4和CCR7高表达是EADC和ESCC具有较强浸润和转移潜能的重要标志; CXCR4和CCR7可能共同参与了从BE到EADC的发展过程.
引文著录: 唐慧, 张超, 李琳, 严新民, 郭强. CXCR4和CCR7在Barrett's食管、食管腺癌和食管鳞癌中的表达及其临床意义. 世界华人消化杂志 2010; 18(34): 3632-3639
Revised: November 10, 2010
Accepted: November 17, 2010
Published online: December 8, 2010
AIM: To detect the expression of CXC chemokine receptor 4 (CXCR4) and CC chemokine receptor 7 (CCR7) in normal esophageal mucosa, Barrett's esophagus (BE), esophageal adenocarcinoma (EADC), and esophageal squamous cell carcinoma (ESCC), and to investigate their clinical significance.
METHODS: The expression of CXCR4 and CCR7 in 56 normal esophageal mucosal specimens, 80 BE specimens (including 22 cases of BE with multifocal atypical hyperplasia), 25 EADC specimens, and 48 ESCC specimens was examined by immunohistochemistry. The expression levels of CXCR4 and CCR7 were then quantified and analyzed statistically.
RESULTS: The positive expression rates of CXCR4 and CCR7 in BE, EADC and ESCC were significantly higher than those in normal esophageal mucosa (CXCR4: 78.75%, 68.00%, 83.33% vs 39.29%; CCR7: 60.00%, 60.00%, 58.33% vs 30.36%; all P< 0.01). However, there were no significant differences in the positive expression rates of CXCR4 and CCR7 among BE, EADC and ESCC. The positive expression rates of CXCR4 were significantly higher than those of CCR7 in both BE and ESCC (P < 0.05 and 0.01). CXCR4 and CCR7 expression was not associated with gender, age, and lesion site in BE, EADC and ESCC, but correlated with tumor differentiation and lymph node metastasis in EADC (both P < 0.05) and TNM stage, lymph node metastasis, and differentiation in ESCC (all P < 0.05). A significant correlation was noted between CXCR4 and CCR7 expression in BE and EADC (r = 0.262, 0.490), but not in ESCC (r = 0.076).
CONCLUSION: Combined detection of CXCR4 and CCR7 expression may contribute to more accurate diagnosis of BE, EADC and ESCC. High expression levels of CXCR4 and CCR7 can be used as important parameters for evaluating tumor invasion and metastasis in both EADC and ESCC.
- Citation: Tang H, Zhang C, Li L, Yan XM, Guo Q. Clinical significance of CXCR4 and CCR7 expression in Barrett's esophagus, esophageal adenocarcinoma and esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(34): 3632-3639
- URL: https://www.wjgnet.com/1009-3079/full/v18/i34/3632.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i34.3632
食管癌是一类发病率高并且预后极差的恶性肿瘤. 我国属于食管癌高发区, 其中90%以上是食管鳞癌(esophageal squamous cell carcinoma, ESCC), 食管腺癌(esophageal adenocarcinoma carcinoma, EADC)的发病率较低, 约占10%. 但近年来, EADC的发病率增加迅速, 已成为发病率上升速度最快的恶性肿瘤[1]. 并且, 确诊后的EADC预后极差, 其5年期生存率与就诊时疾病的严重程度直接相关, 晚期确诊患者的5年期生存率仅为10%-15%, 如能早期诊断则可高达83%-90%. Barrett's食管(Barrett's esophagus, BE)是指食管下段正常的复层鳞状上皮被单层柱状上皮替代的一种病理现象. 前瞻性的研究表明绝大多数EADC伴有BE, 食管下段EADC起源于肠上皮化生的腺上皮, 从组织学上明确了BE-BE伴非典型增生-EADC的发生顺序[2,3]. 因此, BE被公认为是EADC的癌前病变[4,5], 而早期发现和切除癌前病变组织将有助于降低EADC的发病率和死亡率[6].
趋化因子受体(chemokine receptor)是表达在一些特定细胞表面的7跨膜域受体, 属于G蛋白偶联受体(G protein-coupled receptor, GPCR)超家族. 其家族成员可分为4种类型, 即CR、CCR、CXCR和CX3CR[7]. 近年来的研究发现, 众多肿瘤细胞均可表达趋化因子受体, 并在相应的趋化因子作用下, 出现定向趋化运动, 最终导致肿瘤的浸润和转移. 目前研究已证实趋化因子受体4(CXC chemokine receptor 4, CXCR4)和7(chemokine receptor 7, CCR7)在多种肿瘤中存在过度表达, 表明这两种趋化因子受体与肿瘤的发生发展、浸润和转移均密切相关[8].
目前国内外对CXCR4和CCR7在ESCC中表达情况的报道显示, CXCR4和CCR7的高表达与ESCC的浸润转移密切相关[9,10]. 但是, 对于CXCR4和CCR7在EADC及作为其癌前病变的BE中的表达情况; CXCR4和CCR7的异常表达与BE、EADC的各临床病理特征之间的关系; CXCR4和CCR7在不同的食管病理组织学类型中的表达是否有差异的研究尚未见报道. 本实验首次采用免疫组织化学SP法对BE、EADC和ESCC中CXCR4和CCR7的表达情况进行了检测, 并探讨CXCR4和CCR7在这3种食管病理组织学类型中表达异同的潜在临床意义.
连续收集了2006-12/2009-06共计209例样本: 80例BE(含22例BE伴多灶性非典型增生)为云南省第一人民医院消化内镜中心行电镜检查时留取, 其中, 男34例, 女46例, 平均年龄47.8±11.6岁; 25例EADC、48例ESCC和56例正常食管黏膜组织样本均取自云南省第一人民医院普外科和肿瘤科手术切除的肿瘤样本及对应癌旁≥5 cm的健康食管黏膜组织. 25例EADC, 男18例、女7例, 平均年龄54.0±12.7岁; 48例ESCC, 男43例, 女5例, 平均年龄55.2±8.9岁; 56例正常食管黏膜, 男38例、女18例, 平均年龄47.0±10.8岁. 本研究获得了云南省第一人民医院伦理委员会的批准, 样本采集获得了患者的知情同意. 所有病例术前均无化疗、放疗史. 研究样本均经病理组织学证实, 食管癌TNM分期参照美国癌症联合委员会标准. 组织判断标准如下, 正常食管黏膜: 食管癌手术切除样本中, 距癌灶边缘≥5 cm以上, 常规病理切片证实为正常的食管黏膜; BE: 内镜检查发现有明显的柱状上皮化生, 并经食管黏膜活检证实有杯状细胞存在; EADC和ESCC: 食管癌手术切除样本中, 取无坏死的癌组织, 经常规病理切片证实为EADC或ESCC.
1.2.1 免疫组织化学SP法检测CXCR4和CCR7的表达: 兔抗人CXCR4(ab2074)和CCR7(ab72100)购自Abcam公司, 柠檬酸型抗原修复缓冲液(pH6.0)(MVS-0100)、超敏SP试剂盒(KIT-9710), DAB试剂盒(DAB-0031)、苏木素体细胞快速染色液(CTS-1099)、磷酸盐缓冲液(PBS-0061)和中性树胶(DAB-0033)均购自福州迈新生物技术公司. 免疫组织化学采用SP法. 切片厚度4 μm, 一抗工作浓度为1:100. 用PBS代替一抗作阴性对照.
1.2.2 图像采集和结果判读: 切片用Olympus BX 50光学显微镜观察、摄像. 用HMIAS-2000高清晰度全自动彩色图像分析系统(武汉千屏影像技术有限责任公司)采集图像并对各CXCR4和CCR7表达的阳性染色面积及染色强度进行分析. 每张切片随机选择10个视野取平均值. 结果判读采用双盲法, 并由两位病理医师独立读片评定. CXCR4和CCR7染色结果评估参考文献[8]及预实验结果采用综合评分法, 根据染色强度及着色面积进行判断. 细胞染色强度分为4级: 无着色为0级计0分, 浅黄色为1级计1分, 棕黄色为2级计2分, 棕褐色为3级计3分. 在400倍光镜下随机观察5个不同的视野, 根据阳性细胞占总细胞数的着色面积百分率分为5个等级: <5%为0级; 5%-25%为1级; 26%-50%为2级; 51%-75%为3级; >75%为4级, 分别取相应分值0、1、2、3、4分. 用细胞数得分和强度得分的和作为判断表达结果, 若积分≤1为阴性, 2-7为阳性.
统计学处理 采用SPSS13.0统计分析软件分析数据. CXCR4和CCR7在不同组间表达阳性率的比较、及其与各临床病理特征之间的关系, 采用χ2检验或精确概率检验; 计量资料采用t检验及方差分析; 相关性检验用Spearman相关分析. P<0.05为差异有显著性统计学意义, P<0.01为差异有极显著性统计学意义.
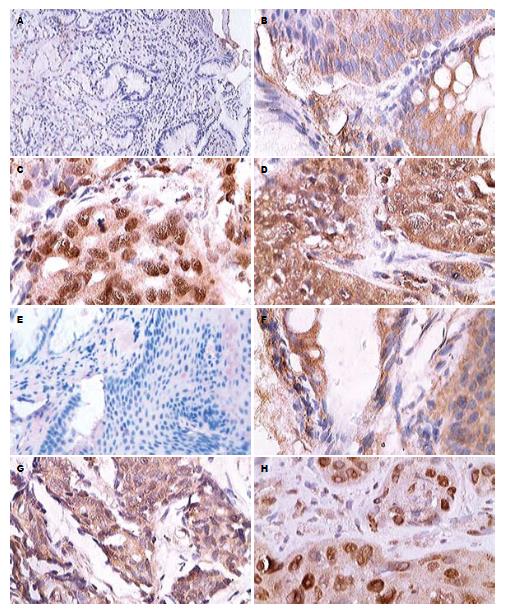
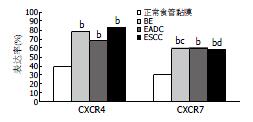
CXCR4和CCR7在正常食管黏膜、BE、EADC和ESCC中均有表达, 表达部位集中在细胞膜及胞质中(图1), 其表达阳性率分别为: CXCR4: 39.29%(22/56), 78.75%(63/80), 68.00% (17/25), 83.33%(40/48); CCR7: 30.36%(17/5), 60.00%(48/80), 60.00%(15/25), 58.33%(28/48). 并且, CXCR4和CCR7在正常食管黏膜中多为弱阳性表达(积分多为2分), 而在BE、EADC和ESCC中多为强阳性表达(积分多为3-7分). χ2检验发现CXCR4和CCR7在BE、EADC和ESCC中的表达均极显著高于正常食管黏膜组织(P<0.01); 但是, CXCR4和CCR7的表达在BE、EADC和ESCC这3类食管病理组织类型中的表达无差异(图2).
在同一类型的食管病理组织中, CXCR4和CCR7的表达水平并不一致: BE和ESCC中CXCR4的表达水平均显著高于CCR7(分别为P<0.05和P<0.01, 图2). CXCR4和CCR7在同一食管病理组织类型中表达水平与各临床病理特征之间关系: (1)BE: CXCR4和CCR7的表达水平与年龄无关, 但与性别、病变位置、是否伴非典型增生均有一定相关性: 在男性、病变位于食管下段、无非典型增生的BE患者中, CXCR4的表达水平均高于CCR7. (2)EADC: CXCR4和CCR7在EADC中的表达水平差异与性别、病变位置、有无淋巴结转移均无关, 但与肿瘤分化程度有一定相关性: 在高分化的EADC中CXCR4的表达水平高于CCR7; 而在中-低分化的EADC中, CXCR4和CCR7的表达水平无差异. (3)ESCC: CXCR4和CCR7的表达水平与肿瘤分化程度、有无淋巴结转移无关, 但与性别、年龄、肿瘤所在位置、TNM分期有一定相关性: 在男性、年龄>50岁、病变位置在食管下段、TNMⅠ-Ⅱ期的ESCC患者中, CXCR4的表达水平均高于CCR7(表1).
| 分组 | 病理特征 | n | CXCR4 | CCR7 | CXCR4与CCR7的阳性比较χ2值 | |||
| 阳性n(%) | χ2值 | 阳性n(%) | χ2值 | |||||
| BE | 性别 | 男 | 34 | 28(82.35) | 0.4587 | 18(52.94) | 1.2276 | 6.7193d |
| 女 | 46 | 35(76.08) | 30(65.22) | 1.3105 | ||||
| 年龄(岁) | ≤50 | 46 | 36(78.26) | 0.0155 | 28(60.87) | 0.0341 | 3.2857 | |
| >50 | 34 | 27(79.41) | 20(58.82) | 3.3759 | ||||
| 位置 | 食管下段 | 78 | 62(79.48) | 4.0000 | 47(60.26) | 2.1688 | 6.8515d | |
| 食管中段 | 1 | 1(100.00) | 1(100.00) | - | ||||
| 贲门 | 1 | 0(0.00) | 0(0.00) | - | ||||
| 是否伴非 | 无 | 58 | 46(79.31) | 0.0396 | 35(60.34) | 0.0104 | 4.9510c | |
| 典型增生 | 伴多灶性非 | 22 | 17(77.27) | 13(59.09) | 0.5291 | 1.6762 | ||
| 典型增生 | ||||||||
| EADC | 性别 | 男 | 18 | 12(66.66) | 0.0525 | 10(55.56) | 0.4675 | |
| 女 | 7 | 5(71.42) | 5(71.43) | - | ||||
| 年龄(岁) | ≤50 | 5 | 2(40.00) | 2.2518 | 2(40.00) | 1.0417 | - | |
| >50 | 20 | 15(75.00) | 13(65.00) | 0.4762 | ||||
| 位置 | 食管下段 | 21 | 14(66.66) | 0.4902 | 13(61.90) | 1.5873 | 0.1037 | |
| 食管中段 | 1 | 1(100.00) | 1(100.00) | - | ||||
| 贲门 | 3 | 2(66.66) | 1(33.33) | - | ||||
| 分化程度 | 中-低分化 | 18 | 11(61.11) | 1.4020 | 14(77.78) | 5.2965a | 1.1782 | |
| 高分化 | 7 | 6(85.71) | 2(28.57) | 4.6667c | ||||
| 淋巴结转移 | 有 | 9 | 9(100.00) | 6.6176a | 8(88.89) | 4.8900a | 1.0589 | |
| 无 | 16 | 8(50.00) | 7(43.75) | 0.1255 | ||||
| ESCC | 性别 | 男 | 43 | 35(85.36) | 1.1163 | 24(55.81) | 1.0780 | 6.5323c |
| 女 | 5 | 5(100.00) | 4(80.00) | 1.1111 | ||||
| 年龄(岁) | ≤50 | 9 | 7(77.77) | 0.2462 | 5(55.56) | 0.0352 | 1.0000 | |
| >50 | 39 | 33(84.61) | 23(58.97) | 6.3312c | ||||
| 位置 | 食管下段 | 33 | 28(84.84) | 0.1745 | 21(63.64) | 1.2218 | 3.8824c | |
| 食管中段 | 15 | 12(80.00) | 7(46.67) | 3.5885 | ||||
| 分化程度 | 中-低分化 | 36 | 33(91.66) | 7.2000b | 30(83.33) | 7.9121b | 1.1429 | |
| 高分化 | 12 | 7(58.33) | 5(41.67) | 0.6667 | ||||
| TNM分期 | Ⅰ-Ⅱ | 36 | 33(91.66) | 7.2000b | 18(50.00) | 4.1143a | 15.1261d | |
| Ⅲ-Ⅳ | 12 | 7(58.33) | 10(83.33) | 1.8151 | ||||
| 淋巴结转移 | 有 | 15 | 15(100.00) | 4.3636a | 15(100.00) | 5.7416a | - | |
| 无 | 33 | 25(75.75) | 23(69.70) | 0.3056 | ||||
CXCR4和CCR7在BE、EADC和ESCC的表达与性别、年龄、病变位置均无关; 将BE按是否伴非典型增生分成两组后统计的结果显示CXCR4和CCR7的表达水平在BE与BE伴多灶性非典型增生这两组间并无统计学差异, 但CXCR4和CCR7在这两组中的表达均显著高于正常食管黏膜组织(P<0.01); EADC中CXCR4和CCR7的表达在中-低分化较高分化、有淋巴结转移较无淋巴结转移均显著升高(P<0.05); ESCC中CXCR4和CCR7的表达在TNM Ⅲ-Ⅳ期较Ⅰ-Ⅱ期均显著升高(P<0.01, P<0.05); ESCC中CXCR4和CCR7的表达在中-低分化较高分化、在有淋巴结转移较无淋巴结转移均显著升高(P<0.01, P<0.05, 表1).
在BE组中, CXCR4表达阳性的46个病例中, CCR7表达阳性的占33例, 而在CXCR4表达阴性的12个病例中, CCR7表达阴性的占10例, CXCR4及CCR7在BE中的表达呈正相关(r = 0.456, P<0.01). CXCR4及CCR7的表达在BE伴多灶性非典型增生和EADC中均呈正相关(分别为r = 0.652, P<0.01; r = 0.490, P<0.05); 而在ESCC中则无相关性(r = 0.076, P>0.05, 表2).
| CXCR4 | CCR7蛋白(n) | r值 | P值 | ||
| 蛋白(n) | + | - | |||
| BE无非典型增生 | |||||
| + | 33 | 13 | 0.456 | <0.01 | |
| - | 2 | 10 | |||
| BE伴多灶性非典型增生 | |||||
| + | 13 | 4 | 0.652 | <0.01 | |
| - | 0 | 5 | |||
| EADC | |||||
| + | 13 | 4 | 0.490 | <0.05 | |
| - | 2 | 6 | |||
| ESCC | |||||
| + | 24 | 16 | 0.076 | >0.05 | |
| - | 4 | 4 | |||
趋化因子及其受体相互作用在诸如细胞的生长发育、分化、凋亡, 肿瘤细胞的生长、浸润、转移, 淋巴细胞向炎症部位的聚集等诸多生理和病理过程中均发挥重要作用[11]. 近年的研究发现, 某些恶性肿瘤可以倾向性特异性的转移到远端的某些器官组织中, CXCR4和CCR7及其配体特异性的高表达可能在其中起着非常重要的作用. CXCR4的配体CXCL12和CCR7的配体CCL21和CCL19在淋巴结、肺和肝脏等组织中高表达, 从而诱导CXCR4和CCR7高表达的肿瘤细胞向这些部位定向迁移可能是CXCR4和CCR7高表达的肿瘤更容易发生淋巴结和远端脏器转移的原因之一[12,13]. CXCR4是一个视紫红质样G蛋白偶联受体(G protein-coupled receptor, GPCR), 基质衍生因子(stroma-derived factor 1, SDF-1), 亦称CXCL12, 是该受体的唯一配体[14]. 近年来的研究发现CXCR4在众多肿瘤中均高表达, 是肿瘤细胞最为普遍表达的趋化因子受体, 因而被认为是一具有广谱性的肿瘤治疗新靶点[12,15]. 其表达升高在包括胰腺癌[16]、宫颈癌[17]、前列腺癌[18]、肝癌[19]、乳腺癌[20]、胃癌[21]、肾癌[22]和黑色素瘤[23]等众多肿瘤中发现, 并且CXCR4的高表达通过其受体CXCL12的介导, 与肿瘤的浸润和淋巴结转移、肿瘤复发、5年期生存率等均密切相关[24-26]. CCR7在众多肿瘤的细胞表面亦高表达, 同时其配体CCL21和CCL19在淋巴结中特异性高表达, CCR7即是通过与其配体CCL21和CCL19结合在淋巴细胞的归巢过程中起重要作用, 尤其与肿瘤细胞定向迁移、浸润和淋巴结转移密切相关[27,28], 并已在包括胃癌[29]、乳腺癌[30]、前列腺癌[31]、结直肠癌[32]和黑色素瘤[33]中得到证实. 国内外亦有CXCR4和CCR7在ESCC中高表达与淋巴结转移密切相关的报道[9,10], 但对CXCR4和CCR7在EADC及作为其癌前病变的BE中的表达情况则鲜见报道.
本研究采用免疫组织化学SP法和图像分析定量, 检测了CXCR4和CCR7在EADC及作为其癌前病变的BE中的表达情况, 并同时检测了其在ESCC以及正常食管黏膜中的表达情况. 以期从肿瘤细胞自分泌趋化因子受体方面解释BE恶变为EADC的可能机制, 并试图了解CXCR4和CCR7在BE、EADC、ESCC这3种食管病理组织学类型中表达异同的潜在临床意义. 结果显示: CXCR4和CCR7在大部分BE、EADC和ESCC中呈强阳性表达(78.75%, 68.00%, 83.33%; 60.00%, 60.00%, 58.33%. 阳性积分多为3-7分), 在正常食管黏膜组织中呈阴性或弱阳性表达(39.29%; 30.36%. 阳性积分多为2分). CXCR4和CCR7在BE、EADC和ESCC中的表达均极显著高于正常食管黏膜组织(P<0.01), 但在3类食管病理组织类型间则无差异, 提示CXCR4和CCR7表达上调是BE、EADC及ESCC的一个普遍特征. 但同时, 由于CXCR4和CCR7在同一类型的食管病理组织中的表达水平并不一致: BE和ESCC中CXCR4的表达水平显著高于CCR7(P<0.05,P<0.01), 并且CXCR4和CCR7表达水平与临床病理特征有一定的关系, 因此, 联合检测CXCR4和CCR7更有助于准确地鉴别诊断BE、EADC和ESCC. 并且, CXCR4和CCR7的表达在公认为EADC的癌前病变-BE中就已升高, 其表达在BE和EADC间无差异, 提示CXCR4和CCR7的表达上调发生在由BE向EADC转化这一病理进程的早期阶段. 将BE按是否伴非典型增生分为两组比较的结果则表明, CXCR4和CCR7的表达在BE和BE伴非典型增生两组中并无差异, 提示CXCR4和CCR7的表达与BE是否伴非典型增生无关, 其表达上调贯穿于BE-BE伴非典型增生-EADC序列的整个病理进程.
对CXCR4和CCR7表达与食管癌患者的临床病理特征之间的关系采用χ2检验的结果显示, CXCR4和CCR7在BE、EADC和ESCC中的表达与性别、年龄和病变位置均无关. 但是, ESCC中CXCR4和CCR7的高表达与肿瘤分期、分化程度和是否有淋巴结转移均密切相关, CXCR4和CCR7的高表达促进了ESCC的浸润和转移, 这与文献报道一致[9,10]. CXCR4和CCR7的异常表达在EADC中也与之类似, 其表达水平在中-低分化较高分化、有淋巴结转移较无淋巴结转移均显著升高(P<0.05). 目前体内外的研究均表明, 在恶性肿瘤中, 趋化因子受体与其配体结合可诱导蛋白水解酶的释放, 并通过对细胞外基质和基膜的降解, 增强肿瘤细胞的浸润能力. 有报道CXCR4表达升高后可促进肿瘤细胞分泌更多的血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)和基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9), 从而进一步促进肿瘤的血管新生、增殖、浸润和转移[34-36]. 总之, CXCR4和CCR7参与了包括BE-BE伴非典型增生-EADC序列和ESCC的发生发展、浸润和转移过程, CXCR4和CCR7的高表达与食管癌的病理组织学类型无关, 并且可作为食管癌具有较强浸润和转移潜能的重要标志.
我们用Spearman相关分析法探讨了CXCR4和CCR7从BE、BE伴多灶性非典型增生到EADC整个病理进程中表达的相关性, 结果显示CXCR4和CCR7的表达水平在这3种病理组织类型中均存在明显的正相关关系(r = 0.456; r = 0.652; r = 0.490), 提示CXCR4和CCR7可能同时参与并共同作用于从BE、BE伴多灶性非典型增生到EADC的整个病理进程, 但其相关性及内在机制还需进一步的研究证实. 而在ESCC中, CXCR4的表达与CCR7的表达无相关性(r = 0.076), 提示CXCR4和CCR7在ESCC的病理进程中可能是在不同的时相或位相起作用.
总之, CXCR4和CCR7的表达上调是BE、EADC和ESCC的普遍特征. CXCR4和CCR7在BE、EADC和ESCC中的表达水平并不一致,其表达差异与临床病理特征有一定关系, 联合检测CXCR4和CCR7有助于更准确诊断BE、EADC和ESCC; CXCR4和CCR7表达升高与EADC和ESCC的肿瘤分化程度、TNM分期和有无淋巴结转移具有显著相关性, CXCR4和CCR7高表达是食管癌具有较强浸润和转移潜能的重要标志; CXCR4和CCR7的表达在BE、BE伴多灶性非典型增生到EADC这3个病理阶段均呈明显的正相关, CXCR4和CCR7可能同时参与并共同作用于从BE到EADC的发生发展过程. 到目前为止, CXCR4和CCR7在BE、EADC和ESCC中表达升高的作用机制还未完全阐明, 其在食管癌发生发展、浸润转移中的作用值得进一步深入探讨.
CXCR4和CCR7在胃癌、乳腺癌、前列腺癌及食管鳞癌中呈现高表达, 并且, CXCR4和CCR7及其配体特异性的高表达可能与肿瘤的远端定向转移密切相关.
李晟磊, 副主任医师, 郑州大学第一附属医院病理科、河南省肿瘤病理重点实验室、郑州大学医学院病理教研室
近来研究显示, CXCR4和CCR7在食管鳞癌的发病机制中起着十分重要的作用, 其高表达与肿瘤的淋巴结转移密切相关. 但对CXCR4和CCR7在食管腺癌及作为其癌前病变的Barrett's食管中的表达情况鲜见报道. 近年来食管腺癌的发病率同肺癌中的腺癌等一致, 也有一定的上扬趋势, 对食管腺癌的研究是今后对食管癌研究的一个重要方向.
杜雅冰和Ding等分别研究了CXCR4和CCR7在食管鳞癌中的表达, 结果表明, CXCR4和CCR7在食管鳞癌中高表达, 并与淋巴结转移密切相关.
本文首次采用免疫组织化学SP法检测了食管腺癌及公认为食管腺癌癌前病变的Barrett's食管中CXCR4和CCR7的表达情况.
本研究表明了缺血后处理在大鼠肝移植缺血再灌注损伤中的作用, 可以应用于肝移植临床, 有利于肝移植术后患者的恢复.
联合检测CXCR4和CCR7有助于更准确地诊断Barrett's食管、食管腺癌和食管鳞癌. CXCR4和CCR7高表达是食管癌具有较强浸润和转移潜能的分子指标.
编辑: 李薇 电编:何基才
| 1. | Forman D. Review article: oesophago-gastric adenocarcinoma -- an epidemiological perspective. Aliment Pharmacol Ther. 2004;20 Suppl 5:55-60; discussion 61-62. [PubMed] [DOI] |
| 2. | Hamilton SR, Smith RR. The relationship between columnar epithelial dysplasia and invasive adenocarcinoma arising in Barrett's esophagus. Am J Clin Pathol. 1987;87:301-312. [PubMed] |
| 3. | Shaheen N, Ransohoff DF. Gastroesophageal reflux, barrett esophagus, and esophageal cancer: scientific review. JAMA. 2002;287:1972-1981. [PubMed] |
| 4. | Devesa SS, Blot WJ, Fraumeni JF Jr. Changing patterns in the incidence of esophageal and gastric carcinoma in the United States. Cancer. 1998;83:2049-2053. [PubMed] [DOI] |
| 6. | Hoff SJ, Sawyers JL, Blanke CD, Choy H, Stewart JR. Prognosis of adenocarcinoma arising in Barrett's esophagus. Ann Thorac Surg. 1998;65:176-180; discussion 180-181. [PubMed] [DOI] |
| 7. | Pistoia V, Corcione A, Dallegri F, Ottonello L. Lymphoproliferative disorders and chemokines. Curr Drug Targets. 2006;7:81-90. [PubMed] [DOI] |
| 8. | Kodama J, Hasengaowa , Seki N, Kusumoto T, Hiramatsu Y. Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer. Eur J Gynaecol Oncol. 2007;28:370-375. [PubMed] |
| 10. | Ding Y, Shimada Y, Maeda M, Kawabe A, Kaganoi J, Komoto I, Hashimoto Y, Miyake M, Hashida H, Imamura M. Association of CC chemokine receptor 7 with lymph node metastasis of esophageal squamous cell carcinoma. Clin Cancer Res. 2003;9:3406-3412. [PubMed] |
| 12. | Kryczek I, Wei S, Keller E, Liu R, Zou W. Stroma-derived factor (SDF-1/CXCL12) and human tumor pathogenesis. Am J Physiol Cell Physiol. 2007;292:C987-C995. [PubMed] [DOI] |
| 13. | Ebert LM, Schaerli P, Moser B. Chemokine-mediated control of T cell traffic in lymphoid and peripheral tissues. Mol Immunol. 2005;42:799-809. [PubMed] [DOI] |
| 14. | Rossi D, Zlotnik A. The biology of chemokines and their receptors. Annu Rev Immunol. 2000;18:217-242. [PubMed] [DOI] |
| 15. | Balkwill F. The significance of cancer cell expression of the chemokine receptor CXCR4. Semin Cancer Biol. 2004;14:171-179. [PubMed] [DOI] |
| 16. | Wehler T, Wolfert F, Schimanski CC, Gockel I, Herr W, Biesterfeld S, Seifert JK, Adwan H, Berger MR, Junginger T. Strong expression of chemokine receptor CXCR4 by pancreatic cancer correlates with advanced disease. Oncol Rep. 2006;16:1159-1164. [PubMed] |
| 17. | Zhang JP, Lu WG, Ye F, Chen HZ, Zhou CY, Xie X. Study on CXCR4/SDF-1alpha axis in lymph node metastasis of cervical squamous cell carcinoma. Int J Gynecol Cancer. 2007;17:478-483. [PubMed] [DOI] |
| 18. | Engl T, Relja B, Marian D, Blumenberg C, Müller I, Beecken WD, Jones J, Ringel EM, Bereiter-Hahn J, Jonas D. CXCR4 chemokine receptor mediates prostate tumor cell adhesion through alpha5 and beta3 integrins. Neoplasia. 2006;8:290-301. [PubMed] [DOI] |
| 19. | Rubie C, Frick VO, Wagner M, Weber C, Kruse B, Kempf K, König J, Rau B, Schilling M. Chemokine expression in hepatocellular carcinoma versus colorectal liver metastases. World J Gastroenterol. 2006;12:6627-6633. [PubMed] |
| 20. | Dewan MZ, Ahmed S, Iwasaki Y, Ohba K, Toi M, Yamamoto N. Stromal cell-derived factor-1 and CXCR4 receptor interaction in tumor growth and metastasis of breast cancer. Biomed Pharmacother. 2006;60:273-276. [PubMed] [DOI] |
| 21. | Yasumoto K, Koizumi K, Kawashima A, Saitoh Y, Arita Y, Shinohara K, Minami T, Nakayama T, Sakurai H, Takahashi Y. Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer. Cancer Res. 2006;66:2181-2187. [PubMed] [DOI] |
| 22. | Pan J, Mestas J, Burdick MD, Phillips RJ, Thomas GV, Reckamp K, Belperio JA, Strieter RM. Stromal derived factor-1 (SDF-1/CXCL12) and CXCR4 in renal cell carcinoma metastasis. Mol Cancer. 2006;5:56. [PubMed] [DOI] |
| 23. | Scala S, Ottaiano A, Ascierto PA, Cavalli M, Simeone E, Giuliano P, Napolitano M, Franco R, Botti G, Castello G. Expression of CXCR4 predicts poor prognosis in patients with malignant melanoma. Clin Cancer Res. 2005;11:1835-1841. [PubMed] [DOI] |
| 24. | Kato M, Kitayama J, Kazama S, Nagawa H. Expression pattern of CXC chemokine receptor-4 is correlated with lymph node metastasis in human invasive ductal carcinoma. Breast Cancer Res. 2003;5:R144-R150. [PubMed] [DOI] |
| 25. | Kim J, Takeuchi H, Lam ST, Turner RR, Wang HJ, Kuo C, Foshag L, Bilchik AJ, Hoon DS. Chemokine receptor CXCR4 expression in colorectal cancer patients increases the risk for recurrence and for poor survival. J Clin Oncol. 2005;23:2744-2753. [PubMed] [DOI] |
| 26. | Burger JA, Kipps TJ. CXCR4: a key receptor in the crosstalk between tumor cells and their microenvironment. Blood. 2006;107:1761-1767. [PubMed] [DOI] |
| 27. | Willimann K, Legler DF, Loetscher M, Roos RS, Delgado MB, Clark-Lewis I, Baggiolini M, Moser B. The chemokine SLC is expressed in T cell areas of lymph nodes and mucosal lymphoid tissues and attracts activated T cells via CCR7. Eur J Immunol. 1998;28:2025-2034. [PubMed] [DOI] |
| 28. | Gunn MD, Tangemann K, Tam C, Cyster JG, Rosen SD, Williams LT. A chemokine expressed in lymphoid high endothelial venules promotes the adhesion and chemotaxis of naive T lymphocytes. Proc Natl Acad Sci U S A. 1998;95:258-263. [PubMed] [DOI] |
| 29. | Mashino K, Sadanaga N, Yamaguchi H, Tanaka F, Ohta M, Shibuta K, Inoue H, Mori M. Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma. Cancer Res. 2002;62:2937-2941. [PubMed] |
| 30. | Wilson JL, Burchell J, Grimshaw MJ. Endothelins induce CCR7 expression by breast tumor cells via endothelin receptor A and hypoxia-inducible factor-1. Cancer Res. 2006;66:11802-11807. [PubMed] [DOI] |
| 31. | Heresi GA, Wang J, Taichman R, Chirinos JA, Regalado JJ, Lichtstein DM, Rosenblatt JD. Expression of the chemokine receptor CCR7 in prostate cancer presenting with generalized lymphadenopathy: report of a case, review of the literature, and analysis of chemokine receptor expression. Urol Oncol. 2005;23:261-267. [PubMed] [DOI] |
| 33. | Takeuchi H, Fujimoto A, Tanaka M, Yamano T, Hsueh E, Hoon DS. CCL21 chemokine regulates chemokine receptor CCR7 bearing malignant melanoma cells. Clin Cancer Res. 2004;10:2351-2358. [PubMed] [DOI] |
| 34. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] [DOI] |
| 35. | Itoh T, Tanioka M, Matsuda H, Nishimoto H, Yoshioka T, Suzuki R, Uehira M. Experimental metastasis is suppressed in MMP-9-deficient mice. Clin Exp Metastasis. 1999;17:177-181. [PubMed] [DOI] |