修回日期: 2010-10-20
接受日期: 2010-10-26
在线出版日期: 2010-12-08
目的: 探讨鼠源抗VEGFR-2嵌合Fab抗体对小鼠肝癌原位移植瘤的抑制作用及对其肿瘤血管生成的影响.
方法: ELISA法检测嵌合Fab抗体的结合活性. 直接注射法建立小鼠H22肝癌原位移植瘤模型, 造模成功小鼠随机分为生理盐水空白对照组和cFab组, 每组24只. 观察用药前后小鼠体质量变化、生存时间及肿瘤组织病理形态变化, 免疫组织化学检测肿瘤组织内微血管密度(MVD).
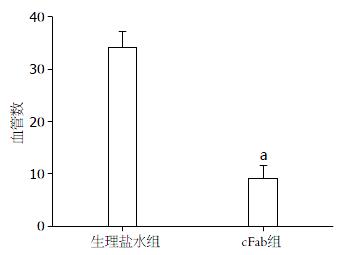
结果: 嵌合Fab抗体与VEGFR-2有较高的亲和力. cFab组肝脏肿瘤体积显著小于生理盐水组(313.9 mm3±41.9 mm3vs 635.4 mm3±70.1 mm3, P<0.05); 两组间小鼠中位数生存时间有显著性差异(20.0 d vs 13.0 d, c2 = 4.611, P = 0.032); cFab组肝脏实体瘤内MVD较生理盐水组显著性减少(34.48±1.39 vs 9.56±1.26, P<0.05).
结论: 鼠源抗VEGFR-2 Fab抗体通过抑制肿瘤新生血管形成, 从而抑制小鼠肝癌原位移植瘤的生长.
引文著录: 张建民, 施晓雷, 朱进, 吴亚夫. 抗VEGFR-2嵌合Fab抗体对鼠肝癌原位移植瘤及其新生血管的抑制作用. 世界华人消化杂志 2010; 18(34): 3621-3626
Revised: October 20, 2010
Accepted: October 26, 2010
Published online: December 8, 2010
AIM: To investigate the inhibitory effects of a mouse chimeric anti-VEGFR-2 Fab antibody on tumor growth and angiogenesis in an orthotopic xenograft mouse model of hepatocellular carcinoma.
METHODS: The antigen-binding activity of cFab antibody was assessed by ELISA. An orthotopic xenograft mouse model of hepatocellular carcinoma was created by direct injection of H22 cells into the liver parenchyma of ICR mice. Twenty-four ICR mice bearing orthotopic HCC were divided into two groups: control group (treated with normal saline) and cFab group (treated with cFab antibody). After the treatment, tumor weight and mouse survival time were compared between the two groups. Histological changes and microvessel density (MVD) in tumors were also evaluated.
RESULTS: The chimeric anti-VEGFR-2 Fab antibody exhibited a strong binding activity to VEGFR-2. Tumor size in the cFab group was significantly decreased compared with the control group (313.9 mm3 ± 41.9 mm3vs 635.4 mm3 ± 70.1 mm3, P < 0.05); and the mice of the cFab group had a significantly longer survival time (20.0 d vs 13.0 d, Long-rank test χ2 = 4.611, P = 0.032). The MVD in the cFab group was also significantly lower than that in the control group (34.48 ± 1.39 vs 9.56 ± 1.26,P < 0.05).
CONCLUSION: The chimeric anti-VEGFR-2 Fab antibody can inhibit tumor growth in an orthotopic xenograft mouse model of hepatocellular carcinoma possibly by inhibiting tumor angiogenesis.
- Citation: Zhang JM, Shi XL, Zhu J, Wu YF. Inhibitory effects of a chimeric anti-VEGFR-2 Fab antibody on tumor growth and angiogenesis in an orthotopic xenograft mouse model of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(34): 3621-3626
- URL: https://www.wjgnet.com/1009-3079/full/v18/i34/3621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i34.3621
分子靶向治疗是目前肿瘤治疗领域发展的新方向, 有望成为肝癌治疗的新手段[1]. 目前, 涉及肝癌靶向治疗的基因工程抗体中的抗肝细胞癌小分子嵌合Fab抗体(chimeric Fab antibody, cFab), 以相对分子质量小、免疫原性低、与相应抗原特异性结合等特点而备受关注[2]. 新生血管为肿瘤组织供应氧和营养物质, 与肿瘤的生长转移密切相关, 其对肿瘤生长的调节是一些因子平衡调节的结果[3,4]. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前已知的作用较强的诱导血管生成的关键调节因子[5-7]. 血管内皮生长因子-2(vascular endothelial growth factor receptor-2, VEGFR-2)在VEGF的信号转导及血管内皮生成中起主导作用, VEGF与 VEGFR-2的结合所产生的信号瀑布效应能够导致肿瘤周围新生内皮细胞的迁移、增殖、生存, 在肿瘤周围血管新生过程中具有重要作用[8-10]. 以VEGFR-2为靶点, 通过抑制VEGF与VEGFR-2的相互作用来抑制血管生长从而达到治疗肿瘤的目的已经成为肿瘤靶向治疗的新途径[11]. 利用噬菌体抗体库展示技术, 选择VEGFR-2作为抗原, 可以得到大量纯化后亲和力高的cFab[12,13], 其可以通过竞争性地抑制VEGF与VEGFR-2的结合, 从而抑制肿瘤血管生长. 本研究复制小鼠肝癌原位移植瘤模型, 旨在观察抗VEGFR-2 cFab对肝癌的作用及其对肿瘤血管生长的影响.
鼠源抗VEGFR-2 cFab(南京医科大学卫生部抗体技术重点实验室合成纯化); 鼠VEGFR-2(R&D美国); 牛血清白蛋白(BSA)(Sigma美国); 四甲基联苯胺(TMB)、辣根过氧化酶标记的羊抗小鼠IgG(HRP-IgG)(上海碧云天生物技术研究所); Tween-20(Roche瑞士); CD31抗体(Santa Cruz美国); RPMI 1640培养液、胎牛血清、胰蛋白酶(HyClone美国). ICR小鼠, ♂, 体质量28 g±2 g, 购于南京医科大学实验动物中心, 饲养于南京鼓楼医院动物中心无特殊病原菌(SPF)环境中. 鼠肝癌细胞株H22购于中科院上海生命科学研究院细胞资源中心. 电子天平(上海天平仪器厂JA5003型), 光学显微镜(Olympus CKX41日本), 酶联免疫吸附仪(Bio-Tekel美国), 聚苯乙烯酶联反应板(康宁, 美国).
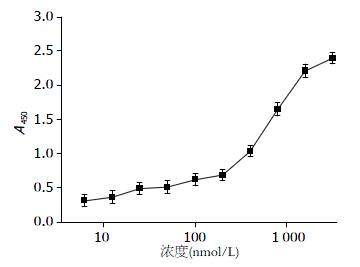
1.2.1 cFab的结合活性检测: 用间接ELISA法检测cFab的结合活性, 具体方法: (1)包被: 用HBS(10 mmol/L, pH9.4)稀释抗原VEGFR-2, 并以相同的浓度(1 mg/L)分别包被到96孔酶标板上, 每孔100 μL, 4 ℃过夜或37 ℃孵化2 h; (2)封闭: PBST洗涤5次, 拍干, 按100 μL/孔加入3% BSA, 37 ℃封闭2 h; (3)加样: 洗涤同上, 加入一定稀释(稀释液为5% BSA)的待测样品, 以稀释液作阴性对照, 100 μL/孔, 37 ℃孵化1 h; (4)酶标二抗: 洗涤同上, 辣根过氧化酶标记的羊抗小鼠IgG 1:250稀释后, 100 μL/孔, 37 ℃孵育1 h; (5)显色: 洗涤同上, 加入显色液TMB, 200 μL/孔, 室温避光孵育15 min; (6)终止反应: 按50 μL/孔加入2 mol/L硫酸终止反应; (7)于酶标仪450 nm波长测A值, 以空白孔调零; (8)以cFab稀释后的浓度C的常用对数为横坐标, 以A450为纵坐标, 绘制曲线.
1.2.2 细胞培养: 鼠肝癌H22细胞培养于含100 mL/L胎牛血清、青霉素100 kU/L、链霉素100 mg/L的RPMI 1640培养基中, 37 ℃, 50 mL/L CO2条件下常规培养, 0.25%胰蛋白酶传代培养.
1.2.3 小鼠肝癌原位移植瘤模型的建立: 鼠肝癌原位移植瘤模型, 采用直接种植法[14]. 收集对数生长期的鼠肝癌H22细胞, PBS调整细胞悬液至5×1010/L. 小鼠腹腔麻醉(3.5%水合氯醛300 mg/kg)后, 取仰卧位, 固定于实验板上, 取肋缘下横行切口, 逐层剪开皮肤和腹膜, 充分暴露肝左叶. 用28号针抽取50 μL H22细胞悬液(含细胞数2.5×106), 30度刺入肝脏缓慢注入细胞悬液, 注射完毕拔出针头, 立即用无菌纱布轻压针孔(1 min)至肝脏表面不再渗血, 逐层关腹.
1.2.4 分组及处理: 将48只小鼠随机分成cFab组(n = 24)和生理盐水组(n = 24), 从种植后第5天开始, 两组分别自尾静脉注射cFab 40 mg/kg(加生理盐水稀释至200 μL/只)和等体积生理盐水, 每周2次, 共用药2 wk. 同时注意观察小鼠生存时间.
1.2.5 肿瘤组织病理形态学观察: 给药2 wk后, 各组取8只小鼠处死, 取其肝脏, 先测量各组小鼠肿瘤组织体积, 比较两组体积大小, 然后40 g/L甲醛液固定, 脱水, 石蜡包埋, 制片, HE染色, 光学显微镜下观察其组织病理形态的改变.
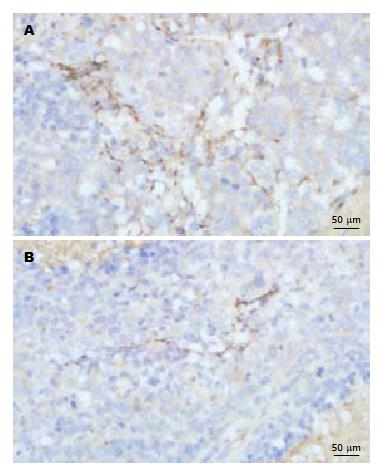
1.2.6 肿瘤组织内微血管密度检测: 石蜡切片常规脱蜡、水化, H2O2 10 min阻断内源性过氧化酶, 枸橼酸缓冲液高温抗原修复, 滴加一抗稀释液约50 μL, 4 ℃孵育过夜, PBS洗涤, 滴加二抗, 于37 ℃孵育30 min, PBS洗涤, DAB显色, 苏木素复染, 中性树胶封片, 显微镜下观察. 先在低倍镜(×10)下观察整个切片, 寻找肿瘤内血管密度最高处, 即"热点", 然后在高倍镜下(×40)计数被染色的血管数目, 记录3个视野内的微血管数, 取其平均值为微血管密度(microvessel density, MVD)[15].
统计学处理 所有结果均采用SPSS for Windows 16.0对数据进行分析. 实验结果以mean±SD表示. 两组间比较均数差异的显著性检验用t检验. 两组间生存时间差异的显著性检验用Long-rank检验. P<0.05为有统计学意义.
以cFab稀释后的浓度C的常用对数(x)为横坐标, A450(y)为纵坐标, 绘制曲线图, 显示cFab与VEGFR-2有较高的亲和力, 且他们之间的作用呈现浓度依赖性(图1).
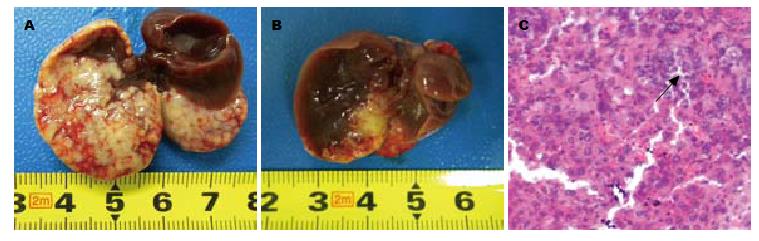
肝小叶结构清晰, 部分肝小叶被结节状的肿瘤组织取代(尤其是靠近肝包膜的肝小叶), 周边的肝小叶受压质地变实, 肝窦扩张充血. 瘤区肿瘤细胞呈类圆形, 异型性明显, 细胞核大, 染色深, 病理性核分裂像易见, 肿瘤细胞呈团块状分布, 有的瘤组织内有不同程度的凝固性坏死, 呈红染区, 有的坏死不彻底区可见明显的核固缩和和核碎裂(图2).
给药2 wk后, 各组取8只小鼠, 取其肝脏肉眼见: 生理盐水组瘤体体积明显大于cFab组, 且癌组织质硬、脆, 易出血坏死, 癌结节散在, 大小不一; cFab组小鼠瘤体较小, 形状较规则(图2A, B). cFab组肿瘤生长受到抑制, 平均体积为313.9 mm3±41.9 mm3, 而生理盐水组为635.4 mm3±70.1 mm3, 两组比较差异有统计学意义(P<0.05).
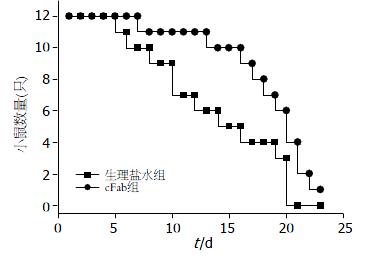
对两组小鼠的生存时间分别进行观察记录, cFab组小鼠(n = 12)中位数生存时间为20.0 d, 而生理盐水组小鼠(n = 12)中位数生存时间为13.0 d, 两组间生存时间有显著性差异(Long-rank检验χ2 = 4.611, P= 0.032, 图3).
近年来, 抗体靶向治疗已经成为肿瘤治疗中发展最迅速的领域之一. 单克隆抗体作为一种新型生物制荆在人类疾病的预防、诊断及治疗方面已显示出重要作用[16-18]. 虽然针对肿瘤抗原的单克隆抗体可以特异地识别肿瘤细胞, 并且能将效应分子如核素、化疗药物等选择性地携带至肿瘤局部杀伤肿瘤[19]. 但由于单抗的免疫原性强, 相对分子质量大, 因此单抗介导的靶向治疗对肝癌虽具有一定疗效, 但结果不够理想. 目前人们已经可以利用噬菌体展示技术, 首先获得抗体基因或抗体基因片段, 然后与适当载体质量组后引入不同表达系统, 从而可以表达出大量目的cFab[20,21]. 虽然最初的肿瘤靶向治疗针对的是肿瘤细胞表面的特异性抗原, 但目前人们已经发现许多其他的一些作用靶点, 比如血管生成的标志物[22]、基质抗原和肿瘤坏死释放的细胞内蛋白等[23-25]. 其中, VEGF已经被鉴定为肿瘤血管生长的关键调节因子, VEGFR-2介导的VEGF信号转导是新生血管形成中的限速步骤, 起着十分关键的作用[26]. 以往研究发现, 阻断VEGFR-2信号转导能显著抑制肿瘤诱导的新生血管形成, 从而抑制肿瘤的生长和转移[27,28].
cFab的相对分子质量约为50×103, 只有完整IgG的1/3, 具有较好的穿透性和药代动力学特征, 且能较好地保持结合抗原的活性因而成为当今应用较多的一种基因工程抗体类型[29-31]. 近年来研制出的一种人鼠嵌合IgG抗体IMC-1C11, 能与可溶性VEGFR-2和细胞表面VEGFR-2胞外区特异性结合阻断VEGF与VEGFR-2的相互作用, 其鼠的部分来源于一个小鼠抗体文库中分离的Fv单链, 其通过抑制VEGF激活VEGFR-2和VEGFR-2酪氨酸激酶途径, 阻断VEGF诱导的内皮细胞的有丝分裂而发挥作用[32,33]. Lu等[34]筛选出的Fab片段在纳摩尔每升级即可与VEGFR-2特异性结合, 阻断VEGF对VEGFR-2的激活作用, 有效地抑制VEGF诱导的人胚胎脐静脉内皮细胞的分裂. 在本实验研究中, 针对VEGFR-2构建的cFab与重组鼠源VEGFR-2显示出了较高的结合活性, 且呈剂量依赖性. 我们推测抗VEGFR-2 cFab在体内可以通过与肿瘤新生血管内皮细胞表面VEGF受体(fetal liver kinase-1, flk-1)结合, 竞争性地抑制VEGF与flk-1的相互作用, 阻断VEGF诱导的内皮细胞的有丝分裂, 抑制新生血管生长从而达到抑制肿瘤生长的目的.
本研究采用直接种植法成功建立了小鼠H22肝癌原位移植瘤模型, 病理可见肝脏肿瘤组织质硬、脆, 易出血坏死, 癌结节散在, 大小不一; 肿瘤组织HE染色镜下显示肿瘤组织区域肿瘤细胞呈类圆形, 异型性明显, 细胞核大, 染色深, 病理性核分裂像易见, 肿瘤细胞呈团块状分布. 动物实验表明, cFab干预组小鼠体质量增长较缓, 生存时间明显延长, 可能是由于cFab与肿瘤组织新生血管内皮细胞表面flk-1结合, 阻断新生血管生成. 生理盐水组小鼠体质量增长过快可能是因为肝脏肿瘤组织生长较快, 正常肝组织受损, 导致腹水形成增多.
肿瘤的MVD是评价肿瘤血管生成状况及抗肿瘤血管生成治疗效果的重要指标, 本研究应用CD31染色使肿瘤的微血管内皮细胞着色来计算单位视野中的微血管数量, 从而反映出肿瘤的微血管生成情况, cFab组与对照组肿瘤内的MVD值分别是34.48±1.39与9.56±1.26, 两组比较差异有显著性, 表明经抗VEGFR-2 cFab治疗后肿瘤组织中微血管生成明显减少.
本研究中, 鼠源抗VEGFR-2cFab在体内通过与肿瘤新生血管内皮细胞表面flk-1结合, 竞争性地抑制VEGF与flk-1的相互作用, 阻断VEGF诱导的内皮细胞的有丝分裂, 抑制新生血管生长, 从而抑制了小鼠肝癌原位移植瘤的生长, 为肝癌的生物治疗提供了新的方向. 鉴于鼠源化的cFab人用会产生人抗鼠抗体[35], 抗体人源化及其对肿瘤的特异性靶向作用还需进一步研究.
肝癌是消化系统中常见的一种肿瘤, 分子靶向治疗是目前肿瘤治疗领域发展的新方向, 有望成为肝癌治疗的新手段.
王德盛, 副教授, 中国人民解放军第四军医大学西京医院肝胆外科
目前, 涉及肝癌靶向治疗的基因工程抗体中的抗肝细胞癌小分子嵌合Fab抗体(cFab), 以相对分子质量小、免疫原性低、与相应抗原特异性结合等特点备受关注.
Lu等筛选出的Fab片段在纳摩尔每升级即可与VEGFR-2特异性结合, 阻断VEGF对VEGFR-2的激活作用, 有效地抑制VEGF诱导的人胚胎脐静脉内皮细胞的分裂.
本研究利用直接种植法成功构建了小鼠H22肝癌原位移植瘤模型, 并检测抗VEGFR-2嵌合Fab抗体对小鼠肝癌原位移植瘤的抑制作用及对其肿瘤血管生成的影响, 从而更加明确了抗VEGFR-2嵌合Fab抗体抑制原位肝癌移植瘤生长的作用机制.
鼠源抗VEGFR-2嵌合Fab抗体为肝癌的生物治疗提供了新的方向, 为将来抗体人源化及其临床应用的研究奠定基础.
本文创新性和科学性较好, 具有一定的研究和实用价值.
编辑: 李军亮 电编:何基才
| 1. | Tanaka S, Arii S. Molecularly targeted therapy for hepatocellular carcinoma. Cancer Sci. 2009;100:1-8. [PubMed] [DOI] |
| 2. | 邢 金良, 杨 向民, 张 思河, 姚 西英, 梁 瑞安, 陈 志南. 人鼠嵌合Fab抗体通用表达载体的构建和抗人肝癌相关抗原HAb18G嵌合Fab抗体的表达. 世界华人消化杂志. 2004;12:271-275. [DOI] |
| 3. | Gridelli C, Maione P, Del Gaizo F, Colantuoni G, Guerriero C, Ferrara C, Nicolella D, Comunale D, De Vita A, Rossi A. Sorafenib and sunitinib in the treatment of advanced non-small cell lung cancer. Oncologist. 2007;12:191-200. [PubMed] [DOI] |
| 4. | Jain RK. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Science. 2005;307:58-62. [PubMed] [DOI] |
| 5. | Zhang Z, Neiva KG, Lingen MW, Ellis LM, Nör JE. VEGF-dependent tumor angiogenesis requires inverse and reciprocal regulation of VEGFR1 and VEGFR2. Cell Death Differ. 2010;17:499-512. [PubMed] [DOI] |
| 6. | Folkman J. Angiogenesis: an organizing principle for drug discovery? Nat Rev Drug Discov. 2007;6:273-286. [PubMed] [DOI] |
| 7. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] [DOI] |
| 8. | Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol. 2005;23:1011-1027. [PubMed] [DOI] |
| 9. | Tabernero J. The role of VEGF and EGFR inhibition: implications for combining anti-VEGF and anti-EGFR agents. Mol Cancer Res. 2007;5:203-220. [PubMed] [DOI] |
| 10. | Frederick B, Gustafson D, Bianco C, Ciardiello F, Dimery I, Raben D. ZD6474, an inhibitor of VEGFR and EGFR tyrosine kinase activity in combination with radiotherapy. Int J Radiat Oncol Biol Phys. 2006;64:33-37. [PubMed] [DOI] |
| 11. | Banks RE, Forbes MA, Kinsey SE, Stanley A, Ingham E, Walters C, Selby PJ. Release of the angiogenic cytokine vascular endothelial growth factor (VEGF) from platelets: significance for VEGF measurements and cancer biology. Br J Cancer. 1998;77:956-964. [PubMed] |
| 12. | Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science. 1985;228:1315-1317. [PubMed] [DOI] |
| 13. | Scott JK, Smith GP. Searching for peptide ligands with an epitope library. Science. 1990;249:386-390. [PubMed] [DOI] |
| 14. | Yao X, Hu JF, Daniels M, Yien H, Lu H, Sharan H, Zhou X, Zeng Z, Li T, Yang Y. A novel orthotopic tumor model to study growth factors and oncogenes in hepatocarcinogenesis. Clin Cancer Res. 2003;9:2719-2726. [PubMed] |
| 15. | Zhong G, Zhang S, Li Y, Liu X, Gao R, Miao Q, Zhen Y. A tandem scFv-based fusion protein and its enediyne-energized analogue show intensified therapeutic efficacy against lung carcinoma xenograft in athymic mice. Cancer Lett. 2010;295:124-133. [PubMed] [DOI] |
| 16. | Goldenberg DM. Advancing role of radiolabeled antibodies in the therapy of cancer. Cancer Immunol Immunother. 2003;52:281-296. [PubMed] |
| 17. | Trail PA, King HD, Dubowchik GM. Monoclonal antibody drug immunoconjugates for targeted treatment of cancer. Cancer Immunol Immunother. 2003;52:328-337. [PubMed] |
| 18. | Milenic DE. Monoclonal antibody-based therapy strategies: providing options for the cancer patient. Curr Pharm Des. 2002;8:1749-1764. [PubMed] [DOI] |
| 19. | Greten TF, Korangy F, Manns MP, Malek NP. Molecular therapy for the treatment of hepatocellular carcinoma. Br J Cancer. 2009;100:19-23. [PubMed] [DOI] |
| 20. | Liu S, Wang N, Yao H, Jiang N, Lu X. Preparation and identification of monoclonal antibody against human hepatocellular carcinoma with a novel immunization. Hybridoma (Larchmt). 2009;28:43-50. [PubMed] [DOI] |
| 21. | Finn RS, Bentley G, Britten CD, Amado R, Busuttil RW. Targeting vascular endothelial growth factor with the monoclonal antibody bevacizumab inhibits human hepatocellular carcinoma cells growing in an orthotopic mouse model. Liver Int. 2009;29:284-290. [PubMed] [DOI] |
| 22. | Tozer GM, Prise VE, Wilson J, Locke RJ, Vojnovic B, Stratford MR, Dennis MF, Chaplin DJ. Combretastatin A-4 phosphate as a tumor vascular-targeting agent: early effects in tumors and normal tissues. Cancer Res. 1999;59:1626-1634. [PubMed] |
| 23. | Rybak JN, Trachsel E, Scheuermann J, Neri D. Ligand-based vascular targeting of disease. ChemMedChem. 2007;2:22-40. [PubMed] [DOI] |
| 24. | Schliemann C, Neri D. Antibody-based targeting of the tumor vasculature. Biochim Biophys Acta. 2007;1776:175-192. [PubMed] |
| 25. | Hofheinz RD, al-Batran SE, Hartmann F, Hartung G, Jäger D, Renner C, Tanswell P, Kunz U, Amelsberg A, Kuthan H. Stromal antigen targeting by a humanised monoclonal antibody: an early phase II trial of sibrotuzumab in patients with metastatic colorectal cancer. Onkologie. 2003;26:44-48. [PubMed] [DOI] |
| 26. | Ferrara N. VEGF and the quest for tumour angiogenesis factors. Nat Rev Cancer. 2002;2:795-803. [PubMed] [DOI] |
| 27. | Tseng JF, Farnebo FA, Kisker O, Becker CM, Kuo CJ, Folkman J, Mulligan RC. Adenovirus-mediated delivery of a soluble form of the VEGF receptor Flk1 delays the growth of murine and human pancreatic adenocarcinoma in mice. Surgery. 2002;132:857-865. [PubMed] [DOI] |
| 28. | Niethammer AG, Xiang R, Becker JC, Wodrich H, Pertl U, Karsten G, Eliceiri BP, Reisfeld RA. A DNA vaccine against VEGF receptor 2 prevents effective angiogenesis and inhibits tumor growth. Nat Med. 2002;8:1369-1375. [PubMed] [DOI] |
| 29. | Friedrich L, Stangl S, Hahne H, Küster B, Köhler P, Multhoff G, Skerra A. Bacterial production and functional characterization of the Fab fragment of the murine IgG1/lambda monoclonal antibody cmHsp70.1, a reagent for tumour diagnostics. Protein Eng Des Sel. 2010;23:161-168. [PubMed] [DOI] |
| 31. | Yang J, Ji S, Dong N, Zhao Y, Ruan C. Engineering and characterization of a chimeric anti-platelet glycoprotein Ibalpha monoclonal antibody and preparation of its Fab fragment. Hybridoma (Larchmt). 2010;29:125-132. [PubMed] [DOI] |
| 32. | Posey JA, Ng TC, Yang B, Khazaeli MB, Carpenter MD, Fox F, Needle M, Waksal H, LoBuglio AF. A phase I study of anti-kinase insert domain-containing receptor antibody, IMC-1C11, in patients with liver metastases from colorectal carcinoma. Clin Cancer Res. 2003;9:1323-1332. [PubMed] |
| 33. | Hunt S. Technology evaluation: IMC-1C11, ImClone Systems. Curr Opin Mol Ther. 2001;3:418-424. [PubMed] |
| 34. | Lu D, Jimenez X, Zhang H, Bohlen P, Witte L, Zhu Z. Selection of high affinity human neutralizing antibodies to VEGFR2 from a large antibody phage display library for antiangiogenesis therapy. Int J Cancer. 2002;97:393-399. [PubMed] [DOI] |
| 35. | 孙 志伟, 刘 彦仿, 马 兰花, 李 国华. 抗肝癌单链抗体融合TNFα导向作用的初步实验研究. 细胞与分子免疫学杂志. 2001;17:69-72. |