修回日期: 2010-08-30
接受日期: 2010-09-07
在线出版日期: 2010-11-18
目的: 探讨急性胰腺炎(AP)患者血浆sICAM-1、TNF-α、D-二聚体水平以及与疾病严重程度的关系.
方法: 收集轻型胰腺炎组(MAP)22例及重症胰腺炎组(SAP)34例, 全身炎症反应综合征(SIRS)组36例与非SIRS组20例, 正常对照24例. 应用ELISA检测患者血浆中sICAM-1、TNF-α和D-二聚体水平, 结果用方差分析, Pearson相关分析和ROC曲线分析.
结果: SAP组血浆中sICAM-1、D-二聚体浓度明显高于MAP组(740.18 μg/L±649.54 μg/L vs 481.18 μg/L±306.50 μg/L; 0.90 mg/L±0.20 mg/L vs 0.69 mg/L±0.19 mg/L, 均P<0.05). TNF-α浓度高于对照组, MAP组与SAP组比较无显著性差异. SIRS组患者血浆中sICAM-1、TNF-α、D-二聚体浓度明显高于非SIRS组(741.17 µg/L±592.95 µg/L vs 479.65 µg/L±451.21 µg/L; 17.82 µg/L±13.84 µg/L vs 12.09 µg/L±3.99 µg/L; 0.90 mg/L±0.17 mg/L vs 0.69 mg/L±0.23 mg/L, 均P<0.05). MAP、SAP的sICAM-1与D-二聚体相关分别为(r = 0.738, r = 0.452; 均P<0.01). TNF-α与D-二聚体无相关(r = 0.110; P = 0.420), ROC曲线显示D-二聚体诊断SAP曲线下面积更大.
结论: sICAM-1和D-二聚体在SAP升高更明显. sICAM-1、D-二聚体明显升高提示SAP诊断, 在SAP患者D-二聚体升高提示治疗应防治血栓形成.
引文著录: 李春燕, 雍桂珍, 冯迎春, 贺国斌, 向军英, 明文. 急性胰腺炎患者sICAM-1、TNF-α和D-二聚体水平与病情严重程度的关系. 世界华人消化杂志 2010; 18(32): 3480-3484
Revised: August 30, 2010
Accepted: September 7, 2010
Published online: November 18, 2010
AIM: To investigate the relationship of plasma levels of soluble intercellular adhesion molecule-1 (sICAM-1), tumor necrosis factor-alpha (TNF-α) and D-dimer with disease severity in patients with acute pancreatitis (AP).
METHODS: Thirty-four patients with severe acute pancreatitis (SAP), 22 patients with mild acute pancreatitis (MAP), 36 patients with systemic inflammatory response syndrome (SIRS), 20 patients with non-SIRS diseases, and 24 healthy volunteers were evaluated in this study. Plasma concentrations of sICAM-1, TNF-α and D-dimer were measured by ELISA. The data obtained were subjected to one-way ANOVA, Pearson correlation and ROC curve analyses.
RESULTS: There were significant differences in plasma sICAM-1 and D-dimer levels between SAP and MAP patients (740.18 μg/L ± 649.54 μg/L vs 481.18 μg/L ± 306.50 μg/L; 0.90 mg/L ± 0.20 mg/L vs 0.69 mg/L ± 0.19 mg/L, both P < 0.05). Significant difference was also noted in plasma TNF-α level between AP patients and healthy controls though there was no significant difference in plasma TNF-α level between SAP and MAP patients. Compared with the non-SIRS group, the plasma concentrations of sICAM-1, TNF-α and D-dimer were significantly higher in the SIRS group (741.17 µg/L ± 592.95 µg/L vs 479.65 µg/L ± 451.21 µg/L; 17.82 µg/L ± 13.84 µg/L vs 12.09 µg/L ± 3.99 µg/L; 0.90 mg/L ± 0.17 mg/L vs 0.69 mg/L ± 0.23 mg/L, all P < 0.05). Plasma sICAM-1 level was related to D-dimer level in both MAP (r = 0.738, P < 0.01) and SAP patients (r = 0.452, P < 0.01). Plasma TNF-α level was not correlated with D-dimer level (r = 0.110, P = 0.420). D-dimer had larger area under the ROC curve in diagnosing SAP.
CONCLUSION: Plasma sICAM-1 and D-dimer concentrations increase greatly in SAP patients. Highly elevated plasma sICAM-1 or D-dimer levels may help identify SAP.
- Citation: Li CY, Yong GZ, Feng YC, He GB, Xiang JY, Ming W. Relationship of plasma levels of sICAM-1, TNF-α and D-dimer with disease severity in patients with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3480-3484
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3480
急性胰腺炎(acute pancreatitis, AP)是消化系统常见急腹症之一, 分为轻型急性胰腺炎(mild acute pancreatitis, MAP)和重症急性胰腺炎(SAP). SAP是AP中病情危重, 可并发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 最终发展为多器官功能衰竭, 其病死率为20%-30%, 有并发症者可高达47%[1], 准确诊断疾病的严重程度有助于患者及时治疗和临床监测. Kaufmann等[2]报道AP患者血中可溶性黏附分子(soluble intercellular adhesion molecule-1, sICAM-1)升高的程度及方式与AP严重程度密切相关, 并可作为区分坏死性胰腺炎与非坏死性胰腺炎的标准. sICAM-1水平在临床上检测较少. D-二聚体为临床中常见检测指标, D-二聚体升高提示形成血栓或微血栓, 可反应胰腺微循环障碍. 本文通过检测患者血浆sICAM-1、TNF-α和D-二聚体浓度在MAP和SAP的差异, 分析sICAM-1、TNF-α是否与D-二聚体相关以及D-二聚体变化是否可提示sICAM-1变化, 这些有助于提示SAP患者诊断分型与治疗.
所有病例均为川北医学院附属医院2007-03/2010-05住院的AP患者, 参照2004年中华医学会消化病学分会胰腺病学组制定的中国急性胰腺炎诊治指南(草案)[1]收集56例AP患者, 其中MAP组22例及SAP组34例. MAP组男18例,女4例, 年龄33-70(平均48)岁; SAP组34例, 其中男16例, 女18例, 年龄20-79(平均51)岁. SIRS是指任何致病因素作用于机体所引起的全身炎症反应, 并且具备以下两项或两项以上体征[3]: 体温>38 ℃或<36 ℃; 心率>90次/分; 呼吸频率>20次/min或PaCO2<32 mmHg; 外周血白细胞计数>12×109或<4×109, 或未成熟粒细胞>10%; 据此将56例AP患者再分为SIRS组与非SIRS组, SIRS组36例, 其中男20例, 女16例, 年龄41-79(平均58)岁; 非SIRS组20例, 其中男12例, 女8例, 年龄20-63(平均44)岁. 选取健康志愿者24名作为对照组, 其中男11例, 女13例, 年龄20-75岁(平均50)岁, 均排除心、肝、肾、恶性肿瘤等器质性疾病. sICAM-1试剂盒、TNF-α试剂盒购自武汉博士德生物有限公司, D-二聚体试剂盒购自上海太阳生物技术公司.
所有患者于入院72 h时空腹抽取静脉血3 mL, 肝素抗凝, 离心后取血浆冻于-80 ℃冰箱保存备用, 采用ELISA测定血浆中sICAM-1、TNF-α和D-二聚体水平. 样本稀释倍数分别为500倍、不稀释和10倍, 所有检测均严格按说明书进行.
统计学处理 数据处理由SPSS13.0统计软件包完成, 结果以mean±SD表示. 方差分析各组之间差异, 各组之间差异用LSD方法. 各变量相关分析用Pearson方法. ROC曲线分析诊断SAP的敏感性. 双侧检验, P<0.05有统计学意义.
AP患者重症组血浆中sICAM-1、D-二聚体浓度高于轻型组血中浓度(均P<0.05, 表1). AP组TNF-α浓度高于对照组, 但MAP组与SAP组比较无显著性差异. D-二聚体最高值3.11 mg/L, 其中SAP组D-二聚体浓度88.2%高于正常值(<0.5 mg/L)1.8倍(SAP均值0.9 mg/L), 41.2%高于正常值2倍, MAP组D-二聚体浓度72.7%高于正常值1.8倍, 4.5%高于正常值2倍.
sICAM-1与D-二聚体相关, AP总的sICAM-1与D-二聚体关系(r = 0.533, P<0.01), MAP、SAP的sICAM-1与D-二聚体关系分别(r = 0.738, P<0.01, r = 0.452, P<0.01). TNF-α与D-二聚体无相关(r = 0.110; P = 0.420).
AP并发SIRS组患者血浆中sICAM-1、TNF-α、D-二聚体浓度明显高于非SIRS组患者血浆中浓度(均P<0.05, 表2).
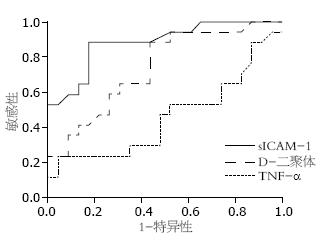
ROC的曲线显示D-二聚体诊断SAP更敏感; D-二聚体、sICAM-1、TNF-α诊断SAP的ROC的曲线下面积分别为0.882、0.739、0.458(图1).
ICAM-1属于免疫球蛋白分子超家族成员, 是一种细胞表面跨膜糖蛋白, 通过介导细胞间和细胞外基质间的黏附, 参与多种炎症反应和免疫过程. 白细胞主要是中性粒细胞自循环血液中游出并在炎症区域聚集, 是AP时胰腺损伤及导致的中心环节. sICAM-1在介导中性粒细胞稳定黏附和穿越内皮细胞向炎症区游出中起关键作用[2], 李荣洲等[4]报告MAP和SAP患者在入院第1天血清中的sICAM-1浓度无明显差异, 而入院第3、5天SAP患者血清中的sICAM-1浓度明显高于MAP患者. Kaufmann等[2]报告AP患者血中sICAM-1升高的程度及方式与AP严重程度密切相关, 并可作为区分坏死性胰腺炎与非坏死性胰腺炎的标准. 但Pezzilli等[5]对15例AP患者的研究发现SAP患者血浆sICAM-1浓度与MAP血浆中sICAM-1浓度比较无显著性差异. 此外sICAM-1水平在临床上检测较少, D-二聚体为临床中常见检测指标, 因此本研究检测sICAM-1水平及进一步分析是否与D-二聚体相关, 了解D-二聚体变化是否可提示sICAM-1变化. 本研究发现第3天, SAP组血浆中sICAM-1水平明显高于MAP组, 支持sICAM-1血浆水平与病情轻重有关, 且sICAM-1与D-二聚体相关, D-二聚体变化也可能提示sICAM-1变化.
TNF-α主要由活化的单核巨噬细胞产生, 可以促进炎症区域白细胞的积聚和激活, 激活的白细胞在其作用下又可释放如血小板活化因子, 白三烯B4、一氧化氮、血栓A2、前列腺素, 氧自由基等增强毛细血管通透性的细胞介质. TNF-α对血管内皮的黏附分子如sICAM-1有上调作用, 黏附分子的上调又可促进白细胞的黏附和收缩, 造成毛细血管渗漏和组织损害[6,7]. 研究表明, 血清TNF-α参与AP早期炎症的发生和发展, 并与病情的严重程度相关[8-13]. 本文34例SAP血浆中的TNF-α的含量表达高于MAP组, 虽无统计意义, 但提示了TNF-α与AP病情轻重的有关, 炎症介质在重症化过程中发挥重要作用. 我们进一步研究TNF-α与D-二聚体无明显相关, D-二聚体变化提示TNF-α的变化有限.
AP时, 渗出可导致血液浓缩, 致血液黏滞度增加. 加上大量炎性介质的释放, 血管内皮细胞受损, 血小板聚集, 导致AP患者尤其是SAP患者血液常处于高凝状态, 消耗凝血因子, 增加纤维蛋白降解产物的生成. D-二聚体是交联纤维蛋白被纤酶水解后形成的一种特异性降解产物, 是纤维蛋白降解产物中的最小片段[14,15]. D-二聚体水平升高提示已有凝血激活后形成血栓或微血栓, 反应了胰腺微循环障碍. AP患者D-二聚体水平升高说明了体内存在凝血和纤溶激活, SAP患者则可能进展为"弥漫性血管内凝血(disseminated intravascular coagulation, DIC)前状态", 甚至DIC[16-18]. D-二聚体也可促进局部炎症细胞合成并释放某些细胞因子[16,19]. 最近Radenkovic等[20]报道: AP患者入院时血浆中D-二聚体水平是预测其发展成多器官功能衰竭新的、准确的方法. 本研究中也显示SAP患者D-二聚体浓度明显高于MAP患者, SAP患者最高浓度高于正常值6倍, 与文献报道基本一致[15-16,21]. D-二聚体升高可反应病情严重程度, 同时提示胰腺微循环障碍, 有血栓或微血栓形成, 治疗应预防凝血系统激活形成微血栓或血栓. 进一步研究表明MAP组D-二聚体浓度高于正常值1.8倍(SAP均值0.9 mg/L)少见. ROC曲线提示D-二聚体诊断SAP比sICAM-1更敏感.
AP不仅仅是局限于胰腺和胰周组织的炎症, 他常常出现严重的并发症如SIRS[19]. SIRS时, 产生并释放大量细胞因子如TNF-α, 广泛作用于微血管系统, 促进组织因子表达并激活外源性凝血途径, 加上内皮细胞黏附分子、细胞间黏附分子的表达, 造成微循环血栓形成及组织损伤[22]. 国内陈兵等[23]报道, SIRS期2 h内TNF-α明显升高达峰值, 而后下降, 于12 h再次逐渐升高, 24 h达峰值. 张芝晶等[24]报道, SIRS患者和非SIRS患者各例相比较, SIRS组的血浆D-二聚体显著高于非SIRS组. 本研究中也显示SIRS组血浆TNF-α、sICAM-1、D-二聚体高于非SIRS组, 与文献一致[22-24].
总之, 我们研究发现, AP患者血浆D-二聚体、sICAM-1水平在SAP组和SIRS组高于MAP组和非SIRS组, 这些表明sICAM-1和D-二聚体浓度升高与AP的严重程度有关. 在SAP中D-二聚体水平升高提示治疗应考虑防治凝血系统激活. 研究sICAM-1与D-二聚体相关, D-二聚体为临床中常见检测指标, 提示诊断SAP可能比sICAM-1更敏感, D-二聚体水平明显升高提示为SAP.
急性胰腺炎(AP)是消化系统常见的急腹症之一, 重症急性胰腺炎(SAP)病情危重, 可并发全身炎症反应综合征(SIRS), 最终发展为多器官功能衰竭, 其病死率为20%-30%, 有并发症者病死率可高达47%, 准确诊断疾病的严重程度有助于患者及时治疗和临床监测.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
Kaufmann等认为AP患者血中sICAM-1升高的程度及方式与AP严重程度密切相关, 并可作为区分坏死性胰腺炎与非坏死性胰腺炎的标准. D-二聚体水平升高提示已有凝血激活后形成血栓或微血栓, 反应了胰腺微循环障碍. AP患者D-二聚体水平升高说明了体内存在凝血和纤溶激活, SAP患者则可能进展为"DIC前状态", 甚至DIC.
sICAM-1和D-二聚体浓度升高与AP的严重程度有关. 在SAP中D-二聚体水平明显升高, 治疗应考虑防治凝血系统激活. 进一步研究sICAM-1与D-二聚体相关, D-二聚体为临床中常见的检测指标, 诊断SAP可能比sICAM-1更敏感, D-二聚体水平明显升高提示为SAP.
本文科学性一般, 具有一定的临床实用价值, 为急性胰腺炎的诊断提供参考.
编辑 曹丽鸥 电编 何基才
| 2. | Kaufmann P, Demel U, Tilz GP, Krejs GJ. Time course of plasma soluble intercellular adhesion molecule-1 (sICAM-1) is related to severity of acute pancreatitis. Hepatogastroenterology. 1999;46:2565-2571. [PubMed] |
| 3. | American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med. 1992;20:864-874. [PubMed] [DOI] |
| 5. | Pezzilli R, Corsi MM, Barassi A, Morselli-Labate AM, D'Alessandro A, Dogliotti G, Fantini L, Malesci A, Corinaldesi R, Melzi d'Eril G. Serum adhesion molecules in acute pancreatitis: time course and early assessment of disease severity. Pancreas. 2008;37:36-41. [PubMed] [DOI] |
| 6. | Yadav D, Agarwal N, Pitchumoni CS. A critical evaluation of laboratory tests in acute pancreatitis. Am J Gastroenterol. 2002;97:1309-1318. [PubMed] [DOI] |
| 7. | Yamauchi J, Shibuya K, Sunamura M, Arai K, Shimamura H, Motoi F, Takeda K, Matsuno S. Cytokine modulation in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2001;8:195-203. [PubMed] [DOI] |
| 9. | Papachristou GI. Prediction of severe acute pancreatitis: current knowledge and novel insights. World J Gastroenterol. 2008;14:6273-6275. [PubMed] [DOI] |
| 12. | Sandberg AA, Borgström A. Early prediction of severity in acute pancreatitis. Is this possible? JOP. 2002;3:116-125. [PubMed] |
| 13. | Panek J, Karcz D, Pieton R, Zasada J, Tusinski M, Dolecki M, Winiarski M. Blood serum levels of proinflammatory cytokines in patients with different degrees of biliary pancreatitis. Can J Gastroenterol. 2006;20:645-648. [PubMed] |
| 14. | 周 永列, 刘 建栋. D二聚体的测定及其临床意义. 国外医学•临床生物化学与检验学分册. 1996;17:4-7. |
| 15. | 孔 浩, 丁 震, 朱 先超, 高 晓阳, 孙 圣斌, 吴 杰, 赵 刚, 王 春友, 侯 晓华. 急性胰腺炎患者血浆D-二聚体变化与病情相关性研究. 中华内科杂志. 2007;46:1011-1013. |
| 16. | Salomone T, Tosi P, Palareti G, Tomassetti P, Migliori M, Guariento A, Saieva C, Raiti C, Romboli M, Gullo L. Coagulative disorders in human acute pancreatitis: role for the D-dimer. Pancreas. 2003;26:111-116. [PubMed] [DOI] |
| 17. | Maeda K, Hirota M, Ichihara A, Ohmuraya M, Hashimoto D, Sugita H, Takamori H, Kanemitsu K, Baba H. Applicability of disseminated intravascular coagulation parameters in the assessment of the severity of acute pancreatitis. Pancreas. 2006;32:87-92. [PubMed] [DOI] |
| 18. | Agarwal N, Pitchumoni CS. Acute pancreatitis: a multisystem disease. Gastroenterologist. 1993;1:115-128. [PubMed] |
| 19. | Radenković D, Bajec D, Karamarkovic A, Stefanovic B, Milic N, Ignjatović S, Gregoric P, Milicevic M. Disorders of hemostasis during the surgical management of severe necrotizing pancreatitis. Pancreas. 2004;29:152-156. [PubMed] [DOI] |
| 20. | Radenkovic D, Bajec D, Ivancevic N, Milic N, Bumbasirevic V, Jeremic V, Djukic V, Stefanovic B, Stefanovic B, Milosevic-Zbutega G. D-dimer in acute pancreatitis: a new approach for an early assessment of organ failure. Pancreas. 2009;38:655-660. [PubMed] [DOI] |