修回日期: 2010-10-21
接受日期: 2010-10-28
在线出版日期: 2010-11-18
目的: 研究智能CT(iCT)肝脏三维重建对Glisson鞘横断肝切除的指导作用.
方法: 23例肝癌患者术前行Philips 256层iCT肝脏三期扫描, 并以iCT自带软件对肝容积和门脉行三维重建, 根据门脉类型和容积重建结果建立模拟解剖性肝切除模型. 临床用模拟模型指导临床Glisson鞘横断法肝切除并评价该模型对临床肝切除的指导作用.
结果: 23例重建肝脏容积为1 311 mL±323 mL, 肝质量为1 102 g±271 g. 针对Glisson横断法肝切除可将门脉分为规则型(Ⅰ)、左中右型(Ⅱ)、左右型(Ⅲ)和特殊型(Ⅳ). Ⅰ和Ⅱ型患者适合Glisson鞘横断肝切除, 而Ⅲ型和Ⅳ型宜需解剖Glisson鞘后阻断肝血流. 模拟切除肝模型和实际切除肝之间的肝质量无统计学差异(P>0.05).
结论: 以256层iCT 3D肝脏重建指导Glisson鞘横断肝切除不但可准确了解肝内门脉的走形和分支类型, 找到最佳Glisson鞘的阻断位置, 而且可以精确评估切除肝的容积, 保证了肝切除的精准性和安全性.
引文著录: 唐继红, 付必莽, 朱洪, 唐波, 孙勇, 张捷, 杨达宽, 何晓顺. 256层智能CT肝容积和门脉三维重建对Glisson鞘横断法肝切除的指导作用. 世界华人消化杂志 2010; 18(32): 3420-3424
Revised: October 21, 2010
Accepted: October 28, 2010
Published online: November 18, 2010
AIM: To investigate the use of three-dimensional CT angiography for preoperative evaluation of patients undergoing hepatic resection using the Glissonean pedicle transection method.
METHODS: The image data for 23 patients undergoing CT angiography with a Philips 256-slice Intelligent CT Scanner were analyzed with Philips brilliance software. Three-dimensional and maximum intensity projection (MIP) image reconstruction was performed. Based on the reconstructed data, liver segment resection models were developed to evaluate the possibility of preoperative virtual liver segment resection.
RESULTS: Based on three-dimensional reconstruction data, the average liver volume and weight, excluding the portal vein and hepatic vein, were 1 219 mL ± 191 mL and 1 451 g ± 227 g, respectively. The portal vein could be divided into four types: I, II, III and IV. Patients with types I and II portal vein were fit for hepatic resection using the Glissonean pedicle transection method. There is no significant difference in the weight of resected liver between virtual and actual hepatectomy (P > 0.05).
CONCLUSION: Three-dimensional CT angiography is a good strategy for preoperative evaluation of patients undergoing hepatic resection using the Glissonean pedicle transection method.
- Citation: Tang JH, Fu BM, Zhu H, Tang B, Sun Y, Zhang J, Yang DK, He XS. Three-dimensional CT angiography for preoperative evaluation of patients undergoing hepatic resection using the Glissonean pedicle transection method. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3420-3424
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3420.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3420
Glisson鞘在肝内的分布是肝脏分叶和分段的基础[1], 因此如何处理和阻断Glisson鞘内的管道结构以判断肝叶或肝段的血供是解剖性肝切除中的关键步骤[2]. 传统的解剖性肝切除中, 需首先解剖Glisson鞘, 然后选择性阻断鞘内供应拟切除肝段或肝叶的门静脉和肝动脉以达到减少出血、同时最大程度地减少残留肝脏缺血性损伤[2-4]. 20世纪末日本Takasaki[5]报道了Glisson鞘横断切肝法, 该法与传统解剖性肝切除方案截然不同, 因其不需要解剖Glisson鞘即可达到完全阻断需切除肝叶血供的目的而得到肯定[6]. 但是, 国内未见Glisson鞘横断法肝切除的相关临床研究报道. 究其原因可能在于肝外科医师认为不解剖Glisson鞘即直接阻断入肝管道系统存在一定的盲目感. CT三维重建不但可术前了解肝内管道结构和走行[7-9], 还可以对肝脏进行容积重建[7], 从而评价残肝体积和肝功能储备情况[10]. 256层Philips智能CT机(philips brilliance intelligent CT, iCT)临床应用为术前详细了解肝脏Glisson鞘内的结构提供理想平台[11], 克服了直接行Glisson鞘阻断的盲目性. 我们采用256层iCT术前对肝脏容积和门脉进行三维重建(three dimensional reconstruction, 3D), 研究其对Glisson鞘横断法解剖性肝切除的指导作用. 结果证实iCT肝脏容积和门脉三维重建可精确了解门脉和肝动脉在肝内分支走行, 对Glisson鞘横断法切肝具有良好的指导作用.
2009-08/2010-07收集昆明医学院第二附属医院肝胆外一科、可行根治性切除的肝癌患者23例. 其中男12例, 女11例, 年龄26-65(47±16)岁. 全组经CT平扫或MRI诊断肝脏占位且能够行肝段、联合肝段或肝叶切除达到根治水平, 甲胎蛋白升高大于正常值2倍, 无明显肝硬化, 既往无肝门区手术历. 肝功能分为Child-Pugh A级18例、B级5例.
1.2.1 扫描条件: 采用256层Philips Brilliance iCT机(philips medical systems, cleveland, USA), 扫描层厚1-2 mm, 扫描速度0.27 s/r. 对比剂为碘普罗胺注射液(优维显, 拜耳医药保健公司广州分公司), 用高压注射器经前臂肘正中静脉注射, 注射速率3-4 mL/s, 总剂量70-90 mL. 分别在注射后30 、70、120 s行动脉期、门脉期及实质期三期扫描.
1.2.2 图像重建: 采用iCT机自带Philips Brilliance Workspace Portal软件, 血管以最大密度投影(maximum indensity projection, MIP)二维或三维模式图像重建. 图像要求清晰显示肠系膜上静脉与脾静脉汇合处至肝门脉四级分支, 360度旋转观察, 排除周围结构对门脉系统的影响, 同时观察门脉各分支与肝动脉的关系及其支配的肝段, 并居于Glisson鞘横断肝切除理论为基础[5,6], 按照我们报道的分型方案进行分型[12]. 肝脏容积测定采用volume程序三维仿真重建完整肝脏, 肝脏质量根据Chan等[13]的公式计算.
统计学处理 采用SPSS16.0软件分析, 行t检验, P<0.05具有统计学意义.
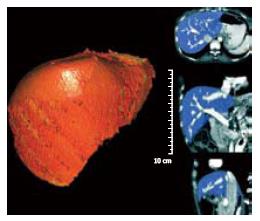
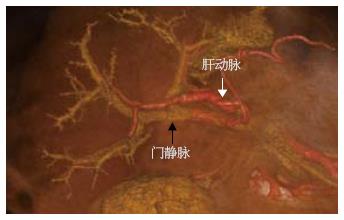
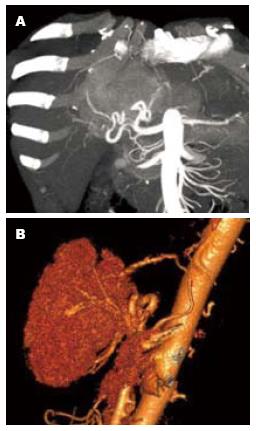
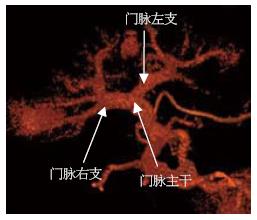
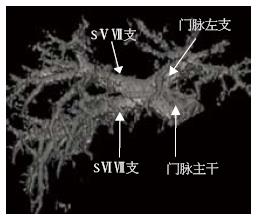
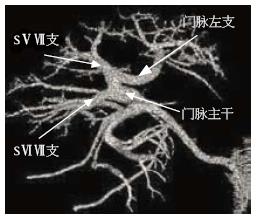
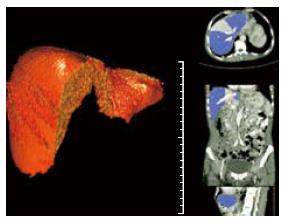
重建测定区域以完整肝被膜为界限、并且肝实质区除管道系统外无散在虚点为准, 3D重建后可以得到完整肝脏, 并观察其外部形态(图1)和内部管道结构(图2), 并且在调整窗宽和窗位的过程可以观察肝内血管和占位之间的关系(图3). 不包括二级以内门静脉和肝静脉系统在内, 23例患者平均肝脏容积为1 311 mL±323 mL, 肝质量为1 102 g±271 g.
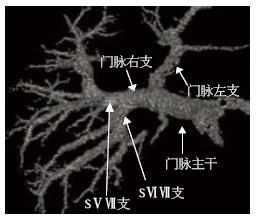
23例患者门脉一、二级分支类型可总结为以下四型: Ⅰ型: 规则型. 门脉在第一肝门后先分为左右两支, 右侧主干>1.0 cm且再分为右前叶支和右后叶支. 右前叶支分出S5、8段支, 右后叶支再分出S6、7段支. 左侧支分别出发S2、3、4段支(图4). Ⅱ型: 左中右型. 门脉进入第一肝门即分成较为均一的左、中、右3支. 右侧支再发出S6、7段, 中间支发出S5、8段, 左侧支发出S2、3、4. 或者先分为左右两支主干, 但于右侧主干1.0 cm内发出有前叶支, 后者再分为S5、8段支; 或S6、7段支直接发自门脉主干, 在发出S5、8段和S2、3、4支(图5). Ⅲ型: 左右型. 门脉进入第一肝门后分为左右两支, 右支主干的角度多大于左侧支, 且右侧主干同一水平分为较均一的3-4, 分别供应S5、6、7、8段, 而左则支则发出S2、3、4段支(图6). Ⅳ型: 特殊型. 门脉在第一肝门分成左右两支, 但是左右两侧主干无规则的肝叶或肝段分支, 包括无规则的有前叶或有后叶支; 或门脉右后页支来自门脉主干等(图7). 各型所占比率见表1.
| 分型 | n | 性别(男/女) | 比率(%) |
| Ⅰ | 9 | 4/5 | 39.1 |
| Ⅱ | 12 | 4/6 | 52.3 |
| Ⅲ | 1 | 1/0 | 4.3 |
| Ⅳ | 1 | 1/0 | 4.3 |
重建后按Takasaki Ken的理论行肝三段标志进行模拟解剖性肝切除(图8), 评估各段所占整肝容积的比例. 临床肝切除后立即称实际肝重, 对比分析模拟切除肝与实际切除肝之间的差异. 其中Ⅰ和Ⅱ患者按照Takasaki Ken的肝三段理论行解剖性临床肝切除, 并根据占位所在位置确定需切除的肝叶或段, 其中肝中段切除6例、肝左段切除8例、肝右段切除7例; 而Ⅲ和Ⅳ型者则解剖Glisson鞘后再阻断切除肝段或叶血管. 全组病例术中术后无明显并发症发生, 顺利康复出院. 术前模拟切除肝质量与实际切除肝质量比较无统计学差异(表2).
| 质量对比(g) | 占整肝百分率(%) | |||||
| 切除肝段或叶 | 左肝切除 | 中肝切除 | 右肝切除 | 左肝 | 中肝 | 右肝 |
| 模拟切除肝质量 | 446 ± 122 | 489 ± 133 | 455 ± 106 | 31.3 ± 5.1 | 33.5 ± 3.3 | 35.4 ± 5.1 |
| 实际切除肝质量 | 455 ± 88 | 471 ± 100 | 497 ± 99 | 32.5 ± 7.3 | 32.4 ± 2.7 | 34.4 ± 3.6 |
与Couinaud把肝脏的分为5叶8段的解剖不同[14], Takasaki[5,6]认为Glisson鞘及其鞘内管道在第一肝门分为左、中、右3支入肝, 分别独立支持左、中、右3个区域肝脏. 左支位于肝圆韧带水平, 中支位于胆囊颈部水平, 而右支则位于胆囊颈右下方水平. 因此, 除尾状叶外, 肝可分为左、中、右3叶, 每叶有独立的格林森系统支持. Takasaki[5]的左段叶包括Couinaud分段的S2、3、4段, 肝中叶为Couinaud分段的S5、8段, 肝右段为S6、7段, 左中右叶约各占整肝体积1/3. 如肝脏病变局限于其中一叶时, 可行相应的解剖性肝叶切除. 由于左、中、右3个肝叶具有独立的格林森系统结构, 因此可在第一肝门部不解剖格林森鞘、直接于肝实质和Glisson间的潜在间隙绕过并结扎目标肝叶Glisson鞘即可阻断目标肝叶血流而达到解剖性肝切除目的. 此法不但可减少解剖格林森系统带来的创伤, 而且减少手术时间和对肝脏的骚扰, 有利于降低医源性肿瘤转移率. Takasaki[5,6]报道一组877例肝癌患者行肝叶切除病例, 5年和10年总的生存率为63%和44%, 而单发肿瘤切除后5年和10年生存率为76%和54%, 高出其他中心20%.
门静脉供血占肝脏供血的70%, 是格林森系统内管径最大的结构, 因此门脉解剖分布决定了解肝内格林森系统的分布. Glisson鞘横断肝叶切除时, 预先或术中判断肝内管道系统的走行是避免损伤的唯一有效手段. 但由于肝脏解剖的复杂性和困难性, 术前获得第一肝门或肝内格林森系统具体走行一直是个难题, 门脉的分型与外科肝切除方案制定之间的关系也确鲜见文献报道. 3D影像技术的出解决了这个难题[8,10], 特别是256排iCT扫描的速度和层厚均明显优于64排和双源CT, 其重建技术可为更准确地了解格林森系统的详细分布提供更好的条件.
本文对23例门脉一级和二级分支类型3D重建, 结果显示门脉类型与我们以前报道相吻合、与门脉类型与Covey等[15]报道相似. 但Covey等分型更注重门脉在肝内的变异, 而本研究分型则居于Glisson鞘横断肝切除. 我们的重建显示不是所有的患者均适宜Glisson横断法切肝, 只有占91.3%的Ⅰ和Ⅱ型门脉适合采用该法, 而Ⅲ和Ⅳ型(占8.6%)的患者如果不解剖Glisson鞘而直接结扎, 则有造成阻断不彻底导致出血过多或误伤的危险. 术前采用256层iCT门脉3D重建可有效避免这一问题. 本组病例由于具有术前3D重建支持, 故21例适合Glisson横断肝切除的采用该法阻断切肝, 而特殊类型者及时调整肝切除方案, 有效避免了损伤或阻断不彻底的可能. 23例患者术中术后无任何并发症发生, 术后实际切除肝与重建模拟切除肝的质量对比结果也显示, 两者切除肝的质量无明显差异, 说明重建的可靠性并提高了解剖性肝切除的精准性.
可见, 256层iCT 3D重建获得了真实的肝容积和门脉类型, 解决了肝外科医师对肝内管道结构的抽象空间限制, 更容易理解需切除肝脏的具体界限. 因此, 以256层iCT 3D肝脏重建指导Glisson鞘横断肝切除不但可准确了解肝内门脉的走形和分支类型, 找到最佳Glisson鞘的阻断位置, 而且可以精确评估切除肝的质量和体积, 保证了肝切除的精准性和安全性.
iCT等技术的出现使得精确评估肝脏容积成为可能. Glisson鞘横断肝切除治疗肝占位病变的效果已经得到公认, 在解剖和鞘外钩扎Glisson鞘而达到目标肝段或叶的完全阻断是理想术式, 但如果没有高准确度iCT等血管和肝容积的三维重建的支持, 直接阻断目标肝段Glisson鞘就显得盲目.
李健丁, 教授, 山西医科大学第一医院放射科CT室
肝占位患者可切除容积的评估一直是肝外科的难点和重点.
Takasaki报道一组877例肝癌患者行肝叶切除病例, 5年和10年总的生存率为63%和44%, 而单发肿瘤切除后5年和10年生存率为76%和54%, 高出其他中心20%.
本研究证实了利用iCT三维重建可以更有效地开展Glisson鞘肝切除, 做到术前即可清晰了解肝内Glisson鞘的分布, 有的放矢地阻断目标肝叶或肝段, 增加了肝部分切除治疗肝占位的安全性和有效性.
本文方法科学, 具有较高的临床应用价值, 对指导临床肝切除术提供了很好的影像技术.
编辑 李军亮 电编 李薇
| 1. | Couinaud C. [The anatomy of the liver]. Ann Ital Chir. 1992;63:693-697. [PubMed] |
| 2. | Bismuth H. Surgical anatomy and anatomical surgery of the liver. World J Surg. 1982;6:3-9. [PubMed] [DOI] |
| 3. | Couinaud C. Surgical anatomy of the liver revisited. Paris: Pers ed 1989; 29-39. |
| 4. | Abdel-Misih SR, Bloomston M. Liver anatomy. Surg Clin North Am. 2010;90:643-653. [PubMed] [DOI] |
| 5. | Takasaki K. Glissonean pedicle transection method for hepatic resection: a new concept of liver segmentation. J Hepatobiliary Pancreat Surg. 1998;5:286-291. [PubMed] [DOI] |
| 6. | Takasaki K. Glissonean Pedicle TransectionMethod for Hepatic Resection. USA: Springer 2007; 1-13. |
| 8. | 钱 农, 潘 昌杰, 倪 新初, 王 翔, 刘 炜, 邵 燕惠, 薛 跃君, 荣 伟良. 多排CT三维血管成像在肝移植中的应用. 世界华人消化杂志. 2005;13:120-123. [DOI] |
| 11. | Chao SP, Law WY, Kuo CJ, Hung HF, Cheng JJ, Lo HM, Shyu KG. The diagnostic accuracy of 256-row computed tomographic angiography compared with invasive coronary angiography in patients with suspected coronary artery disease. Eur Heart J. 2010;31:1916-1923. [PubMed] [DOI] |
| 12. | 付 必莽, 张 捷, 孙 勇, 唐 继红, 顾 亚律, 唐 波, 胡 明道, 杨 达宽, 何 晓顺, 黄 洁夫. 256层智能CT精准肝切除模型的建立及临床应用. 肝胆外科杂志. 2010;18:202-205. |
| 13. | Chan SC, Liu CL, Lo CM, Lam BK, Lee EW, Wong Y, Fan ST. Estimating liver weight of adults by body weight and gender. World J Gastroenterol. 2006;12:2217-2222. [PubMed] |
| 14. | Hwang S, Lee SG, Choi ST, Moon DB, Ha TY, Lee YJ, Park KM, Kim KH, Ahn CS, Kim KK. Hepatic vein anatomy of the medial segment for living donor liver transplantation using extended right lobe graft. Liver Transpl. 2005;11:449-455. [PubMed] [DOI] |
| 15. | Covey AM, Brody LA, Getrajdman GI, Sofocleous CT, Brown KT. Incidence, patterns, and clinical relevance of variant portal vein anatomy. AJR Am J Roentgenol. 2004;183:1055-1064. [PubMed] |