修回日期: 2010-09-13
接受日期: 2010-09-25
在线出版日期: 2010-11-08
目的: 探讨肝炎病毒与酒精引起的肝硬化防治的不同侧重点.
方法: 选取2004-04/2009-05大连医科大学第一附属医院住院的952例肝硬化患者, 按照病因不同分为肝炎后肝硬化(viral cirrhosis, VC)组、酒精性肝硬化(alcoholic cirrhosis, AC)组以及酒精与肝炎病毒混合性因素所致肝硬化(AC+VC)组, 对比3组肝硬化患者性别、入院时年龄、病程、临床表现、肝功能分级、并发症, 以及直接死因等差异.
结果: 在所有肝硬化中, VC所占比例最大(63.66%), AC居第2位. AC+VC组中最多见的是酒精+乙型肝炎患者, 占该组肝硬化总数的2/3以上. 3组肝硬化患者均以男性为主, AC组尤为突出(男∶女 = 48.5∶1). VC组与AC+VC组脾大的发生率明显高于AC组; 3组肝硬化最常见的并发症都是上消化道出血. VC组原发性肝癌的发生率较AC组高, 而AC组自发性腹膜炎的发生率明显高于VC组, 二者差异显著(13.1% vs 5.2%, P<0.01); 无论是VC组还是AC组, 最常见的死亡原因都是肝性脑病, 然后依次是上消化道出血和原发性肝癌. AC+VC组最常见的死因是原发性肝癌.
结论: 对于肝炎后肝硬化和酒精性肝硬化患者, 积极预防上消化道出血和肝性脑病的发生是防治病情加重的关键, 对于后者还要加强预防肠道感染, 而对于混合因素存在的肝硬化则要更加积极防治原发性肝癌的发生.
引文著录: 周永莉, 段志军. 肝炎后肝硬化与酒精性肝硬化患者临床特征的比较及防治. 世界华人消化杂志 2010; 18(31): 3313-3319
Revised: September 13, 2010
Accepted: September 25, 2010
Published online: November 8, 2010
AIM: To compare the clinical characteristics, prophylaxis and treatment between viral and alcoholic cirrhosis.
METHODS: The clinical data for 952 cirrhotic patients who were treated at the First Affiliated Hospital of Dalian Medical University form April 2004 to May 2009 were collected. These patients were divided into three groups: viral cirrhosis (VC) group, alcoholic cirrhosis (AC) group, and VC plus AC group. Sex, age, medical history, clinical manifestations, liver function, complications, and the main cause of death were compared among the three groups of patients.
RESULTS: Of all cases, 63.66% had VC. In the VC plus AC group, two-thirds of patients had alcoholic hepatitis and hepatitis B. Male patients were more commonly seen in the three groups, especially in the AC group (M∶F = 48.5∶1). Compared to the AC group, the VC group and VC plus AC group had a high prevalence of splenomegaly. Upper gastrointestinal bleeding was the most common complication in all the groups. The prevalence of hepatocellular carcinoma in the VC group was higher than that in the AC group, and the prevalence of spontaneous bacterial peritonitis in the AC group was higher than that in the VC group (13.1% vs 5.2%, P < 0.01). Hepatic encephalopathy was the common death cause in both the VC and AC groups, followed by upper gastrointestinal bleeding and hepatocellular carcinoma. The most common cause of death in the AC plus VC group was hepatocellular carcinoma.
CONCLUSION: Prophylaxis and treatment of upper gastrointestinal bleeding and hepatic encephalopathy are important for patients with AC or VC. Prophylaxis of intestinal infection is important for AC patients. Prophylaxis of hepatocellular carcinoma is important for patients with both AC and VC.
- Citation: Zhou YL, Duan ZJ. Viral versus alcoholic cirrhosis: clinical characteristics, prophylaxis and treatment. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3313-3319
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3313
肝硬化(liver cirrhosis)是一世界性疾病, 年死亡人数约50-70万人, 占所有死亡病例的2.7%. 发达国家每年因肝硬化而死亡的人数居死亡原因第5位[1-4]. 引起肝硬化的病因很多, 但以肝炎病毒感染所致的肝炎后肝硬化(viral cirrhosis, VC)和慢性酒精中毒引起的酒精性肝硬化(alcoholic cirrhosis, AC)最常见. 不同国家不同地区、不同年龄段其疾病特点、病因和发病率也有较大差异. 西方发达国家AC占所有肝硬化的2/3以上, 而VC尤其是乙型肝炎后肝硬化则是我国肝硬化的主要组成部分, 近年来AC的发病率逐年上升[5-7]. 目前肝硬化的治疗除了肝移植外尚无确切、有效的根治方法[8,9]. 研究表明肝硬化的形成、发展除与病毒感染或慢性酒精中毒等所致的特殊病理改变有关外, 还与临床治疗策略偏差有重要关系[10,11]. 早期经过积极防治可以延缓病程进展, 一旦肝硬化形成后治疗非常困难, 而且一部分会进展为肝癌, 预后极差, 因此肝硬化的早期防治非常重要[12,13]. 国内外多项临床研究显示, AC与VC在早期阶段, 二者发病过程、临床表现以及对治疗的反应等方面有很大差别[7,14]. 因此, 对比分析不同原因肝硬化在临床表现、并发症、治疗预后等方面异同, 对不同的患者进行有针对性的预防及治疗是非常必要的. 以往也有不少学者比较这两种常见病因肝硬化的临床特点, 但是样本量都偏小, 且只是针对部分临床表现加以对比, 缺乏大样本、全方位的分析. 因此, 本研究旨在通过大样本的临床病例分析, 对比两种常见病因肝硬化的临床表现、并发症和治疗预后等方面异同, 从而对不同病因的肝硬化患者作出有针对性的预防及治疗策略.
收集2004-04/2009-05在大连医科大学附属第一医院消化内科住院的明确诊断为肝硬化患者的入院时病历资料并收集最终死亡患者病历资料(本研究所收集资料均经患者及其家属同意并签署知情同意书, 且经过院伦理会批准后采集的, 所有患者治疗上均采用大连医科大学附属第一医院规范的保肝、利尿和防治并发症方案). 根据下述诊断标准及排除标准共入选VC 656例、AC 198例, VC+AC 98例. 诊断标准如下: VC的发生与肝炎病毒(hepatitis virus, HV)感染密切相关[15-17], 需具备以下条件者即可诊断为VC: 有慢性肝炎病史和(或)HBV、HCV的抗原抗体标记或DNA检查阳性; 有肝功能减退和门脉高压的临床表现, 影像学检查支持肝硬化改变; 除外饮酒等其他原因引起的肝硬化. 根据2006年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组推行的酒精性肝病诊疗指南[18], AC的诊断标准为: 具有长期大量饮酒史, 每日摄入酒精量>40 g, 连续5年以上; 临床上有肝功能减退及门脉高压的表现, 影像学检查支持肝硬化改变; 无肝炎病史, HV标记阴性; 除外其他类型肝硬化(如: 胆汁性、血吸虫性、肝吸虫性肝硬化等). AC+VC诊断标准为: 具有上述两种病因并存, 有肝功能减退和门脉高压的临床表现, 影像学检查支持肝硬化改变. 排除标准: 除酒精性、HV因素之外的其他原因引起的肝硬化, 如胆汁淤积性肝硬化、循环障碍性肝硬化、自身免疫性肝硬化、毒物和药物性肝硬化、代谢性肝硬化、营养不良性肝硬化、血吸虫性肝硬化、先天梅毒性肝硬化、隐源性肝硬化以及非酒精性脂肪性肝病等原因引起的肝硬化.
1.2.1 一般情况: 记录入选肝硬化患者的性别、年龄、病程资料进行对比分析.
1.2.2 对比3组肝硬化患者的临床表现异同: 包括: 肝病面容、乏力、腹胀、食欲下降、肝区疼痛、黄疸、双下肢水肿、鼻衄、齿龈出血、肝掌、蜘蛛痣及腹水、脾大、食管胃底静脉曲张和其他侧枝循环建立情况, 并记录患者入院时肝功能Child-Pugh情况. 所有资料均来自于患者入院时全面系统的病史采集、规范的体格检查及实验检查数据和胃镜、彩超、CT及核磁共振结果.
1.2.3 对比3组肝硬化常见并发症的发生率: 上消化道出血(upper gastrointestinal bleeding, HGB)、原发性肝癌(hepatocellular carcinoma, HCC)、肝性脑病(hepatic encephalopathy, HE)、肝肾综合征(hepatorenal syndrome, HRS)及自发性腹膜炎(spontaneous bacterial peritonitis, SBP).
1.2.4 分别统计3组肝硬化患者直接死因: 对比分析不同病因对于肝硬化患者直接死因构成的影响.
统计学处理 所有数据均输入SPSS13.0软件进行分析. 计数资料采用χ2检验, 计量资料采用多组独立样本的秩和检验, 以P<0.05(双侧)为差异有统计学意义. 3组之间两两比较时, 按照校正检验水准取α = 0.05/3 = 0.0167.
在各种不同病因的肝硬化中, VC所占比例最大(63.66%), AC居第2位, 占19.17%, AC+VC占9.50%, 其他原因肝硬化占7.63%. 其中乙型肝炎后肝硬化占所有肝硬化总数的一半以上, 丙型肝炎后肝硬化占7.36%, 乙型肝炎与丙型肝炎重叠感染所致的肝硬化占1.74%. 在AC+VC组中, 最多见的是酒精+乙型肝炎患者, 占该组肝硬化总数的2/3以上. 所有肝硬化患者均以男性为主, 尤以AC组突出(男∶女 = 48.5∶1). 在发病年龄方面, VC组平均发病年龄最大, AC组最小, AC+VC最居中, VC与AC及AC+VC组之间之间差异显著(P = 0.001, P = 0.002, 表1).
(1)3组肝硬化患者在乏力、腹胀、食欲下降、肝区疼痛、黄疸、鼻衄、齿龈出血、肝掌、腹水、双下肢水肿、食管胃底静脉曲张及其他侧枝循环建立(包括腹壁静脉曲张、腹膜后静脉曲张、肝门区及脾门区静脉曲张)和肝功能Child-Pugh分级方面无统计学差异(均P>0.05). (2)在脾大、蜘蛛痣、肝病面容方面三者之间差异显著. VC组与AC+VC组脾大的发生率明显高于AC组,差异有统计学意义(P = 0.000, P = 0.012). AC组与AC+VC组蜘蛛痣的发生率明显高于VC组, 差异有统计学意义(P = 0.004, P = 0.008). 在肝性面容方面VC组以面色晦暗为主, AC组则以面部毛细血管扩张多见, 二者差异显著(P = 0.000), AC+VC组以面色晦暗为主, 但与VC组和AC组之间无统计学差异(P = 0.032, 表2).
在所有并发症中各组HGB的发生率均居第1位. VC组和AC+VC组中, 按照其并发症发生率的高低排在前3位的分别是HGB、HCC和HE. 而AC组患者的并发症中居前3位的依次是HGB、HE和HCC. AC组SBP的发生率较VC组高, 二者差异显著(P = 0.000). VC组与AC+VC组HCC的发生率明显高于AC组, 差异有统计学意义(P = 0.000, P = 0.004, 表3).
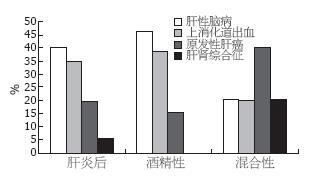
无论是AC组还是VC组最常见的直接死亡原因均为HE, 然后依次是HGB和HCC. AC+VC组常见的死亡原因依次是HCC、HE、HGB和HRS. 3组肝硬化直接死因之间无统计学差异(图1).
本研究表明, 在我国大连地区肝炎病毒感染仍然是肝硬化最常见的病因, 酒精性因素居第2位. 本研究中乙型肝炎后肝硬化占所有肝硬化总数的一半以上, 丙型肝炎后肝硬化占7.36%, 乙型肝炎与丙型肝炎重叠感染所致的肝硬化占1.74%. 研究表明HCC的发生与乙型肝炎病毒基因型有关, 乙型肝炎病毒分为A、B、C、D、E、F、G、H 8个基因型, 而基因型C和F发生HCC的风险较高. 与乙型肝炎病毒C基因型相比, 基因型B进展至肝硬化的时间较长, 发生HCC的几率相对较低[19-26]. 丙型肝炎与乙型肝炎病毒重叠感染者发生HCC的危险性更高[27]. 因此, 应该加强医学知识宣传, 最大限度的长期、持续抑制或清除肝炎病毒, 尽量延缓肝炎向肝硬化、肝癌的进展. 在性别比例方面, 肝硬化患者均以男性为主, AC组尤其明显(男∶女 = 48.5∶1). 不排除与我国饮酒者男性居多, 女性较少饮酒有关. VC平均年龄比AC组及混合组均高, 差异有统计学意义, 这与国内外文献报道基本一致[28,29]. 韩国一项长达10年的病例随访研究发现, 年龄是乙型肝炎进展至肝硬化以及肝癌的独立性致病因素, 也就是说对于乙型肝炎患者, 年龄越大发生HCC的危险性越高[30].
在腹胀、乏力、食欲下降、肝区疼痛、腹水、侧枝循环建立(包括食管胃底静脉曲张、腹壁静脉曲张、腹膜后静脉曲张、肝门区及脾门区静脉曲张)、双下肢浮肿、黄疸、鼻衄、齿龈出血以及肝功能Child-Pugh分级等方面AC与VC两组之间差异无统计学意义(P>0.05). 本研究显示VC患者的肝病面容主要以面色晦暗为主, 而AC患者则多表现为面部及颈部毛细血管扩张. 因此, 对于慢性肝损害门脉高压患者, 其面部特征在某种程度上可能会对病因推断有一定的指导意义. AC患者蜘蛛痣的出现较VC患者多见, 这可能与酒精影响肝脏芳香化酶活性, 使雄激素转化为雌激素增加有关. VC患者脾大的发生率较AC患者明显升高, 二者差异有统计学意义(P = 0.000), 因此对于VC脾大的患者应该注意加强感染与出血的预防. 肝硬化脾大的发病机制目前尚不清楚, 多数学者认为与肝硬化时门静脉高压, 脾脏血液回流受阻, 引起脾脏淤血、水肿及炎症反应有关[31], 但对于VC患者脾大的发生率高于AC患者, 其具体机制有待于进一步研究. 金国花等[32]研究发现乙型肝炎后肝硬化全血细胞减少患者如做脾切除术, 血小板升高可能不明显, 而AC全血细胞减少患者做脾切除术血小板升高较明显, 因其血小板减少主要是外周破坏所致, 这对肝硬化全血细胞减少而有严重出血倾向的患者是否选择脾切除术有一定的指导意义.
本研究显示VC与AC患者HGB的发生率分别为37.50%和44.40%, 在肝硬化各种并发症中居首位, 当慢性酒精中毒与肝炎病毒感染共同损伤时HGB发生率则更高(46.9%), 因此, 对后者应提早胃镜随诊, 早发现早预防. 本研究资料显示VC患者HCC的发生率明显高于AC患者, 二者差异具有统计学意义(P = 0.000), 而酒精性因素与肝炎病毒感染共同参与者则HCC的发生率更高, 占30.6%, 这一结果证实了"酒精与肝炎病毒在肝脏损伤方面有协同作用"的观点[33-35]. 因此, 对于既有肝炎病毒感染又有慢性酒精中毒两种混合性因素参与的肝硬化患者, 应该积极戒酒并及早抗病毒治疗, 预防肝癌发生. 本研究发现AC患者SBP的发生率明显高于VC患者, 分别为13.1%和5.2%, 二者差异有统计学意义(P = 0.000). 国外有研究表明, AC患者易发生小肠内细菌过度生长, 而SBP的发生与小肠内细菌过度生长、肠道运动功能异常有关[36-38]. 美国的一项关于382例肝硬化患者的回顾性研究显示, AC患者SBP的发生率高于非AC患者, 酒精是肝硬化患者并发SBP的易感因素[39]. 因此, 对于AC患者应该注意加强肠道菌群调节治疗. 本研究显示, 对于AC, HE是除HGB之外第2大常见并发症, 其发病率有高于VC组及混合组的趋势, 但3组相比差异无统计学意义. 3组肝硬化最常见的死亡原因都是肝性脑病, 其次为HGB和HCC, 这与国外研究一致[40,41]. 因此, 对于肝硬化晚期患者应积极预防感染、出血、便秘及电解质紊乱等肝性脑病诱因发生.
总之, 肝硬化男性患者发病率较女性高, 尤以AC为著. AC患者平均年龄相对较小, 蜘蛛痣与面部毛细血管扩张更多见, 而VC脾大及面色晦暗发生率较高. 肝硬化患者最常见的并发症是HGB, 最主要的死亡原因则是HE. AC患者的SBP的发生率较VC患者高, VC患者更易发生HCC, 而对于酒精与肝炎病毒混合性因素所导致的肝硬化患者其HCC发生率更高. 文献报道提示, 持续的HBeAg阳性和/或HBV DNA>2 000 IU/mL是肝硬化、肝癌非常重要的危险因素[20,42-45]. 因此对于VC患者最大限度的抑制或清除肝炎病毒, 尽早使HBeAg阳性患者转阴, 或努力将HBV DNA病毒数量控制在2 000 IU/mL以下, 积极预防肝硬化进展及肝癌的发生是治疗的关键. 对于AC患者, 戒酒是首要任务. 嗜酒是SBP的易感因素, 因此应注意调节AC患者肠道菌群失调、预防感染, 避免SBP的发生.
本研究下一步将注重观察上述防治侧重点在临床应用中对肝硬化患者预后的实际作用. 肝硬化的防治作为世界性难题急切需要新的诊治手段研制和应用. 近年来随着无创性肝纤维化诊断指标的研究越来越多, 肝纤维化的有效治疗已经成为可能[46-48]. 随着基因序列信息研究的不断进展, 有理由相信今后关于肝硬化相关基因及其功能的研究将会为肝硬化的防治提供新的、更加有效的技术平台.
肝硬化是一世界性疾病, 年死亡人数约50-70万. 肝硬化的病因很多, 最常见的是肝炎病毒感染和慢性酒精中毒. 目前肝硬化的治疗除了肝移植外尚无确切、有效的根治方法.
范小玲, 主任医师, 北京地坛医院综合科
目前除肝移植外, 肝硬化尚无确切有效的治疗方法, 这是世界性难题.
美国的一项关于382例肝硬化患者的回顾性研究显示, AC患者SBP的发生率高于非AC患者, 酒精是肝硬化患者并发SBP的易感因素.
本研究通过大样本的临床病例分析, 对比两种常见病因肝硬化的临床表现、并发症和治疗预后等方面异同, 从而对不同病因的肝硬化患者作出有针对性的预防及治疗策略.
把对不同病因肝硬化的防治侧重点应用于指导临床, 将对肝硬化的防治起到非常重要的作用.
本文结果分析可靠, 具有一定的临床价值.
编辑 李薇 电编 何基才
| 1. | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat. 2004;11:97-107. [PubMed] [DOI] |
| 3. | Kondili LA, Taliani G, Cerga G, Tosti ME, Babameto A, Resuli B. Correlation of alcohol consumption with liver histological features in non-cirrhotic patients. Eur J Gastroenterol Hepatol. 2005;17:155-159. [PubMed] [DOI] |
| 4. | Zatoński WA, Sulkowska U, Mańczuk M, Rehm J, Boffetta P, Lowenfels AB, La Vecchia C. Liver cirrhosis mortality in Europe, with special attention to Central and Eastern Europe. Eur Addict Res. 2010;16:193-201. [PubMed] [DOI] |
| 5. | Rehm J, Mathers C, Popova S, Thavorncharoensap M, Teerawattananon Y, Patra J. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders. Lancet. 2009;373:2223-2233. [PubMed] [DOI] |
| 6. | Tao N, Sussman S, Nieto J, Tsukamoto H, Yuan JM. Demographic characteristics of hospitalized patients with alcoholic liver disease and pancreatitis in los angeles county. Alcohol Clin Exp Res. 2003;27:1798-1804. [PubMed] [DOI] |
| 8. | Horiguchi K, Hirano T, Ueki T, Hirakawa K, Fujimoto J. Treating liver cirrhosis in dogs with hepatocyte growth factor gene therapy via the hepatic artery. J Hepatobiliary Pancreat Surg. 2009;16:171-177. [PubMed] [DOI] |
| 9. | Sugawara Y, Makuuchi M. Liver transplantation for hepatitis B-related cirrhosis: recent advances. J Hepatobiliary Pancreat Surg. 2006;13:378-381. [PubMed] [DOI] |
| 10. | Liang TJ. Hepatitis B: the virus and disease. Hepatology. 2009;49:S13-S21. [PubMed] [DOI] |
| 11. | Liaw YF, Leung N, Kao JH, Piratvisuth T, Gane E, Han KH, Guan R, Lau GK, Locarnini S. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int. 2008;2:263-283. [PubMed] [DOI] |
| 12. | Wang Y, Liu YH, Mai SJ, He LJ, Liao YJ, Deng HX, Guan XY, Zeng YX, Kung HF, Xie D. Evaluation of serum clusterin as a surveillance tool for human hepatocellular carcinoma with hepatitis B virus related cirrhosis. J Gastroenterol Hepatol. 2010;25:1123-1128. [PubMed] [DOI] |
| 13. | Gramenzi A, Caputo F, Biselli M, Kuria F, Loggi E, Andreone P, Bernardi M. Review article: alcoholic liver disease--pathophysiological aspects and risk factors. Aliment Pharmacol Ther. 2006;24:1151-1161. [PubMed] [DOI] |
| 14. | Toshikuni N, Izumi A, Nishino K, Inada N, Sakanoue R, Yamato R, Suehiro M, Kawanaka M, Yamada G. Comparison of outcomes between patients with alcoholic cirrhosis and those with hepatitis C virus-related cirrhosis. J Gastroenterol Hepatol. 2009;24:1276-1283. [PubMed] [DOI] |
| 19. | Chu CM, Liaw YF. Genotype C hepatitis B virus infection is associated with a higher risk of reactivation of hepatitis B and progression to cirrhosis than genotype B: a longitudinal study of hepatitis B e antigen-positive patients with normal aminotransferase levels at baseline. J Hepatol. 2005;43:411-417. [PubMed] [DOI] |
| 20. | Yu MW, Yeh SH, Chen PJ, Liaw YF, Lin CL, Liu CJ, Shih WL, Kao JH, Chen DS, Chen CJ. Hepatitis B virus genotype and DNA level and hepatocellular carcinoma: a prospective study in men. J Natl Cancer Inst. 2005;97:265-272. [PubMed] [DOI] |
| 21. | Kao JH. Role of viral factors in the natural course and therapy of chronic hepatitis B. Hepatol Int. 2007;1:415-430. [PubMed] [DOI] |
| 22. | Livingston SE, Simonetti JP, Bulkow LR, Homan CE, Snowball MM, Cagle HH, Negus SE, McMahon BJ. Clearance of hepatitis B e antigen in patients with chronic hepatitis B and genotypes A, B, C, D, and F. Gastroenterology. 2007;133:1452-1457. [PubMed] [DOI] |
| 23. | Ni YH, Chang MH, Wang KJ, Hsu HY, Chen HL, Kao JH, Yeh SH, Jeng YM, Tsai KS, Chen DS. Clinical relevance of hepatitis B virus genotype in children with chronic infection and hepatocellular carcinoma. Gastroenterology. 2004;127:1733-1738. [PubMed] [DOI] |
| 24. | Mahmood S, Niiyama G, Kamei A, Izumi A, Nakata K, Ikeda H, Suehiro M, Kawanaka M, Togawa K, Yamada G. Influence of viral load and genotype in the progression of Hepatitis B-associated liver cirrhosis to hepatocellular carcinoma. Liver Int. 2005;25:220-225. [PubMed] [DOI] |
| 25. | Kao JH, Chen PJ, Lai MY, Chen DS. Hepatitis B virus genotypes and spontaneous hepatitis B e antigen seroconversion in Taiwanese hepatitis B carriers. J Med Virol. 2004;72:363-369. [PubMed] [DOI] |
| 26. | Chan HL, Hui AY, Wong ML, Tse AM, Hung LC, Wong VW, Sung JJ. Genotype C hepatitis B virus infection is associated with an increased risk of hepatocellular carcinoma. Gut. 2004;53:1494-1498. [PubMed] |
| 27. | Kew MC. Interaction between hepatitis B and C viruses in hepatocellular carcinogenesis. J Viral Hepat. 2006;13:145-149. [PubMed] [DOI] |
| 28. | Syed VA, Ansari JA, Karki P, Regmi M, Khanal B. Spontaneous bacterial peritonitis (SBP) in cirrhotic ascites: a prospective study in a tertiary care hospital, Nepal. Kathmandu Univ Med J (KUMJ). 2007;5:48-59. [PubMed] |
| 29. | Shen Z, Li YM, Yu CH, Shen Y, Xu L, Xu CF, Chen JJ, Ye H, Xu GY. Risk factors for alcohol-related liver injury in the island population of China: a population-based case-control study. World J Gastroenterol. 2008;14:2255-2261. [PubMed] [DOI] |
| 30. | Park BK, Park YN, Ahn SH, Lee KS, Chon CY, Moon YM, Park C, Han KH. Long-term outcome of chronic hepatitis B based on histological grade and stage. J Gastroenterol Hepatol. 2007;22:383-388. [PubMed] [DOI] |
| 31. | Djordjević J, Svorcan P, Vrinić D, Dapcević B. [Splenomegaly and thrombocytopenia in patients with liver cirrhosis]. Vojnosanit Pregl. 2010;67:166-169. [PubMed] |
| 33. | Mueller S, Millonig G, Seitz HK. Alcoholic liver disease and hepatitis C: a frequently underestimated combination. World J Gastroenterol. 2009;15:3462-3471. [PubMed] [DOI] |
| 34. | Plumlee CR, Lazaro CA, Fausto N, Polyak SJ. Effect of ethanol on innate antiviral pathways and HCV replication in human liver cells. Virol J. 2005;2:89. [PubMed] [DOI] |
| 35. | Kim KA. Current status of liver diseases in Korea: toxic and alcoholic liver diseases. Korean J Hepatol. 2009;15 Suppl 6:S29-S33. [PubMed] [DOI] |
| 36. | Strauss E, Aerosa JP. [Alcoholic hepatitis: bad prognosis due to concomitant bacterial infections]. Rev Soc Bras Med Trop. 2004;37:199-203. [PubMed] [DOI] |
| 37. | Chang CS, Chen GH, Lien HC, Yeh HZ. Small intestine dysmotility and bacterial overgrowth in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology. 1998;28:1187-1190. [PubMed] [DOI] |
| 38. | Casafont Morencos F, de las Heras Castaño G, Martín Ramos L, López Arias MJ, Ledesma F, Pons Romero F. Small bowel bacterial overgrowth in patients with alcoholic cirrhosis. Dig Dis Sci. 1996;41:552-556. [PubMed] [DOI] |
| 39. | Rosa H, Silvério AO, Perini RF, Arruda CB. Bacterial infection in cirrhotic patients and its relationship with alcohol. Am J Gastroenterol. 2000;95:1290-1293. [PubMed] [DOI] |
| 40. | Pathak OK, Paudel R, Panta OB, Pant HP, Giri BR, Adhikari B. Retrospective study of the clinical profile and prognostic indicators in patients of alcoholic liver disease admitted to a tertiary care teaching hospital in Western Nepal. Saudi J Gastroenterol. 2009;15:171-175. [PubMed] [DOI] |
| 41. | Spadaro A, Luigiano C, De Caro G, Morace C, Tortorella V, Bonfiglio C, Pagano N, Consolo P, Alibrandi A, Ajello A. Prognostic factors of survival in complicated viral and alcoholic cirrhosis without hepatocellular carcinoma. A retrospective study. Minerva Gastroenterol Dietol. 2007;53:311-319. [PubMed] |
| 42. | Yang HI, Lu SN, Liaw YF, You SL, Sun CA, Wang LY, Hsiao CK, Chen PJ, Chen DS, Chen CJ. Hepatitis B e antigen and the risk of hepatocellular carcinoma. N Engl J Med. 2002;347:168-174. [PubMed] [DOI] |
| 43. | Iloeje UH, Yang HI, Su J, Jen CL, You SL, Chen CJ. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology. 2006;130:678-686. [PubMed] [DOI] |
| 44. | Chen CJ, Yang HI, Su J, Jen CL, You SL, Lu SN, Huang GT, Iloeje UH. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA. 2006;295:65-73. [PubMed] |
| 45. | Chou YC, Yu MW, Wu CF, Yang SY, Lin CL, Liu CJ, Shih WL, Chen PJ, Liaw YF, Chen CJ. Temporal relationship between hepatitis B virus enhancer II/basal core promoter sequence variation and risk of hepatocellular carcinoma. Gut. 2008;57:91-97. [PubMed] |
| 46. | Bataller R, Brenner DA. Hepatic stellate cells as a target for the treatment of liver fibrosis. Semin Liver Dis. 2001;21:437-451. [PubMed] [DOI] |
| 47. | Thabut D, Imbert-Bismut F, Cazals-Hatem D, Messous D, Muntenau M, Valla DC, Moreau R, Poynard T, Lebrec D. Relationship between the Fibrotest and portal hypertension in patients with liver disease. Aliment Pharmacol Ther. 2007;26:359-368. [PubMed] [DOI] |
| 48. | Iredale JP. A cut above the rest? MMP-8 and liver fibrosis gene therapy. Gastroenterology. 2004;126:1199-1201. [PubMed] [DOI] |