修回日期: 2009-12-19
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 观察伊立替康(CPT-11)联合奈达铂(NDP)二线治疗晚期食管鳞癌的疗效及不良反应.
方法: 依照开放原则, 24例经组织学证实的食管鳞状细胞癌患者一线化疗疾病进展(PD)者, 按CPT-11 65 mg/m2在第1-8天1 h内静脉输注, 然后NDP 80 mg/m2第12 h内静脉输注, 21 d为1周期. 每化疗2周期后按RECIST标准评价疗效, 每1周期后根据CTCAE3.0进行不良反应分级. 所有患者随访24 mo, 结果采用Kaplan-Meier进行生存分析.
结果: 24例均可评价疗效, 完全缓解(CR)1例(4%), 部分缓解(PR)5例(21%), 稳定(SD)7例(29%), PD 11例(46%), 有效率25%(CR+PR), 疾病控制率54%(CR+PR+SD); 中位生存时间(OS)248.5 d(95%CI: 159-563 d), 中位至疾病进展时间(TTP)131 d(95%CI: 45-382 d). 3级血液学毒性: 贫血1例(4%), 中性粒细胞减少4例(17%), 白细胞减少5例(21%), 血小板减少1例
(4%). 仅有1例4级中性粒细胞减少, 研究中未观察到3-4级非血液学毒性, 无治疗相关性死亡.
结论: 伊立替康联合奈达铂二线治疗晚期食管鳞癌的近期疗效显著, 不良反应轻, 耐受性好.
引文著录: 刘莺, 梁冰, 刘文静, 王居峰, 樊青霞. 伊立替康联合奈达铂二线治疗晚期食管鳞癌24例. 世界华人消化杂志 2010; 18(3): 298-302
Revised: December 19, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To evaluate the efficacy and safety of combined chemotherapy with irinotecan and nedaplatin as a second-line regimen for advanced esophageal cancer.
METHODS: An open trial was performed. Twenty-four patients with histopathologically confirmed esophageal squamous cell carcinoma who received combination chemotherapy with irinotecan and nedaplatin as a second-line regimen were evaluated. The combination therapy consisted of intravenous administration of irinotecan 65 mg/m2 over 1 hour on days 1 and 8 of a 21-day cycle, and nedaplatin 80 mg/m2 over 2 hours on day 1. Efficacy was evaluated every 6 weeks (two cycles) according to RECIST criteria. Toxic side effects were graded based on CTCAE 3.0 criteria after each cycle. The follow-up period was 24 months. Survival analysis was performed using the Kaplan-Meier method.
RESULTS: All the 24 patients were assessable for response. In the study, one patient (4%) experienced complete remission (CR), 5 (21%) partial remission (PR), 7 (29%) stable disease (SD), and 11 (46%) progressive disease(PD). The overall response rate (CR + PR) was 25%, and the disease control rate (CR + PR + SD) was 54%. The median overall survival (OS) time was 248.5 d (95% confidence interval [CI]: 159-563 d), and median time to disease progression (TTP) was 131 d (95%CI: 45-382 d). Severe hematological adverse events (grade 3) included: anemia (n = 1; 4%), neutropenia (n = 4; 25%), leucopenia (n = 5; 21%), and thrombocytopenia (n =1; 4%). Grade 4 neutropenia was observed in only one patient (4%). No grade 3-4 nonhematological adverse events occurred. No treatment-related deaths were observed.
CONCLUSION: Combined therapy with irinotecan and nedaplatin as a second-line regimen is effective, safe and well-tolerated in patients with advanced esophageal squamous cell carcinoma.
- Citation: Ying-Liu, Bing-Liang, Liu WJ, Wang JF, Fan QX. Combined chemotherapy with irinotecan and nedaplatin as a second-line regimen for patients with advanced esophageal squamous cell carcinoma: a report of 24 cases. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 298-302
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/298.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.298
食管癌的发病占所有恶性肿瘤的2%, 全世界每年有22万人死于食管癌. 我国是食管癌的高发区, 其发病仅次于胃癌, 居第2
位[1]. 大多数食管癌患者在诊断时因出现远处转移或者局部晚期而失去根治性手术的机会; 而接受根治性手术者, 术后5年内原位复发及远处转移的发生率高达67%[2]. 因此, 食管癌总的疗效很差. 出现复发或远处转移的食管癌是无法治愈的, 为了缓解晚期食管癌患者诸如疼痛、吞咽困难等症状, 减轻患者的痛苦, 许多晚期食管癌患者需要接受姑息治疗. 化疗是晚期食管癌姑息治疗的主要手段, 目前食管癌的一线化疗以顺铂/氟尿嘧啶、顺铂/紫杉醇或多西紫杉醇为主, 其有效率分别为30%-40%及30%-50%; 中位生存时间分别为6-10 mo及7-17 mo[3-6]. 一线化疗后疾病进展且一般状况良好的患者仍需要接受二线治疗, 然而目前尚无标准的二线治疗方案. 因此寻找疗效显著、耐受性良好的化疗方案作为一线化疗失败后的解救治疗, 是我们所面临的主要问题. 伊立替康(CPT-11)在大肠癌、小细胞肺癌、胃癌及子宫颈癌的临床治疗中具有显著的疗效[7-10]. Burkart等[11]报道了CPT-11单药二线治疗晚期食管癌, 按CPT-11 100 mg/m2第1天, 第8天, 第15天给药, 4 wk为一周期; 其近期有效率达36%, 且未出现3级以上的不良反应. 奈达铂(NDP)是第2代无需水化的铂类化合物. 多个体外研究[12]表明其抗瘤疗效与顺铂相当, 但肾毒性及消化系反应的发生率较顺铂显著降低. Hirata等[13]研究证实: 单药NDP治疗食管癌的有效率为30%, 且耐受性好无严重不良反应. 而且目前有多个关于NDP/TAX、NDP/DOC、NDP/FT-207等[14-16]治疗晚期食管癌的研究, 研究中未观察到肾毒性及严重的消化系毒性. 接受二线化疗的晚期食管癌患者耐受性差, 需要选择低毒的化疗方案. 因此本研究选择CPT-11/NDP作为晚期食管癌的二线治疗方案, 观察其近期临床有效率、总生存时间及不良反应.
2006-06/2008-06郑州大学第一附属医院和郑州大学第二附属医院肿瘤科经组织学证实均为食管鳞状细胞癌患者24例, 均有可测量病灶, 预计生存期大于3 mo, 在3 mo内接受不含有依立替康(CPT-11)及奈达铂(NDP)的一线化疗, 疗效评价为疾病进展(PD). 入选患者符合以下所有标准: ECOG评分0-2分; 骨髓功能正常, 血红蛋白(Hb)≥100 g/L, 白细胞总数(WBC)≥4.0×109/L, 中性粒细胞计数≥1.5×109/L, 血小板计数(PLT)≥100×109/L; 肝功能: 血清胆红素低于最大正常值的1.5倍, ALT和AST低于最大正常值的1.5倍; 肾功能: 血肌酐清除率≥60 mL/min. 化疗前签署知情同意书及化疗协议书. 根据RECIST(response evaluation criteria in solid tumors)标准评价疗效; 根据CTCAE3.0(common terminology criteria for adverse events v 3.0)进行不良反应分级.
1.2.1 治疗: 24例患者均采用CPT-11/NDP方案化疗 即: CPT-11 65 mg/m2于第1天及第8天1 h内静脉输注, 然后NDP 80 mg/m2于第1天2 h内静脉输注, 3 wk为1周期; 化疗中出现恶心呕吐, 可给予对症止吐治疗; 出现腹泻者常规给予洛哌丁胺止泻治疗; 中性粒细胞计数<1.0×109/L, 血小板计数(PLT)<80×109/L, 可给予升白细胞及升血小板治疗, 直至血象恢复达到化疗标准. 如果在前1周期化疗中出现4级骨髓抑制/消化系反应, 在以后化疗中将CPT-11及NDB剂量减少20%. 化疗连续进行(至多6个周期), 出现下列情况之一者终止化疗: 疾病进展; 出现患者不能耐受的不良事件; 患者要求退出临床观察; 死亡.
1.2.2 疗效及不良反应评定: 每完成2个周期化疗后针对靶目标复查CT、MRI、上消化道造影、胃镜等, 了解病变变化情况, 近期疗效评价参考 "实体瘤疗效评价标准"(RECIST), 分为完全缓解(CR)、部分缓解(PR)、病变稳定(SD)及进展(PD), 总有效率(RR)为CR+PR, 疾病控制率为(CR+PR+SD); 观察总生存时间(OS)及至疾病进展时间(TTP). 不良反应按CTCAE3.0进行分级, 分为0-4级. 所有患者均进行随访24 mo.
统计学处理 总生存时间(OS)即: 自治疗开始第1天直到死亡的时间. 至疾病进展时间(TTP)即: 自治疗第1天至疾病进展的时间. 应用SPSS13.0分析软件, 采用Kaplan-Meier法绘制患者的生存曲线, 进行统计学分析.
24例接受CPT-11/NDP二线化疗的患者均可进行疗效、生存及不良反应评价, 患者的基线特征资料见表1.
| 特征 | n(%) |
| 年龄(岁) | |
| 中位年龄 | 59.5 |
| 年龄范围 | 38-77 |
| 性别 | |
| 男 | 16(66.67) |
| 女 | 8(33.33) |
| ECOG评分 | |
| 0 | 13(54.17) |
| 1 | 11(45.83) |
| 2 | 0(0) |
| 病理类型 | |
| 鳞癌 | 24(100) |
| 腺癌 | 0(0) |
| 既往治疗 | |
| 化疗联合放疗 | 1(4.17) |
| 手术→化放疗 | 1(4.17) |
| 手术→化疗 | 9(37.50) |
| 化疗 | 13(54.17) |
| 可评价部位 | |
| 食管或食管胃吻合口 | 17(70.80) |
| 肺 | 7(29.17) |
| 肝 | 4(16.67) |
| 淋巴结 | 5(20.83) |
| 脑 | 1(4.17) |
| 甲状腺 | 1(4.17) |
24例患者组织学类型均为鳞状细胞癌, 既往3 mo内均接受过不含有CPT-11及NDP方案的化疗. 其中曾进行手术联合化疗9例
(38%); 手术联合放化疗者1例(4%); 单纯化疗者13例(54%); 放疗联合化疗者1例(4%).
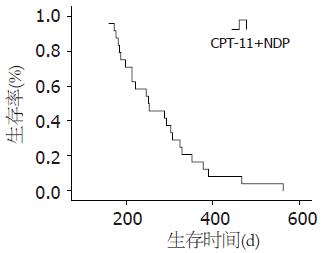
24例患者共接受86周期化疗, 人均3.58个周期. 其中CR1例(4%), PR5例(21%), SD7例(29%), PD11例(46%), 总有效率25%(CR+PR), 疾病控制率54%(CR+PR+SD). 患者生存曲线图如图1所示, 中位生存时间(OS)248.5 d(95%CI: 159-563), 中位至疾病进展时间(TTP)131 d(95%CI: 45-328).
CPT-11联合NDP二线治疗晚期食管癌近期疗效显著, 耐受性较好. 24例患者中有1例因4级中性粒细胞减少减量(4%), 血液学毒性及非血液学毒性详见表2. 在CPT-11/NDP联合化疗中最常见、最严重的可逆性毒性是白细胞减少和贫血, 其中3-4级的白细胞减少有5例(21%); 贫血多为1-2级, 仅有1例出现3级贫血. 非血液学毒性最常见的则是乏力和厌食症, 且多为1级, 无3-4级消化系反应; 而腹泻的发生率为25%, 其中1级腹泻4例(17%)、2级2例(8%), 未观察到严重腹泻发生; 本研究中观察到1例2级肝功能损伤患者, 其总胆红素值为正常最高值2倍; 未观察到因血液学及非血液学毒性致死的病例.
| 不良反应 | 1级 | 2级 | 3级 | 4级 |
| 贫血 | 8(33) | 6(25) | 1(4) | 0 |
| 中性粒细胞减少 | 7(29) | 3(13) | 4(17) | 1(4) |
| 中性粒细胞减少性发热 | 0 | 0 | 1(4) | 0 |
| 白细胞减少 | 9(38) | 5(21) | 5(21) | 0 |
| 血小板减少 | 5(21) | 1(4) | 1(4) | 0 |
| 厌食症 | 6(25) | 3(13) | 0 | 0 |
| 乏力 | 9(38) | 3(13) | 0 | 0 |
| 腹泻 | 4(17) | 2(8) | 0 | 0 |
| 呕吐 | 3(13) | 4(17) | 0 | 0 |
| 肝脏损伤 | 0 | 1(4) | 0 | 0 |
| 神经感觉障碍 | 2(8) | 0 | 0 | 0 |
目前有许多关于晚期食管癌化疗的临床研究, 但这些研究中主要集中在对一线化疗方案的评价, 仅有少数研究探讨晚期食管癌二线方案的疗效及不良反应. 其中来自法国和日本的2个独立研究[17,18]报道了单药多西紫杉醇二线治疗晚期食管癌, 按70-100 mg/m2, 3 wk为一周期方案给药, 其有效率分别为28%, 20%; Burkart等[11]进行的一项Ⅱ期临床研究中按CPT-11 100 mg/m2 第1天、第8天及第15天给药, 4 wk为一周期方案治疗, 单药CPT-11作为晚期食管癌二线方案, 其近期有效率达36%, 且未出现3级以上的不良反应. 而Osaka等曾先后进行了小规模的DOC/NDP联合化疗, 3项研究均按DOC 30 mg/m2第1天+NDP 40 mg/m2第1天, 2 wk为一周期方案二线治疗晚期食管癌, 其有效率分别为39%、11%和27.1%; 中位生存时间分别为: 8.5、11.4和5.9 mo; 3个临床试验中均未出现3-4级非血液学毒性, 未观察到因不良反应致死病例[19-21]. 由于一线化疗疾病进展的晚期食管癌患者对二线治疗的耐受性较低, 因此上述二线方案均采取了小剂量多次给药, 以减少不良反应的发生, 从而改善患者生活质量.
本研究采取CPT-11 65 mg/m2第1天, 8+NDP 80 mg/m2第1天, 3 wk为一周期给药, 结果表明在24例患者中1例CR、5例PR、7例SD, 治疗有效率达25%, 疾病控制率达54%; 疾病进展时间131 d; 中位生存时间248.5 d. 3级血液学毒性包括: 贫血1例(4%), 中性粒细胞减少4例(17%), 白细胞减少5例(21%), 血小板减少1例(4%); 非血液学毒性主要表现在1-2级的乏力和厌食, 而出现1-2级腹泻者仅有6例(25%); 在研究中仅出现1例4级中性粒细胞减少患者, 无3-4级非血液学毒性. 因此本研究具有显著的近期疗效及良好的耐受性. 作为晚期食管癌二线联合化疗, 本研究与Osaka等研究的不同之处在于: 首先是化疗方案组合不同, 其次入选患者的一线治疗有着显著差异. 本研究入选患者一线化疗方案除了DDP/5-FU还包括含有TAX或者DOC的治疗方案, 而后者则限定一线化疗方案仅为DDP/5-FU. 因此CPT-11/NDP联合作为晚期食管癌二线治疗方案, 有着更广的适应范围, 尤其对于一线应用紫杉醇或者多西紫杉醇治疗失败的患者提供个更多的治疗选择. 但是由于本研究的样本量很小, 缺乏改变给药剂量后的疗效及毒副作用的对照研究, 因此目前给药方案所观察到的低毒现象可能与给药剂量小有关. 总之, CPT-11/NDP可以作为晚期食管癌的二线治疗, 同时也需要大规模、多中心的临床试验进一步深入研究.
我国是食管癌的高发区, 因食管癌死亡者仅次于胃癌, 居第2位. 大多数食管癌患者在诊断时因出现远处转移或者局部晚期而失去根治性手术的机会; 化疗是晚期食管癌姑息治疗的主要手段, 一线化疗后疾病进展且一般状况良好的患者仍需要接受二线治疗, 然而目前尚无标准的二线治疗方案. 因此寻找疗效显著、耐受性良好的化疗方案作为一线化疗失败后的解救治疗, 是我们所面临的主要问题.
沈琳, 主任医师, 北京大学临床肿瘤医院消化内科.
Burkart等报道了CPT-11单药二线治疗晚期食管癌, 按CPT-11 100 mg/m2第1天, 第8天, 第15天, 4 wk为一周期方案给药其近期有效率达36%, 且未出现3级以上的不良反应. Hirata等研究证实, 单药NDP治疗食管癌的有效率为30%. Osaka、Masashi、Jin等曾先后进行了小规模的DOC/NDP联合化疗, 三项研究均按DOC 30 mg/m2第1天+NDP 40 mg/m2第1天, 2 wk为一周期方案二线治疗晚期食管癌, 其有效率分别为39%、11%和27.1%; 中位生存时间分别为: 8.5、11.4和5.9 mo.
本研究采取CPT-11 65 mg/m2第1天, 8+NDP 80 mg/m2第1天, 3 wk为一周期给药; 与Osaka Y、Masashi K、Jianhua等研究的不同之处在于: 首先是化疗方案组合不同, 其次入选患者的一线治疗有着显著差异. 本研究入选患者一线化疗方案除了DDP/5-FU还包括含有TAX或者DOC的治疗方案, 而后者则限定一线化疗方案仅为DDP/5-FU.
本研究提示, CPT-11/NDP联合作为晚期食管癌二线治疗方案, 近期疗效显著、耐受性良好, 有着更广的适应范围, 尤其对于一线应用紫杉醇或者多西紫杉醇治疗失败的患者提供了更多的治疗选择.
本文对24例伊立替康联合奈达铂二线治疗晚期食管鳞癌患者的临床资料进行回顾分析, 有一定参考价值.
编辑: 李军亮 电编:吴鹏朕
| 2. | Hofstetter W, Swisher SG, Correa AM, Hess K, Putnam JB Jr, Ajani JA, Dolormente M, Francisco R, Komaki RR, Lara A, Martin F, Rice DC, Sarabia AJ, Smythe WR, Vaporciyan AA, Walsh GL, Roth JA. Treatment outcomes of resected esophageal cancer. Ann Surg. 2002;236:376-384; discussion 384-285. [PubMed] |
| 3. | Kies MS, Rosen ST, Tsang TK, Shetty R, Schneider PA, Wallemark CB, Shields TW. Cisplatin and 5-fluorouracil in the primary management of squamous esophageal cancer. Cancer. 1987;60:2156-2160. [PubMed] [DOI] |
| 4. | Hayashi K, Ando N, Watanabe H, Ide H, Nagai K, Aoyama N, Takiyama W, Ishida K, Isono K, Makuuchi H. Phase II evaluation of protracted infusion of cisplatin and 5-fluorouracil in advanced squamous cell carcinoma of the esophagus a Japan Esophageal Oncology Group (JEOG) Trial (JCOG9407). Jpn J Clin Oncol. 2001;31:419-423. [PubMed] [DOI] |
| 5. | Laack E, Andritzky B, Dürk H, Burkholder I, Edler L, Schuch G, Boeters I, Görn M, Lipp R, Horst H. Docetaxel and cisplatin as first-line treatment for patients with metastatic esophageal cancer a pilot study. Onkologie. 2005;28:647-650. [PubMed] [DOI] |
| 6. | Zhang X, Shen L, Li J, Li Y, Li J, Jin M. A phase II trial of paclitaxel and cisplatin in patients with advanced squamous-cell carcinoma of the esophagus. Am J Clin Oncol. 2008;31:29-33. [PubMed] [DOI] |
| 7. | Douillard JY, Cunningham D, Roth AD, Navarro M, James RD, Karasek P, Jandik P, Iveson T, Carmichael J, Alakl M. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer a multicentre randomised trial. Lancet. 2000;355:1041-1047. [PubMed] [DOI] |
| 8. | Schmittel A, Fischer von Weikersthal L, Sebastian M, Martus P, Schulze K, Hortig P, Reeb M, Thiel E, Keilholz U. A randomized phase II trial of irinotecan plus carboplatin versus etoposide plus carboplatin treatment in patients with extended disease small-cell lung cancer. Ann Oncol. 2006;17:663-667. [PubMed] [DOI] |
| 9. | Ajani JA, Baker J, Pisters PW, Ho L, Feig B, Mansfield PF. Irinotecan plus cisplatin in advanced gastric or gastroesophageal junction carcinoma. Oncology (Williston Park). 2001;15:52-54. [PubMed] |
| 10. | Verschraegen CF, Levy T, Kudelka AP, Llerena E, Ende K, Freedman RS, Edwards CL, Hord M, Steger M, Kaplan AL. Phase II study of irinotecan in prior chemotherapy-treated squamous cell carcinoma of the cervix. J Clin Oncol. 1997;15:625-631. [PubMed] |
| 11. | Burkart C, Bokemeyer C, Klump B, Pereira P, Teichmann R, Hartmann JT. A phase II trial of weekly irinotecan in cisplatin- refractory esophageal cancer. Anticancer Res. 2007;27:2845-2848. [PubMed] |
| 12. | Ota K. [Nedaplatin]. Gan To Kagaku Ryoho. 1996;23:379-387. [PubMed] |
| 13. | Hirata S, Yatsuyanagi E, Yamazaki H, Sugimoto Y, Kosiko S, Kokubo T, Atsuta Y, Sasajima T, Miyokawa N. [Neoadjuvant chemotherapy for esophageal cancer by administration of nedaplatin alone]. Gan To Kagaku Ryoho. 2000;27:221-226. [PubMed] |
| 14. | Gong Y, Ren L, Zhou L, Zhu J, Huang M, Zhou X, Wang J, Lu Y, Hou M, Wei Y. Phase II evaluation of nedaplatin and paclitaxel in patients with metastatic esophageal carcinoma. C. ancer Chemother Pharmacol. 2009;64:327-333. [PubMed] [DOI] |
| 15. | Nakajima Y, Suzuki T, Haruki S, Ogiya K, Kawada K, Nishikage T, Nagai K, Kawano T. A pilot trial of docetaxel and nedaplatin in cisplatin-pretreated relapsed or refractory esophageal squamous cell cancer. Hepatogastroenterology. 2008;55:1631-1635. [PubMed] |
| 16. | Fan QX, Wang R, Lu P, Zhao YF, Lu TY, Han JW, Wang JS, Luo SX, Lu SP, Wang GJ. [Nedaplatin combined with tegafur in the treatment for advanced esophageal cancer]. Zhonghua Zhongliu Zazhi. 2008;30:937-939. [PubMed] |
| 17. | Muro K, Hamaguchi T, Ohtsu A, Boku N, Chin K, Hyodo I, Fujita H, Takiyama W, Ohtsu T. A phase II study of single-agent docetaxel in patients with metastatic esophageal cancer. Ann Oncol. 2004;15:955-959. [PubMed] [DOI] |
| 18. | Metges J, Hennequin C, Ychou M, Metges JP, Hennequin C, Ychou M, Malhaire JP, Gouerou H, Maylin C, Labat JP. Docetaxel (DOC) as a Second Line Chemotherapy in Metastatic Esophageal Cancer (MEC) a French Study. Proc Am Soc Clin Oncol. 2001;20:abstract 635. |
| 19. | Osaka Y, Takagi Y, Hoshino S, Tachibana S, Tsuchida A, Aoki T. Combination chemotherapy with docetaxel and nedaplatin for recurrent esophageal cancer in an outpatient setting. Dis. Esophagus. 2006;19:473-476. [PubMed] [DOI] |
| 20. | Kanai M, Matsumoto S, Nishimura T, Shimada Y, Watanabe G, Kitano T, Misawa A, Ishiguro H, Yoshikawa K, Yanagihara K. Retrospective analysis of 27 consective patients treated with docetaxel/nedaplatin combination therapy as a second-line regimen fou advanced esophageal cancer. J Clin Oncol. 2007;12:224-227. [PubMed] [DOI] |
| 21. | Jin J, Xu X, Wang F, Yan G, Liu J, Lu W, Li X, Tucker SJ, Zhong B, Cao Z. Second-line combination chemotherapy with docetaxel and nedaplatin for Cisplatin-pretreated refractory metastatic/recurrent esophageal squamous cell carcinoma. J Thorac Oncol. 2009;4:1017-1021. [PubMed] [DOI] |