修回日期: 2009-12-02
接受日期: 2009-12-07
在线出版日期: 2010-01-28
目的: 探索多种外排泵抑制剂对H.pylori多重耐药性的影响.
方法: 临床分离培养H.pylori, 对分离敏感株进行氯霉素耐药性诱导, 筛选出多重耐药(MDR)株; 琼脂二倍稀释法对敏感菌株和MDR株进行9种抗生素的药敏试验, 分别加入外排泵抑制剂碳酰氰基-对-氯苯腙(CCCP)、利血平、泮托拉唑后再次进行药敏试验, 比较分析外排泵抑制剂对H.pylori耐药性的影响; 同样方法检测泮托拉唑、雷贝拉唑、奥美拉唑、兰索拉唑和埃索美拉唑对MDR-H.pylori株抗生素最小抑菌浓度(MICs)值的影响.
结果: 诱导出4株MDR-H.pylori; CCCP及泮托拉唑能够部分恢复MDR-H.pylori株对抗生素的敏感性, 而利血平对MDR-H.pylori耐药性无明显影响; 这三种外排泵抑制剂对敏感株的MICs值影响不大; 5种质子泵抑制剂中, 雷贝拉唑能使甲硝唑和阿莫西林的MIC值分别降低至1/4和1/3, 泮托拉唑能使其均降低至1/2左右.
结论: 外排泵抑制剂能够在体外提高多重耐药H.pylori株的药物敏感性; 在所有质子泵抑制剂中雷贝拉唑对降低MDR-H.pylori对抗生素的耐药性作用最强, 其次为泮托拉唑.
引文著录: 张展, 刘志强, 郑鹏远, 唐芙爱. 外排泵抑制剂对幽门螺杆菌多重耐药性的影响. 世界华人消化杂志 2010; 18(3): 262-267
Revised: December 2, 2009
Accepted: December 7, 2009
Published online: January 28, 2010
AIM: To evaluate the effects of efflux pump inhibitors (EPIs) on the multidrug resistance (MDR) of Helicobacter pylori
(H.pylori).
METHODS: H.pylori strains were isolated and cultured on Brucella agar plates containing 10% sheep blood. The MDR of H.pylori strains was induced with chloramphenicol. The susceptibility of multidrug-resistant H.pylori strains and their parental strains to nine antibiotics was assessed by agar dilution test in the presence and absence of EPIs such as CCCP, reserpine and pantoprazole. The minimal inhibitory concentrations (MICs) of different antibiotics against multidrug-resistant H.pylori strains were determined. Similarly, the impact of five proton pump inhibitors (PPIs) on the MICs of these antibiotics was also tested and compared.
RESULTS: Four multidrug-resistant H.pylori strains were induced successfully. The susceptibility of these multidrug-resistant strains to some antibiotics such as cefotaxime were partly restored by CCCP and pantoprazole, but not by reserpine. Of the five PPIs tested, rabeprazole reduced the MICs of metronidazole and amoxicillin against multidrug-resistant H.pylori strains to one forth and one third, respectively, pantoprazole reduced both of them to one half, and the remaining two PPIs showed no obvious effects.
CONCLUSION: Some EPIs can potentiate the activity of antibiotics that are putative substrates of the efflux pump system of H.pylori. Of all PPIs tested, rabeprazole is the most effective one to reduce the MDR of H.pylori.
- Citation: Zhang Z, Liu ZQ, Zheng PY, Tang FA. Effects of efflux pump inhibitors on the multidrug resistance of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 262-267
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/262.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.262
世界人口50%以上存在幽门螺杆菌(Helicobacter pylori, H.pylori)感染, 他是人类胃炎和消化性溃疡的主要致病原, 是胃癌的第1类致癌原, 一旦感染将会持续终身, 除非应用抗生素根除治疗[1-2]. 近年来, 由于抗生素的广泛应用, H.pylori耐药率不断上升, 而且已经出现同时对甲硝唑、克拉霉素、阿莫西林耐药的多重耐药(multi-drug resistant, MDR)株[3,4], Boyanova等报道在既往接受过抗生素治疗的患者中, 26.4%存在同时对甲硝唑和克拉霉素耐药, Wueppenhorst等研究也显示, 临床分离的H.pylori中, 15%存在3种或3种以上的抗生素MDR. 能将抗生素主动排出体外的外排泵(efflux pump)在细菌的MDR机制中起重要作用[5], 我们前期研究显示, hefABC-RND类外排泵系统介导了H.pylori MDR性的产生[6]. 为解决细菌耐药性问题, 近年来外排泵抑制剂(efflux pump inhibitors, EPIs)的研究受到广泛关注, 目前已经发现的细菌EPIs在结构上存在差异, 其共同特点是能抑制细菌对药物的外排从而恢复耐药菌对抗菌药物的敏感性[7,8], 然而, EPIs在H.pylori MDR中的作用研究国内外报道很少, 值得进一步探讨. 本研究旨在通过诱导MDR H.pylori的产生, 研究几种EPIs在H.pylori对多种抗生素耐药中的作用, 从而为解决H.pylori耐药问题提供新的思路.
2008-03/2009-03于郑州大学第二附属医院胃镜室收集患者的胃黏膜组织, 研磨后接种于含10%无菌羊血的布氏琼脂培养基, 在100 mL/L CO2、37 ℃条件下培养3-7 d, 经革兰氏染色、尿素酶实验证实为H.pylori, 共获得临床分离株65个. 标准株NCTC11637由河南省分子重点实验室惠赠. 氯霉素、碳酰氰基-对-氯苯腙(carbonyl cyanide m-chlorophenylhydrazone, CCCP)、四环素购自Sigma公司(上海), 其余所用药品均购自中国食品药品生物检定所. 总RNA抽提试剂盒、cDNA第1链合成试剂盒购自北京赛百盛生物公司, RealMsterMix(SYBR Green)试剂盒购自北京宝赛生物公司, hefA上游引物为5'-CTCGCTCGCATGATCGC-3', 下游引物为5'-CGTATTCGCTCAAATTCCCT-3'; gyrB上游引物为5'-TTACTACGACTTATCTGGG GCTAGCGCTG-3', 下游引物为5'-CCCATCAAT TTCCACATTCTCCGC-3'.
1.2.1 MDR株的诱导及鉴定: 测定分离株及标准株对氯霉素的MIC, 从含1/2 MIC诱导剂氯霉素浓度的布氏琼脂培养基开始, 逐渐增加诱导剂浓度, 直到无菌落生长为止, 每个梯度至少传代3次, 诱导出MDR菌株, 将经诱导获得的菌株作琼脂平板培养, 分别接种于含四环素、头孢噻肟、青霉素G、环丙沙星、氨苄西林、哌拉西林、头孢曲松、克林霉素、琥乙红霉素药物(4×MIC)的琼脂平板, 37℃培养48 h, 可以在3种及以上抗生素平板上生长的菌株为MDR菌株. 参照文献方法[6,9,10], 按照试剂盒说明书进行荧光定量PCR检测, 对其外排泵系统中hefA基因表达情况测定.
1.2.2 琼脂二倍稀释法进行药敏试验:H.pylori在含羊血培养基上生长48 h后, 用接种环刮取菌落悬浮至生理盐水中, 调节至0.5麦氏点浑浊度, 取40 μL涂布到含有不同抗生素不同浓度梯度的含羊血培养基, (1)分别测定9种抗生素对耐药菌株及敏感株的MIC, (2)在培养基中分别加入CCCP(100 μmol/L)、利血平(20 mg/L)和泮托拉唑钠(10 mg/L)再次检测抗生素的MIC, 对比分析EPIs对H.pylori外排泵蛋白系统的影响. (3)分别测定相同浓度(10 mg/L)质子泵抑制剂(proton pump inhibitors, PPIs)作用下克拉霉素、阿莫西林、呋喃唑酮和甲硝唑的MICs值, 比较不同PPIs的作用大小. 菌株的MIC值有4倍变化认为有统计学差异[11].
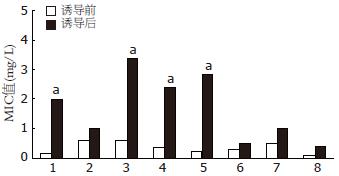
从65株分离的H.pylori中挑选无任何耐药表型9株, 经传代稳定后, 检测对氯霉素的MIC并进行耐药性诱导: 共诱导出4株H.pylori(3株临床分离株和1株标准株)可以在超过32×MIC的氯霉素上生长, 经药敏试验证实诱导后的菌株对多种抗生素的MIC均有不同程度的增加, 经鉴定为MDR株(表1, 图1).
| 菌株 | 处理 | 琥乙红霉素 | 环丙沙星 | 四环素 | 头孢噻肟 | 头孢曲松 | 哌拉西林 | 克林霉素 | 青霉素G | 氯霉素 |
| 04151 | 诱导前 | 0.250 | 0.250 | 0.500 | 0.250 | 0.250 | 0.250 | 0.500 | 0.125 | 0.500 |
| 诱导后 | 2.000 | 0.500 | 4.000 | 1.000 | 2.000 | 0.500 | 1.000 | 0.250 | 32.000 | |
| 08022 | 诱导前 | 0.125 | 1.000 | 1.000 | 0.500 | 0.500 | 0.500 | 0.500 | 0.063 | 0.250 |
| 诱导后 | 2.000 | 1.000 | 4.000 | 4.000 | 4.000 | 0.500 | 0.500 | 0.250 | 16.000 | |
| 11021 | 诱导前 | 0.500 | 1.000 | 1.000 | 0.500 | 0.125 | 0.250 | 0.250 | 0.063 | 0.500 |
| 诱导后 | 2.000 | 2.000 | 2.000 | 4.000 | 4.000 | 1.000 | 1.000 | 0.500 | 32.000 | |
| 11637 | 诱导前 | 0.063 | 0.500 | 0.250 | 0.250 | 0.125 | 0.250 | 1.000 | 0.250 | 0.500 |
| 诱导后 | 2.000 | 1.000 | 4.000 | 2.000 | 2.000 | 0.250 | 2.000 | 1.000 | 16.000 | |
| 几何均值 | 诱导前 | 0.177 | 0.595 | 0.595 | 0.354 | 0.210 | 0.297 | 0.500 | 0.105 | 0.420 |
| 诱导后 | 2.000 | 1.000 | 3.364 | 2.378 | 2.828 | 0.500 | 1.000 | 0.420 | 22.627 |
3株野生株和H.pylori NCTC 11637中均可检测出不同程度的hefA mRNA表达, 相对表达量为1.90±0.45; 其相对应的氯霉素诱导后MDR株中亦可检测出hefA mRNA的表达, 其相对表达量为5.83±0.91, MDR组hefA基因表达水平显著高于敏感野生株(P<0.001).
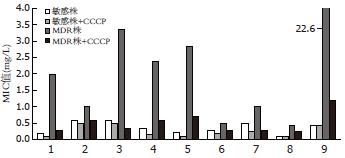
加入100 μmol/L的CCCP后, 对于MDR株, 氯霉素的MIC降为原来的1/19、四环素降为1/10、琥乙红霉素降为1/7、头孢噻肟和头孢曲松都降为1/4; 而对于野生株未明显改变抗生素的MIC(图2).
加入20 mg/L利血平对野生株和耐药株无明显的抑菌作用, 对抗生素MIC值无明显的影响. 加入泮托拉唑10 mg/L, 药敏试验显示, 对于敏感株, 琥乙红霉素和头孢曲松的MIC降为原来的1/4左右; 对于MDR株, 琥乙红霉素降为1/6, 四环素降为1/13, 头孢噻肟和头孢曲松降为1/9, 克林霉素降为1/4(表2).
| 敏感株 | 敏感株+利血平 | 敏感株+泮托拉唑 | MDR株 | MDR株+利血平 | MDR株+泮托拉唑 | |
| 琥乙红霉素 | 0.177 | 0.149 | 0.037 | 2.000 | 2.000 | 0.318 |
| 环丙沙星 | 0.595 | 0.500 | 0.420 | 1.000 | 0.595 | 0.841 |
| 四环素 | 0.595 | 0.420 | 0.177 | 3.364 | 3.364 | 0.250 |
| 头孢噻肟 | 0.354 | 0.250 | 0.125 | 2.378 | 1.682 | 0.250 |
| 头孢曲松 | 0.210 | 0.177 | 0.053 | 2.828 | 2.378 | 0.297 |
| 哌拉西林 | 0.297 | 0.250 | 0.149 | 0.500 | 0.354 | 0.250 |
| 克林霉素 | 0.500 | 0.420 | 0.297 | 1.000 | 0.841 | 0.250 |
| 青霉素G | 0.105 | 0.089 | 0.044 | 0.420 | 0.297 | 0.149 |
| 氯霉素 | 0.420 | 0.354 | 0.250 | 22.627 | 11.314 | 6.727 |
为进一步研究质子泵抑制剂作为EPIs在临床应用中的作用, 我们检测了MDR-H.pylori株对临床常用于根除H.pylori的抗菌药物的耐药情况, 并比较了10 mg/L浓度下5种PPIs对其耐药程度的影响, 发现雷贝拉唑可使甲硝唑和阿莫西林MIC值分别降低至约1/4和1/3, 对克拉霉素和呋喃唑酮MIC值降低不明显, 泮托拉唑使甲硝唑和阿莫西林MIC值均下降至1/2左右, 而埃索美拉唑、奥美拉唑和兰索拉唑对临床常用抗H.pylori抗菌药物的MIC影响不明显(表3).
| 对照 | 奥美拉唑 | 泮托拉唑 | 兰索拉唑 | 雷贝拉唑 | 埃索美拉唑 | |
| 甲硝唑 | 4.757 | 3.364 | 1.414 | 2.378 | 1.189 | 2.828 |
| 阿莫西林 | 3.364 | 2.000 | 1.189 | 1.682 | 1.000 | 1.682 |
| 呋喃唑酮 | 2.378 | 2.000 | 2.378 | 2.000 | 2.378 | 2.378 |
| 克拉霉素 | 5.657 | 4.757 | 3.364 | 5.657 | 4.000 | 4.757 |
由于抗生素的广泛应用, H.pylori耐药率不断上升, 且出现MDR菌株. 细菌的MDR与外排泵系统有关. 2000年Bina等发现H.pylori存在有主动外排系统hefABC[12], 2006年Li等发现了与四环素耐药相关基因HP1165[13], 另外还存在一些非特异性MDR蛋白, 但是其重要性还不甚明了[14,15]. 国外研究及和我们的前期研究[6,16,17]均发现主动外排系统高表达是导致H.pylori MDR的重要因素. 本研究发现H.pylori能够在抗生素浓度压力作用下增加外排泵系统的表达, 从而产生MDR现象, 提示长期抗生素应用是H.pylori产生耐药的原因之一.
主动外排泵系统种类繁多, 根据药物外排机制的不同, 可分ATP水解能驱动型外排泵和跨膜质子梯度能驱动型外排泵两大类, EPIs作用机制有: 干扰外排泵组装、阻断外排泵能量来源、阻碍底物通过外排泵通道、机制尚未明确等. CCCP能够破坏跨膜电化学梯度, 使大部分以H+为外排动力能源的外排泵系统受到抑制, 从而恢复细菌对多种抗生素的敏感性. CCCP作为EPIs对SMR型外排泵(如大肠埃希菌QacE)、MFS型外排泵(如金葡菌NorA)、MATE型外排泵(如多形拟杆菌NorM)和RND型外排泵(如铜绿假单胞菌MexAB-OprM, 大肠埃希菌AcrAB和AcrEF)等均有抑制作用[18-22]. 本研究显示, CCCP降低了MDR-H.pylori株抗生素的MIC值, 推测该作用是由CCCP削弱外排泵系统的外排作用引起的, 但并非所有抗生素的MIC值都降低, 提示H.pylori对一些抗生素产生耐药可能通过其他机制产生. CCCP能够降低H.pylori对氯霉素、琥乙红霉素、头孢噻肟、头孢曲松和四环素的MIC, 提示这几种抗生素可能是hefABC外排泵系统的底物. 对于敏感株, CCCP作用不明显, 可能与外排泵表达量过少有关.
利血平属于生物碱, 对于MFS以及ABC型外排泵具有抑制作用[23], 和抗生素联合应用时需要的浓度较高, 且会引起神经毒性. 本研究发现利血平在H.pylori对抗生素的耐药性影响不明显, 说明H.pylori存在MFS和ABC型外排泵的可能性较小.
PPIs作为EPIs的一类, 其机制与CCCP相似, 有研究发现PPIs可以抑制金葡菌NorA外排泵, 使NorA高表达株的诺氟沙星、环丙沙星和左氧氟沙星MIC值降低4-8倍[24]. PPIs包括奥美拉唑、雷贝拉唑、泮托拉唑、兰索拉唑、埃索美拉唑5种, 在抗H.pylori感染的三联疗法或四联疗法中作为制酸剂已有广泛应用, 但其作为质子动力解偶联剂, 增加MDR-H.pylori的药物敏感性的研究还未见报道. 本研究显示, 泮托拉唑在10 mg/L浓度时不抑制H.pylori的生长, 但可使MDR-H.pylori株对琥乙红霉素、四环素、克林霉素、头孢噻肟和头孢曲松的MICs明显下降, 使敏感株对琥乙红霉素和头孢曲松的敏感性增加, 提示质子泵抑制剂在抗H.pylori感染中, 除了抑制胃酸的分泌, 还可能通过抑制外排泵的外排作用, 从而提高了抗生素的杀菌效果. 有研究发现[25,26]临床应用中5种PPIs制剂对H.pylori清除率无明显影响, 而本研究比较了PPIs对临床常用抗菌药物MICs的影响, 发现雷贝拉唑在体外实验中对MDR-H.pylori影响最明显, 其次为泮托拉唑, 提示雷贝拉唑能更好地逆转该耐药现象, 因此我们建议对于临床上根除失败的H.pylori可选用以雷贝拉唑为抑酸剂的三联或四联疗法再行根除.
H.pylori耐药率不断上升, 且出现MDR菌株, 但是针对H.pylori MDR及其EPIs的研究还比较少, 本研究首次发现了EPIs可以逆转MDR-H.pylori的部分耐药性, 并且发现部分PPIs能够通过抑制MDR-H.pylori外排泵系统的机制降低部分抗生素的MIC值, 从而为探寻根除耐药H.pylori药物提供了新的思路.
世界人口50%以上存在幽门螺杆菌(H.pylori)感染, 他是人类胃炎、消化性溃疡及胃癌的主要致病原, 一旦感染将会持续终身, 除非应用抗生素根除治疗. 由于抗生素的广泛应用, H.pylori耐药率不断上升, 而且已经出现同时对甲硝唑、克拉霉素、阿莫西林耐药的多重耐药(MDR)株, 能将抗生素主动排出体外的外排泵在细菌的多重耐药机制中起重要作用, 外排泵抑制剂(EPIs)能逆转多种临床常见细菌的耐药性状.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科.
hefABC-RND类外排泵系统介导了H.pylori多重耐药性的产生. 为解决细菌耐药性问题, 近年来EPIs的研究受到广泛关注, 目前已经发现的细菌EPIs在结构上存在差异, 其共同特点是能抑制细菌对药物的外排从而恢复耐药菌对抗菌药物的敏感性, 然而, EPIs在H.pylori MDR中的作用研究国内外仍未见报道.
Falsafi等从临床分离了12株MDR H.pylori, 通过加入100 mmol/L CCCP后溴化乙锭的MIC值下降了2-4倍, 而甲硝唑、环丙沙星、四环素等下降了2倍左右, 提示MDR H.pylori的外排泵系统存在较大的底物选择性.
H.pylori MDR发生率不断增加, 而目前尚无有效的阻断办法, 本文按照目前的基础理论从常用的药物中寻找行之有效的EPI制剂, 以期为下一步人工合成更有效的EPIs提供科学依据.
本研究发现EPIs能够在体外提高MDR H.pylori株的药物敏感性, 对于临床出现的MDR菌株可选择以雷贝拉唑为EPIs的三联疗法进行根除.
本研究具有临床和基础研究价值, 有新意.
编辑: 李军亮 电编:何基才
| 1. | Malaty HM. Epidemiology of Helicobacter pylori infection. Best Pract Res Clin Gastroenterol. 2007;21:205-214. [PubMed] [DOI] |
| 2. | Shi R, Xu S, Zhang H, Ding Y, Sun G, Huang X, Chen X, Li X, Yan Z, Zhang G. Prevalence and risk factors for Helicobacter pylori infection in Chinese populations. Helicobacter. 2008;13:157-165. [PubMed] [DOI] |
| 3. | Boyanova L, Gergova G, Nikolov R, Davidkov L, Kamburov V, Jelev C, Mitov I. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods. Diagn Microbiol Infect Dis. 2008;60:409-415. [PubMed] [DOI] |
| 4. | Wueppenhorst N, Stueger HP, Kist M, Glocker E. Identification and molecular characterization of triple- and quadruple- resistant Helicobacter pylori clinical isolates in Germany. J Antimicrob Chemother. 2009;63:648-653. [PubMed] [DOI] |
| 5. | De Rossi E, Aínsa JA, Riccardi G. Role of mycobacterial efflux transporters in drug resistance: an unresolved question. FEMS Microbiol Rev. 2006;30:36-52. [PubMed] [DOI] |
| 6. | Liu ZQ, Zheng PY, Yang PC. Efflux pump gene hefA of Helicobacter pylori plays an important role in multidrug resistance. World J Gastroenterol. 2008;14:5217-5222. [PubMed] [DOI] |
| 7. | Lomovskaya O, Bostian KA. Practical applications and feasibility of efflux pump inhibitors in the clinic--a vision for applied use. Biochem Pharmacol. 2006;71:910-918. [PubMed] [DOI] |
| 8. | Zechini B, Versace I. Inhibitors of multidrug resistant efflux systems in bacteria. Recent Pat Antiinfect Drug Discov. 2009;4:37-50. [PubMed] [DOI] |
| 9. | Nygard AB, Jørgensen CB, Cirera S, Fredholm M. Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR. BMC Mol Biol. 2007;8:67. [PubMed] [DOI] |
| 10. | Romanowski T, Markiewicz A, Bednarz N, Bielawski KP. [Housekeeping genes as a reference in quantitative real-time T-PCR]. Postepy Hig Med Dosw (Online). 2007;61:500-510. [PubMed] |
| 11. | Marquez B. Bacterial efflux systems and efflux pumps inhibitors. Biochimie. 2005;87:1137-1147. [PubMed] [DOI] |
| 12. | Bina JE, Alm RA, Uria-Nickelsen M, Thomas SR, Trust TJ, Hancock RE. Helicobacter pylori uptake and efflux: basis for intrinsic susceptibility to antibiotics in vitro. Antimicrob Agents Chemother. 2000;44:248-254. [PubMed] [DOI] |
| 13. | Li Y, Dannelly HK. Inactivation of the putative tetracycline resistance gene HP1165 in Helicobacter pylori led to loss of inducible tetracycline resistance. Arch Microbiol. 2006;185:255-262. [PubMed] [DOI] |
| 14. | Kutschke A, de Jonge BL. Compound efflux in Helicobacter pylori. Antimicrob Agents Chemother. 2005;49:3009-3010. [PubMed] [DOI] |
| 15. | Saidijam M, Benedetti G, Ren Q, Xu Z, Hoyle CJ, Palmer SL, Ward A, Bettaney KE, Szakonyi G, Meuller J. Microbial drug efflux proteins of the major facilitator superfamily. Curr Drug Targets. 2006;7:793-811. [PubMed] [DOI] |
| 16. | Falsafi T, Ehsani A, Niknam V. The role of active efflux in antibiotic - resistance of clinical isolates of Helicobacter pylori. Indian. J Med Microbiol. 2009;27:335-340. [PubMed] [DOI] |
| 17. | van Amsterdam K, Bart A, van der Ende A. A Helicobacter pylori TolC efflux pump confers resistance to metronidazole. Antimicrob Agents Chemother. 2005;49:1477-1482. [PubMed] [DOI] |
| 18. | Miyamae S, Ueda O, Yoshimura F, Hwang J, Tanaka Y, Nikaido H. A MATE family multidrug efflux transporter pumps out fluoroquinolones in Bacteroides thetaiotaomicron. Antimicrob Agents Chemother. 2001;45:3341-3346. [PubMed] [DOI] |
| 19. | Malléa M, Chevalier J, Eyraud A, Pagès JM. Inhibitors of antibiotic efflux pump in resistant Enterobacter aerogenes strains. Biochem Biophys Res Commun. 2002;293:1370-1373. [PubMed] [DOI] |
| 20. | Pumbwe L, Randall LP, Woodward MJ, Piddock LJ. Expression of the efflux pump genes cmeB, cmeF and the porin gene porA in multiple-antibiotic-resistant Campylobacter jejuni. J Antimicrob Chemother. 2004;54:341-347. [PubMed] [DOI] |
| 21. | Bohnert JA, Kern WV. Selected arylpiperazines are capable of reversing multidrug resistance in Escherichia coli overexpressing RND efflux pumps. Antimicrob Agents Chemother. 2005;49:849-852. [PubMed] [DOI] |
| 22. | Rafii F, Park M, Wynne R. Evidence for active drug efflux in fluoroquinolone resistance in Clostridium hathewayi. Chemotherapy. 2005;51:256-262. [PubMed] [DOI] |
| 23. | Lee EW, Huda MN, Kuroda T, Mizushima T, Tsuchiya T. EfrAB, an ABC multidrug efflux pump in Enterococcus faecalis. Antimicrob Agents Chemother. 2003;47:3733-3738. [PubMed] [DOI] |
| 24. | Aeschlimann JR, Dresser LD, Kaatz GW, Rybak MJ. Effects of NorA inhibitors on in vitro antibacterial activities and postantibiotic effects of levofloxacin, ciprofloxacin, and norfloxacin in genetically related strains of Staphylococcus aureus. Antimicrob Agents Chemother. 1999;43:335-340. [PubMed] |
| 25. | Hong EJ, Park DI, Oh SJ, Song MJ, Choi WH, Hong CH, Park JH, Kim HJ, Cho YK, Shon CI. [Comparison of Helicobacter pylori eradication rate in patients with non-ulcer dyspepsia and peptic ulcer diseases according to proton pump inhibitors]. Korean J Gastroenterol. 2008;52:80-85. [PubMed] |
| 26. | Uygun A, Kadayifçi A, Yeşilova Z, Savaş MC, Ateş Y, Karslioğlu Y, Ciğerim M, Bağci S, Dağalp K. Recent success of pantoprazole -or lansoprazole- based clarithromycin plus amoxicillin treatment in the eradication of Helicobacter pylori. Turk J Gastroenterol. 2004;15:219-224. [PubMed] |