修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2010-01-28
目的: 探讨体外诱导羊水间充质干细胞(AF-MSCs)分化成神经干细胞.
方法: 10只SD怀孕大鼠, 180-240 g, 胎龄16 d, 过量腹腔麻醉致死, 开腹全部切除子宫, 在无菌的条件下抽取全羊水, 采用贴壁法分离AF-MSCs, 体外培养扩增, 观察细胞生长特性, 流式细胞仪检测AF-MSCs表面抗原表达及细胞周期. 取第3代AF-MSCs, 加入预诱导液(DMEM/F12、100 mL/L FBS、1 mmol/L β-MEM)诱导24 h, 然后加入诱导液(DMEM/F12、100 mL/L FBS、5 mmol/L β-MEM)诱导24 h, 最后在分化维持培养液(DMEM/F12、20 µg/L EGF、20 µg/L bFGF)中培养, 行免疫荧光染色, 检测NSE和GFAP的表达.
结果: 成功分离、培养和传代SD大鼠AF-MSCs, 流式细胞术检测提示大鼠AF-MSCs的G0/G1期细胞比例约为87.5%、S+G2+M期比例为12.5%, 表达CD44为98.3%、CD29为70%、和CD105为33.2%、不表达CD45为0.5%, CD34为1%, DLA-DR(MHC class II)为0.1%. 诱导后, AF-MSCs能表达神经细胞标示物NSE和GFAP, 且可在体外继续存活2 wk左右.
结论: 羊水中也存在MSCs, 与其他来源的MSCs特点相符; 羊水可以作为一种新的胎儿MSCs来源, 而且能在体外诱导分化为神经细胞.
引文著录: 冯建勋, 腊晓林, 马艳, 毕晓娟, 温浩. SD大鼠羊水间充质干细胞向神经样细胞体外诱导分化. 世界华人消化杂志 2010; 18(3): 250-255
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: January 28, 2010
AIM: To investigate the differentiation of amniotic fluid-derived mesenchymal stem cells (AF-MSCs) into neural cells in vitro.
METHODS: A total of 10 pregnant Sprague-Dawley rats (180-200 g) at 16 days of gestation were used. The AF was extracted from the amniotic sac. AF-MSCs were isolated from the AF by the adherence method and expanded. Cell surface antigens were analyzed by flow cytometry. AF-MSCs at passage 3 were successively cultured in DMEM/F12 supplemented with 100 mL/L FBS and 1 mmol/L of β-mercaptoethanol for 24 hours, in DMEM/F12 supplemented with 100 mL/L FBS and 5 mmol/L of β-mercaptoethanol for another 24 hours, and finally in DMEM/F12 supplemented with 20 µg/L of epidermal growth factor (EGF) and 20 µg/L of basic fibroblast growth factor (bFGF). Immunofluorescence staining of neuron-specific enolase (NSE) and glial fibrillary acidic protein (GFAP) was performed to assess the differentiation capacity of these cells into neuron-like cells.
RESULTS: AF-MSCs were successfully isolated and cultured. Flow cytometry analysis showed that the percentages of AF-MSCs at G0/G1 and S/G2/M were 87.5% and 12.5%, respectively. The percentages of AF-MSCs positive for CD44, CD2 and CD105 were 98.3%, 70% and 33.2%, while those negative for CD45, CD34 and DLA-DR (MHC class II) were 0.5%, 1% and 0.1%, respectively. After induction, NSE- and GFAP-positive cells were detected. These cells could survive for two weeks in vitro.
CONCLUSION: AF-MSCs can be isolated from AF. They share similar morphology and phenotype to MSCs derived from other tissues. Amniotic fluid is a novel source of mesenchymal stem cells. AF-MSCs can be induced to differentiate into neuron-like cells in vitro.
- Citation: Feng JX, La XL, Ma Y, Bi XJ, Wen H. Differentiation of rat amniotic fluid-derived mesenchymal stem cells into neuron-like cells in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 250-255
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/250.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.250
研究表明, 间充质干细胞(human mesenchymal stem cells, MSCs)是一种多能细胞. 除存在于骨髓中外, 外周血、胎盘和足月脐血中也能分离出MSCs[1,2]. 近来一些研究提示羊水中存在多能干细胞, 且可分化为神经元、星形胶质细胞、少突胶质细胞等, 因此可能成为神经变性疾病移植治疗的种子细胞[3]. 这意味着羊水可能成为一种新的多能干细胞来源[4]. 因此我们采取一种直接贴壁法分离和培养大鼠羊水干细胞, 研究其生物学特性.
清洁级♀SD大鼠10只(新疆医科大学实验动物中心, 合格证编号; DK0512051), 体质量180-240 g. AMNIOMAXTM-II Complete培养基、α-MEM培养基和DMEM/F12培养液均购于美国Gibco; 鼠重组碱性成纤维细胞生长因子(rR-bFGF)和鼠重组表皮生长因子(rR-EGF)购于美国TBD科技公司; 胎牛血清购于美国Gibco; 荧光素标记抗大鼠抗体: CD29、CD34、CD44、CD45、CD105、DLA-DR、阴性对照购于美国Pepro Tech: FITC标记的兔IgG1和PE标记的兔IgG2购于北京中杉金桥生物公司、兔抗神经元特异性烯醇化酶(NSE)单抗和兔抗胶质纤维酸性蛋白(GFAP)单抗购于美国HyClone; FITC标记兔IgG购于北京博奥森生物公司; DAPI Molecular Probe购于美国RochePBS; 2.5 g/L胰蛋白酶-1 mmol EDTA; 其他试剂均为国产分析纯.
1.2.1 大鼠羊水间充质干细胞(AF-MSCs)的分离培养: ♀SD大鼠1只与♂SD大鼠2只同笼后第2天观察♀大鼠阴栓, 从发现阴栓记为怀孕第1天, 到怀孕第16天, 异戊巴比妥钠(20 mg/kg)过量腹腔麻醉致死, 开腹全部切除子宫, 在无菌的条件下抽取全羊水(平均0.5-0.8 mL)后加入到AMNIOMAXTM-II Complete培养基, 制成单细胞悬液, 接种到2 mL培养皿中, 置饱和湿度、50 mL/L CO2、37 ℃培养箱培养. 每天观察至出现梭形细胞为主、类成纤维细胞的MSCs集落且达80%汇合后, 0.5 g/L胰蛋白酶-1 mmol EDTA, 37 ℃消化2 min后, 改用α-MEM培养基培养液, 其中添加200 mL/L胎牛血清(FBS)、4 µg/L碱性成纤维细胞生长因子[10](bFGF), 制成浓度为每毫升2×104个的细胞悬液, 接种到25 cm2培养瓶中, 置饱和湿度、50 mL/L CO2、37 ℃培养箱培养, 记为第1代(P1). 细胞生长达到80%融合时按1:4的比例传代.
1.2.2 细胞核型分析: 采用滴片法: 收获时在培养终止前3 h加入秋水仙素, 最终浓度为2.5 mg/L. 收获细胞时, 将培养液倒进离心管中, 在每个培养瓶内加入已预温至37 ℃的0.2% EDTA胰酶消化液2 mL, 置37 ℃恒温箱中5 min, 用滴管吸打, 使细胞冲击下来, 收集瓶壁上的脱落细胞离心, 用4 g/L KCl及4 g/L柠檬酸钠1:1作为低渗液, 每管8 mL低渗10 min, 用3:1甲醇冰醋酸固定液固定后滴片4-6张, 65 ℃烤片过夜, 胰酶法G显带, 进行核型分析诊断.
1.2.3 大鼠AF-MSCs的生长曲线测定: 取90%融合的P3大鼠AF-MSCs, 制备单细胞悬液, 调整细胞浓度为每毫升2×104个, 接种于96孔培养板, 每孔180 µL. 加入AlamarBlue 20 µL, 每个时间点均设3个复孔, 其中以不含细胞仅有培养基作为对照, 置37 ℃、50 mL/L CO2培养箱培养, 然后每隔2, 4, 8, 16, 24, 36和72 h从中取出100 µL置入96孔板中, 在测定之前室温放置30 min, 将96孔板置于酶标仪上, 以620 nm为参考波长, 570 nm为试验波长测定吸收值A, 按说明书方法计算各复孔的平均值.
1.2.4 大鼠AF-MSCs细胞周期测定: 取90%融合的P3大鼠AF-MSCs, 用0.5 g/L胰蛋白酶-1 mmol EDTA消化后用预冷的无钙、镁含0.5 mmol/L EDTA的磷酸盐缓冲液将细胞制成2×105细胞的悬液. 在4 ℃下逐滴加入3倍体积的950 mL/L乙醇, 连续搅拌使乙醇终浓度达700 mL/L, 冰浴30 min固定. 加PBS离心去除固定剂后, 加PBS后将细胞悬液吹打均匀, 以1 500 r/min离心10 min, 去上清后留0.5 mL, 加入RNA酶A, 终浓度为0.5 mg/L, 37 ℃孵育30 min, 将样品管插入冰浴中, 停止RNA酶A的消化作用. 冷却后每个样品加入1.5 mL(150 mg/L)PI, 冰浴中避光染色至少30 min. 离心并弃染液, 重新悬浮于生理盐水中, 用300目(孔径约40-50 µm)尼龙网过滤后, 即可上流式细胞仪进行细胞周期检测. 测试结果以DNA直方图表示(直方图的横坐标为PI荧光强度, 代表DNA相对含量, 纵坐标代表细胞数量).
1.2.5 大鼠AF-MSCs表面抗原检测: 取90%融合的P3大鼠AF-MSCs, PBS洗涤后制备单细胞悬液, 分别加入FITC或PE标记的抗大鼠抗体: CD29、CD34、CD44、CD45、CD105、DLA-DR设立阴性对照. 用流式细胞仪检测, CellQuest软件分析结果.
1.2.6 大鼠AF-MSCs体外诱导分化为神经元样细胞: 取生长良好、80%-90%融合的P3大鼠AF-MSCs, 加入预诱导液(DMEM/F12、100 mL/L FBS、1 mmol/L β-MEM)诱导24 h, 然后加入诱导液(DMEM/F12、100 mL/L FBS、5 mmol/L β-MEM)诱导24 h, 最后在分化维持培养液中培养(DMEM/F12、20 µg/L EGF、20 µg/L bFGF. 每日用倒置相差显微镜观察记录细胞生长情况和形态变化. 细胞免疫荧光染色鉴定: 将诱导前和诱导分化后5 h的细胞接种于10 g/L明胶(30 min, 室温)包被的4 mm无菌盖玻片上, 行细胞免疫荧光染色(一抗分别为NSE单抗、GFAP单抗; 二抗为FITC标记兔IgG). 步骤为: 在40 g/L甲醛缓冲液固定10 min, 用磷酸盐缓冲液冲洗, 再用10%甲醇溶液固定10 min, 用磷酸盐缓冲液冲洗后, 封闭液(含20 mL/L马血清和0.5 g/L Triton的磷酸盐缓冲液)封闭30 min, 0.01 mol/L PBS冲洗; 滴加一抗4 ℃孵育过夜; 滴加二抗室温避光孵育30 min; DAPI室温避光染色5 min. 阴性对照孔不加一抗. 倒置荧光显微镜下观察拍照.
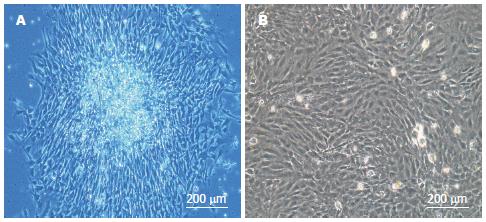
大鼠AF-MSCs原代培养平均17 h后, 可见散在的梭形细胞为主、类成纤维细胞的MSCs集落和多角形细胞为主的类上皮细胞集落, 集落间不接触(图1A). 平均4 d后可达80%以上汇合. 传代细胞在6 h内完全贴壁, 培养3 d可达90%融合, 细胞排列有一定的方向性, 呈漩涡状、辐射状排列, 细胞为梭形, 相互之间界限不清(图1B).
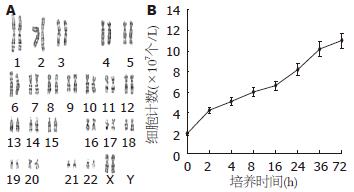
大鼠AF-MSCs其染色体核型为正常二倍体核型(图2A).
大鼠AF-MSCs生长迅速, 几乎没有生长潜伏期, 第3天细胞量即达高峰(图2B).
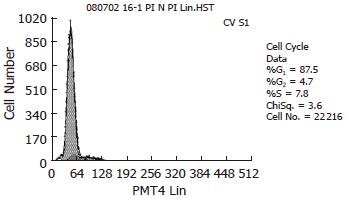
大鼠AF-MSCs的G0/G1期细胞比例约为87.5%、S+G2+M期比例仅为12.5%(图3A). 大部分细胞处于静止期, 只有小部分处于活跃的增殖状态.
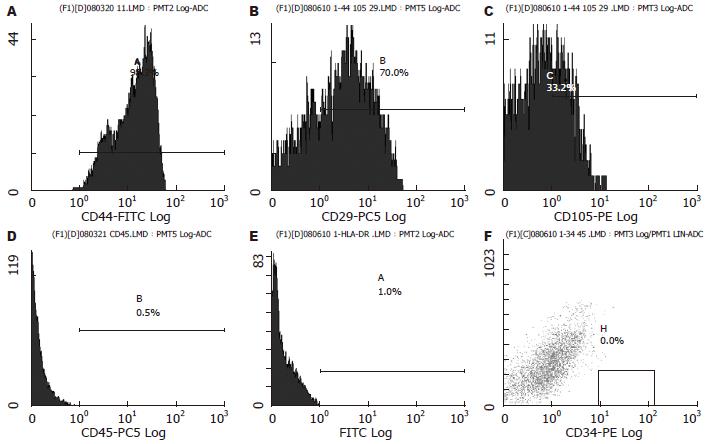
大鼠AF-MSCs表达CD44为98.3%、CD29为70%、和CD105为33.2%、不表达CD45为0.5%, CD34为1%, DLA-DR(MHC class II)为0.1%(图4).
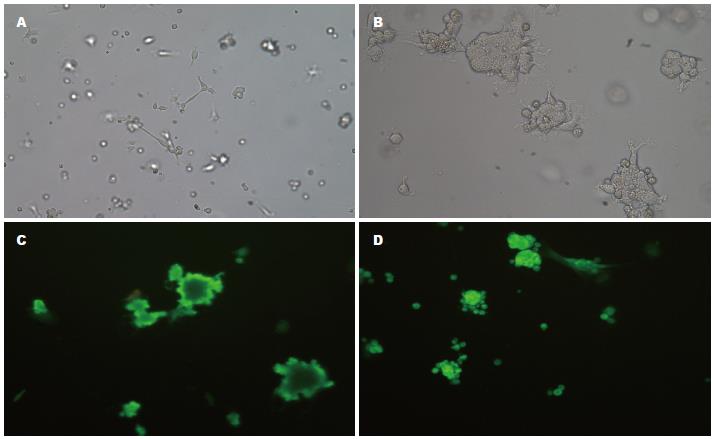
预诱导24 h后, 细胞体积减小, 立体感增强, 部分胞体收缩成锥形或球形, 伪足收缩成较细长突起(图5A), 少量细胞脱落、死亡. 加入诱导液后, 即有少量细胞发生形态变化, 逐渐呈现神经元样细胞形态宽大扁平的细胞胞质向核收缩, 胞体变圆变亮, 折光性增强, 突起逐渐变细增多, 类似轴突诱导后, 大部分细胞发生类似上述形态改变, 较多的神经元样细胞聚集在一起, 呈神经球样(图5B). 相邻的细胞间轴突联结成网状. 诱导的神经细胞形态不一, 有简单的双极细胞, 也有复杂的多极细胞. 少数诱导细胞胞体较大, 突起较多, 较独立存在, 类似胶质细胞. AF-MSCs经诱导后丧失增殖能力, 但仍可在体外继续存活2 wk左右. 为确定AF-MSCs分化后细胞性质, 采用神经元标志物NSE, 神经胶质细胞标志物GFAP的单抗进行鉴定, 以DAB示棕黄色为阳性细胞, 均主要在胞质显色. 结果显示, 诱导前GFAP为阴性, 极少量细胞NSE阳性; 在用巯基乙醇诱导后5 h时大多数细胞为NSE阳性, 其中聚集成团的分化细胞NSE表达为强阳性(图5C), 少数细胞GFAP阳性(图5D).
MSCs是目前干细胞研究领域的热点, 是组织工程重要的种子细胞之一[5], 也是基因治疗的理想靶细胞[6]. 近年来研究发现, 羊水细胞中含有多种干细胞的标志物, 且在体外通过特殊的诱导微环境能够分化成多种不同类型的细胞, 这使羊水来源干细胞成为干细胞研究的一个新的热点.
很早人们就认为羊水中含有源于羊膜组织和3个胚层的细胞[10], 但并不清楚其在整个怀孕期间的生命周期. 由于MSCs缺乏特异性表面标记, 如何获得纯净的MSCs仍是困扰研究者的重要问题. Gronthos等[7]曾根据MSCs表面表达的STRO21和CD106对其进行分离, 获得了纯度较高的细胞, 但数量非常少, 其增殖、分化能力也受到损害, 而且采用免疫磁珠分离和流式细胞仪分选, 价格昂贵. 本研究中, 我们采取直接贴壁分离法分离和培养AF-MSCs. 该方法操作简单、易于掌握、不需特殊试剂和器材, 获得的细胞具有自我纯化特性, 传至P3接近融合时细胞形态呈成纤维细胞样, 与其他来源MSCs相符. 流式细胞仪检测结果显示其表达CD44、CD29、CD105, 不表达CD34、CD45和HLA-DR, 与文献报道MSCs的表面标记的特点一致[9]. 这些结果表明用上述方法从孕中期羊水中得到的细胞具有独特的细胞化学特征和表型, 可以确定为MSCs.
Tsai等[9]从孕4-6 mo人的羊水中分离培养获得的多能MSCs在诱导因子作用下能够向多种细胞分化: 地塞米松、胰岛素、异丁基甲基黄嘌呤和吲哚美辛诱导其分化为脂肪细胞; 地塞米松、维生素C-2-磷酸盐导其分化为成骨细胞; 成纤维细胞生长因子和β-巯基乙醇诱导其分化为神经系细胞, 之后并证实了分化后的神经系细胞能够分泌释放多巴胺[10]. 证明孕中期羊水来源的胎儿MSCs同样具有向中胚层和神经外胚层细胞分化的能力. MSCs在体外分化成为神经细胞目前采用的方法有两种, 抗氧化剂[11]和生长因子[12]诱导. 但是前者快速、分化率较高. 本研究采用β-巯基乙醇两步法体外诱导大鼠AF-MSCs分化为神经细胞, 免疫荧光染色表达神经细胞标示物NSE和GFAP. 与文献报道一致. β-巯基乙醇诱导作用尚不清楚, 但是部分抗氧化剂有此作用, 如二甲基亚砜、叔丁对甲氧酚等[11]. 研究证实, 活性氧在细胞增殖分化过程中起到第二信使的作用[13], β-巯基乙醇作为一种抗氧化剂, 是否通过改变MSCs细胞内的氧化还原状态使其分化为NSE阳性细胞有待进一步研究.
中枢神经损伤修复是目前临床上的难题. 传统理论认为神经不能再生, 近年来学者们发现人体中枢神经系统存在少量的神经干细胞, 可分化为神经细胞. 由于来源于胚胎和成熟个体的神经干细胞存在伦理道德及再次损伤等问题, 因此迫切需要找到方便、可行、高效的神经干细胞种子细胞来源. 而MSCs在细胞治疗中的作用愈来愈引起人们的重视, 例如治疗心肌梗死、促进中风后血管发生、骨损伤的修复等. 但MSCs主要来源于生后组织, 如: 成人骨髓、脐带血、外周血和多种间充组织(肌肉、骨、软骨、肌腱、血管和组织), 但与胚胎或胎儿来源多能干细胞相比, 存在获取困难、分化能力有限、随年龄增长细胞寿命缩短和DNA损伤增加等缺点, 而胚胎干细胞又会牵扯到伦理学问题. 因此AF-MSCs作为胎儿来源的干细胞完全避免上述的缺点具有更广泛的研究前景.
中枢神经损伤修复是目前临床上的难题. 传统理论认为神经不能再生, 近年来学者们发现人体中枢神经系统存在少量的神经干细胞, 可分化为神经细胞. 由于来源于胚胎和成熟个体的神经干细胞存在伦理道德及再次损伤等问题, 因此迫切需要找到方便、可行、高效的神经干细胞种子细胞来源. 而AF-MSCs的研究为其提供了新的思路.
唐晓鹏, 教授, 中南大学肝病研究所/中南大学湘雅二医院感染科.
MSCs是目前干细胞研究领域的热点. 近年来研究发现, 羊水细胞中含有多种干细胞的标志物, 且在体外通过特殊的诱导微环境能够分化成多种不同类型的细胞, 这使羊水来源干细胞成为干细胞研究的一个新的热点.
Gronthos等曾根据MSCs表面表达的STRO21和CD106对其进行分离, 获得了纯度较高的细胞, 但数量非常少, 其增殖、分化能力也受到损害, 而且采用免疫磁珠分离和流式细胞仪分选, 价格昂贵. Tsai等从孕4-6 mo人的羊水中分离培养获得的多能MSCs在诱导因子作用下能够向多种细胞分化.
本研究证实, 羊水可以作为一种新的胎儿MSCs来源, 而且能在体外诱导分化为神经细胞. 为羊水来源干细胞的研究进展提供新的依据.
本研究探讨体外诱导AF-MSCs分化成神经干细胞, 立题有一定新颖性, 检测方法有一定的先进性, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Barbash IM, Chouraqui P, Baron J, Feinberg MS, Etzion S, Tessone A, Miller L, Guetta E, Zipori D, Kedes LH. Systemic delivery of bone marrow-derived mesenchymal stem cells to the infarcted myocardium: feasibility, cell migration, and body distribution. Circulation. 2003;108:863-868. [PubMed] [DOI] |
| 2. | Romanov YA, Svintsitskaya VA, Smirnov VN. Searching for alternative sources of postnatal human mesenchymal stem cells: candidate MSC-like cells from umbilical cord. Stem Cells. 2003;21:105-110. [PubMed] [DOI] |
| 3. | Kakishita K, Nakao N, Sakuragawa N, Itakura T. Implantation of human amniotic epithelial cells prevents the degeneration of nigral dopamine neurons in rats with 6-hydroxydopamine lesions. Brain Res. 2003;980:48-56. [DOI] |
| 4. | Prusa AR, Hengstschlager M. Amniotic fluid cells and human stem cell research: a new connection. Med Sci Monit. 2002;8:RA253-RA257. [PubMed] |
| 5. | Tremain N, Korkko J, Ibberson D, Kopen GC, DiGirolamo C, Phinney DG. MicroSAGE analysis of 2,353 expressed genes in a single cell-derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages. Stem Cells. 2001;19:408-418. [PubMed] [DOI] |
| 6. | Van Damme A, Vanden Driessche T, Collen D, Chuah MK. Bone marrow stromal cells as targets for gene therapy. Curr Gene Ther. 2002;2:195-209. [PubMed] [DOI] |
| 7. | Gronthos S, Zannettino AC, Hay SJ, Shi S, Graves SE, Kortesidis A, Simmons PJ. Molecular and cellular characterisation of highly purified stromal stem cells derived from human bone marrow. J Cell Sci. 2003;116:1827-1835. [PubMed] [DOI] |
| 8. | Campagnoli C, Roberts IA, Kumar S, Bennett PR, Bellantuono I, Fisk NM. Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood, liver, and bone marrow. Blood. 2001;98:2396-2402. [PubMed] [DOI] |
| 9. | Tsai MS, Hwang SM, Tsai YL, Cheng FC, Lee JL, Chang YJ. Clonal amniotic fluid-derived stem cells express characteristics of both mesenchymal and neural stem cells. Biol Reprod. 2006;74:545-551. [PubMed] [DOI] |
| 10. | Kim J, Lee Y, Kim H, Hwang KJ, Kwon HC, Kim SK, Cho DJ, Kang SG, You J. Human amniotic fluid-derived stem cells have characteristics of multipotent stem cells. Cell Prolif. 2007;40:75-90. [PubMed] |
| 11. | Woodbury D, Schwarz EJ, Prockop DJ, Black IB. Adult rat and human bone marrow stromal cells differentiate into neurons. J Neurosci Res. 2000;61:364-370. [PubMed] |
| 12. | Sanchez-Ramos J, Song S, Cardozo-Pelaez F, Hazzi C, Stedeford T, Willing A, Freeman TB, Saporta S, Janssen W, Patel N. Adult bone marrow stromal cells differentiate into neural cells in vitro. Exp Neurol. 2000;164:247-256. [PubMed] |